Barncancer
Varje år diagnostiseras ungefär 350 barn i Sverige med någon cancersjukdom 13, där fördelning av diagnoserna är ca 1/3 leukemier, 1/3 hjärntumörer och 1/3 solida tumörer och lymfom, se figur 5.
Figur 5 Fördelning mellan olika diagnoser i Svenska Barncancerregistret enligt ICCC - 3 grupp (2021-12-31)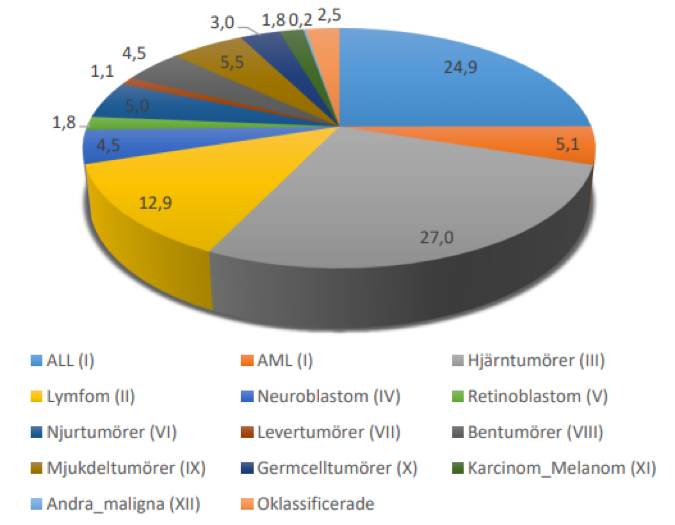
Källa: Svenska Barncancerregistret, årsrapport 2021 13.
Överlevnaden i barncancer har förbättrats påtagligt under de senaste 40 åren och nu överlever cirka 85 % av alla barn som drabbas av barncancer, se figur 6. Men högre överlevnad innebär fler sena komplikationer, och komplikationerna tilltar ju längre tid som går sedan cancerbehandlingen avslutades 14. I dag finns uppskattningsvis ungefär 12 000 personer i Sverige som behandlats för cancer i barndomen, och 70 % av dessa har drabbats av någon typ av sen komplikation 15.
Figur 6 Behandlingsresultat illustrerat som estimat för 5-årsöverlevnad över tid (data från Cancerregistret för tidigare perioder och Svenska Barncancerregistret från 1982)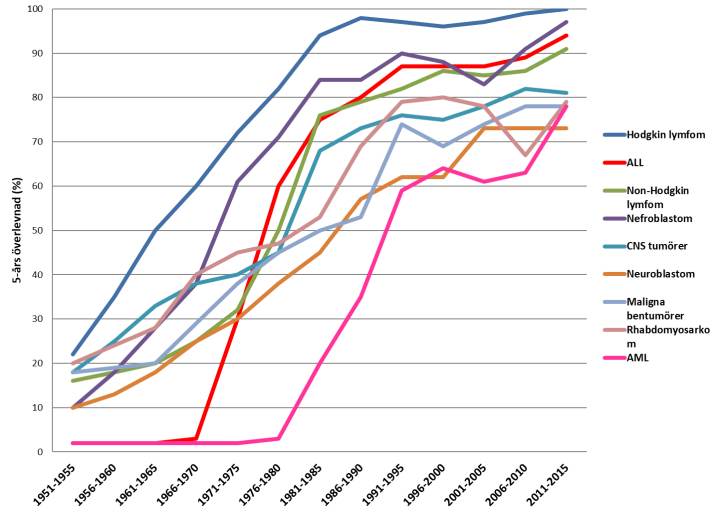
Källa: Svenska Barncancerregistret, årsrapport 2021 13.
Barn med hjärntumörer har störst risk för att utveckla komplikationer i centrala nervsystemet (CNS), men även behandling av andra cancertyper innebär ökad risk för CNS-komplikationer. Barnets ålder vid behandling är en av flera viktiga faktorer för risken för att utveckla kognitiva svårigheter senare i livet 9.
Barncancervården erbjuder inte någon likvärdig rehabilitering för barn med cancer, utan den beror på vilken region barnet tillhör. Ett vårdprogram kan förhoppningsvis styra regionerna till att erbjuda alla barn med cancer likvärdig cancerrehabilitering. Förhoppningen är att mildra de negativa effekter som komplikationer till cancerbehandling medför, med en individanpassad rehabilitering.
Barncancer
Akuta leukemier
De två vanligaste typerna av leukemi hos barn är akut lymfatisk leukemi (ALL) och akut myeloisk leukemi (AML). ALL står för 85–90 % av leukemierna och AML för 10–15 % 16. Vid ALL får barnen en lång läkemedelsbehandling som sträcker sig över cirka två år 17. Behandlingen består förutom av cytostatika, initialt även av höga doser kortikosteroider och sedan återkommande pulsar med kortikosteroider 17. Immunterapi håller på att introduceras i behandlingen av akut leukemi hos barn.
Vid AML ges en kortare, mycket intensiv blockbehandling med cytostatika som sträcker sig över cirka 5–6 månader 18. Vid både ALL och AML finns grupper av barn och ungdomar med olika prognos beroende på olika sjukdomsuttryck, barn och ungdomarna med sämst prognos behandlas med allogen stamcellstransplantation 19. Både ALL och AML kan drabba barn i alla åldrar men ALL-incidensen har en topp vid 2–4 års ålder.
Hjärntumörer
Hjärntumörer är en mycket heterogen grupp 20 och det kan både vara benigna och maligna tumörer. Det finns tre huvudtyper: gliom, medulloblastom och ependymom.
Den optimala behandlingen av en hjärntumör är att komplett avlägsna tumören kirurgiskt, förutsatt att tumören inte är spridd vid diagnos. För vissa diagnoser krävs även annan behandling 21. Dock växer hjärntumören ofta på en plats där minsta skada på närliggande strukturer leder till svåra funktionsnedsättningar. Om tumören exempelvis sitter i hjärnstammen finns stora risker för skada på livsuppehållande funktioner såsom reglering av hjärt- och lungfunktion, vilket medför att den oftast inte går att operera bort. Tumören kan alltså vara benign, men på grund av tumörens lokalisation i hjärnan kan även minsta tillväxt leda till döden.
Tumörer som är maligna består vanligtvis av omogna (ej specialiserade) celler i jämförelse med de benigna tumörerna som består av mer mogna celler och omogna celler är känsligare för cytostatikabehandling och strålbehandling än specialiserade (mogna) celler. De benigna tumörerna kan därför svara sämre på cytostatikabehandling och blir då mer svårbehandlade än maligna tumörer.
Hjärntumörens lokalisation i hjärnan avgör vilken typ av skada som kirurgi kan ge upphov till. Olika komplikationer såsom blödningar och syrebrist i samband med kirurgi ger också upphov till både akuta och sena komplikationer.
Barnets ålder vid behandlingen har stor betydelse. Ju mer outvecklad barnets hjärna är, desto större skada tar den av yttre påverkan såsom strålbehandling, cytostatika och förhöjt intrakraniellt tryck.
Läs mer om riskfaktorer för CNS-påverkan efter barncancer i det nationella vårdprogrammet för långtidsuppföljning efter barncancer.
Solida tumörer
Solida tumörer kan uppkomma överallt i kroppen, t.ex. nefroblastom, neuroblastom, hepatoblastom och germinalcellstumörer. De tre förstnämnda drabbar främst förskolebarn.
Vid flera solida tumörer behandlas barnet först med cytostatika för att krympa tumören och därefter opereras tumören bort. Beroende på resultatet av den första delen av behandlingen kan det vara aktuellt med fortsatt behandling med cytostatika, strålbehandling och/eller högdosbehandling med stamcellsåtergivning.
Diagnosen neuroblastom kan innebära en aggressiv sjukdom som trots multimodal behandling är mycket svårbotad. Eftersom medianåldern är två år vid diagnos av neuroblastom och behandlingen är mycket kraftfull, drabbas en majoritet av barnen av sena komplikationer i form av kognitiva svårigheter, njur- och hörselskador, brist på sköldkörtelhormon, kortvuxenhet med mera.
En annan grupp av solida tumörer är sarkom som uppstår i muskler, senor, bindväv och skelett. Några av de vanligare typerna är Ewings sarkom som främst förekommer bland ungdomar, osteosarkom som är vanligast bland barn över 10 års ålder, och rhabdomyosarkom som förekommer i alla åldrar. Behandlingen utgår från typ av sarkom men det vanligaste är en kombination av cytostatika, kirurgi och strålbehandling.
Germinalcellstumörer kan vara benigna eller maligna och kan uppkomma nästan överallt i kroppen, och de består av embryonala celler som har samma ursprung som könsceller. Det finns en form med specialiserade celler där tumören kan innehålla tänder, ben och brosk. Benigna tumörer avlägsnas med hjälp av kirurgi och maligna tumörer kräver både cytostatikabehandling och kirurgi.
En del barn med solida tumörer får en mycket intensiv behandling, men det finns ingen standardiserad kartläggning av funktionsnivå hos barnet före och efter behandling. Barnens svårigheter uppmärksammas ofta inte förrän de börjar skolan trots att de fått sin behandling som spädbarn eller förskoleålder. För dessa barn skulle det vara värdefullt att kartlägga premorbida funktioner och tidigt inventera behov och eventuella komplikationer samt tidigt erbjuda rehabilitering.
Lymfom
Lymfkörtelcancer uppdelas i Hodgkins lymfom och non-Hodgkins lymfom.
Hodgkins lymfom behandlas främst med cytostatika och i vissa fall med tillägg av strålbehandling och överlevnaden är mycket god. Infertilitet hos pojkar har varit en sen komplikation, men behandlingsregimen har på senare år ändrats för att minimera påverkan på fertiliteten.
Non-Hodgkins lymfom består av tre huvudtyper: T-cellslymfom, Bcellslymfom och storcelligt anaplastiskt lymfom. T-cellslymfom behandlas på samma sätt som akut lymfatisk leukemi, medan B-cellslymfom innebär cytostatika i blockbehandling under cirka 12 veckor, och storcelligt anaplastiskt lymfom behandlas med en intensiv cytostatikaperiod och därefter underhållsbehandling. Överlevnaden är cirka 90 %.
Cancerbehandling med risk för komplikationer
Det nationella vårdprogrammet för långtidsuppföljning efter barncancer inkluderar alla som fått cancerbehandling under barndomen och fram till 18 års ålder med fokus på risker för sena komplikationer både för barn och ungdomar och för de som nu är vuxna. Ju yngre barnet är vid behandling, desto större risk för t.ex. kognitiv påverkan eftersom hjärnan inte är färdigutvecklad vid tidpunkten för start av behandling.
Efter cancerbehandling finns det även en risk för efterföljande cancer, och ett av målen med uppföljning är att begränsa riskerna genom sekundär prevention och tidig upptäck. Vid besök på uppföljningsmottagning, s.k. nyckelmottagningar, görs en medicinsk bedömning och kontroller av att patienten följs enligt rekommendationerna i vårdprogrammet.
Läs mer i det nationella vårdprogrammet för långtidsuppföljning efter barncancer som är uppdelat i kapitel utifrån organ och kroppsliga funktioner.
