Diagnostik – genetisk analys och etiska överväganden
Generellt om genetisk diagnostik
Genetiska varianter bedöms enligt American College of Medical Genetics (ACMG:s) klassifikation på en skala som återspeglar sannolikheten för att varianten har en skadlig effekt på genfunktionen. Se figur 2.
Figur 2.Skala över sannolikhet för att en variant är sjukdomsassocierad
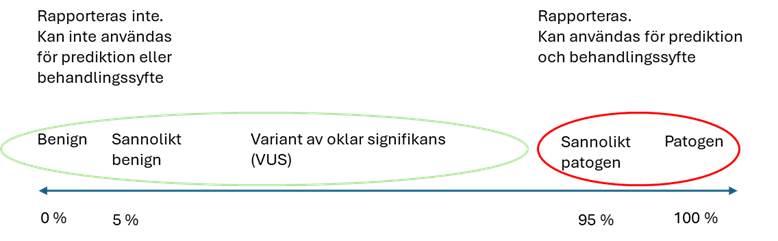
Källa: Bedömningsskala för genetiska varianter enligt American College of Medical Genetics. Bilden är framtagen av vårdprogramgruppen.
Varianter med 95–100 % sannolikhet för skadlig genförändring bedöms som sannolikt patogena (likely pathogenic) eller patogena (pathogenic). Om sannolikheten för skadlig effekt på genfunktionen är 5–95 % är klassificeringen variant med oklar signifikans (VUS). De allra flesta av dessa varianter, upp till 90 %, kommer senare att omklassificeras till benigna eller sannolikt benigna 5. Varianter med under 5 % sannolikhet för att ha skadlig effekt på genfunktionen bedöms som benigna. Endast patogena och sannolikt patogena varianter rapporteras, och de är därför markerade i rött i figuren.
Genetisk analys
Generellt om genetisk analys
Kunskapen om tumörrisksyndrom ökar hela tiden, vilket utmanar sjukvården vad gäller att både genomföra genetiska tester och hantera dessa. Testresultaten kan påverka patientens hälsa och framtida behandling i resten av livet, och har även stor betydelse för släktingarna och de kommande generationerna.
Oftast bygger den genetiska analysen på en så kallad massiv parallell sekvensering (MPS) där man undersöker sekvensdata från flera gener i genomet, t.ex. helgenomanalys, helexomanalys eller analys av en genpanel. Därefter görs analys och tolkning av betydelse av varianter i de gener som är relaterade till frågeställningen. Dagens tekniker möjliggör identifiering av genetiska förändringar som tidigare inte var möjliga att hitta. Samtidigt som fler genförändringar påvisas är det en utmaning att tolkningen av genetiska varianters koppling till sjukdom blir mer nyanserad när kunskapen ökar.
Med MPS kan man även påvisa genetiska varianter som bedöms vara patogena för ett annat tillstånd än det som patienten utreds för. Utförande laboratorier brukar ha riktlinjer för hur dessa varianter ska rapporteras 78. Mer information finns i SFMG:s rekommendationer för hantering av ”oväntade” genetiska fynd vid genomvida analyser.
Billigare tekniker och mer kunskap om genetik i behandlingsriktlinjer kräver att den genetiska vägledningen anpassas till patientens situation och sjukvårdens uppbyggnad.
Inför en genetisk analys är det viktigt att patienter
- samtycker till genetisk analys
- vet att DNA- och blodprov kommer att arkiveras vid det utförande laboratoriet
- förstår
- vad analysresultatet kan innebära för de själva och deras familjer
- att VUS kan bedömas på ett annat sätt längre fram, med nytillkommen kunskap
- att det finns risk för bifynd
- vet att de kan avstå från testning, och vad konsekvenserna i så fall kan bli.
Huvudsyften med genetisk analys vid ärftliga tumörrisksyndrom
Syftet med genetisk analys är att individualisera behandling och prevention.
Genetiska förändringar kan vara förvärvade eller ärftliga. Medfödda förändringar kan ha funnits i familjen i tidigare generationer eller ha uppstått de novo. Cancer är ett exempel på förvärvade genetiska förändringar. Ärftliga genetiska förändringar är sådana som vi ärvt från en eller båda föräldrarna. De novo är en genetisk förändring som fanns i ägget eller spermien när fostret blev till, eller uppkom under tidigt fosterstadium.
En genetisk analys av tumörceller kan förutom att påvisa genförändringar som uppstått i tumören också identifiera en ärftlig genetisk förändring. Genetisk analys ingår i diagnostiseringen vid flera tumörtillstånd, som kan verka icke-ärftliga, och kan göras med flera olika metoder. Syftet kan vara att hitta markörer som förutsäger prognosen och effekten av olika behandlingar. Vissa genetiska förändringar kan också vara viktiga för att avgöra cancertypen. Inom diagnostiken används paneler med ett stort antal gener som undersöks, och därigenom identifieras genetiska förändringar som är ärftliga. För att säkerställa att en förändring är ärftlig bör tumöranalysen kompletteras med analys av normalvävnad, med antingen ett blodprov eller en hudbiopsi. Rutiner för vuxna patienter finns i Bilaga 1.
Genetisk analys för ärftliga tillstånd
Genetisk analys för ärftliga tillstånd kan ske i olika situationer, till exempel:
- Screeninganalys. Patientens sjukdom gör att man misstänker en ärftlig genetisk förändring i släkten. I analysen undersöks ofta flera gener.
- Presymtomatisk testning (även kallad prediktiv testning eller anlagsbärartestning). Det finns en känd genetisk förändring i släkten, och analysen ska visa om en person som inte har haft cancer bär på den aktuella förändringen.
- Fosterdiagnostik. Det finns en känd genetisk förändring hos en blivande förälder, eller hos båda. Analysen görs i första hand på prov från moderkakan eller fostervattnet.
- Preimplantatorisk genetisk testning (PGT). Bygger på provrörsbefruktning. Den genetiska förändringen är känd och analysen görs på embryobiopsi. Ett embryo som bedöms vara friskt från den aktuella genetiska förändringen återförs.
Potentiella resultat av genetisk analys
Efter att en genetisk analys har utförts blir utfallet något av nedanstående:
- Patogen eller sannolikt patogen variant. Den funna varianten har påverkan på genens funktion och dess protein, och bedöms orsaka patientens symtom. Informationen kan då användas för att styra behandling och gör det möjligt att erbjuda anlagsbärartest till släktingar. Genetiska laboratorier i Sverige bör främst rapportera dessa kliniskt signifikanta varianter (patogena och sannolikt patogena), varav övriga nedan uppräknade fynd oftast inte rapporteras ut.
- Normalfynd. Varianten är benign eller sannolikt benign. Den bedöms ha obetydlig eller ingen påverkan på genens funktion och dess protein, och bedöms inte orsaka patientens symtom. Benigna och sannolikt benigna varianter rapporteras inte.
- Oklar variant. En del genetiska varianter bedöms ha oklar klinisk signifikans (VUS). Oftast rapporteras de inte, men detta kan variera mellan laboratorier. Kunskapen om dessa varianters betydelse ökar med tiden, och patienten eller den behandlande läkaren kan efterfråga en ny bedömning av varianten om 2–3 år, om varianten är rapporterad.
- Bifynd. Testet visar en patogen variant i en gen som inte är kopplad till den kliniska bilden (fenotypen). Man brukar rapportera bifynd som har klinisk betydelse för patienten och familjen genom möjligheten att vidta förebyggande åtgärder (t.ex. vid patogena varianter i gener som är associerade med långt QT-syndrom eller i vissa cancerriskgener).
- Sekundärt fynd. Testet visar en patogen variant i en gen som inte är relaterad till fenotypen, men som aktivt har analyserats under utredningen. Ett exempel är patogena varianter i gener som analyseras i tumörvävnad enligt Bilaga 1 Rekommendationer för återrapportering av konstitutionella varianter från cancergenetiska utredningar inom klinisk patologi. Denna rekommendation fokuserar på att rapportera ut fynd som har klinisk betydelse.
Vävnad för genetisk analys
DNA kan extraheras från flera olika vävnader, men vanligtvis används blodprov där DNA extraheras från de vita blodkropparna. Det är dock inte lämpligt om patienten har neutropeni eftersom utbytet av DNA blir lågt. Om ett sådant prov ändå tas är det viktigt att den inremitterande läkaren skriver på remissen att provet tas under neutropeni (specifika krav kan förekomma, kontrollera lokala provtagningsanvisningar). Hud är en annan vävnad, och hudbiopsi kan nyttjas vid t.ex. blodmalignitet eller om patienten fått en benmärgstransplantation. Vid fosterdiagnostik är vävnaden antingen fostervatten eller moderkaka.
Ibland behövs analys på mer än en vävnad för att bekräfta att en genetisk förändring är ärftlig. Detta kan vara aktuellt
- vid någon genetisk förändring i mindre än 50 % av DNA och man misstänker mosaicism
- vid påvisad förändring i TP53-genen i DNA extraherat från blod.
Vid påvisad förändring i TP53-genen behöver CHIP (clonal hematopoiesis of indeterminate potential) uteslutas. CHIP påvisas oftast med ökad ålder och efter behandling med cytostatika. För att utesluta CHIP bör annan vävnad undersökas, t.ex. fibroblaster. Om en variant i TP53-genen påvisas i fibroblaster talar fyndet för konstitutionell förändring i TP53, eventuellt i mosaisk form (vid låg variant allel frekevens, VAF). Om avvikelsen endast finns i perifert blod bör en hematolog konsulteras, eftersom CHIP med en variant i TP53-genen innebär en klart ökad risk för progression till myelodysplastiskt syndrom eller akut myeloisk leukemi.
Arkiverad vävnad efter operation eller biopsi kan i vissa fall användas för screening av gener som är associerade med ärftliga tumörrisksyndrom. Men då är det viktigt att extrahera DNA från normalvävnad. Vid analys av tumörvävnad måste tumörcellshalt anges, och en uppföljande analys behövs för att bekräfta att förändringen är konstitutionell och inte enbart förvärvad.
Metoder för genetisk analys
Det analyserande laboratoriet väljer analysmetod utifrån frågeställning och analysutbud.
Vanligtvis utförs sekvensering av DNA. Vid screening utförs oftast analys med MPS (massive parallel sequencing) där laboratorierna har olika varianter. Vid anlagsbärartestning kan metoder för riktade analyser tillämpas. Analysen kan omfatta hela arvsmassan (whole genome sequencing, WGS), men vanligtvis undersöks ett visst antal gener (panel), allt från tio till flera hundra gener. Man kan även analysera kodande delar av arvsmassan (helexomsekvensering) eller en förvald panel av gener.
Helgenomsekvensering ger oftast möjlighet att påvisa både sekvensvarianter och deletioner eller duplikationer samt introniska varianter. Helexomsekvensering och panelsekvensering är ofta anpassade till analys av både sekvensvarianter och deletioner eller duplikationer, men kan ha lägre känslighet. Vissa gener som är associerade med ärftliga cancerrisksyndrom har pseudogener (till exempel PMS2-genen). Då blir det svårare att upptäcka varianter i dessa gener med ovannämnda metoder och det kan bli nödvändigt med en kompletterande Sangersekvensering eller MLPA-analys. Vid riktad analys kan olika analysmetoder tillämpas. Oftast använder man Sangersekvensering. För att undvika falskt negativa resultat vill man analysera provet i fråga tillsammans med prov från en annan familjemedlem som är bärare av genförändringen, helst med prov från index i familjen.
Ibland analyseras RNA, med antingen analys av en gen eller så kallad transkriptomanalys som möjliggör samtidig analys av all kodande RNA i arvsmassan. Detta kräver speciell provtagning och initieras av ett genetiskt laboratorium.
Etiska aspekter
Etiska frågeställningar är viktiga att lyfta i både planering av sjukvården och det enskilda mötet med patienten och hens familj. Här tar vi upp
- informerat samtycke till genetisk analys
- utredningens betydelse för patienten och släktingarna
- genetisk analys av barn
- jämlik vård.
Informerat samtycke
All information från vården bör anpassas till mottagarens ålder, mognad, erfarenhet, språkliga bakgrund och andra individuella förutsättningar (patientlagen 3 kap. 6 §). Detta gäller också vid genetiska utredningar samt genetisk analys. Resultatet av genetisk diagnostik kan dock ha betydelse även för patientens släktingar, vilket patienten bör informeras om. Patienten bör också få möjlighet att ställa frågor. Den som ger informationen ska också ”så långt som möjligt försäkra sig om att mottagaren har förstått innehållet i och betydelsen av den lämnade informationen” (patientlagen 3 kap. 7 §). Se Kapitel 7 Genetisk vägledning.
Utredningens betydelse för patient och släktingar
Genetiska släktingar till en person med en sjukdomsorsakande genvariant kan erbjudas genetisk vägledning och anlagsbärartest. Både patienten och släktingarna har rätt att känna till sin risk, men också rätt att avstå från att veta.
Genetisk analys av barn
Barn med cancer eller tumör som utreds för ärftlighet kan ibland påvisas ha en patogen variant som inte har någon klinisk betydelse förrän barnet når vuxen ålder. Regioner bör ha en organisation för att fånga upp dessa patienter i sena tonåren för att informera om fynden och förbereda dem på de kontroller som rekommenderas under vuxenlivet.
Jämlik vård
Hälso- och sjukvårdslagen definierar hälso- och sjukvård som åtgärder för att medicinskt förebygga, utreda och behandla sjukdomar och skador. I 3 kap. 1 § anges också att den med störst behov ska ha företräde till vården. Detta är grunden för jämlikhet i vården, men det innebär också att hälso- och sjukvården behöver prioritera personer med manifest sjukdom före personer med risk för att utveckla sjukdom.
För genetiska förändringar i vissa högriskgener (t.ex. BRCA1, BRCA2 och Lynch-generna) finns evidens för nyttan av förebyggande åtgärder. För många tumörrisksyndrom är dock cancerrisken oklar, liksom värdet av kontrollprogram och andra förebyggande åtgärder. Vården har en etisk skyldighet att inkludera individer med sällsynta tumörrisksyndrom i studier och kvalitetsregister, så att man kan utvärdera effekten av att sätta in kontra inte sätta in åtgärder. För att undvika undanträngningseffekter och onödiga undersökningar är det viktigt att utgå från senaste evidens och säkerställa att rätt kontrollprogram erbjuds.
Vad gäller de etiska dilemman som beror på sjukvårdens uppbyggnad och begränsade resurser finns det utmaningar när det gäller tillgången till genetisk diagnostik, eftersom denna kan vara kostsam och det inte alltid är tydliggjort vilken enhet som ska bekosta den genetiska diagnostiken. I flera sjukvårdsregioner har man löst detta genom en så kallad solidarisk finansiering, vilket innebär att alla regioner bidrar till kostnaderna för onkogenetisk utredning inklusive genetisk diagnostik.
Det är eftersträvansvärt att föra nationella diskussioner för att nå konsensus om användning av nya diagnostiska metoder, samt säkerställa tillgång till förebyggande åtgärder och kontrollprogram för att hantera eventuella fynd i sådana analyser.
Besked om testresultat
Patienten kan få svar på den genetiska analysen under olika skeden av sjukdom och behandling. För patienter som inte har haft cancer, se Kapitel 7 Genetisk vägledning.
En del patienter har en pågående cancerbehandling när de får veta att de har ett ärftligt tumörrisksyndrom, andra får beskedet senare långt efter att cancern är färdigbehandlad.
Mainstreamtestning eller testning inom ramen för ”snabbspår” görs i samband med att patienten diagnostiseras med en cancersjukdom. Se även avsnitt 6.1 Utredning genom specialistvård. Oftast undersöks flera gener. En identifierad förändring ger information som har betydelse för patientens behandling och uppföljning, men även för släktingarna. Patienten får en kortare genetisk vägledning innan den genetiska analysen, då syftet i första hand är behandlingsstyrande för den aktuella cancersjukdomen. Om en genetisk förändring identifieras får patienten en utförlig genetisk vägledning om vad det genetiska fyndet innebär för både personen själv och hens släktingar. För detaljer och möjligt innehåll i det första samtalet, se Kapitel 7 Genetisk vägledning.
