Morfologisk kategorisering av tumören
Rekommendationer
- Gallvägstumörer bör klassificeras enligt WHO:s senaste utgåva (5:e, 2019) och senaste versionen av TNM (8:e).
- När färsk vävnad tillvaratas för biobank bör det göras vid eller enligt överenskommelse med en patologavdelning, för att inte äventyra möjlighet till histopatologisk bedömning.
- Preparatet bör tuschmarkeras av patologen, i färskt tillstånd för perihilärt kolangiokarcinom. Om sådan rutin inte är möjlig och kirurgen önskar färgmarkera preparatet bör färgkod tillämpas enligt KVAST-gruppens rekommendationer.
- Fryssnitt bör endast användas om det har betydelse för den peroperativa strategin.
- Rutiner för hantering av endoskopiska mikrobiopsier och finnålsbiopsier bör finnas så att både rutinfärgning och kompletterande immunhistokemisk analys kan genomföras.
- Vätskebaserad cytologi, i utvalda fall med tillägg av FISH-analys, bör användas vid borstprov från gallgångar.
- Cytologi men även PAD behöver kvalitetskontrolleras internt. Särskilt vid cytologi krävs extern samverkan med andra centra för att säkerställa validitet.
- PAD från resektat bör besvaras inom 4 veckor.
Detta kapitel riktar sig till patologer, cytologer, kirurger och andra som tar vävnadsprov som ska skickas for morfologisk analys.
Patologins och cytologins roll i den diagnostiska processen
Operationspreparat, mellannålsbiopsier, finnålsbiopsier och kolangioskopiska mikrobiopsier granskas histopatologiskt, medan borstprov, sköljvätska och finnålsaspirat granskas cytologiskt. Cytologisk provtagning är en viktig del av den preoperativa diagnostiken, så tillgången till cytologkompetens är avgörande.
Diagnostisk biopsi
Biopsi ger ett bättre material än finnålsaspiration för immunhistokemisk analys, och bättre möjligheter att bedöma tumörens relation till stroma och eventuell invasion. Det finns flera biopsimodaliteter som lämpar sig för olika lesioner:
- mellannålsbiopsier för intrahepatiska solida lesioner (t.ex. iCCA)
- kolangioskopiska mikrobiopsier för diagnostik och kartläggning av dysplasier och maligniteter lokaliserad i gallvägarna.
- endoskopiskt ultraljudsledda finnålsbiopsier (EUS-FNB) för lesioner utanför lever och gallvägar (t.ex. lymfkörtelmetastaser).
Oavsett provtyp behöver patologen eller cytologen ha kännedom om punktionsvägen eftersom kontamination av gastrointestinalt eller pankreatobiliärt epitel kan vara en diagnostisk fallgrop. Kännedom om stent i gallvägar är viktig eftersom reaktivt förändrat gallvägsepitel kan uppvisa avsevärd atypi. Av samma anledning är uppgifter om tidigare stenar och PSC relevant.
Borstprov
Vid borstprov från gallvägar bör vätskebaserad cytologi användas. Konventionella cytologiska utstryk bör inte framställas. Allt material från borstningen och eventuell sköljvätska bör hamna i fixeringsmediumet för att optimera förutsättningarna för cytologi, FISH-analys och eventuella molekylärpatologiska analyser.
För FISH-analys används vanligen kommersiellt tillgängligt UroVysion-kit för att upptäcka eventuella polysomier i kromosomer 3, 7 och 17 eller bortfall av tumörsuppressorgen CDKN2A. FISH-analysen bidrar till att öka den cytologiska undersökningens sensitivitet och specificitet.
Vid klinisk misstanke om malignitet bör cytologi kompletteras med FISH-analys, liksom vid cytologiskt fynd av atypi, misstanke om malignitet eller förekomst av maligna celler 149.
Fryssnitt
Fryssnitt bör endast användas om det har betydelse för den peroperativa strategin. Tekniken innebär snitt med sämre kvalitet som måste bedömas av patologen under tidspress, vilket kan resultera i försämrad diagnostisk precision. God kommunikation med operatören är viktig. Fryssnitt från gallvägsresektat som är längre än en gallgångsring bör vara suturmärkta, och sidan (mot patienten eller preparatet) måste anges på remissen så att patologen kan ta ställning till hur materialet bäst ska snittas. Det är viktigt att känna till ev. föregående stent i gallvägar, se även avsnitt 10.1.1 Diagnostisk biopsi.
Kvalitetsuppföljning
En viktig del av patologens roll i det multidisciplinära teamet är att validera diagnos. Kvaliteten bör följas med regelbundna revisioner av nyckelfaktorer såsom hur väl radiologisk och histopatologisk diagnos stämmer överens, och om diagnosen stämmer vid eftergranskning av histopatologiska preparat.
Svarstid är ett viktigt processmått, som också har klinisk betydelse för att patienten ska få rätt behandling och information efter ingreppet. Patologen bör ge svar på resektat inom 4 veckor från ingreppet.
Cytologisk diagnostik av gallvägar finns i dag på fyra enheter i Sverige, eftersom volymen är låg och diagnostiken behöver ha både hög sensitivitet och hög specificitet, mot bakgrund av de konsekvenser som malign cytologi får. Avdelningar som deltar i diagnostiken med borstcytologi i kombination med FISH (eller annan tilläggsanalys) rekommenderas att delta i regelbunden intern och extern kvalitetskontroll.
Anvisningar för provtagarens hantering av provet
Biopsering (mellannål, via kolangioskopi eller finnål) bör göras med en teknik som minimerar fragmentering av vävnaden och dissociering av tumören från medföljande stroma. Materialet fixeras omedelbart i 10 % neutral buffrad formalin (4 % formaldehyd).
Kolangioskopisk mikrobiopsi och endoskopiskt ultraljudsledd finnålsbiopsi (EUS-FNB)
Kolangioskopiska mikrobiopsier som är tagna med miniendoskop och tång från lumen av gallgångar ger ett histologiskt material som kan bedömas på liknande sätt som FNB. Eftersom ytepitelet kan vara avlossat rekommenderas multipla biopsier från varje lokal för att öka provets representativitet. Biopsier från olika lokaler måste läggas i separata och särmärkta rör.
Vävnadsutbytet vid mikrobiopsier och FNB är alltid sparsamt, så det ska finnas rutiner för hanteringen så att preparatet räcker både för rutinfärgning och kompletterande immunhistokemisk analys.
Borstcytologi och FISH
Borsten i sitt kateterhölje placeras distalt om den aktuella strikturen. Borsten förs fram och tillbaka genom strikturen ca 10 gånger 150151. Om hela strikturen inte kan täckas med en borstning ska man upprepa åtgärden för den mer proximala delen, och särmärka provrör för analys. Borstprov från separata strikturer tilldelas varsina och särmärkta rör för analys. Efter provtagning placeras borsten omedelbart i fixeringsvätska och roteras och skakas ordentligt i fixeringsmediumet. Eventuella större vävnadsfragment kan skrapas av från borsten och ned i vätskan. Sköljning av kateterhöljet har visats höja cellhalten i utbytet 152.
Operationspreparat
Operationspreparat bör skickas i färskt tillstånd på is till patologavdelningen för att vävnad ska kunna biobankas utan att man äventyrar den fortsatta utskärningen och undersökningen av resektionsytorna. Högst ett snitt ska göras i axialplanet på preparat av perihilärt kolangiokarcinom för att ta tillvara material från tumör till vävnadsbiobanken. Huruvida vävnad går att ta bör i första hand avgöras av patologen, och proceduren får aldrig äventyra diagnostiken. Vid perihilärt kolangiokarcinom och andra komplexa preparat (t.ex. multiviscerala resektioner) rekommenderas att tuscha resektionsytorna i färskt tillstånd efter biobankning eftersom resektionsytorna är lättare att identifiera och komma åt än efter formalinfixering. För sådana preparat rekommenderas också makrofotografiering före och efter tuschmarkering. Förekommande strukturer (tex delad gallgång) och preparatytor bör markeras eller tuschas enligt KVAST-gruppens rekommendationer (se Figur 1).
Därefter görs parallella snitt (axiella på större, orienterbara preparat) var 1–1,5 cm längs leverns yta (anterior på större preparat) utan att preparatet skärs igenom helt. Absorberande material placeras i varje snitt för att förbättra penetrationen och fixeringen av formalin i vävnaden. Om gallblåsan finns med i preparatet ska den öppnas. Provet kan sedan hanteras (t.ex. genom att använda gasväv runt preparatet) för att minimera deformeringsartefakter vid formalinfixering. Därefter läggs preparatet i 10 % neutral buffrad formalin (4 % formaldehyd) i 24–72 timmar, beroende på preparatets storlek, före utskärning.
Radiala resektionsytor och kärlresektionsränder på operationspreparat
Större delen av den anteriora ytan är inte en resektionsyta eftersom den är peritonealiserad. Däremot är det viktigt att urskilja icke peritonealiserade ytor på levern såsom vid koronära och triangulära ligamenten och resektionsytor vid sammanhängande strukturer (t.ex. diafragmaresektat eller omentadherenser). Resektionsyta vid hilus eller större pedikel bör också skiljas från hepatisk transektionsyta.
Det finns olika syn på vilka ytor som bör beaktas som resektionsytor på preparat som innefattar de perihilära gallgångarna, vid samtidig leverresektion 153154155. Observera att det finns en radial, icke peritonealiserad resektionsyta både i hilärt dissektionsplan och i posterior aspekt av hepatoduodenalt ligament. Radikalitet gentemot kärl kan innebära bedömning i olika områden, tex kan det finnas en resektionsrand på stumpen av portaven i hilusområdet och en annan på leverartär längre bort mot hepatoduodenalt ligament.
För att underlätta bedömning av radikalitet gentemot olika ytor har KVAST-gruppen tagit fram en rekommendation angående färgmarkering med tusch (se Figur 9). Transektionsytan mot leverparenkym tuschas svart. Hilus färgas grönt, hepatoduodenalt ligament gult, koronalt ligament (orange). (resektionsränder). Den peritoneala ytan (ej resektionsyta) är blåtuschad 153.
Figur 9. Makroskopisk orientering och tuschmarkering av operationspreparat från lever och gallvägar. Grön pil indikerar portavenstump och blå pil proximal gallgångsstump.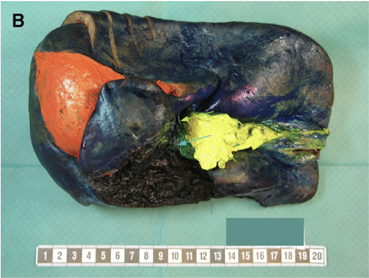
Anamnestisk remissinformation
Allmän information som bör finnas i remiss:
- Klinisk bakgrund, eventuell riskgrupp (t.ex. PSC, inflammation, gallstenar) och eventuell cirros.
- Klinisk-radiologisk diagnos (t.ex. benign eller malignitetsmisstänkt, misstänkt tumörtyp och lokal eller ursprung) eller indikationen för provtagning eller kirurgi.
- Radiologiska fynd (antal lesioner, storlek, utbredning i anatomiska strukturer; solid, cystisk eller/och intraduktal; utseende t.ex. heterogen, hypoekogen, nekrotisk).
- Tumörmarkörer.
- Förekomst av stent, nu eller tidigare.
Biopsier och cytologi
Specifik information vid cytologi och eller biopsi bör innefatta:
- Provtyp (mellannålsbiopsi, endoskopisk mikrobiopsi, FNB, finnålsaspirat, borstprov eller sköljvätska).
- Hur provet tagits (perkutant, via kolangioskopi, med EUS via ventrikel eller duodenum).
- Provtagningslokal, ev. flera.
Operationspreparat
Specifik information vid operationspreparat bör innefatta:
- Typ av ingrepp (tex atypisk leverresektion, segmentektomi, hemihepatektomi,och om extrahepatiska gallvägar har medtagits ”en bloc”; kolecystektomi med eller utan leverresektion) inklusive vilket eller vilka segment preparatet utgörs av.
- Andra medföljande strukturer eller organ (t.ex. diafragma, bukvägg, oment, duodenum).
- Förklaring till eventuella suturmarkeringar (t.ex. resektionsrand leverartär).
- Neoadjuvant cytostatika- och strålbehandling.
- Preoperativa procedurer (t.ex. portavensembolisering).
- Intraoperativa observationer (t.ex. artefakt på leverkapsel).
- Ev. tidigare ingrepp (t.ex. kompletterande kirurgi).
- Om tumören är borttagen makroskopiskt radikalt eller ej.
Klassificering av tumören
Diagnostik av endoskopiska mikrobiopsier, mellannålsbiopsier och finnålsbiopsier
Materialet utgör ofta en diagnostisk utmaning vid mikrobiopsi och FNB eftersom små förband av adenokarcinom eller höggradig dysplasi kan vara svåra att skilja från reaktivt förändrat epitel. Undersökning bör därför kompletteras med immunhistokemiska markörer som stödjer diagnostik vid malignitet eller höggradig dysplasi (p53, SMAD4, IMP-3) och kan kompletteras med andra markörer som är förknippade med neoplasi (maspin, monoklonal CEA, MUC1 och CA125) 156157. Immunhistokemin måste tolkas sammanvägt med rutinmorfologi (i hematoxylin-eosin, H&E) av en erfaren patolog med specialkompetens inom området eftersom det finns ett betydande överlapp både morfologiskt och immunhistokemiskt mellan neoplastiska lesioner och reaktiva förändringar, speciellt vid intensiv inflammation. Den immunhistokemiska utredningen bör riktas efter ev. misstanke om annan tumörtyp än gallvägsadenokarcinom såsom hepatocellulärt karcinom, neuroendokrin tumör, blandad neuroendokrin och icke-neuroendokrin neoplasi (MiNEN) eller metastas (och omfatta t.ex. hepatocytantigen, glypican3, synaptofysin, kromogranin A, SATB2, TTF-1 eller östrogenreceptor).
Diagnostik av borstprov från gallvägar inklusive FISH
Cytologiska prover från gallvägarna besvaras enligt modifierad version av rekommendationerna i WHO Reporting System for Pancreaticobiliary Cytopathology 151.
I utlåtandets diagnosrad rekommenderas en standardiserad diagnosfras för cytologisk diagnos. Om man misstänker eller har diagnostiserat en annan malignitet än adenokarcinom används en fras som är anpassad efter situationen.
Om FISH-analys utförts bör utfallet redovisas. I diagnosraden rekommenderas att använda en standardiserad diagnosfras enligt nedan. Den slutliga cytologiska diagnosen bör avspegla de sammanvägda fynden av cytologi och FISH, och oklara fynd bör särskilt kommenteras i utlåtandet.
Om möjligt bör cytologi och FISH-analys bedömas parallellt för att spara tid, men indikationen för provtagningen och frågeställningen gör att det inte alltid går.
Följande fem diagnosfraser och SNOMED-koder rekommenderas för cytomorfologisk diagnos:
- Otillräckligt material för värdering/ej bedömbart prov. M09000.
- Benignt cellfynd. M00110.
- Atypiskt cellfynd. M69700.
- Misstanke om malignitet – misstanke om adenokarcinom. M81401.
- Maligna celler – adenokarcinom. M81403.
Följande diagnosfraser används för FISH-analys:
- Otillräckligt material för FISH-analys/ej bedömbar FISH-analys.
- FISH-analys med oklart utfall.
- Ingen påvisad aneuploidi.
- Aneuploidi påvisad.
Diagnostik av gallvägstumörer på operationspreparat
Intra- och extrahepatiska gallvägar inklusive gallblåsa kan vara utgångspunkten för flera tumörer som måste särskiljas eftersom de medför olika handläggning och prognos. Gallvägstumörer är relativt ovanliga och specifika för det biliära systemet, så patologen bör ha ett specialintresse för hepatobiliära sjukdomar. Vid behov bör fallet skickas för externkonsultation till en patolog med expertkompetens på området.
Gallvägstumörer ska klassificeras enligt den senaste WHO-utgåvan 158. Det är viktigt att skilja mellan följande tumörentiteter som innebär olika prognoshandläggning och TNM-stadieindelning: iCCA, blandat hepatocellulärt-kolangiocellulärt karcinom (HCCCCA), perihilärt kolangiokarcinom, gallblåsecancer och distal gallgångscancer. Blandad tumör (HCCCCA) som klinisk diagnos ingår i dag i levercellscancer (C22.0), och kan identifieras bättre i ICD11 genom en mer specifik kod (2C12.00).
iCCA indelas enligt WHO i två huvudtyper: ”large duct” och ”small duct”. Den senare innebär högre femårsöverlevnad postoperativt än ”large duct” iCCA. De flesta adenokarcinom från gallblåsa och extrahepatiska gallvägar är av biliär-typ mönster. Andra mönster av adenokarcinom är nödvändiga att känna igen och rapportera, såsom intestinal typ, mucinöst, klarcelligt, lågkohesivt karcinom med eller utan signetringceller och adenoskvamöst karcinom. Skälet är att de i sitt kliniska förlopp kan skilja sig från konventionellt (biliär typ) adenokarcinom. Speciellt vid ”small duct” iCCA är det viktigt att beakta de främsta benigna differentialdiagnoserna, gallgångsadenom och adenofibrom.
Differentieringsgrad på invasiv tumör bör anges som hög (> 95 % körtelbildning), medelhög (50–95 % körtelbildning) och låg (< 50 % körtelbildning). Tumörstadium, inklusive samtliga prognostiska deskriptorer bör anges enligt senaste UICC TNM-8 utgåvan 159:
- T (“Tumor”): Beskriver primärtumörens storlek och utbredning.
- N (“Node”): Anger förekomsten och utbredningen av regionala lymfkörtelmetastaser.
- M (“Metastasis”): Anger förekomsten av fjärrmetastaser.
- L (“Lymphatic invasion”): Beskriver invasion av lymfatiska kärl.
- V (“Vascular invasion”): Anger invasion av blodkärl.
- Pn (“Perineural invasion”): Beskriver invasion av nerver.
- R (“Resection margin”): Anger status för resektionsmarginaler efter kirurgi.
R-status definieras som R0 – ingen resttumör; R1 – mikroskopisk resttumör; R2 – makroskopisk resttumör. Historiskt har cancer i mag-tarmkanalen < 1 mm från resektionsytan betraktats som R1 160161. Detta rekommenderas fortfarande för invasiv cancer och Rklassificering efterfrågas av kliniker. Det finns dock ingen internationell konsensus om definitionen av R1 för gallvägscancerresektioner 162, så man bör ange det minsta avståndet från tumörceller till de förekommande resektionsränderna (hepatisk transektionsyta, proximal och distal gallgångstransektionsyta och radial resektionsyta i ligament hepatoduodenalt/hilus) och eventuellt andra resektionsränder med < 1 mm marginal, i enlighet med internationella riktlinjer 163164. Förekomst av tumörceller innebär inte alltid kontinuerlig växt av primärtumören, utan ibland gäller det diskontinuerlig tumörväxt och spridning såsom kärlinväxt (venös, lymfatisk), perineural växt och skurna lymfkörtelmetastaser 160. Förekomst av peritonealt tumörgenombrott bör alltid rapporteras, och påverkar Tstadium på iCCA och gallblåsecancer. Det beaktas dock inte för kategorisering av Rstatus 165, eftersom den peritoneala ytan inte är en kirurgisk resektionsyta.
Prognosen efter resektion av gallvägscancer är också beroende av förekomst och svårighetsgrad av underliggande kronisk leversjukdom. Det är viktigt att bedöma denna så långt från tumören som möjligt för att undvika förvirrande peritumorala effekter. Fibrosstadie, aktivitetsgradering (enligt Batts och Ludwig för kronisk hepatit eller scoringsystem för steatohepatit) och steatos bör rapporteras enligt KVAST-gruppens dokument Omhändertagande och diagnostik av medicinska leverbiopsier (svfp.se) 166.
Premaligna lesioner indelas i två huvudgrupper:
- makroskopiskt synlig intraduktal papillär neoplasi av gallgångar (IPN), intrakolecystisk papillär neoplasi (ICPN) och mucinös cystisk neoplasi av lever (MCN-L)
- mikroskopisk biliär intraepitelial neoplasi (BilIN).
För samtliga används i dag en tvågradig skala, dvs. låggradig eller höggradig dysplasi. Ett operationspreparat med IPN, ICPN, MCN-L eller BilIN med höggradig dysplasi måste alltid betraktas som potentiell bärande övergång i cancer och bör hanteras av patolog med kompetens inom området. I linje med hur preparat från pankreas hanteras (i huvudsak IPMN) 167 bör komplett bäddning av den makroskopiskt synliga lesionen utföras, och vid höggradig dysplasi bör komplett bäddning av den påverkade gallvägsstrukturen (t.ex. gallblåsa, extrahepatiska gallvägar) utföras. När IPN, ICPN eller MCNL förekommer tillsammans med cancer bör båda komponenterna beskrivas separat med uppgift om både den premaligna och den invasiva delens storlek. Separat radikalitetsbedömning bör också göras för premalign lesion och cancer. Neuroendokrina tumörer (NET) med ursprung i gallvägar är mycket ovanliga och ska klassificeras enligt senaste WHO-utgåvan där man skiljer mellan neuroendokrin tumör grad 3 (NET, G3) och neuroendokrint karcinom (NEC).
Tilläggsanalyser
Molekylärpatologiska prognostiska och prediktiva markörer är på väg att etableras som tillägg inför i första hand målriktad behandling. Testning rekommenderas för patienter som är aktuella för andra linjens behandling, se avsnitt 12.3 Onkologisk behandling.
Molekylärgenetisk analys för prediktiva biomarkörer vid gallvägscancer kan utföras på olika typer av prover, inklusive mellannålsbiopsi, finnålsbiopsi, endoskopisk mikrobiopsi, borstcytologi och finnålsaspiration. Nästa generations sekvensering (NGS) är den föredragna metoden för molekylärgenetisk analys av olika gallvägscancerprover på grund av dess omfattande profileringsförmåga. Valet av provtyp kan dock bero på kliniskt sammanhang, vävnadstillgänglighet och specifika diagnostiska behov.
Testning för FGFR2-fusioner rekommenderas för patienter med alla typer av gallvägscancer, för att vägleda användningen av FGFR-inhibitorer som har visat betydande klinisk effekt hos patienter med FGFR2-fusionspositiv gallvägscancer 168169. NGS på RNA-nivå är att föredra 170 framför konventionella metoder, såsom break-apart FISH, eftersom NGS gör det möjligt att identifiera bredare spektrum av FGFR2-fusioner och samtidigt upptäcka andra relevanta genetiska förändringar, även i små biopsier.
Testning för MMR-proteiner (MLH1, MSH2, PMS2 och MSH6) rekommenderas med immunhistokemi i första hand, och vid tveksamt utfall med genetisk analys, för möjligheten till immunterapi 171.
Patologen bör på begäran kunna erbjuda molekylärgenetisk analys för behandlingsbara terapeutiska mål såsom amplifieringar och mutationer i ERBB2 (HER2) 172, NTRK-fusioner 173 och mutationer i IDH1/2 174, BRAF 175 och BRCA1/2 59 även om det i dagsläget inte finns kopplade behandlingar till dessa genförändringar.
En bred genomisk profilering av tumören med NGS kan erbjudas inom ramen för kliniska studier eller genom implementering av Genomic Medicine Swedens (GMS) genpanel i rutinsjukvården, men NGS rekommenderas inte som rutin i detta vårdprogram vid gallvägscancer, utan enbart då det finns specifika behov. Molekylärgenetisk testning används för att identifiera potentiella behandlingsmål men är också avgörande för att förstå behandlingssvaret, inklusive svaret på cytostatikabehandling och immunterapi 176.
