Uppföljning vid gallblåsepolyper, PSC, och koledokuscystor
Gallblåsepolyper
Sammanfattning och rekommendationer
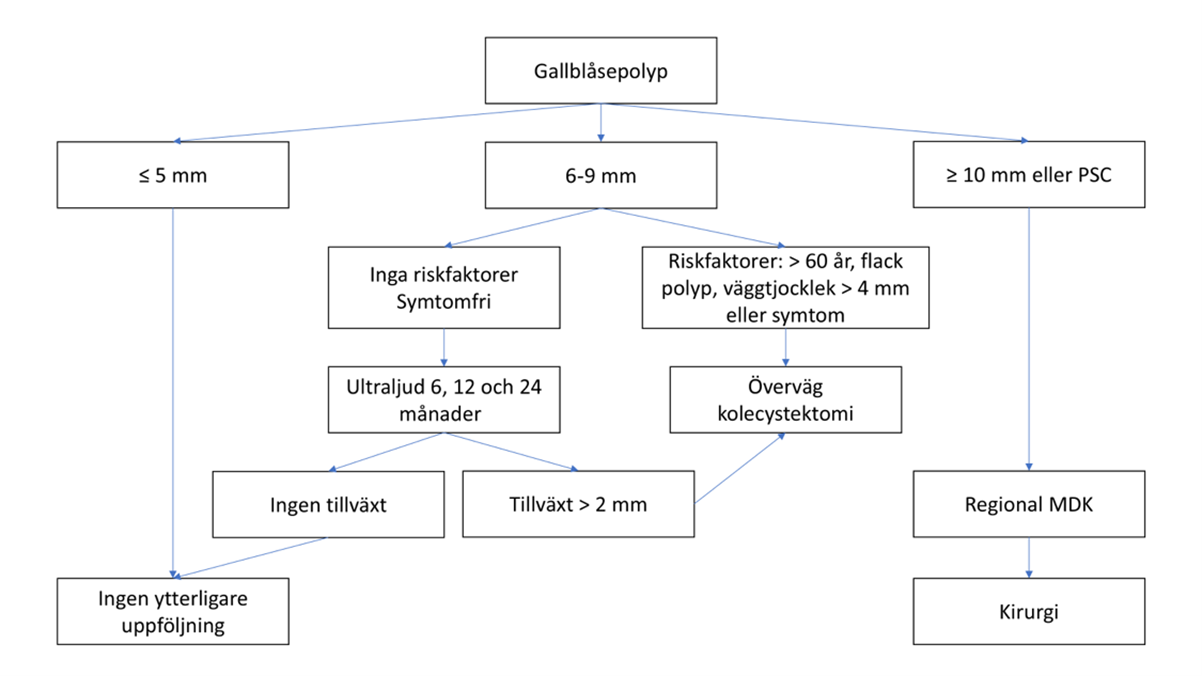
- Vid förekomst av gallblåsepolyp med storlek ≥ 10 mm bör man bedöma fallet vid en MDK och överväga kirurgi.
- Gallblåsepolyper 6–9 mm bör följas upp med ultraljud efter 6, 12 och 24 månader. Om de inte tillväxer kan kontrollerna avslutas efter 2 år. (+++)
- Vid förekomst av gallblåsepolyp och samtidig PSC bör kolecystektomi övervägas, oavsett storlek på polypen, (++)
Ultraljud är förstahandsvalet vid undersökning av gallblåsan. Med mer frekvent användning av ultraljud och förbättrad teknologi upptäcks fler gallblåsepolyper, och förekomsten bland de som genomgår ultraljud uppskattas vara 4–7 % 22. Polyper kan klassificeras som pseudopolyper eller sanna gallblåsepolyper. Pseudopolyper utgör 70 % av alla polyper 23 och är oftast kolesterolpolyper. De sanna gallblåsepolyperna kan delas in i icke-neoplastiska och neoplastiska 24.
Icke-neoplastiska polyper: hyperplastiska polyper, inflammatoriska polyper, adenomyom, fibrom och lipom.
Neoplastiska polyper (potentiellt maligna eller maligna): adenom, adenokarcinom, skivepitelkarcinom och mucinösa cystadenom (histopatologiskt).
Ca 3–4 % av de som opereras för misstanke om polyp visar sig ha en malignitet eller ett premalignt tillstånd 25. Storleken på polypen är den viktigaste prediktiva variabeln för malignitet 26. Andra faktorer som talar för malignitet är ålder > 50 år, primär skleroserande kolangit, symtom och solitära och bredbasiga eller flacka polyper 24. Vid gallblåsepolyp hos en patient med PSC rekommenderas kolecystektomi oavsett polypstorlek.
Uppföljning
De flesta accidentellt upptäckta gallblåsepolyper är < 10 mm och följs upp med förnyade ultraljudsundersökningar, om det inte finns indikation för kolecystektomi. Det saknas säker evidens för att snabb tillväxt är en prediktor för neoplasi 24 men storleksprogression kan vara ett tecken på tumörutveckling 25.
I september 2017 publicerades europeiska riktlinjer om handläggning och uppföljning av gallblåsepolyper 27. En uppdatering publicerades i december 2021, med rekommendationer som stämmer väl överens med den svenska behandlingsalgoritmen 28. Förändringar jämfört den tidigare algoritmen är att man kan avstå från kontroll av gallblåsepolyper med storlek ≤ 5 mm, i stället för som tidigare < 5 mm (figur 7). Det innebär att uppföljning genomförs vid polypstorlek 6–9 mm. I algoritmen ingår nu även de riskfaktorer för neoplasi som kan stödja beslutet om kolecystektomi även vid polypstorlek 6–9 mm, inklusive väggtjocklek > 4 mm. Intervallen för kontrollerna har också ändrats, enligt reviderade europeiska riktlinjer, till 6, 12 och 24 månader i stället för var 6:e månad i 2 år.
Figur 7 Rekommenderad handläggning av gallblåsepolyp
Primär skleroserande kolangit (PSC)
Sammanfattning och rekommendationer
- Det är inte visat att förstadier till malignitet upptäcks med uppföljning av patienter med PSC, men många centrum tillämpar en årlig kontroll.
- MRCP/MRT är icke-invasiv med acceptabel sensitivitet och bör därför utgöra förstahandsval för uppföljning. (++)
- Vid förekomst av malignitetsmisstänkt atypi bör man överväga levertransplantation. (++)
- Vid förekomst av gallblåsepolyp och samtidig PSC bör kirurgi genomföras, oavsett storlek på polypen. (+)
Inledning
Primär skleroserande kolangit (PSC) är en kronisk sjukdom med inflammatoriska förändringar och skleros i gallgångar intra- och/eller extrahepatiskt. Sjukdomen innebär klart ökad risk för gallgångscancer, med en årlig incidens på 0,5 % och en kumulativ livstidsrisk på 5–20 % 212930. Risken är störst i samband med eller inom ett år efter PSC-diagnos. Det är inte säkerställt att uppföljning gör nytta, men många centrum gör ändå årliga kontroller.
Sedan 2022 finns det nationella riktlinjer för PSC som är sammanställda av Svensk Gastroenterologisk Förening 31.
Radiologi
Syftet med radiologisk uppföljning är att följa sjukdomen och se om det behövs någon intervention. Internationella riktlinjer (men inte detta vårdprogram) rekommenderas uppföljning av PSC-patienter med ultraljud alternativt MRT/MRCP för att tidigt upptäcka gallgångscancer, vilket möjliggör kurativ behandling 3233. Evidensen för nytta är dock svag och det finns inget uppföljningsprogram som kan rekommenderas framför något annat. I en svensk prospektiv övervakningsstudie följdes 512 svenska PSC‑patienter, och årlig MRT och CA 19–9-mätning ledde inte till långtidsöverlevnad för de patienter som utvecklade kolangiocarcinom under uppföljningstiden. Incidensen var 0,2 % per år och endast 1 patient utvecklade hepatocellulär cancer (HCC) under 5 års uppföljning 34. Majoriteten (ca 90 %) av höggradiga strikturer var benigna. Tumörmarkören CA 19–9 är ospecifik och har ingen plats i screening för cancer vid PSC, men kan vara ett stöd i tumördiagnostiken. Höga värden ses utan tumörutveckling vid kolangit, och låga värden utesluter inte kolangiocarcinom. Vid misstanke om tumör stärks diagnosen av ett stabilt högt eller stigande värde. Vid höggradiga eller progressiva strikturer som inger misstanke om CCA ska patienten remitteras till ett nationellt högspecialiserat center (NHV-center) för utredning med ERCP, borstprov, biopsier m.m. enligt algoritmen nedan.
Eftersom gallgångscancer tidigt i förloppet sällan ger upphov till en avgränsad tumör, bör gallgångscancer alltid misstänkas hos en PSC-patient som utvecklar en dominant striktur med ikterus, buksmärtor och viktnedgång. En dominant striktur kan utvecklas hos 36–56 % av PSC-patienterna och definieras vid ERCP som antingen en stenos på mindre än 1,5 mm vid ductus choledochus eller hepaticus communis, eller en stenos på mindre än 1,0 mm vid de första generationsgrenarna (dvs. ductus hepaticus sinister/dexter) 35. Enligt internationella organisationer får dock termen dominant striktur inte användas vid MRCP av PSC-patienter 3637. I stället rekommenderas termen höggradig striktur (high-grade stricture), vilket definieras som en striktur som orsakar > 75 % reduktion av lumendiametern i ductus choledochus, duct hepaticus communis, ductus hepaticus sinister eller dexter. Ikterus och buksmärtor ingår dock i PSC-sjukdomens naturalförlopp, utan bakomliggande gallgångscancer, så uppföljningen kan inte enbart baseras på kliniska symtom och laboratorieresultat. Många centrum tillämpar en strategi med årlig MRT/MRCP och CA 19–9-mätning 38.
Tumörmarkörer
CA 19–9 är den mest studerade serummarkören för gallgångscancer vid PSC. Värdet kan dock stiga även vid benigna tillstånd i lever-gallvägarna, t.ex. vid akut bakteriell kolangit, kolestas och cirros, och vid extrahepatisk malignitet. Cirka 5–10 % av befolkningen saknar det så kallade Lewis-antigenet och därmed förmågan att uttrycka CA 19–9.
Sensitiviteten och specificiteten anges som 38–89 % respektive 50–98 % i olika studier, beroende på studiepopulationen och vald cut off-nivå. Högre cut off-nivåer har inte konsekvent förknippats med högre diagnostisk säkerhet för gallgångscancer 33394041424344.
Borstcytologi
Vid malignitetsmisstänkt atypi (grad IV av V) eller polysomi (FISH-analys med diagnostiskt avvikande antal med polysomi) i borstprov på en patient med PSC övervägs transplantation. I Sverige finns relativt god tillgång till donatorer, och här förespråkas transplantation vid malignitetsmisstänkt atypi eller polysomi konfirmation 3245, se avsnitt 9.2.2 Borstcytologi och avsnitt 10.1.2 Borstprov.
Koledokuscystor
Rekommendationer
- Koledokuscystor och indikation för resektion bör värderas på MDK.
- Resektion rekommenderas vid symtomgivande cystor och cystor som är förenade med maljunction med pankreasgång.
- Vid cystor typ I och IV kan resektion övervägas, men det är viktigt att beakta risken för komplikationer och kvarvarande malignitet.
- Uppföljning i form av årlig MRT för patienter med koledokuscystor rekommenderas generellt inte, vare sig kirurgi är genomför eller inte.
Koledokuscystor kan kategoriseras i Todani I–V, utifrån utseende och lokalisation, vilket har relevans för både behandlingsval och cancerrisk 46. Cystorna behöver inte vara lokaliserade i koledokus, och de kan därför ibland även kallas för biliära cystor.
Incidensen är låg i västvärlden (1 fall per 100 000 i befolkningen), men betydligt högre bland asiater, framför allt i Japan.
Hos vuxna är asymtomatiska cystor vanligast, men ikterus och symtom förekommer, medan stora koledokuscystor som debuterar som en palpabel förändring är vanligast hos barn.
Patogenes
Det kan finnas minst tre bakomliggande faktorer till förekomst av koledokuscystor: malformation under anläggningen av gallgångarna intrauterint, patologi i gallgångsvägg motsvarande Hirschprung i tarmen, och maljunction med reflux av pankreassaft till koledokus.
Utredning
MRT/MRCP för att kartlägga cystornas utbredning rekommenderas och kan användas för att värdera tecken på inflammation och malignitetsmisstanke, inklusive till exempel gallgångens väggtjocklek. Maljunction gentemot pankreasgången bör efterfrågas. Komplikationsrisken vid ERCP och PTC gör att det sällan är motiverat att använda dessa för kartläggning.
Normalvidd för koledokus är ca 6 mm, och 8 mm för äldre personer. Efter kolecystektomi är vidden ca 10 mm. Gränsvid gallgång finns därutöver och temporär dilatation förekommer även vid eller efter gallvägsobstruktion. Uppföljande radiologi rekommenderas i dessa fall 47.
Hur stor är risken för utveckling av malignitet?
Det råder brist på data om livstidsprevalens avseende utveckling av malignitet, framför allt när det gäller risken vid asymtomatiska cystor som debuterar i vuxen ålder. I en metaanalys från 2023 påvisades en malignitetsrisk på drygt 10 % i en västerländsk population av vuxna 48.
Det saknas data om normalförekomsten av koledokuscystor bland äldre i en västerländsk population, så livstidsrisken för malignitet är dåligt kartlagd.
Typer av cystor
Det finns fem typer av koledokuscystor, Todani I–V, se Figur 8.
Figur 8. Klassificering av koledokuscystor
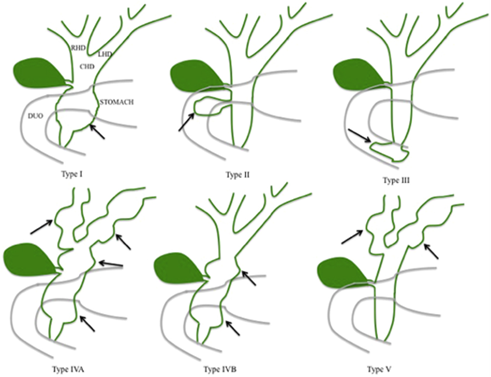
Källa: Bild från Soares et al. 49.
Klassifikation av koledokuscystor enligt Todani:
Typ I
Cystisk, sacculär eller fusiform dilatation av extraheaptisk gallgång.
Excision med anläggande av Roux-slynga har rekommenderats som standard. Det finns centrum som använt hepatikoduodenostomi, vilket kan ge ett enklare ingrepp, men risken för gallsaftsorsakad refluxgastrit och magsäckscancer motiverar försiktighet 50.
Typ II
Divertikel på extrahepatisk gallgång. Låg malignitetsrisk. Ibland associerat med gallstensproblematik och buksmärtor. Excision av enbart cystan är ibland möjligt.
Typ III
Koledokocele i anslutning till papill. Sällan föremål för resektion. Låg cancerrisk.
Typ IV
Engagemang av både extra- och intrahepatisk gallgång. Liksom för typ I finns det en malignitetsrisk. Resektion rekommenderas, och leverresektion kan bli aktuell vid enkelsidigt engagemang, framför allt med komplikationer.
Typ V
Intrahepatiska multipla cystor i gallgångarna. Kallas även för Carolis sjukdom som kännetecknas av både intra- och extrahepatiska dilatationer av gallgången (biliära cystor). Vid enkelsidig distribution kan resektion övervägas, framför allt vid symtom. Carolis syndrom kombinerar dilatationer i små gångar med kongenital leverfibros, och är associerat med njurcystor. Cystorna är ett resultat av malformation av duktalplattan, och det finns därmed också en relation till gallgångshamartom. Malignitetsrisken vid Carolis sjukdom är sannolikt > 5 % 51. Transplantation bör övervägas vid återfall av kolangit och/eller bilobärt engagemang, och framför allt i kombination med portal hypertension eller leverfibros.
Komplikationsrisker efter resektion
Risken för komplikation efter kirurgi varierar, men inflammation och förhållanden i leverhilus kan bidra till hög risk för komplikationer. Detta behöver vägas in, framför allt vid ökad samsjuklighet och hög ålder 52.
Uppföljning
Flera internationella föreningar såsom European Association of the Study of Liver (EASL) rekommenderar att man överväger uppföljning med MRT en gång per år, liksom vid PSC. Det saknas dock belägg för att uppföljningen kan upptäcka premaligna förändringar, och det finns inte heller belägg för en ökad andel som kan genomgå kurativt syftande behandling. Därför rekommenderas en individualiserad bedömning av indikation för uppföljning både före och efter kirurgi. Sammantaget saknas underlag för att rekommendera rutinmässig uppföljning av patienter som inte genomgått kirurgi, men också efter resektion för att upptäcka cancer i kvarvarande delar av gallvägarna.
