Primär behandling
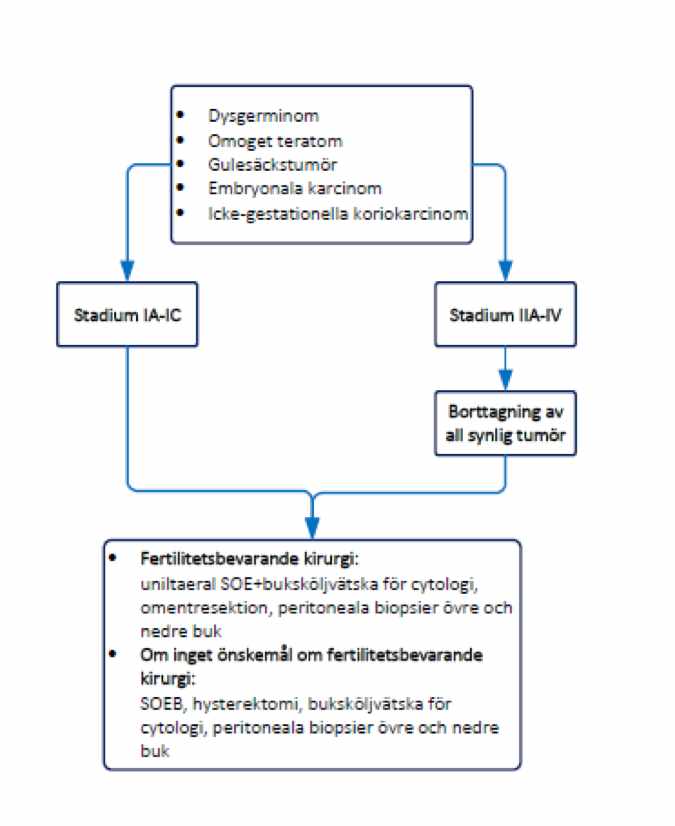
Kirurgisk behandling av germinalcellstumörer
Rekommendationer
- Fertilitetsbevarande kirurgi kan utföras vid alla stadier.
- Om patienten inte önskar bevarad fertilitet utförs laparoskopi eller laparotomi med buksköljvätska för cytologi, bilateral SOE total uterusexstirpation och omentresektion. Multipla peritoneala biopsier tas från bukens övre och nedre delar.
- Lymfkörtelutrymning rekommenderas inte (inte heller vid förmodat stadium I), däremot rekommenderas exstirpation av kliniskt förstorade lymfkörtlar.
De maligna ovariella germinalcellstumörerna (mOGCT) diagnostiseras ofta efter ovarialresektion eller ooforektomi på grund av oklar cysta eller solid äggstockscancer. För säker stadieindelning behöver man då komplettera med en stagingoperation för kartläggning av bukhålan. Detta ingrepp utförs ofta i en andra seans [34].
Kirurgi både vid primäroperation och eventuell sekundär kirurgi för stadieindelning kan utföras i första hand via laparotomi eller, om man kan undvika tumörspill, med minimalinvasiv teknik. Iatrogen cystruptur bör undvikas [34]. Minimalinvasiv kirurgi har i studier visat sig vara ett säkert alternativ till öppen kirurgi vid tidig mOGCT. I en kanadensisk studie på 918 patienter med mOGCT förmodat stadium I genomgick 294 (32 %) minimalinvasiv kirurgi antingen med laparoskopi eller robotassisterat ingrepp. Trots att färre patienter i den minimalinvasiva gruppen genomgick omentresektion och någon typ av lymfkörteldiagnostik fann man ingen skillnad i överlevnad (p=0,81), däremot kortare vårdtid och minskad risk för återinläggning [63]. Dessa resultat stöds av en koreansk studie på 165 patienter med stadium I icke-epitelial äggstockscancer, där man inte fann någon påverkan på total överlevnad hos de 28 (17 %) som genomgick minimalinvasivt ingrepp [64].
Det stadieindelande ingreppet består av åtminstone infrakolisk omentektomi, systematiska peritoneala biopsiser från övre och nedre bukhålan och buksköljvätska för cytologi. Systematisk lymfkörtelutrymning i tidiga stadier har inte visat sig påverka den totala överlevnaden, och rekommenderas därför inte. Mahdi et al jämförde data från 1 081 patienter med mOGCT registrerade vid National Cancer Institute, varav 493 genomgick lymfadenektomi och 590 opererades utan lymfkörtelingrepp. De fann att varken lymfadenektomi eller förekomst av lymfkörtelmetastaser hade någon prognostisk betydelse för överlevnad [25]. Andra studier har påvisat att systematisk lymfadenektomi hos patienter med tidiga stadier mOGCT säkert definierar tumörstadium, men inte har någon påverkan på prognosen [65]. Eftersom majoriteten av alla mOGCT är uttalat cytostatikakänsliga kan de flesta inadekvat stadieindelade patienter och patienter med recidiv behandlas med cytostatika med utmärkt överlevnad oberoende av omfattningen av den initiala kirurgiska stadieindelningen [66].
För kvinnor som avslutat sitt barnafödande rekommenderas komplett kirurgi inklusive hysterektomi och bilateral salpingo-ooforektomi. För unga kvinnor är dock fertilitetsbevarande kirurgi med unilateral salpingo-ooforektomi och sedvanlig staging men bevarande av det kontralaterala ovariet och uterus standardförfarande vid mOGCT i tidigt stadium. I en svensk nationell populationsbaserad kohortstudie på 73 kvinnor med icke-epitelial äggstockscancer, varav hälften mOGCT, fann man ingen skillnad i vare sig progressionsfri eller total överlevnad hos kvinnor som genomgått fertilitetsbevarande kirurgi jämfört med radikal kirurgi [67]. Sparande av uterus och en del av det ena ovariet rekommenderas även vid tumörengagemang av båda ovarier [34, 68]. Biopsi av ett makroskopiskt friskt ovarium rekommenderas inte vid icke-dysgerminom, däremot har dysgerminomen omkring 10 % risk för bilateralitet och en ovarialbiopsi kan i dessa fall övervägas eftersom den adjuvanta behandlingen kan påverkas [68]. Mot bakgrund av den generellt höga känsligheten för cytostatika bör man eftersträva maximal cytoreduktiv kirurgi med bevarande av fertiliteten även hos kvinnor med mer avancerade stadier av mOGCT [68, 69]. Av samma anledning rekommenderas inte kompletterande kirurgi efter avslutat barnafödande [68].
Samtliga fall bör bedömas vid MDK, se kapitel 10 Multidisciplinär konferens.
Figur 7. Kirurgi vid germinalcellstumörer
Gonadoblastom
Gonadoblastom är en ytterst sällsynt tumör som nästan alltid uppstår i dysgenetiska gonader hos individer med rubbningar i könsutvecklingen, i de flesta fall i 10–20-årsåldern. De drabbade har en kvinnlig fenotyp med virilisering och 90 % har Y-kromosom. Gonadoblastom är i regel < 8 cm och i 40 % av fallen identifieras de i båda ovarierna. Kromosomanalys bör utföras. Gonadoblastom är en blandad germinalcells-, könssträngscells-och stromacellstumör med två olika maligniteter som har distinkta histopatologiska skillnader. Behandlingen är kirurgisk med bilateral SOE, men på senare tid kommer allt fler önskemål om konservativ handläggning och fördröjd gonadektomi. Den konservativa handläggningen motiveras av att prevalensen av gonadoblastom hos individer med Turners syndrom är 12,8 % medan incidensen av malignitet i gonadoblastom är 22 %. Det rekommenderas gonadektomi, dvs. bilateral SOE, vid förekomst av en hel Y-kromosom.
Se även kapitel 9 Histopatologi.
Germinalcellstumörer hos barn
Barn och tonåringar med maligna germinalcellstumörer rekommenderas fertilitetsbevarande kirurgi utan lymfkörtelutrymning, och med bevarande av ipsilateral tuba om den är utan tumörengagemang [70, 71]. Kontakt bör tas med barnkirurg eller barnonkolog vid behov.
I en studie av 119 flickor med maligna germinalcellstumörer var 5-årsöverlevnaden mycket god (stadium I 95 %, II 94 %, III 98 % och IV 93 %). Lymfkörtelmetastasering hittades i 19 av 46 lymfkörtlar som togs bort på grund av att de var förstorade eller förhårdnade. I en annan studie analyserade man även förekomsten av lymfkörtelmetastasering hos kvinnor under 18 år med germinalcellstumörer, och fann att 20 % (30 av 150) hade lymfkörtelengagemang [24].
Läkemebehandling behandling av germinalcellstumörer
Germinalcellstumörer är i mycket hög grad platinumkänsliga likt testikelcancer. Cirka 90 % av patienterna i stadium I och 75-80 % av patienterna i stadium II–IV är långtidsöverlevare. Platinumkombinationen cisplatin, vinblastin, bleomycin (PVB) var den första som studerades. Senare studier kunde dock visa att om vinblastin byttes ut mot etoposid så gav det mindre toxicitet (neurotoxicitet, buksmärtor, förstoppning), men även bättre effekt, varefter bleomycin/etoposide/cisplatin (BEP) blev en standard [71, 72]. Högdos cisplatin förbättrar inte resultatet av behandlingen. Det finns inga randomiserande studier som jämfört dubbel kombination av kemoterapi (cisplatin + etoposid) med trippelkombination BEP regimen, vilka båda ges i 5-dagars kur (se nationella regimbiblioteket) [73-75]. Med tanke på karboplatinets skonsammare biverkningar så ersätter ibland (barn eller sköra patienter) karboplatin cisplatin i BEP regimen [71].
Primär läkemedelsbehandling vid dysgerminom
Rekommendation
- Alla patienter med dysgerminom stadium > IA bör behandlas med postoperativ BEP enligt nedan:
– Vid adjuvant behandling stadium IB–C1 ges 2 cykler.
– Vid adjuvant behandling stadium IC2–C3 ges 3 cykler.
– Vid stadium II–IV ges 3–4 cykler: 3 cykler i adjuvant situation och 4 cykler vid resttumör eller spridd sjukdom. - Opererade dysgerminom i stadium IA ges ingen adjuvant cytostatikabehandling.
Stadium I
Ingen adjuvant behandling rekommenderas vid rena dysgerminom stadium IA efter kirurgi. För patienter med tumör i stadium IB–C1 rekommenderas adjuvant behandling med 2 cykler BEP, och för patienter med stadium IC2–C3 rekommenderas 3 cykler BEP [73, 75].
Stadium II–IV
Vid dysgerminom stadium II–IV rekommenderas postoperativ cytostatikabehandling med BEP, med 3 cykler i den adjuvanta situationen och 4 cykler i övriga fall (utan bleomycin efter kumulativ dos på 300 000 IU) [73, 75].
Primär läkemedelsbehandling av övriga germinalcellstumörer (omogna teratom, embryonala karcinom, gulesäckstumör, icke-gestationella koriokarcinom)
Rekommendation
- Patienter med opererade omogna teratom stadium IA, grad 1–3 bör inte få cytostatikabehandling.
- Patienter med samtliga övriga stadier av omogna teratom, embryonala karcinom, icke-gestationella koriokarcinom och gulesäckstumörer bör få postoperativ cytostatikabehandling med BEP
- Gulesäckstumör stadium 1A och omogna teratom IB–IC1 ges 2 cykler.
Vid stadium IC2–C3 ges 3 cykler.
Vid stadium II–IV ges 3-4 cykler.
Stadium I
Omogna teratom stadium IA, grad 1–3 som genomgått korrekt kirurgisk stadieindelning med normaliserade tumörmarkörer postoperativt, behöver ingen adjuvant cytostatikabehandling [73, 75]. Övriga omogna teratom stadium IB–IC1 samt gulesäckstumörer stadium IA rekommenderas adjuvant behandling med BEP-regim i 2 cykler, förutsatt att tumörmarkörerna är normaliserade enligt halveringstidskurvan [73, 75]. Alla embryonala karcinom, gulesäckstumörer stadium IB–C och icke-gestationella koriokarcinom rekommenderas postoperativ BEP-regim i 3 cykler [76]. Behandlingen bör starta så snart efter genomgången kirurgi som möjligt, helst inom 2 veckor, framför allt om embryonal differentiering beskrivs i histologin [77, 78]. Det finns flera små icke-randomiserade studier där över 90 % av patienterna förblir återfallsfria efter adjuvant BEP.
Stadium II-IV
För stadium II–IV rekommenderas postoperativ cytostatikabehandling med BEP-regim, i 3–4 cykler. Kumulativ maxdos av bleomycin måste beaktas vid fjärde cykeln. För patienter med omoget teratom och radiologiska tecken på resttumör efter primärbehandling rekommenderas reoperation med radikal resektion för att undvika growing teratoma syndrome (se avsnitt 11.3.4). Om histologin visar enbart mogen vävnad är patienten färdigbehandlad och ingen ytterligare cytostatikabehandling behövs. Emellertid är det viktigt med radikalitet eftersom de mogna teratomresterna kan tillväxa och bli icke-resektabla samt ge trycksymtom [79]. Ett annat skäl till resektion är att mogna teratomrester i sällsynta fall kan genomgå malign transformation till exempelvis adenokarcinom eller sarkom.
Hos patienter med avancerade stadier av icke-resektabel tumör kan primär cytostatikabehandling med 4 cykler BEP vara ett alternativ, oavsett histologi [80] med ställningstagande till senare kirurgi. Dessa patienter bör diskuteras på nationell MDK.
Mogna teratom med malign transformation
Upp till cirka 2 % av mogna ovariella teratom har en komponent med malign transformation [7, 81], främst hos kvinnor över 50 år [82]. Malign transformation till skivepitelcancer är vanligast, men samtliga vävnadstyper i det mogna teratomet kan transformeras (exempelvis till tyreoideacancer eller adenokarcinom). I dessa fall bör den onkologiska behandlingen anpassas och riktas mot den typ av malign tumör som det rör sig om. Överlevnaden för mogna teratom med malign differentiering beror på subtypen av den maligna komponenten [83-85].
Gliomatosis peritonei
Gliomatosis peritonei är ett sällsynt benignt tillstånd som är associerat till mogna ovariella teratom och kännetecknas av peritoneala implantat innehållande mogen glial vävnad [86]. Gliomatosis peritonei utvecklas genom metaplasi av submesoteliala celler, vilka genomgår transformering pga. påverkan av tillväxtfaktorer som utsöndras från den ovariella tumören [87]. Även om gliomatosis peritonei har en tendens att orsaka återfall verkar det inte påverka överlevnaden negativt [88].
Växande teratomsyndrom
Växande teratomsyndrom (”growing teratoma syndrome”) är en transformering av omoget till moget teratom under och efter cytostatikabehandling. Tidigare förhöjda tumörmarkörer ska vara normaliserade och enbart mogna teratomkomponenter får finnas vid histologisk undersökning. Incidensen är oklar men har beskrivits hos upp till 20 % av alla patienter med omogna teratom [67, 89]. Rekommenderad behandling är komplett kirurgi med extirpation av all tumörvävnad, då det annars kan orsaka svåra lokala problem. För att undvika growing teratoma syndrome är kirurgisk resektion av all tumörvävnad som kvarstår efter avslutad cytostatikabehandling starkt rekommenderad vid omoget teratom eller mixed germinalcellstumör med inslag av teratom.
Kirurgisk behandling vid könssträngs- och stromacellstumörer
- Primärbehandling utgörs av kirurgi enligt principerna för epitelial äggstockscancer men utan lymfkörtelutrymning.
- Fertilitetsbevarande kirurgi kan utföras i tidigt stadium vid önskemål om bevarad fertilitet
Granulosacellstumörer
Stadium I
Behandlingen av granulosacellstumörer är främst kirurgisk. Syftet med primärkirurgin är att fastställa diagnosen och utvärdera tumörutbredning och stadium. Det rekommenderade ingreppen är buksköljvätska för cytologi, bilateral SOE, total hysterektomi, omentresektion och multipla peritoneala biopsier från bukens övre och nedre delar. Iatrogen cystruptur bör undvikas. Till skillnad från kirurgi vid epitelial äggstockscancer rekommenderas inte rutinmässig lymfkörtelutrymning i bäckenet och paraaortalt vid tidigt sjukdomsstadium. Anledningen är att överlevnaden är god vid förmodat tidigt stadium utan lymfkörtelutrymning och att det är ovanligt med lymfkörtelmetastasering vid granulosacellstumörer. Kliniskt suspekta lymfkörtlar skall dock exstirperas [90]. En noggrann stadieindelning är prognostiskt viktig och de patienter som diagnostiserats efter en unilateral SOE bör genomgå kompletterande kirurgi för korrekt stadieindelning. Ett flertal studier har kunnat visa att en inkomplett stadieindelning är associerat med sämre prognos och kortare sjukdomsspecifik överlevnad [91, 92]. De flesta patienter upptäcks och förblir i stadium I även efter en eventuell stadieindelande reoperation. I en europeisk multicenterstudie på adult granulosacellstumör undersökte man 168 patienter, varav 82.1 % diagnostiserades i stadium I och 17.9% i stadium II-IV. Två tredjedelar (n=112, 66.7 %) genomgick kirurgisk restaging, varefter 20 (17.9 %) uppgraderades avseende tumörstadium [34]. Det finns inga studier som belyser valet av kirurgisk teknik, dvs. laparoskopi eller laparotomi, men den bedömda risken för iatrogen cystruptur avgör. Det finns heller inga publicerade studier som rapporterar eventuell förekomst av porthålsmetastaser efter laparoskopisk kirurgi av granulosacellstumörer.
Kirurgi vid stadium I
Även om radikalkirurgi med systematisk stadieindelning är den rekommenderade behandlingen vid adulta granulosacellstumörer diagostiseras majoriteten i tidigt stadium och möjligheter finns för konservativ fertilitetsbevarande kirurgi, med bevarande av uterus och det kontralaterala ovariet. I en kinesisk studie på 113 patienter med granulosacellstumörer i stadium 1 genomgick 61 patienter fertilitetsbevarande kirurgi och 52 radikal kirurgi. Man kunde inte påvisa någon skillnad i sjukdomsfri överlevnad mellan grupperna. Av 22 patienter med graviditetsönskan blev 19 (86.4 %) gravida och frekvensen levande födda barn var 95 % [92]. En europeisk studie har dock påvisat en sämre sjukdomsspecifik överlevnad vid stadium 1C jämförbar med senare stadier, varför man konkluderar att fertilitetsbevarande kirurgi är ett säkert alternativ endast i stadium 1A [93].
I studier som undersökt hela gruppen könsstängs- och stromacellstumörer har man kommit till liknande slutsatser. I en översiktsartikel, som innefattande 900 patienter, fann man jämförbara utfall mellan patienter som behandlats med konservativ- jämfört med radikal kirurgi [94] medan man hos 255 patienter från SEER databas drog slutsatsen att cancerspecifik- men inte total överlevnad var bättre efter radikal kirurgi jämfört med fertilitetsbevarande kirurgi (p=0,015) [95].
Cystenukleation (20,5 % fall i denna analys) för adult granulosacellstumör visade sig vara associerad med en signifikant högre risk för återfall jämfört med unilateral salpingo-ooforektomi (70 % mot 16 %, p<0,001, motsvarande) [94]. I CORSETT studien lika många (20,8 %) patienter med könssträngstumörer genomgått cystenukleation [96]. Patienter som genomgått cystenukleation följd av unilateral salpingooforektomi, hade en bättre prognos avseende återfall jämfört med gruppen som genomgått cystenukleation enbart (10 år – 70% jämfört med 41 %, p=0,05), samtidigt påverkades inte totalöverlevnaden [94]. Vid FIGO stadium IC, cystenukleation ledde till en signifikant försämrad prognos för återfallfri överlevnad [94].
Patienter med granulosacellstumörer i stadium 1A kan således säkert genomgå fertilitetsbevarande kirurgi, medan patienter i stadium 1C bör involveras i behandlingsbeslutet och monitoreras noga om man väljer konservativ behandling.
Endometriebiopsi bör utföras vid konservativ kirurgi vid granulosacellstumör för att utesluta endometriecancer.
Det finns ingen konsensus internationellt avseende kompletterande kirurgi dvs. kontralateral salpingo-ooforektomi och hysterektomi efter avslutat barnafödande [69].
Stadium IB-IV
Vid högre stadium och hos postmenopausala kvinnor rekommenderas kirurgi med buksköljvätska för cytologi, bilateral SOE, total uterusexstirpation, omentresektion, multipla peritoneala biopsier från bukens övre och nedre delar [34]. Iatrogen cystruptur bör undvikas. Rutinmässig lymfkörtelutrymning para-aortalt och bilateralt i bäckenet rekommenderas inte. Vid kliniskt suspekta körtlar ska dessa exstirperas.
Hos premenopausala kvinnor kan fertilitetssparande kirurgi övervägas. Var god se diskussion i avsnitt 11.4.1.2 ovan. Det finns inga studier som belyser frågan om kirurgisk teknik dvs. laparoskopi eller laparotomi. Avgörande är hur stor risken bedöms vara för iatrogen cystruptur. De allra flesta patienter upptäcks och förblir i stadium I även efter reoperation. Det finns heller inga publicerade studier som rapporterar eventuell förekomst av porthålsmetastaser efter laparoskopisk kirurgi av granulosacellstumörer.
Tekom
Tekom är benigna [97]. Rena tekacellstumörer förekommer inte före puberteten, och medelåldern vid insjuknandet är 60 år. Tumörstorleken varierar, från mycket små till 20 cm i diameter. De flesta tekacellstumörer utsöndrar östrogen och huvuddelen av patienterna får vaginala blödningar. Cirka 20–30 % av patienterna utvecklar endometriecancer. Många tekacellstumörer upptäcks som bifynd i samband med behandling av en endometriecancer. Behandling av post- och perimenopausala kvinnor bör vara bilateral SOE och hysterektomi. Yngre kvinnor behandlas med ensidig ooforektomi, om målet är att bibehålla fertiliteten. Ibland förekommer Meigs syndrom, som består av ovarialresistens, ascites och pleuraexsudat med benign cytologi.
Fibrom
Fibrom är benigna, oftast ensidiga tumörer, och de vanligast förekommande könssträngs- och stromacellstumörerna. Även dessa kan variera i storlek, från minimala förändringar till stora tumörmassor. De ger ofta ett malignt intryck vid palpation; man känner en hård resistens på ovariets plats. Även vid fibrom förekommer ibland Meigs syndrom. Fibrom behandlas kirurgiskt med avlägsnande av tumörförändringen.
Fibrosarkom
Fibrosarkom är en ytterligt sällsynt högmalign tumörform som behandlas med radikal kirurgi. Någon vedertagen adjuvant cytostatikabehandling finns inte.
Sertoli–Leydigcellstumörer
Rekommendationer
- Primärbehandling utgörs av kirurgi enligt principerna för epitelial äggstockscancer men utan lymfkörtelutrymning.
- Välj fertilitetsbevarande kirurgi om patienten vill föda barn.
Sertoli-Leydigcellstumörer (SLCT) drabbar framför allt kvinnor yngre än 40 år (medelålder 25 år) och de producerar i regel androgener. Virilisering noteras i 70–85 % av fallen; i viss mån går den tillbaka när tumören har avlägsnats. Symtomen inkluderar oligomenorré och amenorré, hirsutism, akne och djupare röst. Patienten utvecklar manligt hårfäste, klitorisförstoring och larynxförstoring. Det är också vanligt med förhöjda värden av testosteron och androstendion. Merparten av de rena Sertolicellstumörerna utsöndrar östrogen och patientens symtom är relaterade till detta. I mindre än 1 % av fallen är tumörerna bilaterala.
SLCT är som grupp lågmaligna men vissa lågt differentierade former kan ha ett mer aggressivt förlopp. Majoriteten tumörer diagnostiseras i stadium IA. Den kirurgiska behandlingen är densamma som för adult granulosacellstumör hos kvinnor i barnafödande ålder och de som genomgått menopaus. Enligt en studie är ruptur en prediktor för sämre prognos med en ökad återfallsrisk. Högt stadium, låg differentieringsgrad och förekomst av heterologa element i tumörvävnad medför försämrad prognos. I riktlinjerna från European Society for Medical Oncology rekommenderas adjuvant cytostatikabehandling vid förekomst av två kriterier av dessa vid stadium I [68, 85]. Kunskapen om mest effektiva cytostatikabehandling vid SLCT är begränsad, men det är framför allt BEP-regim som har använts [98].
Olika rapporter uppvisar en 5-årsöverlevnad på 70–90 % [96]. I en retrospektiv studie inkluderande 21 kvinnor med SLCT rapporteras en total 5årsöverlevnad på 100 % för patienter med högt differentierade tumörer och 77,8 % för medelhögt till lågt differentierade tumörer som behandlats med postoperativ cytostatikabehandling [99]. Den totala 5-årsöverlevnaden var 92,3 % för stadium I och 33,3 % för mer avancerade stadier. Nyligen publicerades en retrospektiv studie inkluderande 40 patienter med SLCT [98]. Även dessa resultat talar för att adjuvant cytostatikabehandling bör rekommenderas vid stadium I och låg differentieringsgrad eller heterologa komponenter, samt för patienter med stadium II–IV.
Molekylärbiologiska studier har rapporterat om förekomsten av DICER1-mutationer vid SLCT [100]. DICER1 kodar ett enzym som krävs för att producera mogna mikro-RNA, som är kritiska för normal organutveckling. Fyndet kan tala för en association mellan SLCT och pleuropulmonärt blastom, en barncancerform som uppkommer från mesenkymet i pleura.
Fertilitetsbevarande kirurgi vid granulosacellstumörer
Primär läkemedelsbehandling för könssträngs- och stromacellstumörer
Adulta granulosacellstumörer
Rekommendationer
- Patienter med tumörer i stadium I som blivit korrekt kirurgiskt stadieindelade bör inte få adjuvant cytostatikabehandling.
- Patienter med tumörer i stadium II–III som blivit radikalopererade bör få adjuvant behandling med 3 cykler BEP, alternativt 4 cykler etoposid och cisplatin eller 6 cykler karboplatin och paklitaxel.
- Patienter med tumörer i stadium IV eller icke-radikalt opererade patienter bör få 4 cykler BEP, alternativt 6 cykler etoposid och cisplatin eller 6 cykler karboplatin och paklitaxel.
Vid adult granulosacellstumör stadium I rekommenderas i regel ingen adjuvant behandling, förutsatt att patienten genomgått korrekt stadieindelande kirurgi. Inhibin B eller AMH kan följas om dessa varit initialt förhöjda. Fler återfall har rapporterats hos patienter med adult granulosacellstumörer i stadium IC2–3, och därför rekommenderar ESMO i ”Clinical Practice Guidelines” antingen aktiv uppföljning eller cytostatikabehandling (3 cykler BEP eller 6 cykler karboplatin och paklitaxel) för dessa patienter [37]. I likhet med detta rekommenderar National Comprehensive Cancer Network (NCCN) i sina riktlinjer för maligna könssträngs- och stromacellstumörer antingen observation eller cytostatikabehandling för patienter med stadium I och hög eller intermediär risk för återfall. European Society of Gynaecological Oncology (ESGO) och European Society of Paediatric Oncology (SIOPE) har gett ut riktlinjer för behandling av icke-epitelial äggstockscancer hos tonåringar och unga vuxna, och i dem rekommenderas adjuvant cytostatikabehandling för adult granulosacellstumörer stadium IC2–3 [101].
I en fransk retrospektiv studie från 2023, som inkluderande 469 patienter med könssträngs- och stromacellstumörer, verkade adjuvant cytostatikabehandling inte ge förlängd progressionsfri överlevnad vid stadium I–II [102]. Dock fick endast 14,7 % av patienterna adjuvant cytostatikabehandling, och endast 33 kvinnor hade stadium IC2–3, så dessa data är osäkra. Vårdprogramgruppen rekommenderar ingen adjuvant cytostatikabehandling till patienter med stadium I. För juvenila granulosacellstumörer stadium IC rekommenderar internationella riktlinjer, inklusive ESGO-SIOPE och ESMO, adjuvant cytostatikabehandling i samråd med barnonkolog och nationella nätverket för icke-epitelial äggstockscancer.
För kvinnor med stadium II–IV rekommenderas platinumbaserad kombinationsbehandling: antingen BEP, endast etoposid och cisplatin eller karboplatin och paklitaxel. För antal cykler, se rekommendationsruta.
På 1980-talet bestod kombinationsbehandlingen av cisplatin, doxorubicin och cyklofosfamid med tumörsvar hos 63 % av åtta behandlade patienter. Under 1990-talet övergick man till BEP baserat på studier av testikelcancer med motsvarande histologi. I en mindre prospektiv studie svarade 83 % av patienterna med könssträngs- och stromacellstumörer på BEP [103]. Effekten av BEP-regimen har bekräftats i en större prospektiv studie [104].
BEP innebär stor risk för biverkningar, och taxanbaserade regimer har utvärderats i syfte att hitta en lika effektiv men mindre toxisk regim. En retrospektiv jämförelse mellan BEP och taxanbaserad behandling, med eller utan platinum, inkluderade 222 patienter med antingen nyupptäckt könssträngs- och stromacellstumör eller återfall i sjukdom. Tumörsvaret och den progressionfria överlevnaden var likartad för de båda behandlingarna men taxanbehandlingen hade en mer fördelaktig biverkningsprofil [105].
Sertoli-Leydigcellstumörer
Rekommendationer
- Vid stadium IA med hög differentieringsgrad och utan heterologa komponenter bör patienten inte få adjuvant cytostatikabehandling.
- Vid stadium IA med låg differentieringsgrad eller heterologa komponenter, samt vid stadium IB–III efter radikal operation, bör patienten få adjuvant cytostatikabehandling med 3 cykler BEP, alternativt 4 cykler etoposid och cisplatin eller 6 cykler karboplatin och paklitaxel.
- Vid stadium IV eller icke-radial operation rekommenderas 4 cykler BEP, alternativt 6 cykler etoposid och cisplain eller 6 cykler karboplatin och paklitaxel.
Sertoli-Leydigcellstumörer (SLCT) drabbar framför allt kvinnor yngre än 40 år (medelålder 25 år) och de producerar i regel androgener. Virilisering noteras i 70–85 % av fallen; i viss mån går den tillbaka när tumören har avlägsnats. Symtomen inkluderar oligomenorré och amenorré, hirsutism, akne och djupare röst. Patienten kan även utveckla manligt hårfäste, klitorisförstoring och larynxförstoring. Det är också vanligt med förhöjda värden av testosteron och androstendion. Merparten av de rena Sertolicellstumörerna utsöndrar östrogen och patientens symtom är relaterade till detta. I mindre än 1 % av fallen är tumörerna bilaterala.
SLCT är som grupp lågmaligna men vissa lågt differentierade former kan ha ett mer aggressivt förlopp. Majoriteten av patienterna diagnostiseras i stadium IA. Alla med SLCT bör screenas för den ärftliga DICER1-genen. Det är oklart vilken cytostatikabehandling som är mest effektiv vid SLCT, men det finns rapporter om respons efter behandling med framför allt BEP [98]. Vid risk för toxicitet kan etoposid och cisplatin vara ett alternativ, eller karboplatin och paklitaxel.
Enligt olika rapporter är 5-årsöverlevnaden 70–90 % [99]. I en retrospektiv studie som inkluderande 21 kvinnor med SLCT var den totala 5årsöverlevnaden 100 % för patienter med högt differentierade tumörer och 77,8 % för medelhögt till lågt differentierade tumörer som inte fått cytostatikabehandling postoperativt [99]. Den totala 5-årsöverlevnaden var 92,3 % för stadium I och 33,3 % för mer avancerade stadier. Resultaten av en retrospektiv studie inkluderande 40 patienter med SLCT talar också för att adjuvant cytostatikabehandling bör rekommenderas vid tumörer med stadium I och låg differentieringsgrad eller heterologa komponenter, samt vid tumörer med stadium II–IV.
Behandling övriga ovanliga icke-epiteliala äggstockstumörer
Småcellig cancer, hyperkalcemisk typ
Småcellig äggstockscancer av hyperkalcemisk typ (”small cell ovarian carcinoma of the hypercalcemic type”, SCCOHT) är en sällsynt och aggressiv äggstockscancer som framför allt drabbar yngre kvinnor. Risken för extraovarial spridning är hög varför prognosen ofta är sämre [37]. De flesta diagnostiseras med en unilateral tumör utan spridning, men överlevnaden i stadium IA är 30–40 % [106]. Debutsymtomen skiljer sig inte nämnvärt från de vid epitelial äggstockscancer men cirka 70 % av patienterna uppvisar hyperkalcemi.
SCCOHT kan skiljas från andra äggstockscancerformer med immunhistokemisk färgning för SMARCA4 [107]. Dessa tumörer omfattar alltså mutationer i SMARCA4-genen och uttrycker därför inte SMARCA4-protein, till skillnad från de flesta andra cancerformer.
Kirurgisk behandling
Eftersom sjukdomen har ett aggressivt förlopp rekommenderas radikal kirurgi i de flesta studier [108]. Kirurgisk behandling omfattar hysterekomi, bilateral SOE, bedömning av peritoneala ytor och lymfkörtelutrymning för stadieindelning, även för de med makroskopiskt stadium I [37]. Data är otillräckliga när det gäller fertilitetsbevarande ingrepp, men konservativ kirurgi kan övervägas i utvalda fall [106]. Den allra största dataserien kommer från 1994 och rapporterade minskad överlevnad hos patienter som behandlats konservativt, utebliven funktion av kvarlämnade gonader efter onkologisk behandling och inga graviditeter [37, 109].
Läkemedelsbehandling
Det finns inga prospektiva studier som belyser vilken typ av postoperativ behandling patienter med SCCOHT bör erbjudas. Endast små retrospektiva studier finns publicerade. I en retrospektiv studie från 2006, inom ramen för Gynecologic Cancer Intergroup, redovisas utfallet för 17 patienter. Man fann en bättre överlevnad för patienter i stadium I än vad som tidigare redovisats, med sju av tio patienter i livet efter en uppföljningstid på 40 månader i median. Alla patienter fick postoperativ platinumbaserad cytostatikabehandling, varav tio i kombination med cisplatin och etoposid. Fem av dessa patienter var långtidsöverlevare som även fick postoperativ strålbehandling. Fem patienter fick en kombinationsbehandling med paklitaxel och karboplatin, men fick återfall under pågående behandling eller kort tid efteråt [110]. Ytterligare en retrospektiv studie omfattande 47 patienter med SCCOHT, som behandlades 1990–2014, visar att cytostatikabehandling och eventuellt strålbehandling kan öka överlevnaden [111].
Fall av SCCOHT bör diskuteras på MDK, helst på nationell nivå. Rekommendationen i dag är att erbjuda dessa patienter postoperativ cytostatikabehandling med en kombination av etoposid och cisplatin.
Småcellig cancer, pulmonell typ
Småcellig cancer av pulmonell typ (”small cell carcinoma of the ovary, pulmonary type”, SCCOPT) är en extremt ovanlig och högmalign typ av äggstockscancer. Vid en genomgång av 21 fall (stadium IA–IV) var 5 återfallsfria vid uppföljning 21–90 månader efter postoperativ kombinationscytostatikabehandling innehållande åtminstone etoposid och ett platinumpreparat [112].
Fall av SCCOPT bör diskuteras på MDK och vid behov rådgör man med lungonkologer. Rekommendationen är om möjligt radikal kirurgi och postoperativ cytostatikabehandling med en kombination av etoposid och platinumpreparat (cisplatin eller karboplatin) [106].
Storcellig neuroendokrin cancer
Storcellig neuroendokrin äggstockscancer, eller odifferentierat karcinom av icke- småcellig neuroendokrin typ, är en sällsynt form av äggstockscancer med färre än 50 fall beskrivna i litteraturen [113]. Oftast uppvisar tumören en epitelial komponent (ofta endometrioid) och ursprunget tros vara monoklonalt [114]. Mer sällan ses tumören som en del av ett teratom eller som en renodlad neuroendokrin tumör. Storcellig neuroendokrin äggstockscancer är en högmalign cancer med en ytterst dålig prognos, och en majoritet av patienterna avlider inom ett år från diagnos [115, 116].
Det saknas konsensus om hur dessa patienter bör behandlas, men med tanke på det epiteliala ursprunget och den rapporterad effekten av platinum [117] rekommenderas cytoreduktiv kirurgi följt av adjuvant platinumbaserad cytostatikabehandling.
BEP:standardbehandling av icke-epiteliala äggstockstumörer
BEP-regimen består av en 5-dagarskur med bleomycin 30 000 IE (dag 1, 5 och 15), etoposid 100 mg/m2 (dag 1–5) och cisplatin 20 mg/m2 (dag 1–5) i en 21-dagarscykel. De vanligaste biverkningarna är illamående, förstoppning, håravfall, neutropeni, njurfunktionspåverkan, hörselpåverkan, tinnitus och Reynauds fenomen samt bleomycin-inducerad pneumonit, som är dosberoende. Det är angeläget att full dos BEP ges med det rekommenderade intervallet, för att behålla den kurativa effekten. Behandling med granulocytstimulerande tillväxtfaktorer förkortar den neutropena perioden och rekommenderas alltid vid spridd sjukdom, och bör även övervägas adjuvant [118, 119].
Eftersom icke-epiteliala äggstockstumörer i högre grad drabbar kvinnor i fertil ålder måste man beakta risken för prematur ovariell svikt och infertilitet, och diskutera det med patienten före behandling. Påverkan på fertiliteten har samband med antalet cykler BEP, där mer än tre cykler ger en ökad risk för ovariell svikt [118]. Efter remittering till en fertilitetsenhet bör man överväga att tillvarata obefruktade eller befruktade ägg, alternativt ovarialvävnad, se även kapitel 16 Fertilitet, graviditet och äggstockscancer. Andra biverkningar vid behandling av yngre individer är hypertoni och kardiovaskulär påverkan med ökad risk för hjärtinfarkt samt sekundärt metabolt syndrom i form av adipositas och insulinresistens [119]. Sekundära maligniteter såsom leukemi förekommer efter etoposid behandling. Den kumulativa dosen är avgörande med över 5 % riskökning om den kumulativa dosen etoposid överstiger 2 000 mg/m² [120].
Cisplatin
Hydrering är avgörande för att förhindra cisplatininducerad nefrotoxicitet. Cisplatin ska inte ges vid eGFR < 40 ml/min/1,73 m2), utan då rekommenderas i stället karboplatin och etoposid (5 dagars kur, se nationella regimbibliotetet). Vid aGFR 40–49 ml/min ges cisplatin i 100 % endast i 3 dagar, och vid aGFR 50–59 ml/min ges cisplatin i 100 % endast i 4 dagar.
Etoposid
Mer än 90 % av etoposid är bundet till plasmaproteiner [121]. Risken för hematologisk toxicitet ökar med ökad andel obunden etoposid, såsom vid hypoalbuminemi [122], så vid P/S-albumin < 30 g/L rekommenderas att minska etoposiddosen till 75 %.
Bleomycin
Bleomycin ges med en kumulativ maxdos på 300 000 IE, vilket i praktiken brukar innebära att bleomycin seponeras efter dag 1 i cykel 4. Den möjliga risken för bleomycininducerad pneumonit (BIP) [123] måste beaktas och andra regimer övervägas hos patienter med ökad risk för BIP. Symtom på BIP kan uppstå flera veckor eller månader efter behandlingsstarten.
Bleomycin bör inte ges till patienter med
- nedsatt njurfunktion (aGFR < 40 ml/min) eftersom det påverkar elimineringen av bleomycin och ökar risken för BIP; vid aGFR 40–49 reduceras bleomycindosen till 50 %
- nedsatt lungfunktion (lungsjukdom, storrökare)
- en kumulativ dos > 300 000 IE eftersom den är associerad med ökad toxicitet [124].
Behandling av bleomycininducerad pneumonit (BIP)
Behandlingen av BIP inkluderar steroider (t.ex. 0,5–1 mg prednisolon/kg/dag) under 3–6 månader. Pneumocystisprofylax med trimetoprim-sulfa krävs om höga doser steroider påbörjas. Vid svårare fall av BIP bör man överväga imatinib (300 mg, 1 x 1) tidigt i behandlingen för att lindra pneumoniten och minska risken för utveckling av lungfibros.
