Bildgranskning
Rekommendation:
- Dubbelgranskning bör tillämpas.
- Vid dubbelgranskning och diskussionsmöten bör en av två granskare vara erfaren screeninggranskare och ha tillräckligt hög årlig granskningsvolym.
- Intervallcancerfall bör identifieras och analyseras.
Arbetsmiljö
- Arbetsstationen bör vara avskärmad från buller och ljus.
- Dedikerade screeninggranskningssessioner rekommenderas, separat från annat diagnostiskt arbete och med möjlighet att arbeta ostört.
- Regelbundna raster eller avbrott minskar risken för uttröttning.
- Arbetsstationen ska ge möjlighet att snabbt växla mellan olika fönster i ett förprogrammerat visningsprotokoll. En knappsats eller liknande ska finnas för att navigera i hängningsprotokollet (key-pad).
- Granskningsskärmar avsedda för bröstdiagnostik ska användas. Två stora skärmar (45–50 cm diagonalt, 19–21″) med hög upplösning (5MP) med en ljusstyrka på 300 cd/m2 bör användas 110111. De bör vara kalibrerade enligt DICOM part 14: greyscale standard display function 112.
- Rummets belysning bör anpassas för att ge en hög och stabil kontrast av visade bilder 110.
Krav på medicinteknisk utrustning
Krav på medicintekniska produkter regleras i:
- lag (2021:600) med kompletterande bestämmelser till EU:s förordning om medicintekniska produkter
- förordning (2021:631) med kompletterande bestämmelser till EU:s förordning om medicintekniska produkter
- förordning (EU)2017/745, MDR (EUR-Lex - 32017R0745).
CE-märkning av en medicinteknisk produkt anger att den uppfyller kraven i förordning (EU)2017/745, MDR. Alla medicintekniska produkter som inte är egentillverkade, specialanpassade eller avsedda för klinisk prövning ska vara CE-märkta för att få släppas på marknaden.
För utrustning som skapar joniserande strålning, såsom mammografiutrustning, gäller även kraven i:
- strålskyddslag (2018:396)
- Strålsäkerhetsmyndighetens föreskrift och allmänna råd om medicinska exponeringar (SSMFS 2018:5)
- Strålsäkerhetsmyndighetens föreskrifter om grundläggande bestämmelser för tillståndspliktig verksamhet med joniserande strålning (SSMFS 2018:1).
Mammografiutrustningen bör uppfylla krav enligt IEC-standarden:
- IEC60601-2-45 Medical electrical equipment - Part 2-45: Particular requirements for the basic safety and essential performance of mammographic X-ray equipment and mammographic stereotactic devices IEC 60601-2-45:2011+AMD1:2015+AMD2:2022 CSV.
Vårdgivare som har medicinteknisk utrustning ska uppfylla kraven i:
- Socialstyrelsens föreskrifter om användning av medicintekniska produkter (HLSF-FS 2021:52).
Visningsprotokoll
Ett visningsprotokoll bör etableras lokalt. Syftet med ett visningsprotokoll är att screeningundersökningen ska presenteras på ett standardiserat sätt och att det går att bläddra genom en bildpresentation för att underlätta granskningen. Visningsprotokollet ska göra det lättare att jämföra de olika projektionerna av samma bröst, samt presentera bilder i en storlek som underlättar upptäckt av små förändringar inklusive mikroförkalkningar. Tidigare mammografiundersökningar ska också presenteras i visningsprotokollet, för jämförelser som ökar specificiteten 113114115. Att enbart jämföra med närmast föregående undersökning räcker inte nödvändigtvis, men sensitiviteten kan öka om man jämför med äldre undersökningar för att upptäcka långsamväxande förändringar 116. Även eventuella kliniska mammografier som har gjorts mellan screeningundersökningarna bör finnas tillgängliga för jämförelse. Om kvinnan vid föregående tillfälle undersöktes vid en annan mammografiavdelning bör man vid behov beställa de bilderna och skjuta upp granskningen tills de finns tillgängliga.
Omtagna bilder ska lägga som extrabilder i slutet av visningen eller i stack per projektion. Även en suboptimal bild kan tillföra information som underlättar bedömningen.
Figur 4. Exempel på ett visningsprotokoll för screeningbilder.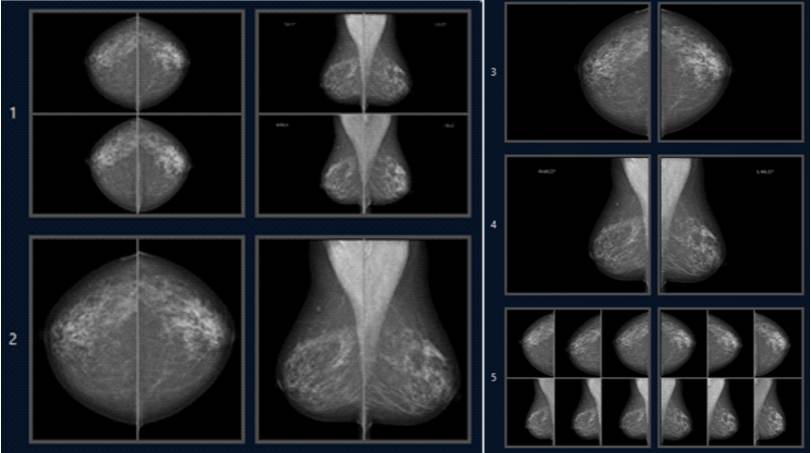 Bilderna presenteras i fem olika visningar. I den första visningen presenteras de aktuella bilderna överst, och jämförande bilder från näst föregående screeningomgång under dem. Därefter följer visningar av de aktuella screeningbilderna i olika storlek. I den avslutande visningen presenteras de aktuella bilderna i mitten av skärmen, omgivna av bilder från de två närmast föregående screeningomgångarna.
Bilderna presenteras i fem olika visningar. I den första visningen presenteras de aktuella bilderna överst, och jämförande bilder från näst föregående screeningomgång under dem. Därefter följer visningar av de aktuella screeningbilderna i olika storlek. I den avslutande visningen presenteras de aktuella bilderna i mitten av skärmen, omgivna av bilder från de två närmast föregående screeningomgångarna.
Screeninggranskning
Dubbelgranskning
Enligt europeiska riktlinjer ska screeningundersökningar dubbelgranskas för att säkerställa god sensitivitet, även när undersökningen primärt granskas av erfaren bröstradiolog 64. Studier har visat en något högre sensitivitet med dubbelgranskning än med enkelgranskning, med en effekt på 0,10–0,83 fler upptäckta cancrar per 1 000 screenade kvinnor 117118119.
Dubbelgranskning kan vara blindad eller oblindad, och det beslutas på regional nivå. Vid blindad granskning har andragranskaren inte tillgång till förstagranskarens bedömning, vilket eliminerar risken för påverkan 118. Studier har visat att första- och andragranskarens bedömning i högre grad skiljer sig åt vid blindad granskning 120. Blindad dubbelgranskning har i en nederländsk randomiserad studie visat högre sensitivitet, men på bekostnad av ökad återkallningsfrekvens, fler falskt positiva svar och fler benigna biopsier, jämfört med oblindad granskning 121. Dessa resultat är dock inte direkt överförbara till det svenska screeningprogrammet, eftersom den studerade screeninggranskningen inte innehöll arbitrering (dvs en granskningsmetod där ett fall går till en tredje granskare om förste- och andragranskarens screeningbeslut skiljer sig åt) eller konsensusmöte.
Vid oblindad granskning har andragranskaren tillgång till förstagranskarens bedömning. En fördel med det är att andragranskaren kan direktselektera fall, vilket minskar andelen fall som läggs till diskussion (se 12.5.2 Diskussion) och kortar ledtiden 118. Ledtiden kan också förkortas eftersom andragranskaren har möjlighet att prioritera de fall som förstagranskaren har lagt till diskussion.
Screeningundersökningar bör helst granskas i sammanhängande omgångar utan störningsmoment (batch reading) eftersom det finns indikationer på att detta kan minska andelen återkallelser med bibehållen cancerdetektionen 122123. Det är dock oklart hur många undersökningar som bör granskas per omgång. Europeiska riktlinjer antyder att träffsäkerheten kan minska om man arbetar med granskning i mer än 30–40 minuter i sträck 124. En norsk studie på 3 miljoner screeninggranskningar visade en tendens till lägre specificitet och högre sensitivitet i början av en granskningsomgång, och högre specificitet och lägre sensitivitet i slutet 125. Det finns också studier som talar för att uppmärksamheten minskar efter drygt 20 minuters granskning 126127, så en optimal screeninggranskningsomgång skulle kunna utgöras av 60–70 screeningundersökningar 125 vilket alltså kan ses som ett riktmärke.
Även tidpunkt under dagen kan ha betydelse. En stor norsk studie visade en tendens till att sensitiviteten sjönk och specificiteten ökade ju längre dagen fortskred, även om skillnaderna var små 128.
Symtom
I samband med granskningen görs även en bedömning av eventuella symtom som kvinnan har uppgett vid undersökningstillfället. Vid uppgiven knuta ska bildtagande personal ha märkt det aktuella området med en radiotät markör (se schablon, figur 2). Om screeningundersökningen, i kombination med anamnes och eventuellt tidigare undersökningar, säkert kan bedömas som negativ behöver uppgivna symtom inte automatiskt leda till selektion. Om undersökningen inte säkert kan bedömas som negativ, vanligen vid täta bröst, kan kvinnan selekteras trots att det saknas något misstänkt mammografiskt fynd.
Exempel på symtom som talar för bröstcancer är nytillkommen knöl, nytillkommen indragning av hud eller bröstvårta, blodig sekretion och eksem på bröstvårta och vårtgård. Om de uppgivna symtomen inte leder till diskussion eller selektion kan granskaren göra en anteckning som klargör att symtomen har beaktats.
Bifynd
I samband med granskning av screeningundersökningen kan olika typer av bifynd noteras, som inte ger misstanke om bröstcancer. Dessa bör inte leda till selektion och bifynd ska heller inte beskrivas i svaret från mammografiscreeningen. Ett undantag är fynd av bilateralt förstorade lymfkörtlar vilka kan tala för lymfom.
Exempel på bifynd är förändringar av benignt utseende, tecken på trasigt bröstimplantat och förstorade lymfkörtlar i axillen hos en patient som har känd orsak till lymfkörtelförstoring, såsom känt lymfom.
Screeningbeslut
Frisk
Ett standardiserat normalsvar (se 13.1 Svarsbrev) går automatiskt ut till kvinnan om det slutgiltiga beslutet efter dubbelgranskning blev ”frisk”.
Diskussion
Om en eller båda granskare beslutat om diskussion, på grund av något misstänkt eller oklart fynd, går undersökningen vidare till ett diskussionsmöte där man fattar ett konsensusbeslut om ”frisk”, ”selektion” eller ”tekniskt omtag”. Två läkare deltar i diskussionen, varav den ena ska vara erfaren screeninggranskare (se 12.6.2 Kompetenskrav vid screeninggranskning). Diskussionsmöten är resurskrävande men är ett viktigt steg för att begränsa andelen falskt positiva svar 118. Diskussionsmöten bör hållas regelbundet och frekvensen anpassas till enhetens screeningvolym, med syfte att ha korta ledtider och ett jämnt flöde av selektionsutredningar. Tid avsatt i schemat underlättar diskussionsmötesrutiner. Diskussionsmötena kan vara ett viktigt läromoment för screeninggranskare under upplärning.
Vid oblindad dubbelgranskning kan andragranskaren direktselektera eller fatta beslut om tekniskt omtag utan ett diskussionsmöte.
Tekniskt omtag
Om granskningen av screeningundersökningen anser att bildkvaliteten är otillräcklig för att bedöma om bilderna visar någon förekomst av bröstcancer behöver orsaken till den låga bildkvaliteten analyseras. Bilderna vägs då samman med den information som mammografisjuksköterskan antecknat i formuläret i samband med bildtagningen. Dålig bildkvalitet kan ha teknisk orsak, och beror oftast på undermålig positionering, eller vara relaterat till habitus, där man får bedöma om det går att ta bättre bilder. Det sistnämnda kan bero på att kvinnan har avbrutit undersökningen innan alla bilder tagits, eller på att kvinnan har någon sjukdom eller funktionsnedsättning. I vissa fall bedömer man att en eller flera bilder behöver tas om för att få en säker bedömning, och kvinnan kallas då tillbaka för ett tekniskt omtag – förutsatt att det bedöms vara möjligt att få bättre bilder. Mammografisjuksköterskan kan med fördel visa det tekniska omtaget för en läkare som kan bedöma om det håller tillräcklig kvalitet. Efter omtag granskas undersökningen på nytt med beslut om ”frisk”, ”diskussion” eller ”selektion”.
Ibland blir bedömningen att ett tekniskt omtag inte är meningsfullt trots bristfällig bildkvalitet. Om svårigheterna under bildtagningen har en medicinsk förklaring bör man bedöma om det är meningsfullt med framtida mammografiundersökningar. Kvinnan kan i så fall sättas på en spärrlista (se 10.3 Spärrlista). Om problemet kan vara övergående eller fluktuerande bör kvinnan kallas som vanligt till nästa screeningomgång. I dessa fall granskas det bildmaterial som finns, och om det inte visar tecken på bröstcancer skickar man ut ett normalsvar med reservation för att det inte gick att göra en fullständig undersökning.
Selektion
Ett selektionsbeslut fattas när mammografifynd eller kvinnans symtom kan misstänkas vara bröstcancer. Vid selektionsbeslutet görs en remissanteckning om vilka kompletterande mammografiprojektioner och undersökningar som planeras vid utredningstillfället, samt vid behov hur fallet ska prioriteras, om extra tid krävs (t.ex. vid planerad stereotaktisk biopsi) eller om tolk behövs.
Fyndet som lett till selektionen bör beskrivas eller märkas ut, för att minska risken för missförstånd vid utredningstillfället. Sifferkodning kan användas för att ange prioritetsgrad. Eventuell sifferkod som anges vid selektionstillfället är att betrakta som en prioriteringskod. Undersökningskoden för mammografibilderna sätts efter att kompletterande bilder tagits vid utredningstillfället.
Selektionsutredning och undersökningskoder
Om kvinnan vid utredningstillfället bedöms vara frisk får hon återgå till screeningen. Bröstradiologen ansvarar då för att ge kvinnan ett muntligt friskbesked. Mammografiutlåtandet vid utredningstillfället bör även gälla de bilder som togs vid screeningtillfället, eftersom inget annat svar på mammografiscreeningen går ut. Nationella undersökningskoder bör användas vid all radiologisk bröstdiagnostik. Aktuella undersökningskoder finns beskrivna i dokument hos Regionala cancercentrum i samverkan (se Tidig upptäckt av bröstcancer). Diagnostik i samband med selektionsutredningen beskrivs vidare i Nationellt vårdprogram bröstcancer.
Om selektionsutredningen leder till provtagning av en icke malignitetsmisstänkt förändring, och patienten behöver återkoppling av provsvaret, kommer den utredande läkaren och patienten överens om hur svaret ska ges (via brev eller telefon). Om det behövs fortsatt utredning sker det inom ramen för bröstcancerprocessen (se Nationellt vårdprogram bröstcancer).
Kvalitetssäkring och kompetenskrav
Varje mammografienhet bör ha rutiner för att kvalitetssäkra verksamheten, bland annat säkerställa att all personal i screeningverksamheten har rätt utbildning och kompetens. Medicinskt ansvarig läkare bör ha en nyckelroll i avdelningens kvalitetsarbete. Enhetens resultat, mätt med kvalitetsindikatorer och ledtider, bör följas upp regelbundet, och jämföras på regional och nationell nivå. Informationen från uppföljningen bör användas för att upptäcka eventuella förbättringsområden och för att utveckla verksamheten. Lokala rutiner bör uppdateras regelbundet och överensstämma med regionala och nationella riktlinjer. Intervallcancerfall (se 5.2 Definition av cancer i relation till screeningen) är en viktig kvalitetsindikator och bör identifieras, klassificeras och analyseras.
Kompetenskrav för bröstradiologer
Radiologen ska ha god kännedom om nationella och regionala vårdprogram och medicinska riktlinjer inom bröstradiologi och bröstcancer. Radiologen ska också ha aktuell strålskyddsutbildning.
För att arbeta självständigt inom bröstradiologi ska radiologen ha genomgått en upplärningsperiod som motsvarar 2,5 år på heltid. Under upplärningsperioden ska det finnas tillgång till handledning. Efter individuell bedömning kan arbetet successivt bli mer självständigt. Till en början ska arbetet omfatta klinisk bröstradiologi, inklusive punktioner. Radiologen ska också regelbundet delta på multidisciplinära konferenser. Efter cirka 6 månader kan radiologen, efter individuell bedömning, börja delta i granskningsarbete i screeningen.
Det är värdefullt att screeningenheten eller den enskilda radiologen har rutiner för att återkoppla screeninggranskningen i form av antal granskade undersökningar, andel fall lagda till diskussion och antal fall som granskaren friskförklarat men där selektionsutredning har resulterat i en cancerdiagnos. Det finns även metoder för att systematiskt kvalitetsutvärdera radiologens granskning, t.ex. det brittiska programmet Personal Performance in Mammographic Screening (PERFORMS) där ett antal bilder granskas som vore det screening, med återkoppling på individ- och gruppnivå om mått såsom sensitivitet och specificitet och typer av fall som radiologen eventuellt missar 129. Resultat av PERFORMS-granskning har visat sig korrelera med resultat av screeninggranskning 130.
Upprätthålla kompetens
För att upprätthålla kompetensen för självständigt arbete inom bröstradiologi bör radiologen regelbundet tjänstgöra på en bröstradiologisk avdelning. I arbetet bör det ingå att göra både klinisk bröstdiagnostik, inklusive punktioner, och screening, och att delta vid konsensusdiskussioner och multidisciplinära konferenser. Radiologen bör granska 3 500–11 000 screeningundersökningar årligen 64. Det bör finnas tillgång till svar på cytologi och histopatologisk diagnos för att kunna följa upp patientfall. Vidare bör radiologen regelbundet delta i fortbildning inom bröstdiagnostik och hålla sig uppdaterad om kunskapsläget inom området.
Kompetenskrav vid screeninggranskning
Målet är att alltid ha en erfaren granskare vid dubbelgranskningar och diskussionsmöten. Europeiska riktlinjer rekommenderar att åtminstone den ena av granskarna är en läkare med minst 2,5 års erfarenhet av bröstradiologi och en granskningsvolym på 3 500–11 000 screeningundersökningar per år 131. Evidensen för dessa gränsvärden är dock låg och de får ses som ett riktmärke. I en stor retrospektiv norsk studie med över 2 miljoner screeningundersökningar och 121 radiologer sågs en tendens till sänkt specificitet vid låg årlig granskningsvolym (< 4 000 screeningundersökningar) och sänkt sensitivitet vid hög årlig granskningsvolym (> 10 000 undersökningar) 132.
För radiologer under upplärning behövs en individuell bedömning, men riktmärket är att de efter cirka 6 månaders arbete med klinisk bröstradiologi kan börja granska screeningundersökningar, och vara en av granskarna i samband med konsensusdiskussioner. Screeningenheten bör ha rutiner för att undvika att två mindre erfarna granskare deltar i granskningen av samma fall.
Fjärrgranskning av bilder
Vid fjärrgranskning av screening bör det finnas rutiner för säker datahantering. Om en extern granskare anlitas ansvarar den upphandlande verksamheten för att granskaren uppfyller kraven på kompetens och utrustning. Det bör också finnas rutiner för säker kommunikation mellan fjärrgranskare och personal på screeningenheten.
Intervallcanceranalys
Intervallcancerfrekvens är ett mått på screeningprogrammets effektivitet, och. man bör eftersträva en låg nivå av intervallcancerfall. Nivån bör bedömas tillsammans med andra kvalitetsindikatorer i screeningprogrammet, såsom återkallningsfrekvens, detektionsrat och längden på intervallet mellan screeningundersökningar. Data om screeningupptäckt cancer och intervallcancer används för att beräkna screeningprogrammets sensitivitet.
Varje screeningenhet bör ha rutiner för att identifiera, analysera och klassificera sina intervallcancerfall. I samband med analysen bedömer man först screeningundersökningen, och därefter den kliniska mammografin vid diagnostillfället, varvid bedömningen av screeningundersökningen omprövas. I samband med bedömningen klassificeras intervallcancerfallen. Om det finns olika åsikter om klassificeringen rekommenderas ett majoritetsbeslut.
Intervallcancer kan klassificeras i följande grupper 133:
- Mammografiskt ockult: Cancern syns varken på screeningmammografin eller på den kliniska mammografin vid diagnostillfället.
- Sann intervallcancer: Cancern är inte synlig på screeningmammografin, men kan ses på den kliniska mammografin vid diagnostillfället.
- Minimala tecken (minimal signs): Screeningmammografin visar en diskret förändring, som inte nödvändigtvis borde ha lett till selektion. Vid diagnostillfället finns antingen fortfarande minimala tecken eller en tydlig förändring på den kliniska mammografin.
- Missad cancer: En tydlig förändring som borde ha lett till selektion syns på screeningmammografin och vid den kliniska mammografin vid diagnostillfället.
Analysen omfattar även att bedöma om screeningundersökningen, inklusive positioneringen, höll tillfredsställande teknisk kvalitet, för att ta reda på om suboptimal bildkvalitet kan ha bidragit till att cancern inte upptäcktes. Uppföljning och analys av intervallcancer är viktigt i utbildningssyfte, och samtliga läkare som deltar i screeninggranskning bör också delta i analysen av intervallcancerfall. Analys av fall med minimala tecken och missad cancer kan bidra till att öka granskarens sensitivitet. Andelen missade cancrar bör inte överstiga 20 % av det totala antalet intervallcancerfall 124.
Medicinskt ansvarig läkare
Medicinskt ansvarig läkare på en bröstradiologisk avdelning bör ha ingående kunskap om screeningprogrammet och om radiologisk bröstdiagnostik. I det medicinska ansvaret ingår även att ha kunskap om regionala och nationella riktlinjer, och ansvar för att implementera dem i enlighet med vårdprogrammen.
Den medicinskt ansvariga läkaren ska även se till att det finns rutiner för att sammanställa och följa upp screeningprogrammets kvalitetsindikatorer och för att analysera intervallcancrar. Läkaren bör vidare ansvara för att det finns fungerande rutiner för att utbilda och fortbilda bröstradiologer och utvärdera läkares kompetens. Dessutom bör den medicinskt ansvariga läkaren fungera som kontaktperson för avdelningen i medicinska frågor från andra kliniker eller remittenter, och skapa rutiner för att hantera anmälningsfall och avvikelserapporter.
Granskning med artificiell intelligens
Artificiell intelligens (AI) som appliceras på bildigenkänning, med metoder såsom djupinlärning med faltningsnätverk, har gett goda resultat när det gäller att klassificera mammografibilder. Det finns också flera CE-märkta AI-produkter för mammografitolkning. Retrospektiva studier har visat potentiella fördelar med AI i screeningen, men det har saknats evidens från prospektiva studier 134. Nu finns dock resultat från två svenska prospektiva studier, och flera andra studier är på gång både nationellt och internationellt 135.
I en svensk randomiserad studie med 100 000 deltagare utvärderas ett granskningsprotokoll med AI (Transpara v 1.7, Screenpoint Medical) som triagerar screeningundersökningar till låg eller hög risk för cancer. Lågriskundersökningar enkelgranskas medan högriskundersökningar dubbelgranskas, och AI används som beslutsstöd vid granskningen (MASAI, clinicaltrials.gov NCT04838756). En första analys på 80 000 kvinnor visar att AI-stödd screening är kliniskt säker eftersom cancerdetektionen inte sjönk trots att läkargranskningsvolymen minskade med 44 % 136. I studien upptäcktes 20 % fler cancrar med AI jämfört med dubbelgranskning (6,1 per 1 000 respektive 5,1 per 1 000 screenade kvinnor). Återkallningen ökade med AI-stödd screening (2,2 % respektive 2,0 %), men den ökade återkallningen resulterade i fler upptäckta cancrar och andelen falskt positiva var densamma (1,5 %) i både interventionsgruppen och kontrollgruppen. Andelen fall som hänvisades till konsensusdiskussion var också jämförbar i de två grupperna (4,0 % med AI-stödd screening och 3,9 % med standardscreening). MASAIstudien har intervallcancer som primärt utfallsmått, och resultaten förväntas vara klara under 2025.
Ytterligare en prospektiv AI-screeningstudie med 55 581 kvinnor har genomförts i Sverige (ScreenTrust CAD, clinicaltrials.gov NCT04778670) 137. Studien hade en parad design där undersökningarna dubbelgranskades och analyserades med AI (Lunit v 1.1.6). Om någon av granskarna eller AI flaggade undersökningen som misstänkt hänvisades den till konsensusdiskussion. Olika granskningsförfaranden kunde sedan simuleras: AI som ensam granskare, enkelgranskning plus AI eller dubbelgranskning plus AI. Med enkelgranskning plus AI upptäcktes 4 % fler cancrar än med standard dubbelgranskning (4,7 per 1 000 respektive 4,5 per 1 000 screenade kvinnor) samtidigt som återkallningen minskade (2,9 % respektive 2,8 %). Med detta screeningprotokoll skulle granskningsvolymen före diskussionsmötet kunna minskas med cirka 50 %. Andelen fall som lades till diskussion ökade dock från 7,4 % till 9,0 %. Screeningenheten i Stockholm där studien genomfördes (S:t Görans sjukhus) har infört AI i screeningen.
Nyligen startade ytterligare en prospektiv observationsstudie i Sverige, där man använder AI (Transpara) för triagering till enkel- eller dubbelgranskning (AIM-RÖ, clinicaltrials.gov NCT06187350).
Det finns ingen uppdaterad rekommendation från ECIBC eller Socialstyrelsen om användning av AI eftersom de ovan nämnda prospektiva studierna nyligen har publicerats 72131. Om en screeningenhet väljer att införa AI måste det ske inom ramen för ett ordnat införande med krav på noggrann monitorering av algoritmens prestanda och kvalitetsindikatorerna för screening (se Kapitel 16 Kvalitetsindikatorer och målnivåer). Mer evidens för ett välgrundat beslut om att införa AI väntas med resultat om intervallcancerfrekvens och kostnadseffektivitet, optimalt screeninggranskningsprotokoll och reproducerbara resultat.
I det svenska pilotprojektet VAI-B har en valideringsplattform utvecklats där regionala screeningenheters mammografibilder kan testas med ett urval av AI-verktyg 138.
