Primär behandling
Val av behandling
Primärbehandlingen beror på om patienten har cHL eller NLPHL, och vid klassiskt Hodgkins lymfom görs även en indelning i låga och avancerade stadier. Detta kapitel innehåller även ett avsnitt om strålbehandling.
Behandling av klassiskt Hodgkins lymfom, låga stadier
Rekommendationer
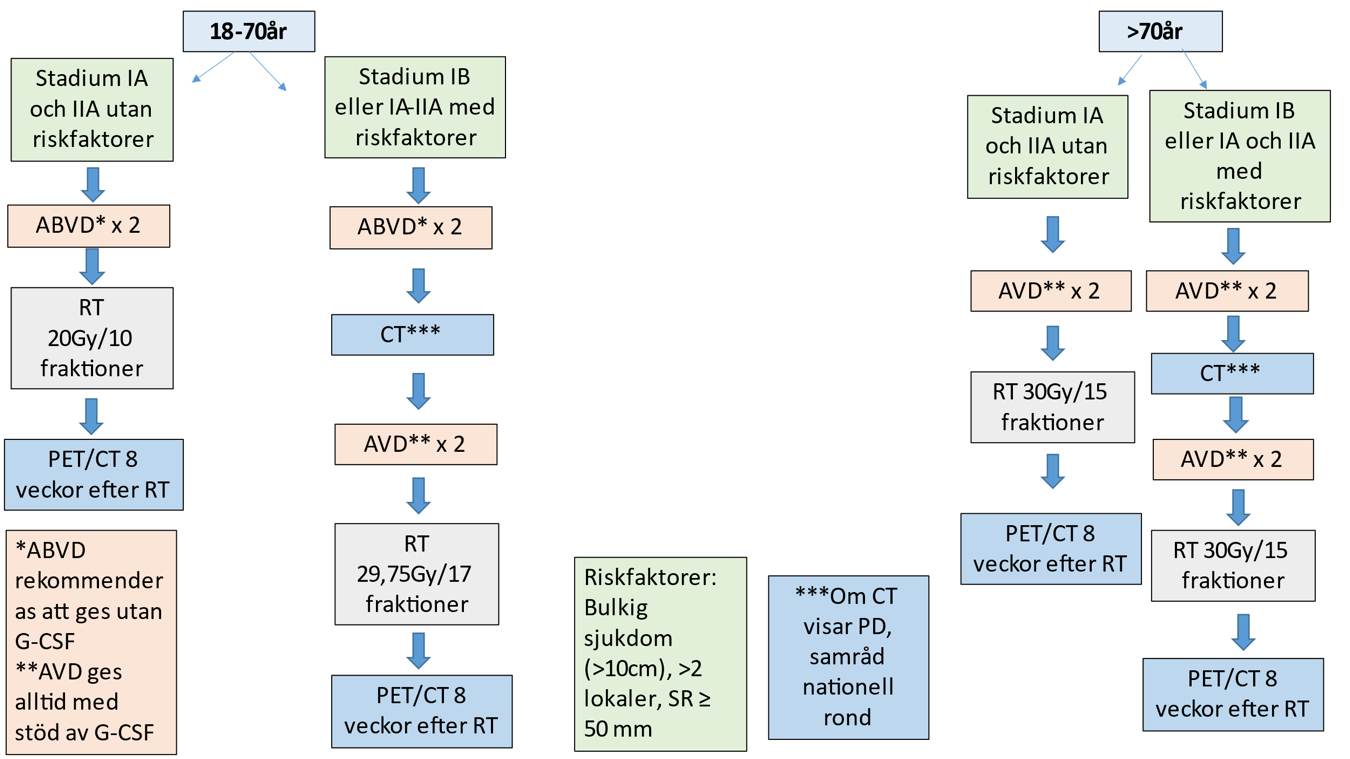
Stadium IA och IIA samt IB, 18–70 år (++++)
- Stadium IA och IIA utan förekomst av negativa prognosfaktorer: ABVD* x 2 följt av INRT/ISRT 20 Gy/10 fraktioner.
- Stadium IA och IIA med förekomst av en eller flera negativa prognosfaktorer samt stadium IB (oavsett förekomst av negativa prognosfaktorer): ABVD* x 2, behandlingskontroll med CT, i avsaknad av progress AVD** x 2 följt av INRT/ISRT 29,75 Gy/17 fraktioner.
Stadium IA och IIA samt IB, > 70 år (++)
- Stadium IA och IIA utan förekomst av negativa prognosfaktorer: AVD** x 2 följt av INRT/ISRT 30 Gy/15 fraktioner.
- Stadium IA och IIA med förekomst av negativa prognosfaktorer samt stadium IB (oavsett förekomst av negativa prognosfaktorer): AVD x 4 följt av INRT/ISRT 30 Gy/15 fraktioner.
* ABVD rekommenderas att ges utan G-CSF pga. ökad risk för lungtoxicitet 24.
** AVD ges alltid med stöd av G-CSF.
För riskfaktorer, se faktaruta 2.
Flödesschema 1. Behandling av klassiskt Hodgkins lymfom, låga stadier
Alla patienter med låga stadier där man överväger att inte ge kombinationsbehandling med cytostatika och strålbehandling bör diskuteras på den nationella Hodgkinronden för behandlingsbeslut innan cytostatika startats.
Låga stadier, stadium IA och IIA samt IB, behandlas sedan lång tid med kombinerad behandling 30 dvs. cytostatikabehandling (ABVD) följt av strålbehandling. Strålbehandlingen planeras utifrån ursprunglig tumörvolym, så undersökning med FDG-PET-DT före behandlingsstart är nödvändig för att kunna minimera fältets volym enligt involved node/involved site (INRT/ISRT (se avsnitt 11.5 Strålbehandling). En förutsättning för att ge kombinationsbehandling är att dosplanen ger acceptabla doser till riskorgan såsom hjärta och lungor. Patienten bör alltid diskuteras vid en nationell Hodgkinrond (se avsnitt 11.5 Strålbehandling) om dosplanen innebär doser till lungorna V20 > 30 % 31 och/eller medeldos till hjärtat > 5–10 Gy 3233. Även vid lägre doser till riskorgan uppmuntras att strålplanen visas vid ronden.
Om dosplanen innebär oacceptabla doser till frisk vävnad ges behandling i enlighet med avancerade stadier (se avsnitt 11.3). I avsaknad av negativa prognosfaktorer visar randomiserade studier att mängden cytostatika och dosen strålbehandling kan minskas utan att öka risken för återfall 34.
I långtidsuppföljning av RATHL-studien för avancerade stadier sågs ingen försämring av sjukdomskontroll om Bleomycin uteslöts efter 2 cykler 35. Vid uppföljning av lungfunktion i samma studie sågs en tydlig ökning av kvarstående försämrad diffusionskapacitet vid fler än 2 cykler ABVD (abstract 612 ASH 2023). Med detta som bakgrund ges inte mer än två cykler ABVD inför strålbehandling vid tidiga stadier. G-CSF bör undvikas vid ABVD pga. ökad risk för lungtoxicitet av bleomycin (+++). AVD (ABVD utan Bleomycin) ges alltid med stöd av G-CSF (se avsnitt 14.3.6). Gränsdragningen avseende åldersgrupper är inte absolut utan bygger på en helhetsbedömning av allmän samsjuklighet och postulerade riskfaktorer för att utveckla bleomycinorsakad lungtoxicitet: njursvikt, tidigare strålbehandling mot lungorna. ABVD (och AVD) bör ges med så liten dosreduktion som möjligt. Ge fulldos om TPK > 50 x 109/L och oavsett värde för neutrofila.
När det gäller äldre patienter, över 70 år, med cHL i låga stadier har toxiciteten än större betydelse. Toxicitet från bleomycin har inte specifikt studerats hos patienter äldre än 75 år. Den kliniska erfarenheten är att ABVD inte tolereras av patienter över 70 år. Den vetenskapliga grunden för rekommendationer avseende denna grupp patienter är svag. I HD 13-studien 36 observerades en något ökad risk för återfall vid behandling med AVD jämfört med ABVD. De försämrade resultaten för AVD-gruppen får i detta sammanhang ses som acceptabla jämfört med den dramatiska ökningen av bleomycintoxicitet. Därför rekommenderas AVD inför strålbehandling i denna åldersgrupp.
Vid hög ålder och samsjuklighet är det inte lämpligt med tyngre kombinationscytostatikabehandling eller antracyklinbehandling, och då kan man i tumörreducerande syfte i stället pröva bendamustin, 90 mg/m2 i två dagar, helst 3–4 cykler, och därefter ISRT 30–36 Gy beroende på kvarvarande tumörbörda.
Vid hög ålder och samsjuklighet kan man överväga enbart strålbehandling.
Behandling av klassiskt Hodgkins lymfom, avancerade stadier
Rekommendationer
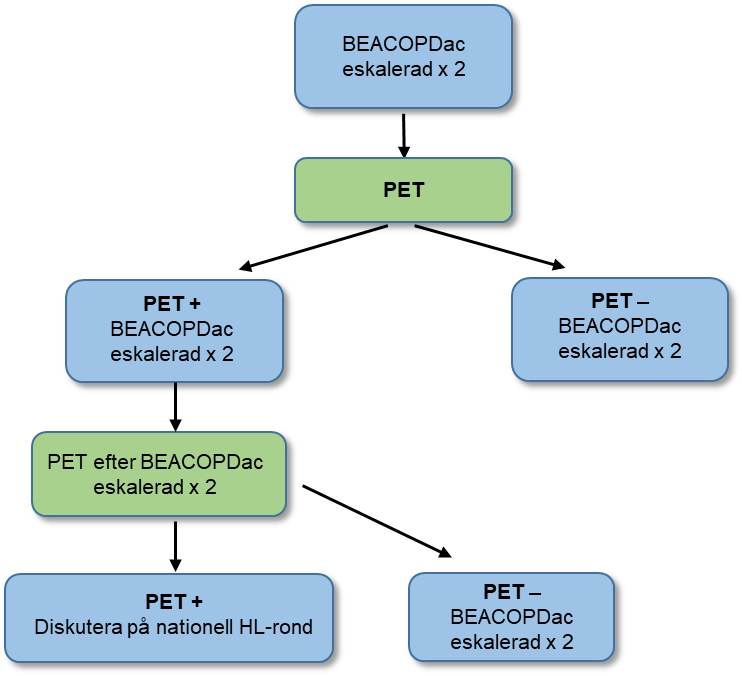
Stadium IIB - IV 18–60 år*
- Inled med BEACOPDac x 2 (++++). Efter de första 2 kurerna rekommenderas tidig utvärdering med FDG-PET-DT (++++).
- För PET-negativa (Deauville 1–3) rekommenderas ytterligare 2 kurer BEACOPDac eskalerad (+++).
- För PET-positiva (Deauville 4–5) rekommenderas ytterligare 4 BEACOPDac. Ny FDG-PET-DT görs efter BEACOPDac eskalerad nr 4.
- Om FDG-PET-DT är fortsatt positivt, diskutera på nationell Hodgkinrond. Man kan överväga salvagecytostatika eller lokal strålbehandling i detta läge.
- Det är viktigt att följa rekommendationer för dosreduktion! Se Nationella regimbiblioteket.
Stadium IIB – IV, > 60 år
* För patienter i åldern 18–60 år bygger behandlingen på den tyska HD18-studien 39. BEACOPP eskalerad byts dock ut mot BEACOPDac eskalerad (eller BrECADD enligt nedan) på basen av brittiska studier, som visar lägre toxicitet och lika bra totalöverlevnad och recidivfri överlevnad som av BEACOPP 40. Försiktighet rekommenderas vid behandling med BEACOPDac eskalerad för patienter 50–60 år. Uppmärksamhet på samsjuklighet och låga albuminvärden. Det är viktigt att följa rekommendationerna för dosreduktion även för BEACOPDac eskalerad. Dessa finns i Nationella regimbiblioteket. Mellanprover med blodstatus och neutrofila bör tas 3 gånger i veckan (måndag, onsdag, fredag).
Studien HD21 har publicerats i Lancet och visat signifikant bättre PFS samt signifikant bättre resultat avseende toxicitet för BrECADD jämfört med BEACOPP eskalerad 41 Denna har dock inte analyserats hälsoekonomiskt ännu.
För patienter som har svårt att tolerera BEACOPDac/BrECADD och har en negativ PET2 kan behandlingen de-eskaleras till 4 AVD istället för 2 BEACOPDac/BrECADD. Möjligheten att de-eskalera stärks av studien AHL2011, där de-eskalering till ABVD gav likvärdiga resultat som 6 BEACOPP eskalerad för PET2-negativa patienter 42. Bleomycin bedöms ha en begränsad roll, varför AVD bedöms rimligt i sådana situationer.
I Sverige räknas stadium IIB–IV som avancerad sjukdom och behandlas med enbart cytostatika.
Se även faktaruta 3, riskfaktorer för stadium IIB, III och IV, cHL (International Prognostic Score, IPS). Hänsyn tas i normalfallet inte till IPS i valet av behandling.
Flödesschema 2. Behandling av klassiskt Hodgkins lymfom, avancerade stadier, 18–60 år
När det gäller patienter över 60–70 år som bedöms klara kombinationscytostatikabehandling rekommenderas nu AVD i kombination med nivolumab (N-AVD).
AVD som cytostatika är att föredra av flera skäl: Äldre patienter med HL har i allmänhet svårt att tolerera mer intensiv behandling, och i synnerhet bleomycin 43. Dosintensiteten kan vara svår att upprätthålla och det anses inte lämpligt att kombinera ABVD-regimen med G-CSF pga. ytterligare ökad risk för bleomycinassocierad lungtoxicitet 43. Behandling med AVD ger lika bra överlevnad som ABVD och är överlägsen CHOP för äldre 44. I RATHL-studien finns inga signifikanta skillnader i överlevnad för de patienter som efter 2 ABVD-cykler randomiserades till ytterligare 4 AVD-cykler jämfört med dem som randomiserades till ytterligare 4 behandlingar med ABVD 45. Detta resultat kvarstår med lång tids uppföljning 46. I ABVD-armen gav bleomycin nedsatt lungfunktion som kvarstår över tid 35.
En studie har nu visat mycket god PFS med N-AVD, som är överlägsen den som uppnås med A2VD (se nedan). Vinsten var störst för äldre patienter och patienter i avancerat stadium 3747. Tillägg av nivolumab till AVD anses därför motiverat för denna mycket begränsade patientgrupp, med annars dålig prognos.
Studien ECHELON-1 visade bättre totalöverlevnad för A2VD än för ABVD 48. A2VD kan därför övervägas för äldre med autoimmuna sjukdomar, där man vill undvika PD-1-hämmare. Uppmärksamhet på neurotoxicitet är viktigt. Vid tecken på neurotoxicitet bör brentuximab vedotin (och/eller vinblastin) seponeras. Bra resultat har också visats vid behandling sekventiellt med 2 brentuximab vedotin, följt av AVD och därefter ytterligare 2 brentuximab vedotin 49. Sådan förbehandling med brentuximab vedotin kan också övervägas vid dåligt allmäntillstånd.
Vid hög ålder och samsjuklighet är tyngre kombinationscytostatikabehandling eller antracyklinbehandling inte lämpligt. Då kan man i pallierande syfte exempelvis behandla med bendamustin eller veckodos vinblastin (5–10 mg/m2) samt överväga strålbehandling med större strålfält än vad som normalt anses indicerat. PD-1-hämmare kan användas vid recidiv.
Infektionsprofylax
Patienter med HL kan ha en defekt cellmedierad immunitet 50, och vid lång cytostatikabehandling och för äldre patienter finns risk för opportunistinfektioner. Vid avancerade stadier och vid behandling med fler än 2 cykler cytostatika rekommenderas Pneumocystis jirovecii-pneumoni-profylax. Herpesprofylax och candidaprofylax kan övervägas (se avsnitt 14.3 Infektionsprofylax och kroniska infektioner). Vid allergi mot trimetoprim-sulfa ska pentacarinat ges.
Hodgkins lymfom under graviditet
Hodgkins lymfom är den vanligaste hematologiska maligniteten som diagnostiseras under graviditet och 3 % av alla cHL-patienter är gravida vid diagnos 5152. Det finns evidens för att cHL kan behandlas framgångsrikt under graviditeten efter den första trimestern med bra behandlingsresultat och minimala negativa effekter för fostret. I en retrospektiv analys 53 var de vanligaste komplikationerna för tidiga sammandragningar och för tidig fostervattenavgång. Den mest studerade cytostatikakombinationen är ABVD 5455. Förlossningen behöver inte påskyndas för att tidigare kunna starta cytostatikabehandling, med tanke på att förtidsförlossning är den främsta orsaken till nedsatt utveckling hos barn som varit utsatta för cancerbehandling prenatalt.
Fullständig utredning med lymfkörtelbiopsi rekommenderas. Radiologisk stadieindelning bör begränsas till det minimum som krävs för att identifiera sjukdom som allvarligt hotar moderns eller barnets välbefinnande. PET-DT ska undvikas. I första hand rekommenderas endast röntgen torax med lämplig skärmning och ultraljud av buken alternativt helkropp MRT (utan gadolinium) 56.
Behandlingsstrategin bör individualiseras baserad på symtom, stadium, graviditetsperiod och patientens önskemål. Patienten ska alltid diskuteras på en nationell Hodgkinrond, se avsnitt 11.5 Strålbehandling; extra rond kan vid behov sammankallas via e-post. Tätt samarbete med förlossningsenheten ska eftersträvas.
Allmänt gäller följande principer 5657:
- Start av behandlingen kan skjutas upp, men noggrann övervakning och uppföljning under hela graviditeten måste säkerställas. Om patienten är allvarligt sjuk och omedelbar behandling krävs ska man dock överväga att avbryta graviditeten. FDG-PET-DT efter förlossningen rekommenderas och därefter standardbehandling.
- Under första trimestern rekommenderas cytostatikabehandling endast vid vital indikation. Man kan då överväga att ge vinblastin + steroider.
- Strålbehandling bör inte ges under graviditeten.
- Under andra och tredje trimestern kan ABVD ges utan risk för påverkan på fostret 53. Behandling med AVD istället för ABVD kan ges för att undvika den potentiella risken för bleomycinrelaterade komplikationer vid eventuellt behov av syrgasbehandling i samband med förlossning. Med hänsyn till ökad plasmavolym under graviditet, bör cytostatikadoser beräknas på patienten aktuella vikt och inte på vikten före graviditet 57.
- Behandling med BEACOPDac rekommenderas inte.
- Om kvinnan blir gravid efter genomgången behandling för Hodgkins lymfom ses ingen ökad risk för återfall 58.
Behandling av NLPHL
Rekommendationer
Ca 5 % av alla HL-fall är histologiskt NLPHL och behandlas enligt följande:
- Stadium IA och IIA, icke-bulkig sjukdom
– Rituximab veckovis x 4. FDG-PET-DT efter 6 veckor. Vid PET-negativitet INRT/ISRT 20 Gy/10 fraktioner, annars 30 Gy/15 fraktioner. - Stadium IA och IIA, bulkig sjukdom (oftast lokaliserat på halsen)
– R-CHOP X 3 med FDG-PET-DT 3 veckor efter avslutad behandling. Vid PET-negativitet INRT/ISRT 20 Gy/10 fraktioner, annars 30 Gy/15 fraktioner. - Stadium IB och IIB
– Ovanligt och bör diskuteras på nationell Hodgkinrond. Minst tre R-CHOP 21 följt av lokal strålbehandling. - Stadium IIIA och IVA utan tumörrelaterade symtom
– Rituximab veckovis x 4, vilket upprepas 3 månader från start, förutsatt respons, eller RCHOP 21 x 6. - Stadium IIIB och IVB
– R-CHOP 21 x 6.
Vid NLPHL uttrycker tumörcellerna CD20 på sin yta och de flesta patienter (i praktiken alla med lågt stadium och många med mera avancerad sjukdom) uppvisar initialt mycket goda responser enbart med rituximabbehandling. En hel del patienter förblir också i långtidsremission med enbart denna behandling. Vid lokaliserad sjukdom ser man i retrospektiva studier dock en högre återfallsfrekvens vid behandling enbart med rituximab 5960, jämfört med enbart lokal strålbehandling given med involved field-teknik 616263. Därför rekommenderas inte singelbehandling med rituximab i litteraturen om syftet är kuration 59. Den beskrivna strålbehandlingen innebär dock både större strålvolymer och högre slutdoser än vad vi numera använder vid kombinationsbehandling av klassiskt Hodgkins lymfom och är inte ett lämpligt alternativ med tanke på eventuella långtidsbiverkningar av strålbehandlingen.
Det finns inga randomiserade studier för denna ovanliga variant av Hodgkins lymfom, men utifrån våra egna och andras positiva erfarenhet av singelbehandling med rituximab har Svenska Hodgkingruppen enats om att införa en ny, kurativt syftande kombinationsbehandling. Denna behandling innebär att de allra flesta patienter med NLPHL stadium I–II behandlas med rituximab i tumörreducerande syfte följt av konsoliderande strålbehandling i kurativt syfte, dock till de mindre volymer och lägre slutdoser som används vid klassiskt HL.
I drygt 20 % av fallen är sjukdomen avancerad (stadium III–IV) vid diagnos, och beroende på patientens ålder och allmäntillstånd kan man välja en långtidspallierande behandling med enbart rituximab eller kurativt syftande cytostatikabehandling. Det verkar också finnas en undergrupp som hela tiden recidiverar, vilket talar för att först prova med enbart antikroppsbehandling. Det finns indicier som talar för att regimer som innehåller högre doser av alkylerare, t.ex. CHOP, är bättre än exempelvis ABVD vid denna sjukdom, kanske pga. bättre effekt vid samtidig ockult transformation 6465. Vi rekommenderar därför R-CHOP 21 när cytostatikabehandling är indicerad.
Uppföljning av NLPHL
Generellt bör man ordna någon form av långtidsuppföljning för alla patienter med NLPHL eftersom det finns rapporter om mycket sena återfall, även efter 20 år. Transformationsrisken till, framför allt, T-cellsrikt B-cellslymfom är inte ringa och anses vara ökad vid primärt bukengagemang 60. En rebiopsi bör utföras vid varje återfall.
Strålbehandling
Strålbehandling av HL bör utföras vid sjukhus med stor vana vid denna behandling. Alternativet är att den färdiga strålplanen diskuteras vid en nationell Hodgkinrond i god tid före strålstarten.
Strålförberedelser
För detaljer angående planering och genomförande av strålbehandling hänvisas till bilaga 4 Radiotherapy protocol for Hodgkin Lymphoma.
Alla patienter med mediastinal utbredning rekommenderas behandling i Deep Inspiration Breath Hold (DIBH) 6667, både för att minska de interna rörelserna och för att riskorganen får en mer fördelaktig placering och därmed lägre dos. Behandlingen ges antingen med protoner 6869 vid Skandionkliniken i Uppsala eller med fotoner på hemmakliniken.
För att kunna genomföra behandling i DIBH krävs en god reproducerbarhet av patientens andetag. Om patienten, av olika skäl, inte kan hålla andan inom gatingfönstret på ett reproducerbart sätt görs en kompletterande 4DCT för kontroll av rörelsen i behandlingsområdet. Om rörelsen i behandlingsområdet är 5 mm eller mindre kan protonbehandling ges i friandning (FB), men om större rörelse ges behandlingen med fotoner 70.
Patienter ≤ 60 år med lokaliserad (stadium I–IIA), supradiafragmal sjukdom är inkluderbara i PRO-Hodgkinstudien och då ges behandlingen med protoner i första hand (icke-randomiserad studie).
Vid behandlingsområden utanför mediastinum (hals eller ljumskar tex) kan protonbehandling också vara aktuell. I de fall protonbehandling planeras och patienten har en port-a-cath (subcutan venport) i behandlingsområdet bör man ta ställning till extirpation av denna före behandlingsstart. Den kan störa dosplanering och behandling om den ligger i behandlingsområdet.
Vid protonbehandling görs alla förberedelser på närmaste universitetsklinik enligt fastställd rutin.
Ronder
Alla patienter med kurativt syftande behandling bör diskuteras vid en nationell Hodgkinrond, speciellt om dosplanen innebär doser till lungorna där V₂₀ Gy > 30 % 31, medeldosen till hjärtat överstiger 5 Gy 3271 och/eller medeldosen till bröstparenkym till unga kvinnor (< 30 år) överstiger 4 Gy 7273.
Även vid lägre doser till riskorgan uppmuntras att dosplanen visas vid ronden.
Konferensen äger rum torsdagar udda veckor kl. 12.00.
Kontaktpersoner:
Daniel Molin
E-post: Daniel.Molin@igp.uu.se
Ingrid Kristensen
Tel: 046-17 39 03
E-post: Ingrid.Kristensen@skane.se
Alla patienter med låga stadier där man överväger att inte ge kombinationsbehandling med cytostatika och strålbehandling ska också diskuteras på ronden före behandlingsbeslut.
Om protonbehandling planeras visas jämförande proton- och fotonplaner även på Skandionrond. Konferensen äger rum måndagar och onsdagar varje vecka kl. 13.00 samt vid behov på fredagar kl. 11.00.
Fixation
Fixationen utförs individuellt beroende på behandlingsområde och behandlande klinik. Det kan vara en fördel att diskutera upplägget med fysiker/dosplanerare före patienten gör sin planerings-DT.
Vid behandlingsområde på hals och i bröstkorgen kan man överväga att fixera patienten med armarna ner i fempunktsmask, öppen för ansiktet. Masken tillverkas med stöd för haka och axlar samt tajt över bröstkorgen. Axlar och bröstkorg ska vila stabilt mot bordet. Kort strap eller ring att hålla i med händer i höftnivå samt knäkudde.
Att behandla med armarna ner kan innebära att bröstparenkymet hos kvinnor faller ner och därmed något ur behandlingsområdet.
Om behandling med protoner övervägs ska fixationen vara kompatibel med protonbehandling.
Planerings-DT
Planerings-DT ska utföras enligt nedanstående:
- DT ska utföras med 3 mm snitt.
- DT utan kontrast för dosberäkning.
- DT med kontrast kan övervägas för bättre bildåtergivning av bl.a. körtlar.
- Vid behandlingsområden i mediastinum rekommenderas:
– Planerings-DT i djup inandning DIBH. Vid behandling i DIBH rekommenderas förberedande andningsträning samt kontroll av inandningens reproducerbarhet. Detta kontrolleras genom att patienten gör upprepade DIBH kontroller med lågdos DT. Om möjligt både samma dag som dosplanerings -DT samt några dagar senare.
– Fyrdimensionell DT (4D-DT) för kontroll av rörelser inom behandlingsområdet skall göras vid behandling i FB.
Targetdefinition
Cytostatikabehandling ges som regel före strålbehandlingen och gör att körtlarna minskar i storlek. Därför är alla primära diagnostiska undersökningar av vikt. Detta gäller i första hand diagnostisk DT och FDG-PET-DT, men även MRT, palpationsfynd och operationsberättelse kan vara av betydelse.
Fusionering av diagnostiska undersökningar och dosplanerings-DT rekommenderas. Matchningen påverkas i hög grad av patientens positionering på respektive undersökning, och det är därför en fördel om diagnostisk FDGPET-DT är utförd med patienten i behandlingsläge, med nackstöd och på plan bordstopp.
Valet av targetdefinition (INRT eller ISRT) är individuellt och beror på om optimal matchning kan uppnås för den enskilda tumörlokalstationen. Vid ISRT tar man hänsyn till att det finns en osäkerhet vid matchningen eller att diagnostiska undersökningar inte är optimala genom att lägga till extra CTVmarginal.
Involved-node radiotherapy INRT
Target vid strålbehandling enligt INRT definieras enligt följande 74:
- Gross Tumor Volume (GTV) inkluderar eventuella kvarvarande patologiska lymfkörtlar.
- Clinical Target Volume (CTV) inkluderar GTV och motsvarar den primära tumörutbredningen före cytostatikabehandling, med hänsyn tagen till att frisk vävnad återtagit sin plats efter att tidigare varit ”förflyttad” pga. förstorade körtlar. Således inkluderas inte frisk normalvävnad såsom muskulatur, skelett eller lunga. Ingen ytterligare marginal används i kranio-kaudal riktning.
- Internal Target Volume (ITV) används vid behandlingsområden med en förväntad rörelse, oftast aktuellt i torax4D-CT eller multipla lågdos-CT i DIBH används för att definiera ITV. ITV inkluderar CTV med marginal som täcker in osäkerheter i storlek, form och position av behandlingsområdet orsakade av t.ex. andningsrörelser.
- Planning Target Volume (PTV) inkluderar ITV/CTV med en marginal. Då patienten är fixerad i mask används 5 mm marginal. Även mediastinalt används ofta 5 mm om ITV är inritat.
Involved site radiation therapy ISRT
Vid ISRT används samma principer som vid INRT 74. Här tar man dock hänsyn till att det inte alltid finns optimala diagnostiska undersökningar före start av cytostatikabehandling eller att det inte går att göra en optimal matchning mellan diagnostisk undersökning och dosplanerings-DT.
Det behövs då ett större CTV (ca 10 mm marginal i kranio-kaudala riktningen till CTV som har ritats enligt INRT-konceptet) för att täcka in eventuella osäkerheter i definitionen av behandlingsområdet.
Fraktionering
Tabell 2.Fraktionering vid kurativt syftande behandling
|
Behandling |
Dos/fraktion (Gy RBE) |
Fraktioner/vecka |
Slutdos |
Kommentar |
|
Stadium I-IIA, utan riskfaktorer (<70 år) |
2 |
5 |
20 |
|
|
Stadium I-IIA, med riskfaktorer (<70 år) |
1,75 |
5 |
29,75 |
|
|
Stadium I-IIA, utan och med riskfaktorer. (>70 år) |
2 |
5 |
30 |
|
|
NLPHL, stadium I-IIA |
2 |
5 |
20–30 |
Beroende på responsutvärdering, se avsnitt 11.4 |
|
Kvarvarande PET-upptag efter full cytostatikabehandling |
2 |
5 |
36–40 |
|
Förkortningar: Relative biological effectiveness (RBE)
Tabell 3. Fraktionering vid palliativ behandling
|
Dos/fraktion (Gy RBE) |
Fraktioner/vecka |
Slutdos (Gy RBE) |
|
2 |
5 |
20-30 |
Tabell 4. Andra fraktioneringsmönster som kan användas vid palliativ behandling
|
Dos/fraktion (Gy RBE) |
Fraktioner/vecka |
Slutdos |
Kommentar |
|
3 |
5 |
30-36 |
De högre doserna om patienten inte tål cytostatika och endast strålbehandling ges |
|
5 |
5 |
20 |
T.ex. smärtande skelettmetastaser |
|
2 |
5 |
10-12 |
Strålbehandling av enstaka lokaler under pågående immunterapi |
Riskorgan
En förutsättning för att ge kombinationsbehandling med cytostatika och strålbehandling är att acceptabla doser till nedanstående riskorgan erhålls. Dos till hjärta och lungor hos alla patienter och bröst hos unga kvinnor (< 30 år) är framför allt viktiga. Guide till acceptabla doser till riskorgan finns nedan.
Risken för sena biverkningar ökar ju yngre patienten är vid strålbehandlingstillfället, och risken för hjärtsjukdom ökar ju fler andra riskfaktorer patienten har såsom övervikt, hypertoni, hyperlipidemi och rökning 33.
Vid strålbehandling av buken hos unga kvinnor måste man särskilt beakta att ovarierna är mycket strålkänsliga. 2 Gy motsvarar den dos där 50 % av folliklarna dör. Denna dos är dock beroende av ovarialreserv och patientens ålder 75.
Hos män är de hormonproducerande Leydigcellerna mer strålresistenta än de spermieproducerande cellerna och därför kan man se en bevarad testosteronproduktion trots avsaknad av spermier (azoospermi). En stråldos över 2 Gy ger en hög risk för bestående azoospermi, medan Leydigceller kan tåla doser mellan 12 och 20 Gy innan man ser en minskad testosteronproduktion. Den individuella variationen är dock stor.
Guide till acceptabla doser och volymer vid riskorgan.
Nedan gäller för ordinerad dos 29.75 Gy(RBE)/17 fraktioner.
Tabell 5. Guide till acceptabla doser och volymer vid riskorgan
|
|
Optimal |
Acceptabel (Går tekniken att förbättra?) |
Om nödvändigt (Återfall/refraktär sjukdom) |
Undvik |
|
Hjärta Medel (Gy RBE) |
< 5 < 10 % |
5–10 10–25 % < 15 % |
10–18 25–35 % 15–20 % |
Koronarkärl och vänster kammare |
|
Lunga (total) V5 Gy (RBE) |
< 35 % < 20 % < 8 |
35–45 % 20–28 % 8–12 |
45–55 % 28–35 % 12–15 |
|
|
Thyreoidea V25 Gy (RBE) |
< 62,5 % |
|
|
Hela thyreoidea |
|
Bröst (hö resp vä) Medel (Gy RBE) |
< 4 < 10 % |
4–15 10–20 % < 10 % |
> 15 > 20 % > 10 % |
Körtelvävnad |
OAR som bör ritas in då behandlingsområdet är i närheten.
Ytterligare riskorgan kan vara aktuella att rita in beroende på targetområdets lokalisation. Benämningen av riskorgan följer standardiserad svensk nomenklatur för strålbehandling:
- A_CoronaryD_L
- Breast_L & Breast_R
- BrachialPlexus_L & BrachialPlexus_R
- Esophagus
- Heart
- Kidney_L & Kidney_R
- Larynx
- Lung_L & Lung_R
- Mandible
- OralCavity
- Ovary_L & Ovary_R
- Parotid_L & Parotid_R
- SpinalCord
- Submanibular_R & Submandibular_L
- Testis_L & Testis_R
- Thoracic nerves
- Thyroid
Dosplanering
Dosplaneringsteknik väljs med hänsyn tagen till behandlingsområdets läge, omkringliggande riskorgan och patientens ålder, kön och eventuell samsjuklighet.
Protonbehandling finns sedan 2015 tillgänglig i Sverige, via Skandionkliniken i Uppsala, och studieprotokoll är framtaget för Hodgkinpatienter (PRO-Hodgkin). Med denna teknik finns möjlighet att ytterligare ”skräddarsy” dosen till behandlingsområdet och därmed minimera dosen till omkringliggande riskorgan. Störst potentiell vinst finns vid supradiafragmal sjukdom. Patienter som kan bli aktuella för protonbehandling ska diskuteras på nationell Hodgkinrond och nationell protonrond.
Se bilaga 4 Radiotherapy protocol for Hodgkin Lymphoma (gäller både foton-och protonplanering).
