Behandling av återfall
Rekommendation
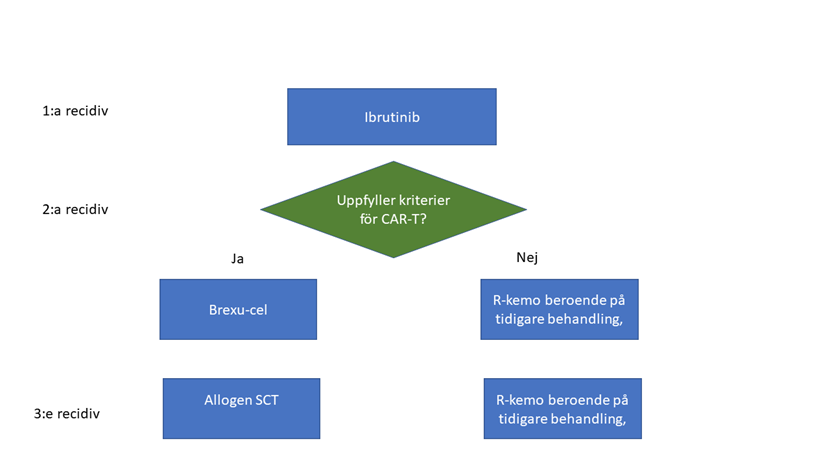
Vid recidiv efter kemoimmunterapi: ibrutinib
Vid recidiv efter BTK-hämmare hos patienter som erhållit två eller flera linjers behandling: CAR-T (brexu-cel), för patienter som bedöms lämpliga
Andra alternativ:
- R-CHOP
- R-bendamustin
- R-BAC
- R-GEMOX
- R-lenalidomid
Recidiv efter kemoimmunterapi – BTK hämmare
Den preparatgrupp som är mest väletablerad i form av respons och långtiseffekt vid recidiverande MCL är BTK-hämmare (BTKi) (+++). Det finns ett flertal preparat på marknaden, men i Europa är enbart ibrutinib registrerat på denna indikation. Ibrutinib rekommenderas därför för de flesta patienter som andra linjens behandling efter kemoimmunterapi, och ges i dosen 560 mg x 1 som kontinuerlig behandling fram till sjukdomsprogress.
Kommentar:
För hantering av biverkningar av BTK-hämmare, såsom blödningsbenägenhet, arytmier och hypertoni, hänvisas till Nationellt vårdprogram för kronisk lymfatisk leukemi .
Ett flertal kliniska prövningar pågår med nya läkemedel för recidiverande MCL, och man bör därför alltid ställa sig frågan om en patient i denna situation kan ingå i en klinisk prövning.
Recidiv efter ibrutinib – brexu-cel
För patienter som tidigare behandlats med ibrutinib eller annan BTK-hämmare, är f n den mest effektiva behandlingen CAR-T i form av brexucabtagene autoleucel (brexu-cel). Brexu-cel är i Sverige godkänt för behandling av vuxna patienter med recidiverande eller refraktärt mantelcellsymfom (MCL) efter två eller fler linjers systemisk behandling med bland annat en Brutons tyrosinkinashämmare (BTK-hämmare).
I en fas 2 studie, ZUMA-2, om 74 patienter sågs 59 % komplett remission 51. Effekt sågs även hos patienter med högriskkriterier, såsom TP53 mutation eller blastoid histologi. Den mest påtagliga biverkan är neurotoxicitet (ICANS). Grad 3-4 ICANs sågs hos 31 % av patienterna i studien. Patienter som recidiverat efter allogen stamcellstransplantation kan också komma ifråga för CAR-T.
Baserat på inklusionskriterier och internationella erfarenheter 52 har nedanstående riktlinjer för behandling med brexu-cel utarbetats av den svenska RCC-CAR-gruppen (+). CAR-T-cellbehandling skall endast administreras av kvalificerade centra och föregås av nationell MDK.
Figur 1. Behandlingsalgoritm för recidiv av MCL
Kriterier för brexu-cel
|
Absoluta kriterier |
|
|
Indikation |
MCL, som fått minst två behandlingslinjer, inkl BTK hämmare |
|
|
CD19+ |
|
Hjärtfunktion |
EF >40 % |
|
Lungfunktion |
SpO2 ≥92 % på luft |
|
ECOG |
0–1 |
|
Infektionsstatus |
Aktiv eller okontrollerad infektion utgör kontraindikation |
|
Relativa kriterier |
|
|
Neutrofiler |
≥1,0x109 |
|
Lymfocyter |
>0,1x109 |
|
Trombocyter |
≥50x109 |
|
Hb |
>80g/l |
|
Njurfunktion |
GFR ≥30ml/min |
|
Leverfunktion |
ASAT/ALAT <2,5xUNL, Bilirubin <1,5x UNL |
|
Tumörkontroll |
|
|
LD |
≤2x UNL |
|
|
Ej snabbt progredierande sjukdom eller stor tumörbörda |
Remitteringsgång
- Patient bedöms uppfylla kriterier för CAR T-cellsbehandling
- Sätts upp på nationell MDK via mail till CARMDK@akademiska.se
- Fallet diskuteras och om CAR T-celler rekommenderas föreslås behandlingsort i första hand på bas av geografisk närhet/regiontillhörighet
- Ansvarig läkare meddelas och skriver remiss till CAR behandlingssjukhus
- Patienten kallas för leukaferes
- Handläggning i väntan på CAR T-celltillverkning diskuteras
- Lymfodepletion och CAR T-celler ges på CAR T-cell sjukhuset
- Patienten övervakas m a p akuta biverkningar
- Patienten registreras i EBMT-registret och nationella lymfomregistret av CAR T-cell sjukhuset
- Utvärdering av respons med PET-CT och benmärgsundersökning efter 30 och 90 dagar.
- Uppföljning för behandlingseffekt och biverkningar var 3:e månad i 2 år sedan för ev senbiverkningar i 15 år
Bridging terapi
Mycket talar för att det är fördelaktigt att minska tumörbördan så mycket som möjligt före CAR T-cellterapi. För att åstadkomma detta får patienten sk bridging terapi under tillverkningen av CAR T-celler. Behandlingen väljs utifrån vad patienten tidigare behandlats med och responderat på. Radioterapi mot lokaliserad sjukdom kan vara ett bra alternativ vid MCL 52. I ZUMA-2 studien användes också dexametason eller BTK-hämmare.
Specifika biverkningar av CAR T-celler
De allvarligaste biverkningarna av CAR T-celler är cytokinfrisättningssyndrom (CRS) och neurotoxicitet (immune effector cell associated neurotoxicity syndrome (ICANS) 53. CRS kommer ofta de första dagarna efter CAR T-celler och orsakas av en kraftig immunaktivering. Kardinalsymptomen är feber, hypotension och hypoxi men alla organsystem kan drabbas. CRS kan ofta behandlas framgångsrikt med anti IL6-R antikroppen tocilizumab (Roactemra®) och steroider. En infektion kan driva ett CRS och empirisk infektionsbehandling är ofta nödvändig. Neurotoxicitet orsakas sannolikt av cytokiner och inträffar någon dag senare än CRS och kan vara alla typer av neurologiska symptom. Behandlingen är steroider och neurologisk övervakning. Dödsfall finns beskrivna både för CRS och ICANS.
Sena biverkningar har hittills varit långdragen pancytopeni som behandlas med transfusioner och ev G-CSF och B-cellsaplasi då alla normala B-celler uttrycker CD19. Om Ig brist i kombination med upprepade bakteriella infektioner ges substitution. Internationella riktlinjer finns tillgängliga för hantering av ovanstående biverkningar
Allogen stamcellstransplantation (SCT) ger möjlighet till långtidsremission hos patienter med återfall av mantelcellslymfom (+++). Yngre patienter som tidigare genomgått högdosbehandling med autologt stamcellsstöd och i förekommande fall CAR-T bör därför värderas för allogen SCT, med hänsyn till biologisk ålder och samsjuklighet 54. Behandlingen är dock förknippad med en betydande sjuklighet och dödlighet.
För att uppnå tillräckligt stabil remission inför allogen SCT bör patienten få induktionsbehandling, vilken är beroende av vilken primärbehandling som givits.
Övriga patienter
Behandlingsvalet avgörs här av vilken primärbehandling som givits. Vid icke-symtomgivande sjukdom kan exspektans övervägas också vid återfall.
Om > 6 månader förflutit sedan senaste dosen rituximab, bör rituximab övervägas som tillägg till kemoterapi.
Föreslagna behandlingsalternativ:
- R-bendamustin (++)
- R-cytarabin (++)
- R-BAC (++)
- VR-CAP (++)
- R-CHOP (++)
- R-GEMOX (++).
R-BAC ges vid återfall i följande dosering: bendamustin 70 mg/m2 dag 1–2 och cytarabin 500 mg/m2 dag 1–3. Rituximab ges dag 1.
Andra aktiva läkemedel vid återfall av MCL
Lenalidomid +/- rituximab
Ges i dosen 25 mg/dag i 3 veckor, följt av 1 veckas paus. Kan också kombineras med rituximab, 375 mg/m2, givet med fyra veckors intervall (++).
Andra lovande läkemedel under utveckling för patienter med återfall av MCL är BTK hämmare som acalabrutinib, zanobrutinib och pirtobrutinib, BCL2-hämmaren venetoclax 55, och glofitamab, en bispecifik CD20/CD3 antikropp 51. Dessa läkemedel är dock ännu ej godkända för användning vid MCL.
CNS-återfall
Här rekommenderas i första hand behandling med ibrutinib 56 (+++). Patienter med respons på behandling bör också anmälas till nationell CAR-T MDK för diskussion om behandling med brexu-cel, då respons verkar likvärdig med den som ses hos patienter utan CNS-återfall i registerstudier (+).
I andra hand kan behandling ges som vid primärt CNS-lymfom. Förslagsvis kan DeAngelis-protokollet användas 57: MVP x 5, konsolidering med högdos cytarabin x 2 (+). Strålbehandling kan också övervägas.
Strålbehandling
Mantelcellslymfom är en mycket strålkänslig tumör, varför låga doser av strålbehandling (4 Gy x 2) är en utmärkt effektiv och vältolererad behandling i symtomlindrande syfte (++) 58. Detta kan också ges mot stora områden, exempelvis buken.
Klorambucil
Detta är en vältolererad och ofta effektiv symtomlindrande behandling.
