Primär behandling
Behandlingsindikation
Rekommendationer
Endast patienter med symtomgivande sjukdom bör behandlas.
Indikationer för behandling
- B-symtom (återkommande feber, nattliga svettningar och viktnedgång samt trötthet)
- Hyperviskositet
- Förstorade lymfknutor, antingen symptomatiska eller ”bulky” (> 5 cm i diameter)
- Symtomgivande förstoring av lever och/eller mjälte
- Symtomgivande förstoring eller infiltration av andra organ eller vävnader
- Perifer neuropati orsakat av WM
- Anemi (Hb ≤ 100 g/l)
- Trombocyter ≤ 100 x 109/l
- Symtomatisk kryoglobulinemi
- Autoimmun hemolytisk anemi eller trombocytopeni
- Symtomatisk köldhemolys
- Njursjukdom relaterad till WM
- Amyloidos relaterad till WM
I första hand bör patienter behandlas inom ramen för klinisk prövning
Val av behandling
Det är viktigt att tänka på att WM är en sjukdom som i de flesta fall är relativt tacksam att behandla. Med anledning av detta bör onödigt toxiska behandlingsalternativ undvikas i de fall det är möjligt 34.
För behandlingsregimer, se bilaga 3 Behandlingsregimer.
Figur 1. Översikt av behandling för nydiagnostiserad WM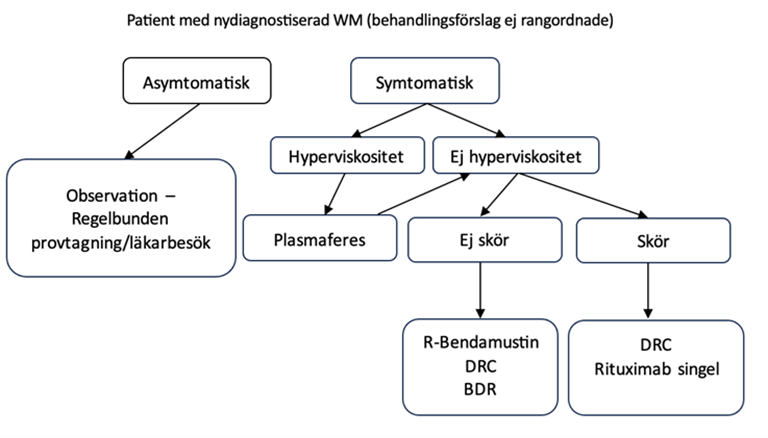
Plasmaferes
Rekommendationer
För patienter med hyperviskositetssymtom bör behandlingen inledas med plasmaferes.
Hyperviskositet uppträder framförallt hos patienter med IgM M-komponent > 40 g/l.
För patienter med hyperviskositetssymtom bör behandlingen inledas med plasmaferes 35. Plasmaferes kan även användas för att minska risken för ”flare” i samband med rituximab-behandling (se avsnitt 14.3.4. Rituximab flare). Kan i undantagsfall ges som enda behandling till patienter med hyperviskositet som huvudsymtom och som inte bedöms tolerera någon annan behandling. Plasmaferes sänker M-komponenten snabbt (plasmabyte om 3–4 l sänker M‑komponenten med 60–75 %) och minskar sjukdomssymtomen, men har kort duration (ofta dagar/veckor) och ingen effekt på själva sjukdomen.
Systemisk behandling
Rekommendationer
- Vid val av behandling bör behandlingen individualiseras beroende på sjukdomspresentation och samsjuklighet.
- Rituximab som singelbehandling är ett alternativ vid låg tumörbörda och till äldre och skörare patienter. (++)
- R-bendamustin (BR) rekommenderas till patienter med låg samsjuklighet och hög tumörbörda. (+++)
- DRC kan rekommenderas till de flesta patienter men framför allt till patienter med låg/måttlig tumörbörda, viss samsjuklighet eller cytopenier. (+++)
- Bortezomibbaserade behandlingar kan användas då man önskar snabb sjukdomskontroll, t.ex. vid hyperviskositetssymptom. (+++)
- BTK-hämmarna ibrutinib och zanubrutinib rekommenderas inte generellt i primärbehandling då de inte är subventionerade för behandling av WM (se Kapitel 11 Behandling av återfall). Vårdprogramgruppen kan i undantagsfall rekommendera BTK-hämmare till patienter som är för sköra för immunokemoterapi.
Rituximab som singelbehandling
Rituximab som singelbehandling kan vara ett behandlingsalternativ till patienter med en stillsam sjukdom med milda till måttliga symtom, vanligen cytopeni såsom anemi 3637. Det kan också vara ett alternativ till äldre skörare patienter som inte anses tåla mer intensiv cytostatikabehandling. Om patienten har ett behandlingssvar efter fyra veckovisa infusioner, kan man förlänga behandlingen med ytterligare fyra veckovisa infusioner för att förbättra behandlingssvaret 3839. Patienter med hemolytisk anemi som inte svarar på behandling med steroider kan behandlas med rituximab som singelbehandling. Vid köldhemolys med köldagglutininer och vid neuropati med MAG-antikroppar kan rituximab som singelbehandling vara effektiv 40. I sällsynta fall kan akut försämring av neuropati förekomma efter rituximab. Försämringen är dock reversibel inom några veckor till månader 41.
Vid M-komponent > 40 g/l finns risk för ”flare” (se kapitel 12.3.4 "Rituximab flare"). I dessa fall bör singelbehandling med Rituximab undvikas.
Rituximab i kombination med cytostatika
Rituximab är i dag inkluderad i nästan alla behandlingsregimer för WM på grund av god behandlingseffekt utan allvarliga biverkningar och kan ges i kombination med bl.a. cyklofosfamid och bendamustin. Valet av cytostatikabehandling styrs av patientens samsjuklighet, hur snabbt man behöver få sjukdomskontroll och sjukdomens presentation. 34
Bendamustin
Bendamustin i kombination med Rituximab (BR) är ett bra behandlingsalternativ, speciellt hos patienter med stor tumörbörda och låg samsjuklighet. I en subgruppsanalys av 44 patienter med WM, i en studie där patienter med indolenta lymfom randomiserades till behandling med R-CHOP eller RB 42, visades högre behandlingssvar, längre sjukdomsfri överlevnad och mindre biverkningar vid behandling med BR. Det finns inga prospektiva randomiserade studier som jämfört RB med DRC, men flera retrospektiva studier och registerstudier visar bättre och djupare behandlingssvar, längre sjukdomsfri överlevnad, men också en högre toxicitet och långvarig T‑cellspåverkan med BR. 43 En nyligen publicerad fransk studie med BR visade en sjukdomsfri överlevnad på 82 månader, men med en kumulativ incidens på sekundära maligniteter på 18 % efter 66 månader. 43 Ingen av dessa studier visat en skillnad i total överlevnad jämfört med DRC 4445.
DRC
Dexametason, rituximab och cyklofosfamid (DRC) kan ges som primärbehandling till de flesta patienter förutom de med uttalad samsjuklighet. Regimen ger ett bra behandlingssvar (80–90 %) och i den studien med längst uppföljningstid 46 ses en sjukdomsfri överlevnad på 35 månader och en 8‑årsöverlevnad på 47 % 47. Regimen har acceptabla biverkningar och lägre risk för sekundära maligniteter och T-cellspåverkan än BR. Mediantiden till svar är lång (4,1 månader) vilket gör den till ett sämre behandlingsval om snabb sjukdomskontroll krävs. I detta fall kan tillägg av bortezomib vara indicerat 48.
Bortezomib
Bortezomib har använts både i singelbehandling och i kombination med steroider och/eller Rituximab. Höga svarssiffror (81–96 %) har setts hos patienter med singel Bortezomib eller i kombination med lågdos Dexametason och Rituximab (BDR) både i primär- och återfallsbehandling 495051. Bortezomib ger ett snabbt behandlingssvar och kan användas till patienter där man önskar snabb sjukdomskontroll eller vid nedsatt njurfunktion. 52
P.g.a. den neurotoxiska effekten bör bortezomib användas med försiktighet till patienter med neuropati. Risken att utveckla neurotoxicitet är mindre då bortezomib ges en gång, i stället för två gånger i veckan, och vid subkutan administration 50.
En stor randomiserad europeisk fas III-studie (ECWM-1) jämförde DRC med eller utan tillägg av subkutant bortezomib. B-DRC och DRC gav höga behandlingssvar (> 90 %) men visade ingen skillnad i sjukdomsfri överlevnad och total överlevnad. Behandlingssvaret var snabbare med B-DRC 48 och kan därför rekommenderas i speciella situationer där man önskar snabb sjukdomskontroll tex vid hyperviskositet.
Bortezomib-baserade regimer kan med fördel även användas vid AL amyloidos, tillstånd med njurpåverkan eller vid plasmacellsdominans i benmärgen.
Underhållsbehandling
Rekommendationer
- Underhållsbehandling med Rituximab (+++) eller andra läkemedel (+) rekommenderas för närvarande inte.
Underhållsbehandling med Rituximab rekommenderas inte. I en tysk studie med induktionsbehandling BR randomiserades patienter med behandlingssvar till underhåll med Rituximab i två år eller exspektans. Efter medianuppföljning 5,9 år sågs ingen skillnad i sjukdomsfri överlevnad eller total överlevnad mellan grupperna 53. För underhållsbehandling med andra läkemedel saknas randomiserade studier.
Speciella behandlingsproblem
Rekommendationer
- Vid progredierande neuropati rekommenderas i första hand behandling med Rituximab som singelbehandling. (++) Om det även finns annan behandlingsindikation rekommenderas kombinationsbehandling med t.ex. DRC. (++)
- Vid symtomgivande Bing–Neels syndrom är behandling med BTK-hämmare bäst studerat (+) Diskutera gärna med regionalt centrum.
- Vid köldhemolys sekundär till WM (CAS) rekommenderas i första hand behandling av grundsjukdomen.
- Vid kryoglobulinemi rekommenderas i första hand Rituximab och steroider (++)
- Behandling av cold agglutinine disease (CAD) och AL-amyloidos av IgM-typ hänvisas till nationella riktlinjer i benign hematologi respektive AL-amyloidos.
Neuropati
Tillståndet är svårbehandlat och bristfälligt studerat och de få studier som finns är uteslutande på anti-MAG-neuropati. Manifest neuropati förbättras sällan, men demyeliniseringsprocessen kan bromsas om behandling sätts in tidigt. Singelbehandling med Rituximab i fyra veckodoser a 375 mg/m2 rekommenderas 54 till patienter med IgM associerad neuropati och avsaknad av annan behandlingsindikation. Klinisk utvärdering rekommenderas tre och sex månader efter behandlingen, vilken kan upprepas efter sex månader. Om ingen förbättring efter 12 månader avslutas behandlingen med rituximab. Det saknas konsensus för utvärdering med olika skattningsverktyg av behandlingseffekt. Inte heller upprepade EMG eller kontroll av MAG-antikroppar är tillförlitligt 55. Andra behandlingsalternativ är kombinationsbehandling, till exempel DRC eller plasmaferes 40. Använd läkemedel som kan försämra neuropati, t.ex. Bortezomib, med försiktighet. En pågående singel-arm studie på DanaFaber i Boston undersöker effekten av kombinationsbehandlingen acalabrutinib+rituximab på anti-MAG neuropati vid IgM-associerad sjukdom. 56
AL Amyloidos
Målet med behandling är att reducera tumörklonen/fria lätta kedjorna så snabbt och djupt som möjligt. För mer information om utredning och behandling av AL-amyloidos av IgM-typ hänvisas till gällande riktlinjer för amyloidos på SFH hemsida.
Bing–Neels syndrom (BNS)
BNS är en ovanlig manifestation av en redan ovanlig sjukdom där standardiserad behandling saknas och är begränsad till läkemedel som penetrerar CNS.
Behandling rekommenderas till patienter med symptomgivande BNS med målsättning klinisk förbättring eller symptomlindring. Prospektiva studier saknas. Vid behandling av symtomatisk BNS finns mest data för behandlingseffekt av Ibrutinib, vilket rekommenderas i första hand. Ca 80 % av patienterna förbättras kliniskt efter insatt behandling, men på bara ca hälften av patienterna nås avsaknad av lymfomceller i likvor. Mekanismen bakom detta är oklar. I en pågående studie i Nederländerna studeras Zanubrutinib som singelbehandling vid BNS (ZaBINES-studien) med preliminärt liknande behandlingseffekt som för Ibrutinib. Zanubrutinib har liknande CNS-penetrans som Ibrutinib. Dosen är 320 mg dvs samma som vid standardbehandling med Zanubrutinib.
Fludarabin, Cladribin och Bendamustin (sistnämnda med begränsade data på penetration till CNS) är andra över tid mer beprövade alternativ. Behandlingseffekten av intratekal behandling är i regel kort, men kan vara ett behandlingsalternativ vid enbart meningeal infiltration, som tillägg till systemisk behandling eller som palliation. HD-metotrexatbaserade eller HD‑AraC är effektiva behandlingar, men med hög toxicitet och bör därför reserveras till yngre patienter med upprepade relaps och bibehållet gott allmäntillstånd. Rituximab har dålig penetrans till CNS, men kan ges i kombination med ovanstående om systemisk behandlingseffekt önskas. Strålning kan avvändas vid lokaliserad CNS-sjukdom med korrelerande fokalneurologiska symtom. Steroider har kortvarig effekt, men bör användas som på samma indikationer som vid övriga CNS-lymfom 1112.
Transformation till aggressivt lymfom
Histologisk transformation, vanligast till diffust storcelligt B-cellslymfom (i 80–90 % av fallen av non GCB subtyp), är rapporterat för < 5 % av WM-patienterna. Transformationen uppträder vanligen efter 4–5 år efter diagnos, men kan förekomma under hela sjukdomsförloppet. Transformation är vanligare vid MYD88wt och är klonalt relaterat till WM i ca 85 % av fallen. Alarmsymptom för transformation är tillkomst av B-symptom, snabbt växande lymfkörtlar, extranodal presentation tex skelett eller CNS, förhöjt LD eller sjunkande M-komponent. Diagnosen ställs med vävnadsbiopsi, gärna efter PET-CT för riktad biopsi. Prognosen är dålig. Beträffande behandling finns inga prospektiva studier, behandling med R-CHOP är mest beprövat. CNS profylax ska övervägas. Data för mer intensiv immunokemoterapi är begränsad. Till lämpliga patienter som svarar på immunokemoterapi rekommenderas konsolidering med autolog SCT 57. Behandling med CAR T‑celler har i en mindre studie visat sig vara effektiv 5859. För ytterligare detaljer för utredning och behandling hänvisas till Nationellt vårdprogram Indolenta B-cellslymfom och hårcellsleukemi, kapitel 10 Follikulärt lymfom.
Köldhemolys (Cold Agglutinin Syndrome CAS och Chronic Cold Agglutinin Disease (CAD))
Vid symtomgivande CAS bör behandlingen riktas mot den bakomliggande sjukdomen. I akuta situationer då man behöver snabb kontroll på hemolysen bör plasmaferes övervägas. I många fall är hemolysen dock kompenserad och behandling kan avstås. Allmän behandling vid köldhemolys är att hålla sig varm (”varma sockar och vantar”), folsyrasubstitution och vid behov transfusion med blodvärmare.
För utredning och behandling av CAD hänvisas till kommande nationella riktlinjer i benign hematologi 60616263.
Kryoglobulinemi
Rituximab och steroider är förstahandsval. Standardbehandling för WM kan också övervägas. Vid svår sjukdom kan plasmaferes övervägas 60.
Blödningar
Vid livshotande förvärvad von Willebrands sjukdom finns ej konsensus kring lämplig behandling då studierna är små och icke-randomiserade. En metaanalys undersökte 137 patienter med förvärvad von Willebrand samt MGUS av IgG eller IgM-typ och man fann att intravenöst immunoglobulin (IvIg) var effektivast för att få kontroll över koagulationsproblemen 64. Plasmaferes och sedvanlig behandling mot WM bör också övervägas. När man väljer behandling mot WM hos en patient med blödningsbesvär, oavsett genes, så bör man ha försiktighet med BTK-hämmare då dessa har en trombocythämmande effekt.
Bedömning av behandlingssvar
Målet med behandlingen beror bland annat på patientens ålder och samsjuklighet. Hos yngre patienter är målet att uppnå ett maximalt kliniskt svar. Detta kan definieras som komplett eller partiell remission. Hos äldre patienter kan målet vara mer inriktat på att lindra symtom och minska risken för organskada. Det kan dröja lång tid (6–12 månader) innan patienten svarar på given behandling, varför tidpunkten för remissionsbedömning är viktig. Vid en ”flare” reaktion kan M-komponenten kvarstå länge och ibland måste då tumörsvaret värderas genom benmärgsprov. Efter Rituximabinnehållande behandling kan M-komponenten ibland fortsätta att sjunka flera år efter avslutad behandling.
Tabell 3. Kriterier för behandlingssvar vid Waldenströms makroglobulinemi 6566
|
Komplett remission (CR) |
Ingen M-komponent av IgM-typ normal benmärg Regress av lymfadenopati och organförstoring Inga WM-relaterade symtom |
|
Mycket god partiell remission (VGPR) |
Som CR men påvisbar M-komponent som dock minskat > 90 % |
|
Partiell remission (PR) |
> 50 % minskning av M-komponent av IgM-typ > 50 % minskning av lymfadenopati och organförstoring Inga nytillkomna WM-relaterade symtom |
|
Begränsad remission (MD) |
> 25 % minskning av M-komponent av IgM-typ Inga nytillkomna WM-relaterade symtom |
|
Stabil sjukdom (SD) |
< 25 % minskning men < 25 % ökning av M-komponent av IgM-typ Ingen progress av lymfadenopati, organförstoring eller cytopenier Inga nytillkomna WM-relaterade symtom |
|
Progressiv sjukdom (PD) |
> 25 % ökning av M-komponent av IgM-typ Med total ökning med minst 5 g/l där ökningen ska vara bestående vid två provtagningstillfällen om inga andra tecken till progress. |
