Bakgrund och orsaker
Epidemiologi
Epidemiologiska data för kolorektalcancer (KRC) finns tillgängliga hos Socialstyrelsen 2, NORDCAN (Association of the Nordic Cancer Registries)3 och Global Cancer Observatory (tidigare GLOBOCAN) 45. KRC står för cirka 11 % av alla nya cancerfall i Sverige och är den tredje vanligaste cancerdiagnosen både nationellt och globalt (efter bröstcancer och prostatacancer i Sverige, och efter bröstcancer och lungcancer globalt) och den näst vanligaste orsaken till cancerdöd efter lungcancer. Drygt 5 000 nya fall av koloncancer och 2 000 fall av rektalcancer konstateras per år. KRC, och särskilt rektalcancer, är något vanligare hos män än kvinnor.
Risken för att drabbas av KRC fram till 75 års ålder är i Sverige 3,6 % hos män och 2,8 % hos kvinnor. Livstidsrisken skattas till 5 %, men är något svår att beräkna eftersom dödsfall till följd av andra sjukdomar får allt större betydelse vid stigande ålder (s.k. konkurrerande risker). Cirka en fjärdedel av alla fall av KRC diagnostiseras före 65 års ålder, och cirka 6 % diagnostiseras före 50 års ålder.
Den åldersstandardiserade incidensen av KRC har gradvis ökat sedan 90-talet. Detta beror på att fler insjuknat i koloncancer, medan incidensen av rektalcancer har varit relativt stabil (figur 1 och 2). KRC ökar i ung ålder, före 50 år, vilket är särskilt tydligt för rektalcancer.
Ettårsöverlevnaden i Sverige är över 85 % och femårsöverlevnaden cirka 70 %. Överlevnaden beror på sjukdomsstadium vid diagnos (figur 3 och 4).
Figur 1. Åldersstandardiserad incidens per 100 000 för koloncancer hos män och kvinnor, 1970–2022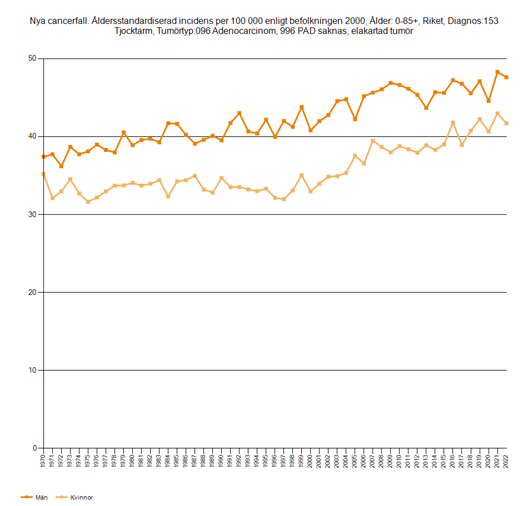
Källa: Socialstyrelsens statistikdatabas.
Figur 2. Åldersstandardiserad incidens per 100 000 för rektalcancer hos män och kvinnor, 1970–2022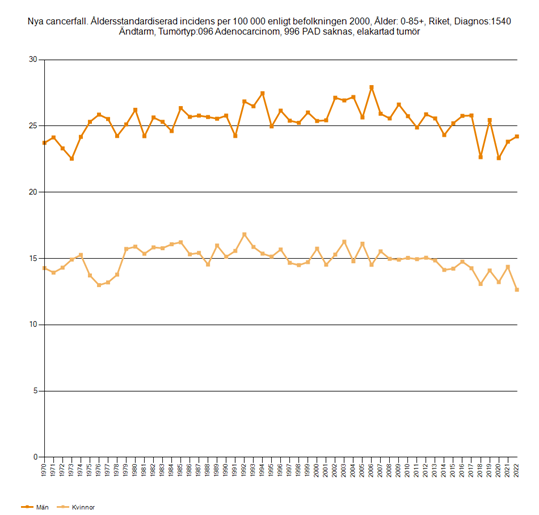
Källa: Socialstyrelsens statistikdatabas.
Figur 3. Överlevnad i koloncancer för patienter med diagnos ställd 2016–2022, utifrån stadium vid diagnos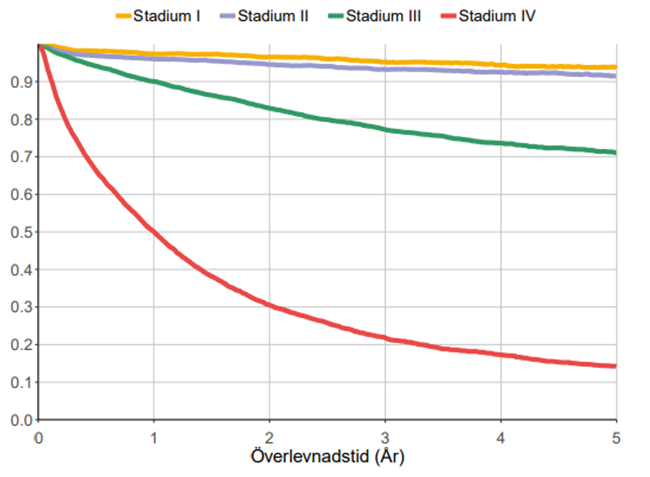
Källa: Kvalitetsrapport för koloncancer år 2022, Svenska Kolorektalcancerregistret.
Figur 4. Överlevnad i rektalcancer för patienter med diagnos ställd 2016–2022, utifrån stadium vid diagnos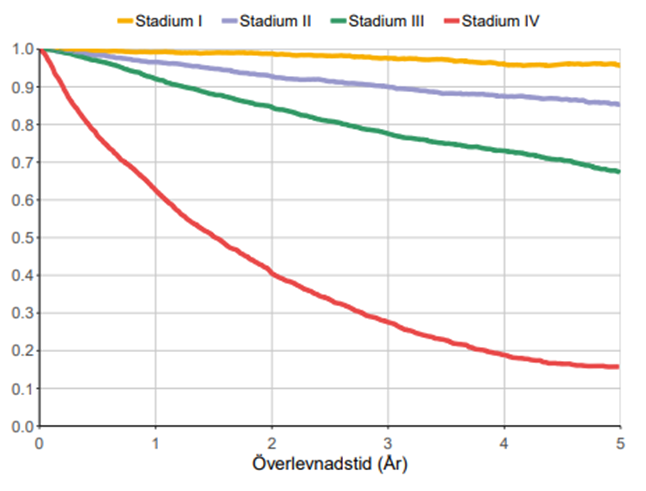
Källa: Kvalitetsrapport för rektalcancer år 2022, Svenska Kolorektalcancerregistret.
Appendixcancer (blindtarmscancer) är en ovanlig cancerform och en separat entitet från KRC, men den kliniska handläggningen avhandlas i detta vårdprogram (förutom för neuroendokrin appendixcancer, som står för 30–50 % av fallen). Antalet nya fall av appendixcancer är cirka 150–200 per år i Sverige. Överlevnaden beror i hög grad på histologisk subtyp och eventuell perforation med spridning till bukhålan.
Uppkomst, riskfaktorer och primärprevention
Uppkomst
Enligt dagens paradigm uppkommer de flesta fall av KRC ur en neoplastisk polyp, en utveckling som beräknas ta cirka 10–15 år. Utvecklingen kan dock gå väsentligt snabbare, till exempel hos patienter med DNA-reparationsdefekter (Lynchs syndrom). Nomenklaturen har förändrats på senare år 6 och polyper med neoplastisk potential består i dag av konventionella adenom (tubulära, tubulovillösa eller villösa adenom) men också av sågtandade lesioner (hyperplastiska polyper, sessila serrata lesioner med eller utan dysplasi, och traditionella sågtandsadenom [serrata adenom]). Dessa utvecklas sannolikt via olika molekylära vägar och bidrar till den heterogenitet som KRC uppvisar när det gäller exempelvis patientens ålder och kön samt tumörlokal i tarmen och molekylär patologi.
Exakt incidens och prevalens av precancerösa lesioner är svårvärderad, men data från delvis utvalda patientgrupper finns från bland annat Sverige och Europa 78. Benägenheten att utveckla adenom ökar med åldern och adenom är vanligare bland män än kvinnor. En av världens största prevalensundersökningar från Tyskland rapporterade, för åldrar 55–59 år, detektionsfrekvenser på 6,6 % för avancerade adenom och 16 % för icke-avancerade adenom hos män, och 9,6 % respektive 3,5 % hos kvinnor 8. Enligt europeiska rekommendationer bör adenomdetektionsfrekvensen ligga på minst 25 % hos patienter över 50 år.
I den tyska studien 8 beräknades också den kumulativa transitionsfrekvensen för konventionella adenom till cancer (tabell 2).
Tabell 2. Kumulativ transformationsfrekvens från adenom vid olika åldrar till cancer före 80 års ålder
|
Ålder |
Icke-avancerat adenom till cancer |
Avancerade adenom till cancer |
|
55 år |
29 % |
63 % |
|
65 år |
15 % |
52 % |
|
75 år |
1,9 % |
24 % |
Källa: 8
Den höga prevalensen adenom i relation till livstidsrisken för att utveckla KRC innebär att de flesta adenom inte övergår i cancer. Risken för höggradig dysplasi respektive cancer i ett adenom är associerad med storleken. Flera studier anger skiftande cancerfrekvens för polyper: 0–1,5 % för polyper < 10 mm och 2,4–10,2 % för polyper > 10 mm 9. Det är sedan länge känt att polypektomi minskar incidensen av KRC, vilket ytterligare bekräftar adenom–karcinomsekvensen. Reviderade riktlinjer för koloskopikontroll efter exstirpation av olika polypformer publicerades 2022 10.
Riskfaktorer
Riskfaktorer för cancer indelas ofta i icke-påverkbara och påverkbara, och det gäller även KRC. Till de icke-påverkbara riskfaktorerna för KRC räknas hög ålder, ärftlighet, kroppslängd och manligt kön. En relativt stor andel av KRC-fallen beräknas bero på påverkbara riskfaktorer, i Sverige cirka 35–45 % och mer hos män än hos kvinnor 1112. Det bör noteras att studier avseende riskfaktorer är populationsbaserade och att studier på individnivå saknas.
Flera riskfaktorer för KRC kopplas till levnadsvanor 13 (tabell 3). Alkoholkonsumtion, och i mindre grad tobaksrökning, ökar risken för att insjukna, medan fysisk aktivitet minskar risken. Även kosten anses ha en viktig roll vid utvecklingen av KRC, vilket delvis beror på den dubbla exponeringen genom både blodförsörjning till tarmen och direkt kontakt mellan tarminnehåll och tarmepitel. Flera kostfaktorer har identifierats som sannolika riskfaktorer, men i dag är det endast processat kött som klassas som en etablerad riskfaktor. Viss evidens finns även för att konsumtion av rött kött ökar risken för att insjukna och att fiber, fullkorn och mejeriprodukter minskar risken.
Kostens roll är komplex, och det är svårt att reda ut betydelsen av enskilda kostkomponenter eller olika kostmönster och effekter som är sammanlänkade med andra livsstilsfaktorer. Övervikt och obesitas får en allt starkare evidensbas som riskfaktor, där varje ökning i kroppsmasseindex (BMI, body mass index) med 5 kg/m2 medför en riskökning för KRC med cirka 5 %. Betydelsen av övervikt och obesitas är större för koloncancer än för rektalcancer.
Tabell 3. Riskfaktorer och skyddsfaktorer för KRC. Flera av riskfaktorerna samvarierar. Sammanställningen begränsas därför till potentiella biologiska mekanismer och tar inte upp interaktioner eller medieringseffekter.
|
Faktor |
Föreslagna biologiska mekanismer |
|
Ökad risk – etablerad |
|
|
Alkohol |
Direkt skada av etanol och särskilt dess metabolit acetaldehyd på DNA och tarmslemhinnan, reaktiv ökad proliferation. |
|
Tobaksrökning |
Tobaksrök innehåller ett stort antal cancerframkallande ämnen. |
|
Övervikt och obesitas |
Låggradig inflammation, hyperinsulinemi och IGF1 (insulin-like growth factor), könshormonsrubbningar. |
|
Processat kött |
N-nitrosoföreningar från nitrater och nitriter, hemjärn, heterocykliska aminer och polycykliska aromatiska kolväten vid tillagning på hög värme, joniserade fettsyror och sekundära gallsyror från fettet i köttet. |
|
Inflammatorisk tarmsjukdom (främst dåligt kontrollerad) |
Inflammation. |
|
Ökad risk – sannolik |
|
|
Rött kött |
Som för processat kött men generellt mindre N-nitrosoföreningar och lägre fetthalt. |
|
Minskad risk – etablerad |
|
|
Fysisk aktivitet |
Metabola effekter, minskad inflammation, stärkt immunförsvar, snabbare tarmpassage. |
|
ASA/NSAID |
Minskad inflammation. |
|
Minskad risk – sannolik |
|
|
Fullkorn och fiberrika livsmedel |
Snabbare tarmpassage, utspädning av tarminnehållet, gynnsam påverkan på tarmflora. |
|
Kalcium och mejeriprodukter |
Bindning av kalcium till okonjungerade gallsyror, fria fettsyror och hemjärn i tarmen, påverkan på cellsignalering. Mjölksyreproducerande bakterier i fermenterade mejeriprodukter. |
Vissa medicinska tillstånd och läkemedel har också kopplats till utvecklingen av KRC. Inflammatorisk tarmsjukdom (särskilt dåligt kontrollerad ulcerös kolit) ökar risken för att insjukna medan användning av acetylsalicylsyra (ASA)1415 minskar risken. Andra läkemedel såsom menopausal hormonbehandling 16 och metformin17 har också visat potentiella förebyggande effekter. Inga rekommendationer om kemoprevention finns i dag även om rekommendationer om intag av ASA diskuteras för personer med ärftligt ökad risk.
En möjlig riskfaktor som uppmärksammas allt mer är tarmfloran, där bakterier såsom fusobakterier verkar vara associerade med tumörutvecklingen 1819. Flera stora observationsstudier har också visat en association mellan antibiotikaanvändning och ökad risk för koloncancer 202122.
Prevention
Rekommendationer
- Rekommendationer för primärprevention av KRC överensstämmer med, och bör därför integreras i, allmänna strategier för prevention av cancer allmänt och andra icke-smittsamma sjukdomar.
- Rekommendationer för att minska risken för att insjukna i KRC innefattar att begränsa alkoholkonsumtion, inte röka, behålla en sund kroppsvikt, vara fysiskt aktiv och minska stillasittande samt äta en kost som har lågt innehåll av processat och rött kött men som är rik på fullkorn och fiber.
Primärpreventiva insatser innefattar åtgärder för att minska riskfaktorerna och öka motståndskraften mot riskfaktorer. I dag fokuserar primärprevention av KRC främst på allmänna livsstilsrekommendationer och folkhälsostrategier. Det finns dock förhoppningar om att i framtiden kunna individualisera primärpreventionen, s.k. precisionsprevention. Riskstratifiering utifrån olika riskalgoritmer eller genetiska profiler diskuteras i relation till anpassade livsstilsrekommendationer, förebyggande läkemedel och anpassade kontrollprogram.
Åtgärder där polyper, cancerförstadier och tidig cancer tas bort anses höra till sekundärprevention och behandlas på andra ställen i vårdprogrammet och i andra vårdprogram och riktlinjer, till exempel allmän screening, surveillance-koloskopi efter polypektomi, vid inflammatorisk tarmsjukdom och vid ärftligt ökad risk. Se Nationellt vårdprogram för tjock- och ändtarmcancerscreening, riktlinjerna Endoskopisk uppföljning efter kolorektal polypektomi och Koloskopisk övervakning av IBD (Svensk gastroenterologisk förening) samt delar av kapitlet om ärftlighet som behandlar surveillance vid ärftligt ökad risk: avsnitt 6.2.1.3 Prevention och tidig diagnostik (om Lynchs syndrom), 6.2.2.3 Kontrollprogram och riskreducerande kirurgi (om polypossyndrom) och 6.2.3 Familjär KRC.
