Kirurgisk behandling
Behandling av tidig kolorektalcancer (KRC)
Tidig KRC definieras som stadium T1–2 N0M0. Preoperativ stadieindelning med DT, MRT och ultraljud är mycket osäker och tidig KRC är oftast en postresektionsdiagnos. Därmed finns få eller inga randomiserade studier inom området. Alla misstänkta fall av tidig KRC bör genomgå kvalificerad endoskopisk bedömning, inkluderande kromoendoskopisk visualisering för att bedöma möjligheterna till lokal resektion. De efterföljande rekommendationerna begränsas till fall med T1-cancer eftersom majoriteten med T2-cancer bör genomgå kirurgisk resektion. Fördelarna med lokal resektion är färre komplikationer, bevarad tarmfunktion och lägre kostnader. Vid lokal resektion ska alltid riskerna för lymfkörtelmetastasering och recidiv vägas mot riskerna med kirurgisk resektion.
Diagnostik och stadieindelning
Endoskopisk bedömning av tumörens morfologi, i kombination med någon metod för digital kromoendoskopi, är viktig för att identifiera potentiella fall av tidig KRC som är lämpliga för lokal resektion. Vare sig DT och MRT är tillräckligt tillförlitligt för att bedöma T- eller N-stadium 123 124 . I rektum kan endoskopiskt ultraljud användas för att bedöma om tumören infiltrerar muscularis propria (T2-cancer). Preterapeutisk diagnostik av invasionsdjupet (sm 1–3) vid T1-cancer är däremot inte pålitligt med vare sig endoskopisk bedömning eller ultraljudsbedömning. Därför används lokal resektion ofta som diagnostisk metod (”excisionsbiopsi”) vid tidig KRC. Om tumören bedöms kunna tas bort endoskopiskt är det en stark rekommendation att inte ta någon biopsi eftersom den avsevärt försvårar endoskopisk resektion. Om cancerdiagnosen sätts efter lokal resektion baseras beslut om kompletterande kirurgisk resektion på detaljer i PAD (låg- eller högriskcancer). DT thorax-buk och MRT rektum ska göras före lokal excision om misstanken på tidig cancer har väckts och efter den lokala excisionen om cancerdiagnosen ställs på PAD.
Definitioner
Högriskcancer föreligger om patienten har minst en av följande riskfaktorer:
- kärl- eller lymfkärlsinväxt (LVI)
- budding grad 2 eller 3
- höggradig cancer (låg differentiering)
- djup invasion i submukosa (> 1 mm, sm 2–3) eller Haggitt 4 vid stjälkad polyp*
- positiv eller osäker rektionsmarginal (R1/Rx) **
- ”piecemeal”-resektion.
* Invasionsdjup i submukosan har ifrågasatts som oberoende riskfaktor.
** Riktlinjer anger oftast 1 mm som kurativ marginal även om mycket talar för att 0,1 mm marginal är tillräckligt.
Lågriskcancer definieras som fall utan någon av högriskfaktorerna ovan.
Tidig koloncancer
Rekommendationer
- Vid misstanke om tidig T1-koloncancer bör lokal resektion övervägas efter en kvalificerad endoskopisk bedömning. Biopsier bör inte tas om endoskopisk resektion är möjlig.
- Endoskopisk resektion av misstänkt tidig koloncancer ska behandlas på högvolymsenheter.
- Högrisk T1-cancer i kolon bör behandlas med kirurgisk resektion. Om det inte görs bör intensifierad uppföljning planeras.
- Vid R1-/Rx-resektion eller snäv marginal kan kompletterande endoskopisk resektion av ärret (ESD eller fullväggsresektion) övervägas som alternativ till kirurgi.
- Patientens samsjuklighet och preferens ska tas i beaktande vid beslut om kompletterande kirurgi och uppföljning.
Behandling
Stjälkade tumörer kan i majoriteten av fallen slyngas endoskopiskt, oftast efter förbehandling av stjälken med clips, endoskopisk ligatur (endoloop) eller injektion av adrenalin. Bredbasiga och flacka tumörer behandlas med endoskopisk mukosaresektion (EMR) om de är mindre än 2 cm. Tumörer som är större än 2 cm bör tas bort med endoskopisk submukosadissektion (ESD). Det viktiga är att cancermisstänkta tumörer tas bort i en bit (”en bloc”). Piecemeal-resektion bör undvikas vid avancerade polyper där cancer misstänks eftersom detta enskilt kan göra att patienten behöver kompletterande kirurgi. PAD efter resektion blir avgörande för vidare handläggning (kompletterande ESD eller fullväggsresektion alternativt kirurgisk resektion).
Endoskopisk resektion av tidig koloncancer är oftast tekniskt utmanande och ska bara utföras på centrum med hög kompetens och stora volymer.
Tidig rektalcancer
Rekommendationer
- Vid misstanke om tidig T1-rektalcancer ska lokal resektion övervägas.
- Endoskopisk bedömning är avgörande för selektion av fall till lokal resektion. Biopsier bör inte tas om endoskopisk resektion är möjlig.
- MRT och ultraljud är osäkra metoder av begränsat värde för att stadieindela tidig rektalcancer.
- I första hand rekommenderas ESD vid lågrisk T1-cancer.
- Högrisk T1-cancer i rektum bör behandlas med kirurgisk resektion. Om patienten avstår ska intensifierad uppföljning planeras.
- Vid R1-/Rx-resektion eller snäv marginal kan kompletterande endoskopisk resektion av ärret (ESD eller fullväggsresektion) övervägas som alternativ till kirurgi.
- Patientens samsjuklighet och preferens ska tas i beaktande vid beslut om kompletterande kirurgi och uppföljning.
Behandling
Skaftade polyper är ovanliga i rektum men kan i majoriteten av fallen tas bort med endoskopisk slyngning, se avsnitt 12.1.3.1 ovan avseende koloncancer. ESD är förstahandsmetod för lokal resektion av bredbasiga och flacka tumörer i rektum vid misstanke om tidig cancer. Alternativ inkluderar transanal endoskopisk mikrokirurgi (TEM) och transanal minimalinvasiv kirurgi (TAMIS). Det finns ännu inga randomiserade studier, men metaanalyser visar att metoderna är onkologiskt likvärdiga vid tidig rektalcancer 125 126 . ESD görs utan sedering medan TEM och TAMIS görs under narkos. En annan fördel med ESD är att muscularis propria förblir intakt medan fullväggs-TEM och fullväggs-TAMIS innebär att det så kallade TME-skiktet öppnas. Det ökar risken för komplicerad och felaktig dissektion vid eventuell efterföljande total mesorektal excision (TME), vilket kan leda till lägre anastomos eller permanent stomi. ESD är dessutom betydligt mer kostnadseffektivt än TEM eller TAMIS 127 . Transanal lokal excision rekommenderas inte eftersom risken för R1-resektion är för stor.
Uppföljning av tidig KRC
Alla fall med tidig KRC ska diskuteras på MDK för beslut om ytterligare behandling och uppföljning.
Lågriskcancer kolon och rektum
Kurativ resektion av lågriskcancer (R0 utan högriskfaktorer) ska följas upp endoskopiskt efter 1 år och 3 år, och i övrigt på samma sätt som alla fall av KRC. Vid rektaltumörer görs oftast en tidig DT thorax-buk och MRT för att utesluta fjärrmetastasering och erhålla utgångsbilder för framtida kontroller.
Högriskcancer kolon
I första hand rekommenderas kirurgi om patienten anses klara det. Risken för lokalrecidiv eller lymfkörtelmetastaser är 5 % om patienten har en riskfaktor och 23 % vid två riskfaktorer 128 .
Vid R1-/Rx-resektion, eller om snäv marginal är enda riskfaktorn, kan kompletterande endoskopisk resektion av ärret (ESD eller fullväggsresektion) övervägas som alternativ till kirurgi. Om PAD från ett komplett borttaget ärr inte visar någon kvarvarande cancerväxt är intensifierad uppföljning ett alternativ.
Patientens samsjuklighet och inställning till kirurgisk behandling måste vägas in i beslutet om kirurgi eller konservativ behandling. Tidig DT thorax-buk bör utföras för att utesluta fjärrmetastasering och erhålla utgångsbilder för framtida kontroller. Om patient med högrisktumör väljer att avstå från resektionskirurgi rekommenderas intensifierad uppföljning med endoskopi och DT thorax-buk var 3:e–6:e månad i 2 år, beroende på fynd och riskfaktorer, och därefter kontroller efter 3 år och 5 år.
Högriskcancer rektum
I första hand rekommenderas kirurgi om patienten anses klara det. Enligt europeiska riktlinjer kan uppföljning vara ett alternativ till kirurgi om djupväxt i submukosan (sm 2–3) är enda riskfaktorn 129 .
Vid R1-/Rx-resektion eller snäv marginal kan kompletterande endoskopisk resektion av ärret (ESD eller fullväggsresektion) övervägas som alternativ till kirurgi. Om PAD från ett komplett borttaget ärr inte visar någon kvarvarande cancerväxt kan kirurgi avstås.
I rektum är adjuvant kombinerad cytostatika- och strålbehandling ett alternativ om patienten inte vill eller kan genomgå kirurgisk behandling efter en endoskopisk R1-resektion 130 131 .
Om patient med högriskcancer väljer att avstå från resektionskirurgi rekommenderas intensifierad uppföljning med endoskopi, MRT rektum och DT thorax-buk var 3:e–6:e månad i 2 år, beroende på fynd och riskfaktorer, och därefter kontroller efter 3 år och 5 år.
Kommentarer:
- Nyare data talar för att invasionsdjupet (sm 1–3) inte är en oberoende riskfaktor för lymfkörtelmetastasering 132 133 , vilket utökar kriterierna för lokal resektion framför allt i rektum. Nya endoskopiska metoder som dissekerar djupare än ESD-skiktet är under frammarsch, exempelvis endoskopisk intermuskulär dissektion (EID).
- Vid T2-stadium eller högre är lokal resektion inte ett behandlingsalternativ i kurativt syfte, men fullväggsresektion kan utgöra en palliativ åtgärd.
- Det onkologiska utfallet är likvärdigt om kompletterande kirurgi görs efter lokal resektion jämfört med primär kirurgi.
- Vid planering av uppföljning är det viktigt att värdera om detektion av recidiv kommer leda till någon form av åtgärd. Om patienten inte bedöms vara aktuell för sådan åtgärd är rekommendationen att avstå från uppföljning. I alla lägen är patientens önskan och preferenser avgörande för beslut om typ av uppföljning.
Resektionskirurgi
Allmänna principer
Rekommendationer för kirurgisk behandling
- Ingreppet bör inledas med bedömning av förekomst av tidigare icke upptäckt tumörspridning samt lokal överväxt av primärtumör.
- Dissektionen bör ske i anatomiskt skikt med borttagande av intakt mesokolon med centrala kärlligaturer respektive utföra total mesorektal excision (TME).
- Minimalinvasiv operation bör erbjudas som förstahandsalternativ. Jämfört med öppen kirurgi är de onkologiska resultaten likvärdiga. Däremot finns fördelar i form av snabbare återhämtning, mindre analgetikabehov, kortare vårdtid och lägre incidens av bukväggskomplikationer.
Oavsett om öppen eller minimalinvasiv teknik används gäller de allmänna principer som beskrivs här.
Ingreppet inleds med bedömning av bukhålan med avseende på tidigare oupptäckt tumörspridning eller lokalt avancerad tumör. I synnerhet kan ytlig levermetastasering och begränsad peritoneal carcinos missas vid preoperativ stadieindelning. Vid fynd av peritoneal carcinos hos en patient som är potentiellt tillgänglig för cytoreduktiv kirurgi och hyperterm intraperitoneal cytostatikabehandling (HIPEC), ska dissektion med öppnande av peritoneala ytor undvikas. Carcinosutbredningen i hela buken ska noggrant dokumenteras enligt peritonealt cancerindex (PCI), och biopsier från misstänkta peritoneala metastaser tas innan ingreppet avslutas. Vid carcinos med synkron tarmobstruktion kan avlastning med stomi eller bypass utföras i väntan på definitiv åtgärd. Oväntat fynd av lokal tumöröverväxt föranleder bedömning av om radikalitet med hög säkerhet kan uppnås med hjälp av ”en bloc”-resektion. Dissektion i inflammatoriska adherenser ska undvikas eftersom det är svårt att skilja dessa från tumörväxt och det finns risk för lokal tumörspridning. Vid tveksamhet om huruvida radikalitet kan uppnås, eller om radikalitet förutsätter betydligt mer omfattande kirurgi än planerat, avlastas patienten om det behövs och kontakt tas med en högspecialiserad enhet.
Radikal resektion förutsätter tillräckliga marginaler, medtagande tarmens mesenterium inklusive dränerande lymfkärl och regionala lymfkörtlar. För icke lokalt avancerad rektalcancer utförs operationen enligt TME. I analogi med detta har komplett mesokolisk excision (CME) tillsammans med central kärlligatur lanserats.
Longitudinell spridning till de mesokoliska lymfkörtlarna är oftast relativt begränsad, men vid koloncancer bör en longitudinell marginal på minst 10 cm tillsammans med adekvat central kärlligatur eftersträvas. Vid cancer i övre rektum kan 5 cm distal marginal tillämpas genom partiell mesorektal excision (PME), medan övrig rektalcancer förutsätter TME. Vid pre- eller perioperativt upptäckta patologiska lymfkörtlar vid centrala kärlavgångar är det rimligt att eftersträva excision av dessa. Det är dock mer osäkert hur den centrala kärldelningen ska drivas rutinmässigt. Spridning till lymfkörtlar vid tillförande kärls centrala avgångar är associerat med betydligt sämre prognos, men det är inte säkerställt att rutinmässig delning på denna nivå bidrar till någon överlevnadsvinst.
Vid rektalcancer kan spridning till mesenterica inferiors avgång påvisas i 1–4 % av fallen, men i en retrospektiv svensk nationell kohortstudie var hög delning av arteria mesenterika inferior inte associerat med bättre onkologiskt utfall 134 . I studier av CME kombinerat med central ligatur kan morbiditet såsom blödning från centrala kärl begränsas till en acceptabel nivå, givet att ingreppet utförs av en adekvat utbildad kirurg. Retrospektiva studier indikerar även att CME förbättrar prognosen vid högersidig koloncancer 135 . Det är dock inte slutgiltigt avgjort att långt driven central kärlligatur är den del av CME-konceptet som medför gynnsamma resultat. Långtidsresultat från prospektiva randomiserade studier inväntas 136 137 .
I Sverige dominerar laparoskopisk operation för koloncancer medan robotassisterad laparoskopisk operation är vanligast för rektalcancer. Fördelarna med minimalinvasiv kirurgi innefattar korttidresultat med minskat analgetikabehov, kortare vårdförlopp och färre bukväggskomplikationer. Det finns inget som talar för att öppen kirurgi innebär fördelar för patienten om adekvat onkologisk resektion kan ske minimalinvasivt och de onkologiska långtidsresultaten är jämförbara med resultat efter öppen kirurgi vid både kolon- och rektalcancer. Värdet av robotassisterad operation jämfört med konventionell laparoskopisk operation för rektalcancer har tidigare studerats prospektivt randomiserat, utan konklusiva fynd till fördel för endera metoden 138 . I en ny och jämförelsevis stor kinesisk prospektiv randomiserad kontrollerad studie rapporteras dock gynnsamma korttidsdata som talar för robotassisterad operation, med lägre grad av positiv cirkumferent resektionsmarginal och lägre peri- och postoperativ morbiditet 139 .
Kirurgi vid koloncancer
Högersidig hemikolektomi
Vid tumörer i caekum, ascendens och höger flexur, förutsatt att minst 10 cm distal marginal uppnås, avlägsnas högerkolon inklusive flexuren tillsammans med 5–10 cm av terminala ileum. Kärlen delas vid markering 1, 4 och 6 i figur 7. Se även figur 8 Utvidgad högersidig hemikolektomi nedan.
Figur 7. Högersidig hemikolektomi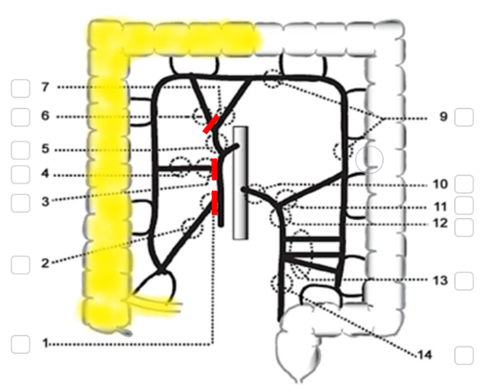
Källa: SCRCR:s registerformulär för operation. Gul och röd markering av vårdprogramgruppen.
Konceptet CME har studerats av många grupper i mer än ett decennium och är teoretiskt fördelaktigt vid stadium III-cancer; dock kan den preoperativa radiologiska stadieindelningen då vara osäker. I väntan på resultat från pågående och framtida studier konstateras att det finns begränsad evidens för att rutinmässigt använda CME vid högersidig hemikolektomi. Det saknas konsensus om att CME skulle innebära en generell fördel jämfört med onkologisk resektion med beaktande av anatomiska skikt, central kärldelning och lateral marginal. Vid tumörer med cN-stadium I–II hos utvalda patienter (efter värdering av eventuell vinst mot möjlig ökad operationsrisk) kan CME övervägas för att få med fler lymfkörtlar i resektatet.
Utvidgad högersidig hemikolektomi
Vid tumörer lokaliserade i höger flexur och i transversum fram till vänster flexur avlägsnas högerkolon inklusive flexuren och 5 cm av terminala ileum. Transversum delas minst 10 cm distalt om tumören. Kärlen delas vid markering 1, 3 och 5, och på lämplig plats mellan punkterna vid markering 9, i figur 8. Se även figur 7 Högersidig hemikolektomi ovan.
Figur 8. Utvidgad högersidig hemikolektomi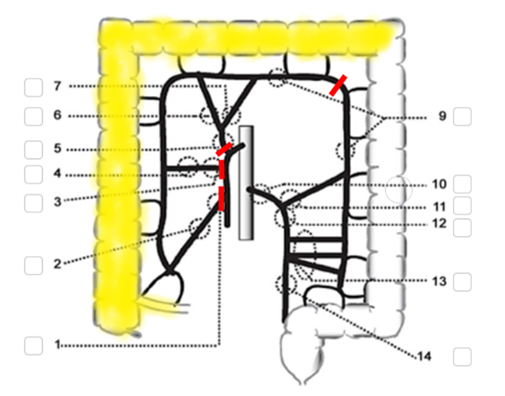
Källa: SCRCR:s registerformulär för operation. Gul och röd markering av vårdprogramgruppen.
Risken för försämrad cirkulation vid Griffith’s point i anslutning till vänster flexur, mellan arteria mesenterica superiors respektive inferiors försörjningsområden, måste beaktas. Vid tumörer i transversum finns risk för spridning till lymfkörtlar i gastro-koliska ligametet. Resektion av gastro-koliska ligamentet (inklusive gastroepiploicakärlen) och omentum majus ”en bloc” bör övervägas. Segmentell resektion av kolon transversum rekommenderas inte generellt, men kan användas i utvalda fall.
Traditionell vänstersidig hemikolektomi alternativt vänstersidig segmentresektion
Tumörer lokaliserade i vänster flexur och descendens har traditionellt opererats med vänstersidig hemikolektomi som innebär resektion av vänster kolonflexur, descendens och sigmoideum med anastomos mellan kolon transversum och rektum. Kärlen delas vid markering 7 och 10 i figur 9. Ingreppet är dock mycket ovanligt i dag, och en anastomos mellan mellersta transversum och rektum är inte alltid möjlig beroende på kärlanatomin.
Numera rekommenderas i stället en vänstersidig segmentresektion med minst 10 cm proximal och distal marginal, och delning av vänstergrenen av a. colica media vid markering 7 i figur 9 och av a. colica sinistra vid markering 11. I båda fallen delas vena mesenterica inferior centralt, nära pankreas. Evidens saknas för att den mer omfattande resektionen (”traditionell vänstersidig hemikolektomi”) skulle vara onkologiskt bättre.
Figur 9. Vänstersidig segmentresektion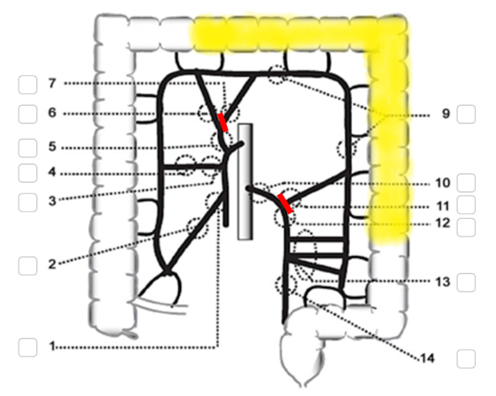
Källa: SCRCR:s registerformulär för operation. Gul och röd markering av vårdprogramgruppen.
Sigmoideumresektion
Vid tumörer lokaliserade i kolon sigmoideum delas arteria mesenterica inferior antingen vid aortaavgången, ”high tie” (vid markering 10 i figur 10), eller ”low tie”, distalt om avgången av arteria colica sinistra (vid markering 11). Evidens saknas för att high tie skulle innebära bättre överlevnad.
Figur 10. Sigmoideumresektion
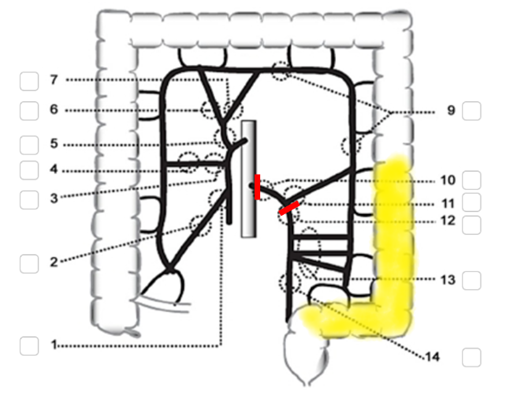
Källa: SCRCR:s registerformulär för operation. Gul och röd markering av vårdprogramgruppen.
Risken för nedsatt blodcirkulation vid Sudeck’s point, mellan den mest distala sigmoidalartären och arteria rektalis superior, måste beaktas. De hypogastriska nerverna bör identifieras och behållas intakta. Dissektion inpå aortaväggen bör undvikas för att minimera risken för skada på sympatiska nerver. Anastomos utförs ända till ända mellan descendens och övre rektum, vilket ofta förutsätter mobilisering av vänster flexur. Vid distala sigmoideumtumörer, nära den rektosigmoidala övergången, bör en hög främre resektion göras inkluderande cylindrisk resektion av mesorektum minst 5 cm nedom tumörens nedre begränsning, dvs. PME.
Subtotal kolektomi, kolektomi och proktokolektomi
Vid synkrona tumörer lokaliserade i både höger- och vänsterkolon rekommenderas (prokto)kolektomi, liksom vid familjär adenomatös polypos (FAP), Lynchs syndrom eller annan ärftlig cancer samt vid metakron tumör efter tidigare resektion. Kolektomi innebär avlägsnande av hela kolon medan rektum sparas. Vanligen delas kolon strax ovan promontorienivå. Vid proktokolektomi avlägsnas kolon och rektum. En resektion som omfattar högerkolon och transversum förbi vänster flexur (men inte hela kolon) benämns subtotal kolektomi. Vid kolektomi delas vanligen kärlen vid markering 1, 4, 5 och 10 i figur 11.
Figur 11. Kolektomi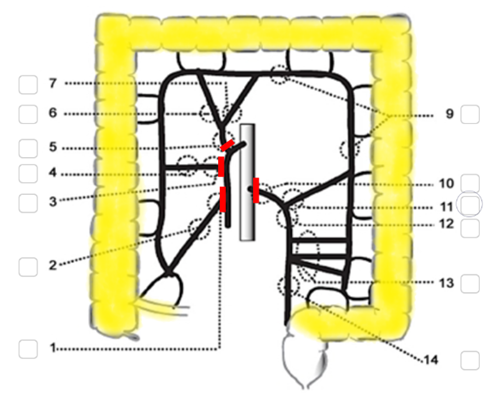
Källa: SCRCR:s registerformulär för operation. Gul och röd markering av vårdprogramgruppen.
Hartmanns operation
För kolontumörer lokaliserade i sigmoideum eller rektosigmoidala övergången, när det inte är lämpligt med anastomos, rekommenderas Hartmanns operation som innebär resektion av sigmoideum (vid distal tumör även rektosigmoidala övergången), förslutning av rektum och anläggande av ändsigmoideostomi. Kärlen delas vid markering 10 eller 12 i figur 12. Se även avsnitt 12.2.2.4 ovan.
Figur 12. Hartmanns operation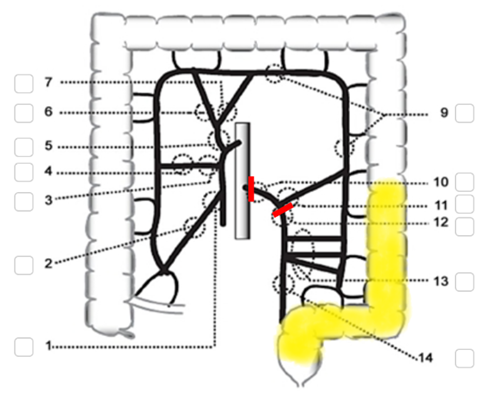
Rekommenderad läsning
Kirurgi vid rektalcancer
Rekommendationer
- Vid all resektionskirurgi vid rektalcancer ska dissektionen ske i det anatomiska så kallade TME-skiktet.
- Främre resektion är standardbehandling för rektalcancer belägen i mellersta och övre tredjedelen av rektum.
- Abdominoperineal excision (APE) är standardbehandling vid tumörer i nedre rektum.
- Hartmanns operation kan användas i kurativt syfte om patienten exempelvis har svag sfinkterfunktion, hög samsjuklighet och riskfaktorer samt vid palliativ resektion.
- Extralevatorisk abdominoperineal excision (ELAPE) är framför allt motiverad för tumörer med hotad eller säkerställd överväxt på levatorer och för mer avancerade tumörer.
- Dissektion med patienten i bukläge, jämfört med i benstöd, innebär bättre assistans, översikt, ergonomi och utbildningsmöjligheter.
Främre resektion
Tumör i mellersta och nedre rektum opereras med låg främre resektion med sida-till-ända-anastomos eller rak ända-till-ända-anastomos samt eventuellt avlastande stomi. Låg främre resektion utförs om minst 1 cm distal marginal kan uppnås. Ingreppet utförs enligt TME principer. Vid tumörer i övre rektum rekommenderas hög främre resektion med PME förutsatt att distal marginal på 5 cm kan uppnås, följt av ända-till-ända-anastomos eller sida-till-ända-anastomos utan avlastande stomi 142 . Mesorektum ska delas vinkelrätt mot rektums längsaxel för att undvika sneddning in mot rektum. Det har på senare år framkommit belägg för att en mindre distal marginal är fullt tillräckligt i många fall, men det är inte fullt klarlagt vilken distal marginal som är optimal 143 . Fördelar med PME är ett bättre funktionellt resultat, åtminstone på ostrålad rektum, och lägre postoperativ komplikationsfrekvens.
Rektum bör sköljas före distal avstapling för att minska risken för lokalrecidiv i anastomosen 144 .
En tillfällig loopstomi minskar de kliniska konsekvenserna av ett anastomosläckage. Loopstomier är dock associerademed egna komplikationer. Vid loopileostomi kanhöga stomiflöden med dehydrering och ibland njursvikt som följd utvecklas. I utvalda fall kan stomin läggas ner i det direkta postoperativa förloppet (inom 8–13 dagar) efter rektumresektion hos patienter utan tecken till postoperativa komplikationer 145 .
Hartmanns operation
Rekommendation
- Hartmanns resektion av rektum med förslutning distalt och sigmoideostomi bör övervägas för patienter med svag sfinkter och/eller hög samsjuklighet.
- Dissektionen vid Hartmanns operation ska göras i samma anatomiska skikt och med samma onkologiska principer som vid övriga rektum-resektioner för cancer.
För äldre patienter eller patienter med avancerad samsjuklighet kan anastomosläckage vara livshotande. I synnerhet låg kolorektal anastomos medför även risk för försämrad tarmfunktion. Vid avancerad samsjuklighet och/eller svag sfinkter kan därför Hartmanns operation övervägas. Det finns en pågående debatt om vilket som är bäst för dessa patienter: Hartmanns operation eller APE (med eller utan intersfinkterisk dissektion i bäckenplanet), men konklusiva data saknas för närvarande. Risk för insufficiens av rektalstumpen med besvärlig bäckenabscess samt fortsatt analinkontinens pga. diversionsproktit kan vara skäl för att överväga intersfinkterisk APE i stället.
Abdominoperineal excision (APE)
Rekommendation
- Oavsett perineal dissektionsteknik och patientläge är god kännedom om tumörstatus, anatomin och tekniken med möjlighet till utvidgad excision nödvändig.
- APE med utvidgad resektion av levator är motiverad vid tumörer med hotad eller säkerställd överväxt på levator och sfinkter för att uppnå R0-resektion.
- Fällknivsläge ger mycket bra översikt och möjlighet till vid excision, oavsett tumörlokal.
Låg rektalcancer inbegriper den distala tredjedelen av rektum upp till cirka 5 cm från anus. Denna del av rektum har mesorektum och mesorektal fascia endast i övre delen, och distalt därom ligger intilliggande vävnader och organ (levatormuskel, bakre vaginalvägg eller prostata) i princip direkt an mot rektalväggen. Detta gör att en låg rektalcancer relativt snabbt kan bli lokalt avancerad med överväxt på omgivande muskulatur, prostata eller vagina. APE används vid distal rektalcancer när andra operationsmetoder inte är lämpliga, dvs. när distal marginal och radikalitet inte är möjligt att uppnå vid distal tarmdelning. Frekvensen av lokalrecidiv efter APE är fortsatt något högre än efter låg främre resektion. En möjlighet till mer radikal kirurgi för de tumörer där levator eller sfinkter misstänks eller konstateras vara involverad i tumören är utvidgad resektion perinealt. En unilateral eller begränsad (”skräddarsydd”) resektion av levatorn, baserat på en preoperativ kartläggning med MRT, för att uppnå R0-resektion har på senare tid presenterats som tillräcklig 146 . Vid omfattande levatorengagemang kan ELAPE (extra-levator abdominal perineal excision) vara aktuell 147 . Utvidgad resektion av levator kräver rekonstruktion av bäckenbotten, med lambåteknik eller med biologiskt material. Det är fortfarande oklart vilken rekonstruktionsteknik som är bäst 148 . Noggrann preoperativ staging är en förutsättning för valet mellan APE och utvidgade resektioner i syfte att uppnå R0-resektion.
Vid både konventionell APE och utvidgad resektion, när det finns tumörväxt dikt an mot prostata eller vagina, måste en partiell resektion av prostata eller av bakre vaginalväggen utföras och i vissa fall är en bäckenutrymning ett alternativ. Fördelen med fällknivsläge är den utmärkta översikten, god visualisering samt bättre assistans, ergonomi och inte minst utbildningsmöjligheter.
Intersfinkterisk APE
Intersfinkterisk APE utförs som en vanlig TME med resektion av rektum ned till bäckenbotten, med patienten i ryggläge. Tarmen kan delas med tvärstapler på vanligt sätt nedom tumören. Den perineala fasen utförs sedan enklast med patienten i benstöd med en intersfinkterisk resektion av analkanalen. Detta är ett alternativ till Hartmanns operation.
Transanal TME
Rekommendationer
- Transanal TME är en svår operation som kräver omfattande erfarenhet av laparoskopisk teknik och särskild utbildning. De onkologiska resultaten är ofördelaktiga, med ökad frekvens av multifokala lokalrecidiv och fler anastomosläckage än vid standard öppen eller minimalinvasiv TME 149150.
- Transanal TME ska i nuläget inte användas vid operation för rektalcancer i Sverige.
Kirurgi vid lokalt avancerad KRC
Sammanfattning:
- Lokalt avancerad KRC kännetecknas av tumörer som inte går att avlägsna radikalt med standardresektion.
- Fria kirurgiska resektionsmarginaler (R0) är en grundläggande kirurgisk princip för behandling av lokalt avancerad KRC och lokalrecidiv.
- Preoperativ kartläggning och behandlingsplanering bör ske i samarbete med enhet som har specialkompetens för utvidgade resektioner.
- Dissektion av tumörnära adherenser eller fibros bör undvikas och i stället krävs utvidgad resektion för att uppnå fria resektionsmarginaler.
- Lokalt avancerad rektalcancer är till stor del NHV-reglerad.
Allmänna principer
Radikal resektion, dvs. fria kirurgiska resektionsmarginaler (R0), är en grundläggande kirurgisk princip för behandling av lokalt avancerad kolorektal cancer 151 . Icke-radikal resektion är förenad med ett påtagligt sämre onkologiskt utfall i form av sämre lokal kontroll och överlevnad.
Lokalt avancerad KRC kännetecknas av tumörer som inte går att avlägsna radikalt med standardresektion av typen CME eller TME. Orsaken kan vara överväxt på andra organ eller strukturer (T4b), eller förändrad anatomi vid till exempel lokala tumörrecidiv. Vid dessa tillstånd bör konverterande onkologisk behandling övervägas och den kirurgiska strategin anpassas för att optimera patientnyttan. Noggrann preoperativ kartläggning bör ske på MDK tillsammans med en enhet som har specialkompetens för detta 152 . DT kan behöva kompletteras med MR, och för att inte missa fjärrmetastasering kan PET-DT vara av värde.
Inflammatoriska adherenser eller fibros efter konverterande behandling kan inte skiljas kliniskt från tumör, och i hälften av fallen innehåller de viabel cancer 153 . Det kan finnas överväxt eller saknas säkra dissektionsplan mot bukvägg, större blodkärl, andra organ eller skelett, vilket kräver ”en bloc”-resektion av dessa för att uppnå fria kirurgiska resektionsmarginaler. Denna kirurgi kräver utöver mer omfattande resektion ofta dessutom rekonstruktiva åtgärder på till exempel urinvägar, större blodkärl eller bukvägg vilket kräver ett multidisciplinärt tillvägagångsätt tillsammans med plastikkirurg, kärlkirurg eller urolog.
Kirurgi vid lokalt avancerad koloncancer
De flesta intraabdominella och retroperitoneala strukturer kan vara engagerade vid lokalt avancerad koloncancer. I avancerade fall kan en t.ex. ”en bloc”-duodenopankreatektomi eller resektion av vena cava vara nödvändig för att uppnå botande resultat. Stora inflammatoriska tumörer kan påverka patientens allmäntillstånd så att varken konverterande behandling eller primär rekonstruktion kan genomföras. I vissa fall kan dock avlastande stomi och/eller perkutan dränering av abscess räcka för att förbättra patientens allmäntillstånd inför behandlingsstart.
Kirurgi vid lokalt avancerad rektalcancer
Rektalcancer som engagerar mesorektal fascia ökar komplexiteten av ingreppet och konsekvenserna för funktionellt utfall 154. Dissektion utanför mesorektum är utmanande och associerad med större intraoperativ blodförlust. Anterior växt hotar urogenitala organ och innebär hög risk för inkomplett resektion (R1) om inte den cirkumferenta resektionsmarginalen utvidgas. Lateral växt kan engagera iliacakärl och uretär liksom lumbosakralplexus, vilket gör att kirurgisk resektion och rekonstruktion blir mer komplex. Dorsal växt kan engagera sacrum men vara resektabel med sakrektomi upp till S2-nivå.
”En bloc”-resektion av urogenitalorgan kan krävas, och rekonstruktion av urinvägarna omfattar allt från sutur av urinblåsa till Brickerdeviation efter cystektomi.
Fall med lokalt avancerad kolorektalcancer där total bäckenutrymning, resektion av del av korsbenet ovan coccyx eller annan del av bäckenskelett eller lateral bäckenväggsdissektion med eller utan kärl- och/eller nervresektion bedöms, vid preterapeutisk utvärdering, potentiellt nödvändigt för att uppnå mikroskopisk radikalitet (R0) ska utföras på NHV-enhet för avancerad bäckenkirurgi.
Kirurgi vid lokalrecidiv
Lokalrecidiv uppkommer i 5–10 % av fallen efter resektion för koloncancer och rektalcancer. Av dessa patienter har hälften inga tecken på synkron fjärrmetastasering 155 . Misstanke om lokalrecidiv kan väckas vid stigande CEA, nytillkomna lokala symtom eller nytillkommen lokal mjukdelsökning på planerad uppföljande DT. Kompletterande utredning med MRT och PET-DT rekommenderas, och om möjligt även biopsi. Obehandlade lokalrecidiv i bäckenet leder ofta till svårt lidande. Kunskapsläget avseende neoadjuvant eller konverterande onkologisk behandling är mycket begränsat, men retrospektiva studier indikerar att rebestrålning och cytostatika kan ha effekt 156 . För patienter som tidigare inte strålbehandlats rekommenderas neoadjuvant kombinerad cytostatika- och strålbehandling vid lokalrecidiv av rektalcancer, se avsnitt 11.2.5 Rebestrålning.
Vid kirurgisk behandling av lokalrecidiv gäller huvudsakligen samma principer som för primär lokalt avancerad cancer, med skillnaden att ingreppet oftast är tekniskt svårare pga. förändrad anatomi, avsaknad av fria anatomiska dissektionsplan och inte sällan uttalad fibros. Detta gör det svårare att uppnå R0-resektion vid lokalrecidiv jämfört med primär cancer 157 . Prognosen är dessutom sämre, men total 5-årsöverlevnad på 35–50 % kan uppnås vid radikal resektion 158 . Vid påvisat eller misstänkt lokalrecidiv bör patienten remitteras till en enhet med specialkompetens.
Lokalt återfall av kolorektalcancer där total eller bakre bäckenutrymning, resektion av del av korsbenet ovan coccyx eller annan del av bäckenskelett eller lateral bäckenväggsdissektion med eller utan kärl- och/eller nervresektion bedöms potentiellt nödvändigt för att uppnå mikroskopisk radikalitet (R0) skall utföras på NHV-enhet för avancerad bäckenkirurgi.
Kirurgi vid misstanke om laterala lymfkörtelmetastaser
Sammanfattning:
- Lateral lymfkörtelmetastasering förekommer hos 15–20 % av patienter med låg rektalcancer med avancerat T-stadium.
- Laterala lymfkörtlar i framför allt iliaca interna-regionen, med tvärmått > 7 mm före neoadjuvant behandling, ska inge misstanke om metastatisk lymfkörtel.
- Lateral lymfkörtelutrymning rekommenderas om initialt suspekta lymfkörtlar på utvärderande MRT efter neoadjuvant behandling har tvärmått > 4 mm.
Lymfkörtelmetastasering till laterala lymfkörtlar utmed bäckenväggarna utanför mesorektum är väl beskrivet och förekommer huvudsakligen vid låga tumörer med avancerat T-stadium. För T3–T4-tumörer belägna i mellersta och nedre rektum förekommer de i 15–20 % av fallen. Laterala lymfkörtelmetaser i iliaca interna- och obturatorius-regionen klassificeras som N+ medan körtelmetastaser i iliaca externa-regionen klassificeras som M1 och i bägge fallen ses en associerad försämrad cancerspecifik överlevnad liknande den för N2a respektive N2b.
Laterala lymfkörtelmetastaser (i framför allt iliaca interna-regionen) utgör en riskfaktor för senare uppkomst av laterala lokalrecidiv av rektalcancer.
Diagnos sker i första hand med MRT där storleken (diameter i transversalplanet) på de laterala lymfkörtlarna korrelerar till risken för metastatisk körtel.
Evidensen för nyttan med lateral lymfkörtelutrymning bygger huvudsakligen på retrospektiva jämförande studier. Det saknas randomiserade studier avseende nyttan av lateral lymfkörtelutrymning efter neoadjuvant behandling men i en stor japansk randomiserad studie på patienter med stadium II–III-tumörer nedom peritoneala omslagsvecket, och som inte fått neoadjuvant behandling, rapporterades lägre lokalrecidivfrekvens om lateral körtelutrymning utfördes utöver TME (7 % jämfört med 13 %, p = 0,02).
Klinisk misstanke om lateral körtelmetastasering utgör indikation för neoadjuvant behandling. Laterala lymfkörtelmetastaser kvarstår dock i uppskattningsvis en till två tredjedelar av fallen efter neoadjuvant behandling vilket kan motivera lateral körtelutrymning utöver TME om utvärdering visar otillräckligt behandlingssvar.
För T3–T4-tumörer i mellersta och nedre rektum med laterala lymfkörtlar i iliaca interna-regionen med tvärmått större än 7 mm före neoadjuvant behandling och större än 4 mm efter neoadjuvant behandling är risken för lateralt lokalrecidiv hög och i dessa fall bör lateral lymfkörtelutrymning övervägas, vilket sannolikt reducerar risken för lokalrecidiv. Om initialt suspekta lymfkörtlar krympt till mindre än 4 mm är risken för lokalrecidiv låg varför lateral körtelutrymning inte rekommenderas med hänsyn till potentiell morbiditet kopplad till ingreppet.
Lateral körtelutrymning bör göras med nervsparande teknik inbegripande obturatoriusloge och iliaca interna-regionen. Dessa fall ska remitteras till utförare med stor vana och kompetens för detta och ingår i NHV för avancerad bäckenkirurgi.
För referenser rörande lateral lymfkörtelspridning vid rektalcancer, se 56159 160 161 162 163 164 165 166 167 .
Kirurgi vid appendixneoplasier
Rekommendationer
- Icke perforerad appendixcancer behandlas som högersidig koloncancer.
- En perforerad appendixtumör medför stor risk för peritoneala metastaser varför bedömning av eventuell carcinos alltid bör göras.
- Vid misstanke om peritoneala metastaser kontaktas en HIPEC-enhet.
- Appendektomipreparat ska inte skäras eller klippas upp före fixering.
Appendixneoplasier är ovanliga och upptäcks oftast i samband med t.ex. en akut appendektomi eller som bifynd vid en DT-undersökning. Knappt 1 % av alla appendektomipreparat innehåller någon form av neoplasi 168 . Appendixneoplasier är biologiskt heterogena och prognosen varierar beroende på den histologiska subtypen. Peritoneal metastasering ses oftare vid appendixneoplasier än vid annan KRC, vilket delvis beror på att appendix är tunnväggig och lättare perforeras 169 .
Appendixneoplasier är epiteliala eller icke epiteliala. Vanligast är de mucinösa epiteliala tumörerna. De klassificeras som låg- eller höggradiga beroende på grad av dysplasi och invasivitet. Till de mucinösa epiteliala tumörerna hör low grade appendiceal mucinous neoplasm (LAMN) och high grade appendiceal mucinous neoplasm (HAMN), där HAMN uppvisar en mer uttalad cellatypi men utan invasiv växt 170 . Tumörperforation kan medföra spill av mucin och mucinbildande epiteliala celler ut i bukhålan. Om det enbart förekommer acellulärt mucin utanför appendix är prognosen god, medan spridning av neoplastiska celler ökar risken för utveckling av pseudomyxoma peritonei 171 , ett tillstånd som karakteriseras av stora mängder mucinös ascites och en utbredd peritoneal metastasering 172 173.
Begreppet mucocele innebär en slemfylld och vidgad appendix. Orsaken kan vara såväl benign som malign. Behandlingen är appendektomi, där en del av caekum ibland behöver tas med för att uppnå radikalitet. Det är av största vikt att undvika perforation med spill av slem. Vid perforation bör uppsamlat slem skickas för cytologi och eventuella peritoneala förändringar biopseras. Appendektomipreparat bör inte skäras eller klippas upp före fixering, eftersom det försvårar den mikroskopiska bedömningen av en eventuell perforation – något som har stor betydelse för handläggning och uppföljning.
Stadieindelning av maligna appendixneoplasier görs enligt TNM, men för adekvat bedömning av prognos behöver den histologiska subtypen fastställas. Följande subtyper finns: mucinösa och icke mucinösa adenokarcinom, adenokarcinom med signetcellsdifferentiering, neuroendokrina tumörer (NET/carcinoider) och gobletcell-adenokarcinom (som är en blandform av adenokarcinom och carcinoid). Cirka 30–50 % av alla maligna tumörer i appendix är neuroendokrina och avhandlas i annat vårdprogram.
Preoperativ utredning av appendixneoplasier försvåras av att tumören oftast inte kan ses eller biopseras vid koloskopi, som dock bör utföras för att utesluta synkron kolonneoplasi eller överväxt på cekum. Övrig rekommenderad utredning är DT thorax-buk och analys av tumörmarkörer (CEA, CA 19–9 och CA 125). Vid radiologiskt misstänkt peritoneal spridning blir ofta diagnostisk laparoskopi aktuellt för att värdera tumörutbredningen och ta biopsier 174 . Dessa patienter handläggs i samråd med en HIPEC-enhet. Vid konstaterade peritoneala metastaser hos en patient som bedöms tåla ett stort kirurgiskt ingrepp ska patienten remitteras till en HIPEC-enhet. Detsamma gäller vid perforerad appendixcancer, där risken att utveckla peritoneala metastaser är mycket hög. Om en perforerad appendixtumör upptäcks vid en akut operation bör som regel resektionen begränsas till en appendektomi, vid behov medtagande del av caekum.
Icke perforerad appendixcancer (adenokarcinom/gobletcell-adenokarcinom) utan tecken på peritoneala metastaser behandlas och följs upp som högersidig koloncancer.
För de icke-maligna appendixneoplasierna (LAMN och HAMN) utan peritoneal metastasering rekommenderar Svenska peritonealcancergruppen uppföljning enligt tabell 16 175 .
Tabell 16. Utredning och uppföljning av appendixneoplasier (LAMN och HAMN) utan peritoneal metastasering
|
Histopatologi |
Utredning/uppföljning |
|
Baseline för alla |
DT buk + tumörmarkörer Koloskopi |
|
Icke perforerad, R0 |
Färdigbehandlad |
|
Perforerad utan extraappendicealt mucin eller celler |
DT buk + tumörmarkörer, 1 och 3 år postoperativt |
|
Perforerad med extraappendicealt mucin |
DT buk + tumörmarkörer, 1, 3 och 5 år postoperativt |
|
Perforerad med extraappendiceala celler |
DT buk + tumörmarkörer (ev. MRT buk) var 6:e månad i 2 år och sedan 3, 4 och 5 år postoperativt |
Vid tveksamhet, konsultera en HIPEC-enhet.
Akut kirurgi vid KRC
Rekommendationer
- Vid akut obstruerande avancerad KRC bör avlastande stomi anläggas som rutin.
- Vid obstruktion pga. icke-avancerad koloncancer kan resektion utföras, under förutsättning att sedvanliga kirurgisk-onkologiska principer kan följas.
- Vid tveksamhet om hur avancerad tumören är, eller om resektion inte kan ske enligt sedvanliga kirurgisk-onkologiska principer, bör en avlastande stomi anläggas i det akuta skedet för senare planerad resektion.
- Vid fri perforation eller kraftig icke avstannande blödning bör resektion utföras.
- Stent kan övervägas vid obstruktion om adekvat kompetens och erfarenhet finns tillgänglig.
Bakgrund
Koloncancer debuterar med akut insjuknande i cirka 20 % av fallen, varav i 70 % som ileus orsakad av en stenoserande tumör, men även perforation och blödning förekommer. De obstruerande tumörerna är vanligen lokaliserade till vänsterkolon. Akut resektion av koloncancer är behäftad med en ökad perioperativ dödlighet (30-dagarsdödligheten i Sverige är 5,6 % jämfört med 1 % efter planerad resektion; 90‑dagarsdödligheten för akutopererade är 11 % jämfört med 1,7 % efter planerad resektion) (SCRCR 2020–2022). Patienter som genomgått akut resektion vid koloncancer har sämre relativ 3- och 5‑årsöverlevnad jämfört med planerat opererade (SCRCR 2016–2022).
Akut resektion av obstruerande kolontumör på både höger och vänster sida innebär ökad morbiditet och mortalitet och flera studier visar att en konvertering av den akuta situationen till en planerad kan förbättra dessa parametrar 176177178.
Utredning
Akuta patienter bör utredas preoperativt avseende primärtumörens utbredning och eventuella metastaser för att en optimal behandling ska kunna planeras.
Operation
Den akuta situationen kan konverteras till planerad om perforation, ischemi eller blödning inte gör att resektionskirurgi blir nödvändig. Avlastning bör ske genom att anlägga en avlastande proximal stomi eller, om stor erfarenhet finns, anläggande av självexpanderande metallstent vid vänstersidig obstruktion 179 . Vid akut obstruerande avancerad KRC bör alltid proximal avlastning göras.
Vid resektion ska sedvanliga onkologiska principer iakttas (proximal kärlligatur, intakt mesokolisk fascia och R0-kirurgi). Om tveksamheter föreligger om en resektion enligt dessa principer kan göras bör patienten i stället avlastas till förmån för ett flerstegsförfarande.
Avseende anastomosförfarande eller inte rekommenderar Association of Coloproctology of Great Britain and Ireland 180 primär resektion med anastomos vid okomplicerad obstruerande högersidig koloncancer, liksom vid okomplicerad vänstersidig obstruerande koloncancer om patientens tillstånd är gott. Detta är vedertaget förutsatt att patienten är adekvat utredd och att en kolorektalkirurg finns tillgänglig. Stomi bör övervägas om patienten har nedsatt allmäntillstånd och allvarligare samsjuklighet, får steroidbehandling eller har fekal peritonit.
I sällsynta fall där blödning är indikation för akut åtgärd finns fallrapporter om angiografisk coiling eller endoskopisk intervention inklusive stentning. I de fall som presenterar sig med perforation och peritonit behöver det perforationsbärande tarmavsnittet avlägsnas. Det finns ingen evidens för vilken operationsmetod som är lämpligast. I vissa fall kan en täckt perforation behandlas utan akut kirurgi.
Kirurgiska metoder:
- Avlastande stomi oralt om det tumörbärande området som enda åtgärd i det akuta skedet, och sedan avlägsnande av det tumörbärande området i ett planerat ingrepp.
- Resektion av ischemiskt påverkad proximal tarm, proximal stomi samt mukös fistel på aboral tarm fram till det tumörbärande området.
- Resektion av det tumörbärande området och uppläggande av den orala tarmänden eller båda tarmändarna som stomi.
- Resektion av det tumörbärande området med primäranastomos, med eller utan en avlastande stomi.
Palliativ kirurgi
Rekommendationer
- Palliativ kirurgi kan syfta till att lösa akuta problem eller lindra symtom.
- Vid obstruktion bör stomiavlastning, enterokolisk bypass, tumörresektion eller endoskopisk stent övervägas.
- Resektion av asymtomatisk primärtumör bör inte utföras.
I den palliativa situationen bör beslut om kirurgi fattas utifrån en sammantagen bedömning av patientens allmäntillstånd, förväntad överlevnad, möjlighet till symtomlindring och patientens egen önskan. En operation kan syfta till att lösa eller lindra akuta symtom och problem.
Vid kolonobstruktion finns alternativen stomiavlastning, enterokolisk bypass, tumörresektion eller endoskopisk stent. Obstruktion på tunntarmsnivå orsakas ibland av en sammanväxning som är enkel att åtgärda, men det kan också röra sig om en utbredd adherensbildning eller peritoneala metastaser. I de senare fallen kan en gastrostomi ge symtomlindring.
En asymtomatisk primärtumör vid synkrona icke resektabla metastaser bör normalt inte resekeras. En Cochrane-analys från 2012 och en nyligen publicerad randomiserad studie visar ingen fördel av resektion jämfört med standard onkologisk behandling 181 182 . Vid rektalcancer kan palliativ resektion övervägas i utvalda fall, för att undvika det lidande som en avancerad bäckentumör kan orsaka. Strålbehandling kan i många fall ge lindring, om patienten inte tidigare fått strålbehandling eller bara har fått 25 Gy.
Perioperativt omhändertagande
Rekommendationer
- Patienter som genomgår elektiv kolorektal kirurgi bör omfattas av program för snabb postoperativ återhämtning, Enhanced Recovery Program.
- ERAS-riktlinjerna (Enhanced Recovery After Surgery) ger en omfattande ram för att optimera perioperativ vård för patienter som genomgår elektiv kolorektal kirurgi
- Aktuella riktlinjer finns publicerade på ERAS Society:s webbplats.
ERAS-riktlinjerna syftar till att minska perioperativ stress, upprätthålla postoperativ fysiologisk funktion och påskynda återhämtning efter operation. Detta uppnås genom en multimodal strategi som har visat sig minska sjuklighet, förbättra återhämtning och förkorta vårdtiden.
Huvuddragen i riktlinjerna kan sammanfattas enligt nedan:
- Optimering före operation: preoperativ riskbedömning, rökavvänjning, minskning av alkoholkonsumtion, korrigering av anemi, preoperativ fysisk träning och näringsoptimering.
- Förberedelse inför operation: förebyggande av postoperativt illamående och kräkningar (PONV), antibiotikaprofylax och huddekontaminering. Vid kolonkirurgi rekommenderas inte mekanisk tarmrengöring.
- Intraoperativ hantering: Riktlinjerna inkluderar rekommendationer för anestesi, förebyggande av hypotermi, kirurgisk teknik och vätskehantering.
- Postoperativ vård: smärtlindring, trombosprofylax, tidig mobilisering, postoperativt näringsintag, glykemisk kontroll, förebyggande av postoperativ tarmparalys.
- Implementering av ERAS: multidisciplinärt team, patientutbildning och uppföljning efter utskrivning.
- Multidisciplinärt tillvägagångssätt: Framgångsrik implementering av ERAS kräver samarbete mellan kirurger, anestesiologer, sjuksköterskor, fysioterapeuter och andra vårdgivare.
