Neoadjuvant (preoperativ) behandling
Neoadjuvant behandling av koloncancer
Rekommendationer
- Standardbehandling för stadium I–III koloncancer är direktoperation.
- Vid mer avancerad pMMR (MSS), operabel tumör (T4 och/eller N2), kan 6 veckors oxaliplatinbaserad neoadjuvant cytostatika förbättra prognosen, förutsatt att patienten är i gott allmäntillstånd och inte uppvisar obstruktiva symtom.
- Vid lokalt avancerad koloncancer där det bedöms svårt att uppnå radikalitet, s.k. konverteringssituation, och pMMR (MSS), rekommenderas neoadjuvant cytostatika, ev. med tillägg av antikropp.
- Vid konverteringssituation och dMMR (MSI-high) kan immunterapi övervägas.
Cytostatikabehandling och immunterapi
Traditionellt planeras koloncancer för direktkirurgi. I undantagsfall ges preoperativ cytostatikabehandling vid lokalt avancerad koloncancer där det bedöms svårt att uppnå radikalitet, i syfte att krympa tumören.
Detta synsätt har reviderats något efter publikation av FOxTROT-studien 86 . I studien randomiserades patienter med lokalt avancerad koloncancer (T3cd–4, N0–2) till direktoperation eller till preoperativ cytostatikabehandling i form av fluorouracil, kalciumfolinat och oxaliplatin (FOLFOX) eller kapecitabin och oxaliplatin (CAPOX) i 6 veckor, med eller utan tillägg av panitumumab vid KRAS vildtyp följt av operation. Efter 2 år sågs bättre sjukdomskontroll för de som fick neoadjuvant cytostatika. I den gruppen sågs även en påtaglig tumörkrympning, och vid blindad granskning av patolog sågs oftare morfologiska tecken på sådan krympning. Denna regress sågs oberoende av kliniska eller patologiska variabler förutom att andelen var signifikant lägre hos dMMR-tumörerna (MSI-high) än hos pMMR-tumörer (MSI-low och MSS).
Ytterligare en studie på T3–4-tumörer har jämfört neoadjuvant cytostatika i 3 månader, FOLFOX eller CAPOX, med standardbehandlingen operation direkt. Resultatet visade histopatologisk effekt i form av tumörkrympning, men ingen effekt på sjukdomsfri överlevnad 87 .
Ytterligare data presenterades nyligen där standardbehandling, dvs. operation, jämförts med tre cykler CAPOX eller fyra cykler FOLFOX, vid T3–4, N0–2-tumörer 88 . Studien visade ingen vinst i varken total överlevnad eller sjukdomsfri överlevnad, men totalt mindre cytostatika gavs i studiearmen och analogt sågs krympning av tumörerna.
Sammanfattningsvis talar data så här långt för att en del patienter med lokalt avancerad koloncancer, radiologiskt T3cd–4, N0–2 som är primärt operabel, kan övervägas för neoadjuvant cytostatika, och då i första hand 6 veckors FOLFOX eller CAPOX. För att behandling i nuläget ska vara aktuell krävs ett allmäntillstånd motsvarande WHO performance status 0–1, pMMR (MSS) samt god passage förbi tumören vid koloskopi. Ytterligare parametrar som ökar indikationen är T4 och N2. Sidoskillnad studerades i FOxTROT-studien och rapporterades på ESMO 2019, men det rapporterades inte i publikationen eftersom studien inte var designad eller dimensionerad för den parametern, inte heller subgrupper som T4 och N2. I denna tidigare subgruppsanalys sågs fördel neoadjuvans för vänstersidiga tumörer, så även för T4.
I konverteringssituationer vid pMMR (MSS), när en krympning i första hand krävs för att möjliggöra operation, eller för att minska ingreppet signifikant, bör cytostatikaregimer som ger maximal krympning väljas, i första hand kombinationscytostatika där tillägg av antingen EGFR- eller VEGF-hämmare kan vara aktuellt. Även trippelbehandling med 5‑fluorouracil (5‑FU), irinotekan och oxaliplatin kan övervägas. Resonemangen är jämförbara med de vid konverteringssituationer i stadium IV, varför utförligare resonemang och riktlinjer för regimval och behandlingslängd finns i det kapitlet om adjuvant behandling. Se avsnitt 14.4.2.2 Systemisk behandling vid potentiellt resektabla metastaser (konvertering).
Vid resektabel koloncancer dMMR (MSI-high) bör varken neoadjuvant cytostatika eller immunterapi ges. Det har nyligen publicerats data från NICHE‑2-studien, med en medianuppföljning på 26 månader (range 5–65 mån) 89 . Patienter med icke-metastaserad dMMR koloncancer stadium II–III behandlades med en dos ipilimumab (1 mg/kg) och två doser nivolumab (3 mg/kg) och opererades ≤ 6 veckor efter registrering. Primära effektmått var säkerhet i form av tidsenligt utförd säker kirurgi, vilket uppnåddes. Tre års sjukdomsfri överlevnad för ITT har inte redovisats, men inga återfall har påvisats under uppföljningen. Hela 68 % uppnådde pCR, och 4 % av patienterna fick biverkningar grad 3–4.
NICHE-2 studien indikerar att immunterapi på sikt kan bli en standardbehandling innan kirurgi, men det finns fortsatt utmaningar med preoperativ stadieindelning, responsutvärdering och långtidsresultat i större kohorter. Randomiserade studier och livskvalitetsstudier behövs. En studie, AZUR-2, pågår i Sverige. Patienter med T4 N+ eller stadium III dMMR (MSI-high) koloncancer randomiseras mellan dostarlimab och sedvanlig behandling, dvs. direktkirurgi och adjuvant cytostatikabehandling.
I avvaktan på slutgiltiga data från NICHE‑2 och kompletterande studier bör patienter med resektabel koloncancer dMMR (MSI-high) direktopereras. Immunterapi bör enbart ges inom ramen för studier. Det enda undantaget är vid konverteringssituationer, då en diskussion kring bästa alternativet, som kan inbegripa immunterapi, bör drivas på MDK. Resonemangen är jämförbara med konverteringssituationer i stadium IV, varför utförligare resonemang och riktlinjer för regimval och behandlingslängd finns i kapitlet om adjuvant behandling. Se avsnitt 14.4.2.2 Systemisk behandling vid potentiellt resektabla metastaser (konvertering).
Strålbehandling
För koloncancer har strålbehandling studerats i betydligt mindre omfattning än för rektalcancer. Preoperativ strålbehandling har inget tilläggsvärde vid operabel tumör. I en amerikansk registerstudie på patienter med cT4-koloncancer sågs dock signifikant högre andel R0-resektioner och bättre överlevnad bland den lilla andel patienter som fick preoperativ strålbehandling 90 . Några randomiserade studier som belyser detta finns inte publicerade.
Även om evidensen således är svag kan kombinerad strål- och cytostatikabehandling övervägas vid lokalt avancerad koloncancer med överväxt på intilliggande icke resektabel vävnad, förutsatt att det inte finns några fjärrmetastaser. Förslagsvis ges strålbehandling 50,4 Gy i kombination med 5‑FU/kapecitabin.
Neoadjuvant behandling av rektalcancer
Rekommendationer
- Vid tidig rektalcancer, där risken för lokalrecidiv är < 5–6% med enbart kirurgi, rekommenderas kirurgi direkt utan föregående strålbehandling.
- Vid intermediärrisk rektalcancer, där risken för lokalrecidiv är ≥ 6–8 % med enbart kirurgi, rekommenderas short course radiotherapy (SCRT) följt av resektion, antingen direkt (2–4 dagar efter strålbehandlingens slut) eller fördröjt (4–8 veckor efter strålbehandlingens slut).
- Vid lokalt avancerad rektalcancer, där tumörkrympning önskas för att möjliggöra eller underlätta kirurgin, eller vid hög risk för fjärrecidiv, rekommenderas total neoadjuvant terapi (TNT) inför kirurgi, i första hand i form av SCRT följt av 12–18 veckors kombinationscytostatika.
- Till patienter med lokalt avancerad rektalcancer, vilka inte bedöms tåla kombinationscytostatika, är SCRT med fördröjd kirurgi standardbehandling.
- Vid klinisk, radiologisk och endoskopisk komplett remission efter neoadjuvant strålbehandling bör patienter informeras om, och efter samtycke inkluderas i, ett ”watch and wait”-program på dedikerad enhet.
- Förekomst av dMMR kan påverka valet av behandling.
Bakgrund
Beroende på den kliniska situationen kan lokaliserad rektalcancer behandlas neoadjuvant (preoperativt) med strålbehandling och/eller cytostatika i olika syften. Ett är att krympa tumören för att underlätta radikal kirurgi. Ett annat är att minska risken för lokoregionala recidiv och fjärrecidiv genom att behandla potentiella mikrometastaser. Ett tredje syfte är att möjliggöra organbevarande behandling.
Strålbehandling vid rektalcancer
Ett antal randomiserade studier har visat att strålbehandling minskar risken för lokalrecidiv 91 92 . Sammantaget visar studierna att neoadjuvant strålbehandling 5 Gy x 5 (så kallad short course radiotherapy, SCRT) sänker den relativa risken för lokalrecidiv med 50–70 %, oavsett typ av kirurgi. Strålbehandling är effektivare om den ges preoperativt än postoperativt 93 .
SCRT är en strategi som utvecklades i Sverige. På många håll i världen används dock mestadels konventionellt fraktionerad strålbehandling, dvs. doser om 1,8–2 Gy dagligen upp till 45–50,4 Gy under 5–6 veckor. Flera randomiserade studier vid lokalt avancerad rektalcancer visar att den lokala tumörkontrollen och sannolikt också överlevnaden ökar om konventionellt fraktionerad strålbehandling kombineras med cytostatika, så kallad kemoradioterapi (CRT) 94 95 . Tidigare användes oftast 5‑fluorouracil (5‑FU), men senare studier har visat att kapecitabin är minst lika effektivt 96 .
Jämförelser mellan SCRT och CRT vid rektalcancer cT3–4 har inte visat några signifikanta skillnader i risk för lokalrecidiv, sjukdomsfri överlevnad eller total överlevnad. CRT ger mer akuta biverkningar men ingen skillnad i sena biverkningar 97 98 .
Kvinnor som genomgått strålbehandling mot lilla bäckenet vid kolorektalcancer bör avregistreras från livmoderhalscancerscreening. Se Nationellt vårdprogram för livmoderhalscancerprevention.
Total neoadjuvant terapi (TNT)
Med bättre kirurgi och preoperativ strålbehandling ses numera betydligt färre lokalrecidiv än tidigare 91 92 . Risken för fjärrmetastasering har däremot inte minskat nämnvärt. Adjuvant cytostatikabehandling kan minska risken för fjärrmetastaser, men det saknas tydlig evidens för dess värde vid rektalcancer. Total neoadjuvant terapi (TNT) innebär att inte bara strålbehandling ges före operationen, utan också den adjuvanta cytostatikabehandlingen. TNT har studerats i flera nyligen presenterade studier som undersökt både SCRT och CRT i kombination med cytostatika givet antingen före eller efter strålbehandlingen.
Treårsuppföljningen av den randomiserade svensk-nederländska RAPIDO-studien visade att SCRT följt av 6 cykler CAPOX (18 veckor) neoadjuvant gav dubbelt så hög andel patienter med patologisk komplett remission jämfört med neoadjuvant CRT och adjuvant cytostatika till utvalda patienter (28 % respektive 14 %) och lägre risk för fjärrmetastasering (20 % respektive 27 %). Inga signifikanta skillnader sågs vad gäller lokalrecidiv eller total överlevnad 99 . Under 2023 publicerades femårsuppföljningen 100 . Risken för fjärrmetastaser var fortfarande lägre, men en högre risk för lokoregionala recidiv sågs i TNT-armen (10 % respektive 6 %). Orsaken till den ökade risken för lokoregionala recidiv är i nuläget oklar. Den verkar inte drivas av laterala lymfkörtelmetastaser, utan av recidiv i anastomosen eller presakralt hos patienter som opererats med sfinkterbevarande kirurgi och som fått strålbehandling med den äldre 3D-CRT-tekniken.
Tre andra studier har visat fördelar med TNT jämfört med standard CRT, i form av högre andel med patologisk komplett remission, färre fjärrmetastaser eller bättre total överlevnad 101 102 103 . RAPIDO-studien stängde för inklusion 2016 och sedan dess har många centrum i Sverige inkluderat patienter i multicenterstudien LARCT-US (Locally Advanced Rectal Cancer Trial Uppsala Style), som bygger på experimentarmen i RAPIDO-studien, med SCRT men med kortare CAPOX-behandling 12 veckor). Resultaten har nyligen publicerats och visar att den antitumorala effekten verkar vara likvärdig med den i RAPIDO-studien 104 .
Att ge TNT med CRT i stället för SCRT har studerats bl.a. i OPRA-studien 105 . I denna amerikanska fas II-studie randomiserades patienter med stadium II–III rektalcancer mellan CRT (mediandos 54 Gy) följt av cytostatika (CRT-CT) och den omvända sekvensen, alltså cytostatika följt av CRT (CT‑CRT). Patienter som efter denna behandling var i klinisk komplett remission erbjöds ”watch and wait” som alternativ till operation. Med tre års medianuppföljning var den sjukdomsfria överlevnaden 76% i båda studiearmarna. Vid treårsuppföljningen var TME-fri överlevnad hela 53 % i CRT-CT-armen och 41 % i CT-CRT-armen.
Tidstrender
Andelen svenska patienter som får någon typ av neoadjuvant strålbehandling före operation av rektalcancer har länge legat på 60–65%. Vid förra versionen av detta vårdprogram stramades kriterierna för neoadjuvant strålbehandling åt, och 2020 hade andelen gått ner till drygt 50 %. Vidare har det under de senaste åren skett stora förändringar avseende vilken typ av neoadjuvant behandling som givits (se figur 6). En ökad andel har fått SCRT med fördröjd kirurgi, med eller utan sekventiell cytostatikabehandling, medan andelen som fått CRT eller SCRT med direktkirurgi har minskat.
Figur 6. Neoadjuvant behandling av rektalcancer 2009–2022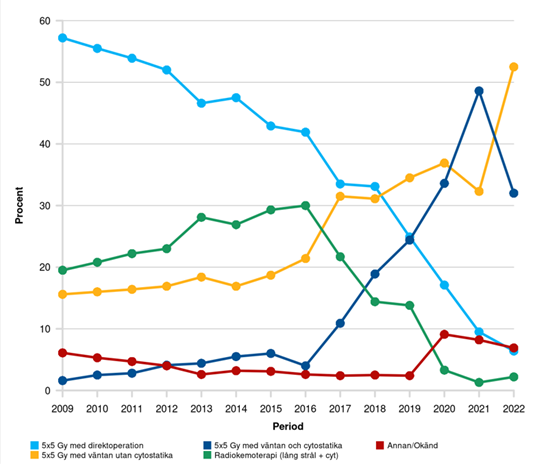
Källa: Interaktiv rapport från Svenska Kolorektalcancerregistret med data hämtat 2024-04-02. Se online‑rapporten (statistik.incanet.se/kolorektal/rektum) för senast uppdaterade data.
Behandlingsrekommendationer
Vid handläggning av nydiagnostiserad lokaliserad rektalcancer har hållningen i Sverige traditionellt varit att det finns tre olika vägval för behandlingen: att operera direkt, att ge SCRT för att minska risken för framtida lokalrecidiv eller att ge CRT för att krympa tumören och därmed förbättra möjligheterna till radikal kirurgi. Behandlingsbeslutet baseras framför allt på MRT, där tumörerna kategoriseras som lågrisk, intermediärrisk eller högrisk med avseende på lokal kontroll och därmed behov av neoadjuvant strålbehandling. Vid val av neoadjuvant behandling vägs numera även risken för fjärrmetastasering in i bedömningen. Efter att bl.a. RAPIDO-studien visat fördelar med TNT har SCRT följt av neoadjuvant cytostatika blivit den nya standardbehandlingen i Sverige vid lokalt avancerad rektalcancer.
Lågrisktumör
Vid tidig cancer, där risken för lokalrecidiv med enbart kirurgi är högst 5–6 %, rekommenderas operation utan föregående neoadjuvant behandling. Här ingår majoriteten av cT1–2 och alla höga cT3 MRF-, begränsad cT4a och cN1 såvida inte MRF+ föreligger.
Intermediärrisktumör
Vid primärt resektabel tumör rekommenderas SCRT följt av operation, om risken för lokalrecidiv med enbart kirurgi är högre än 6–8 % men risken för fjärrmetastaser inte är påtagligt förhöjd. Här ingår de flesta lågt belägna tumörer, T4a-tumörer (om utbrett engagemang), T4b-tumörer (om inväxt i lättresektabelt organ) och cN1-tumörer som orsakar MRF+.
I Stockholm III-studien jämfördes operation direkt (3–7 dagar eller strålslut) med fördröjd kirurgi (4–8 veckor efter strålslut) efter kort neoadjuvant strålbehandling SCRT till patienter med primärt resektabel rektalcancer 106 . Inga skillnader sågs beträffande risk för lokalrecidiv, sjukdomsfri överlevnad eller total överlevnad. Direktkirurgi var förknippat med fler postoperativa komplikationer, men detta verkar bara gälla om operationen utfördes dag 5–7 efter avslutad strålbehandling. Fördröjd kirurgi var å andra sidan förknippat med fler akuta strålbiverkningar. Fördelar med fördröjd kirurgi är att vissa tumörer går i komplett remission efter SCRT med väntan, och då kan patienten erbjudas en organbevarande strategi, se avsnitt 11.2.3 nedan. Vidare kan väntetiden till operation användas till att vid behov optimera patienten inför kirurgi, med exempelvis nutritionsstöd och rökavvänjning. Flera regioner i landet har konsekvent gått över till fördröjd kirurgi, medan andra håller kvar vid de gamla rutinerna, dvs. operation 2–4 dagar efter avslutad strålbehandling; vårdprogramgruppen anser att båda alternativen är acceptabla.
Högrisktumör
TNT rekommenderas vid lokalt avancerad rektalcancer, där tumörkrympning behövs för att öka chansen för radikal kirurgi, eller vid förhöjd risk för fjärrmetastasering. Här ingår lokalt avancerade primärtumörer som växer ≤ 1 mm från mesorektal fascia eller som växer över på annat organ som inte är lätt att resekera, såsom prostata, vesiculae seminales, urinblåsa och bäckenvägg. Här ingår också N2 och EMVI+, som är associerade med ökad risk för fjärrmetastaser. En ytterligare högriskgrupp är patienter med misstänkt metastasering till laterala (extramesorektala) lymfkörtlar. Huvudsyftet vid laterala lymfkörtelmetastaser är att eradikera dem med neoadjuvant behandling och vid kvarvarande patologiska laterala lymfkörtlar exstirpera dessa.
Lymfkörtelmetastaser längs aorta, iliaca communis, iliaca externa och ljumskarna klassas enligt TNM inte som regionala metastaser utan som fjärrmetastaser. Trots detta bör patienter med spridning till dessa lymfkörtelstationer värderas för möjligheten till kurativt syftande behandling inkluderande onkologisk och kirurgisk behandling, baserat på övrig tumörutbredning och patientens allmäntillstånd.
Vilket TNT-schema bör användas? I RAPIDO-studien gavs SCRT följt av 6 cykler CAPOX, vilket får anses vara det evidensbaserade förstahandsvalet. Den neoadjuvanta behandlingen blir relativt lång, och därför rekommenderas en ny MRT av rektum efter 3 cykler CAPOX för att vid dålig respons kunna avbryta behandlingen och operera patienten i stället. SCRT följt av 6 cykler CAPOX är behäftat med biverkningar. I RAPIDO-studien sågs diarré grad 3+ hos 18 % av patienterna, och 15 % fick avbryta CAPOX-behandlingen i förtid pga. biverkningar. I det prospektivt utvärderade LARCT-US-protokollet gavs 4 cykler CAPOX neoadjuvant, alltså 2 cykler mindre än i RAPIDO-studien. Samma protokoll som i LARCT-US användes i den kinesiska STELLAR-studien, med bättre responser och total överlevnad än med CRT 102 .
Ännu finns ingen randomiserad jämförelse mellan SCRT följt av cytostatika och CRT följt av cytostatika, men studier pågår. Vårdprogramgruppen rekommenderar fortsatt SCRT följt av cytostatika som förstahandsval för TNT, men kommer noga att följa ytterligare publikationer under de närmsta åren som kan komma att bekräfta eller förkasta den farhåga som framkommit under det senaste året, om en ökad risk för lokoregionala recidiv. Amerikanska NCCN:s riktlinjer anger SCRT och CRT vid TNT som likvärdiga alternativ. Chansen till organbevarande behandling är sannolikt något högre vid CRT följt av cytostatika (53 % i OPRA-studien). Det kan därför vara ett alternativ när maximal tumörkrympning önskas, antingen av primärtumörområdet till patienter som själva efterfrågar det, eller i lymfkörtelmetastaser som är svåra att avlägsna kirurgiskt. Det bör dock hållas i åtanke att en behandlingsassocierad dödlighet på 2 % rapporterades i OPRA-studien 105 .
För patienter med nedsatt allmäntillstånd eller samsjuklighet, som inte bedöms tåla vare sig kombinationscytostatika eller CRT, är SCRT med fördröjd kirurgi standardbehandling.
En del patienter kommer även i fortsättningen att behandlas med CRT följt av operation utan neoadjuvant cytostatika, som tidigare var standardbehandling vid lokalt avancerad rektalcancer. Optimal tidpunkt för kirurgi efter CRT är oklar. På många håll görs en utvärdering av tumörresponsen efter cirka 6 veckor följt av kirurgi efter cirka 8 veckor, vilket i de flesta fall kan vara rimligt. Om ytterligare tumörkrympning behövs, exempelvis vid svårresektabel överväxt på laterala strukturer eller högt upp mot sakrum, kan upp till 12 veckor väntan övervägas. En förutsättning är att tumören svarat på behandlingen, dvs att tumörkrympning noterats på MRT.
Till patienter med hjärtsjukdom kan det vara olämpligt att ge kapecitabin eller 5‑FU. Studier på metastaserad kolorektal cancer har visat att kombinationen tegafur, gimeracil och oteracil (”S-1”) i stället kan ges till dessa patienter, med lägre risk för biverkningar från hjärtat. Det finns ännu inga publicerade studier på S-1 i kombination med strålbehandling, men denna regim finns med som ett acceptabelt alternativ i en pågående studie (Pelvex II) vid lokalrecidiv av rektalcancer.
Lathund strålbehandling
Det är svårt att ange exakta kriterier för selektion av patienter till neoadjuvant strålbehandling. I tabell 15 nedan har vårdprogramgruppen sammanställt grundrekommendationer baserade på cTNM enligt MRT. Denna lathund kan användas som ett stöd vid MDK-diskussionen och gäller för patienter utan fjärrmetastaser och i gott allmäntillstånd, som bedöms tåla den onkologiska behandlingen och en kurativt syftande resektion.
Tabell 15. Indikationer för neoadjuvant strålbehandling vid rektalcancer utifrån MRT-baserat cTNM-stadium
|
|
T1–2 |
T3ab |
T3cd |
T4a* |
T4b, lätt resekt |
T4b, svårt resekt |
N0–N1 |
N2 |
EMVI |
MRF+ primär |
MRF+ TD eller lgl met extranodal |
Lat lgl met |
|
Högt belägen (helt ovan perit omsl) |
0 |
0 |
0 |
TNT |
0** |
TNT |
0 |
0** |
0** |
- |
- |
- |
|
Högt belägen (ej helt ovan perit omsl) |
0 |
0 |
0 |
TNT |
0** |
TNT |
0 |
0** |
TNT |
TNT |
5x5 |
TNT |
|
Mellan > 5–10 cm |
0 |
0 |
5x5 |
TNT |
TNT |
TNT |
0 |
TNT |
TNT |
TNT |
5x5 |
TNT |
|
Lågt belägen (helt ovan intersfinkterplan) |
0 |
0 |
5x5 |
- |
TNT |
TNT |
0 |
TNT |
TNT |
TNT |
5x5 |
TNT |
|
Lågt belägen (växt i intersfinkterplan) |
5x5 |
5x5 |
5x5 |
- |
TNT |
TNT |
0 |
TNT |
TNT |
TNT |
5x5 |
TNT |
* Vid T4a: om begränsad utbredning kan kirurgi direkt övervägas.
** Ingick i RAPIDO-studien varför SCRT + cytostatika kan vara ett alternativ pga. relativt hög risk för fjärrmetastasering. Enbart cytostatika utan strålbehandling (jfr koloncancer – FOxTROT-studien) kan också övervägas.
Förklaringar:
- Höjdangivelsen avser avståndet i cm, uppmätt med stelt rektoskop, från analöppningen till tumörens nedre kant.
- Intersfinkterplan ligger mellan interna och externa sfinktermusklerna 107 . I praktiken innebär ”växt i intersfinkterplan” att tumören engagerar analkanalen.
- T1: invasion i submukosa, T2: invasion i muscularis propria, T3: invasion utanför muscularis propria (T3a: < 1 mm, T3b: 1–5 mm, T3c: 6–15 mm, T3d >15 mm), T4a: serosagenomväxt, peritonealt engagemang, T4b: överväxt på annat organ. Lätt resekt = ”lätt resektabelt” organ såsom bakre vaginalvägg. Svårt resekt = ”svårt resektabelt” organ, såsom prostata, urinblåsa, bäckenvägg.
- N1a: 1 perirektal lgl-met, N1b: 2–3 perirektala lgl-met, N1c: TD perirektalt, N2: > 3 perirektala lgl-met. För att klassa lgl som patologisk krävs: i) diameter kortaxel > 9 mm + minst 1 av kriterierna ”rund form”, ”oregelbunden kant” och ”heterogen signal”, ii) diameter kortaxel 5–8 mm + minst 2 av kriterierna ovan, eller iii) diameter kortaxel < 5 mm + samtliga 3 kriterier ovan. Detta är en lätt modifierad version av riktlinjer från European Society of Gastrointestinal Radiology, ESGAR 53 .
- MRF+ = mesorektal fascia engagerad (≤ 1 mm marginal).
- Lat lgl = lymfkörtelmetastaser utanför MRF.
- Perit omsl = peritoneala omslagsvecket.
- TD = tumour deposit.
- EMVI = extramural vaskulär invasion.
- 0 = ingen neoadjuvant behandling, operation direkt.
- 5 Gy x 5 = SCRT, operation inom 4 dagar efter strålbehandlingens slut eller 4–8 veckor efter strålbehandlingens slut.
- TNT= total neoadjuvant terapi.
Organbevarande behandling
Efter SCRT eller CRT av lokalt avancerad rektalcancer befinns cirka 10–15 % av tumörerna vara i komplett remission i operationspreparatet, vilket av naturliga skäl lett till frågan om dessa patienter helt hade kunnat undvika operation. Allt fler centrum runtom i världen erbjuder numera patienter i klinisk komplett remission att ingå i ”watch and wait” (W&W) i stället för att opereras. Under uppföljning har det visat sig att cirka 20–30 % av patienterna med klinisk komplett remission får lokal tumöråterväxt men att chansen till bot efter salvage-kirurgi är hög 108 .
I Sverige genomfördes 2016–2023 en prospektiv studie för patienter med klinisk komplett remission, och prospektiv registrering fortsätter även efter studiens slut. Kriterierna för klinisk komplett remission är att ingen palpabel tumör finns, att vid endoskopi inga tecken på tumör föreligger och att MRT inte kan påvisa kvarvarande tumör eller patologiska lymfkörtlar. Bedömningen av klinisk komplett remission ska ske vid något av de centrum i Sverige som deltog i studien och patienterna får fortsatt skriva på informerat samtycke och inkluderas i en prospektiv tät uppföljning inklusive livskvalitetsmätningar. Ansvariga för studien är Eva Angenete (Göteborg) och Anna Martling (Stockholm).
Chansen till klinisk komplett remission efter SCRT eller CRT varierar med tumörens storlek och är betydligt högre för T1–T2 (cirka 40–60 %) än för T3–T4 (cirka 10–15 %). Chansen ökar dessutom med högre stråldoser, med tillägg av intensiv cytostatika och möjligen med ökad tid från strålbehandlingens slut. Inom studier har dessa faktorer utnyttjats för att öka chansen till organbevarande behandling. I två prospektiva danska studier uppnådde exempelvis > 70 % av patienterna klinisk komplett remission efter behandling med högre stråldoser än vanligt (62–65 Gy) 109 . I den nyligen publicerade franska OPERA-studien randomiserades 148 patienter med T2-3N0–1 rektalcancer (mindre än halva cirkumferensen) till vanlig CRT eller CRT kombinerat med kontaktterapi. Primär endpoint var organbevarande vid uppföljning efter 3 år och detta uppnåddes hos hela 81 % i experimentgruppen 110 .
Att erbjuda W&W till patienter som uppnått klinisk komplett remission efter standardmässig neoadjuvant behandling brukar benämnas ”opportunistic W&W”. Det gäller sålunda patienter om behandlats med neoadjuvant strålbehandling baserat på att de har tumörer som uppfyller indikationerna för det, och som tack vare ett ovanligt gott tumörsvar uppnått klinisk komplett remission. Den svenska uppföljningsstudien för W&W som beskrivs ovan avser sådana patienter. En annan strategi är att ge neoadjuvant behandling till patienter med låga tumörstadier trots att de egentligen inte uppfyller kriterierna för det, med målet att de ska uppnå klinisk komplett remission och därmed ha en chans att undvika kirurgi. Detta brukar benämnas ”intentional W&W” och kan exempelvis innebära att en patient med T2N0-tumör i nedre rektum, som med standardbehandling hade opererats direkt, i stället behandlas med strålbehandling med siktet inställt på W&W. Flera retrospektiva och prospektiva studier har visat att dylika patienter har en förhållandevis hög chans till organbevarande behandling, i synnerhet om den neoadjuvanta behandlingen intensifieras 109 110 . En ny svensk nationell studie (CORRECT-studien) randomiserar patienter med T1-T3b N0/1 cancer i mellersta eller distala rektum till kontaktterapi i kombination med antingen SCRT eller CRT. Primära endpoint är organbevarande efter två års uppföljning. Ansvarig för studien är Alexander Valdman, Stockholm.
Även om det sålunda finns alltmer evidens för att sannolikheten för organbevarande behandling ökar om högre stråldoser ges, och att strålbehandling som alternativ till primärkirurgi vid lågrisktumörer innebär en förhållandevis hög chans till organbevaring, saknas fortfarande långtidsdata för onkologiska utfall och toxicitet. Därför bör doseskalerad behandling vid intermediärrisk- och högrisktumörer i första hand ske inom studier, liksom all strålbehandling vid lågrisktumörer. För lågrisktumörer pågår flera internationella studier, varav en är fas III-studien STAR‑TREC som koordineras från England. I den randomiseras patienter med lågrisktumörer som är intresserade av organbevarande behandling till SCRT eller CRT. Primärt utfallsmått är framgångsrik organbevarande behandling. Stockholm, Göteborg och Malmö har deltagit i STAR‑TREC som nu är färdiginkluderad. Kontaktperson är Pehr Lind, Stockholm.
Till patienter med lågrisktumörer som själva efterfrågar organbevarande behandling, men som av olika skäl inte kan inkluderas i någon studie, förefaller det rimligt att efter noggrann information om varför kirurgi alltjämt anses vara det evidensbaserade förstahandsvalet, överväga strålbehandling, i första hand enligt någon av behandlingsarmarna i STAR‑TREC. Till patienter med intermediärrisk- och högrisktumörer som inte kan tänka sig kirurgi är det rimligt att erbjuda antingen CRT följt av cytostatika (enligt OPRA-studien) eller doseskalerad CRT enligt de danska studierna. En annan patientgrupp som kan behandlas enligt ”intentional W&W” är gamla och multisjuka patienter för vilka det av medicinska skäl är olämpligt med stora kirurgiska ingrepp.
Alternativa strategier
Neoadjuvant cytostatika utan strålbehandling
På ASCO-mötet 2023 presenterades den amerikanska PROSPECT-studien 111. I den randomiserades 1 194 patienter med T2–3N1- eller T3N0-rektalcancer till neoadjuvant CRT eller neoadjuvant FOLFOX utan någon strålbehandling. Ingen skillnad sågs mellan armarna avseende sjukdomsfri överlevnad, total överlevnad eller lokalrecidiv, och författarna drog därför slutsatsen att FOLFOX är ett fullgott alternativ till CRT. Problemet med studien är att majoriteten av patienterna var lågriskpatienter som enligt svensk praxis inte hade fått någon neoadjuvant behandling. Resultaten blir därför svårtolkade och går tills vidare inte självklart att generalisera till mer avancerade tumörstadier. För patienter för vilka det finns starka skäl att undvika strålbehandling, exempelvis vid önskemål om bevarad fertilitet eller om patienten tidigare har strålbehandlats, kan emellertid behandlingsupplägget vara ett alternativ.
En tumör i rektosigmoidala övergången kan i vissa fall betraktas som en koloncancer och behandlas med neoadjuvant FOLFOX enligt FOxTROT-studien. Se avsnitt 11.1.1.
Immunterapi vid dMMR (MSI-high)
Prevalensen av dMMR (MSI-high) vid rektalcancer uppskattas till 5–10 %. I en första rapport från en amerikansk singel-center fas II-studie för behandling av dMMR lokalt avancerad rektalcancer sågs mycket lovande resultat efter behandling med enbart PD1-hämmaren dostarlimab hos de första 14 patienterna 112 . På ASCO 2024 rapporterades data efter en utökning av studien till 42 patienter. Hos de som fullgjort 6 månaders behandling med dostarlimab noterades 100 % klinisk komplett remission och inga fall av tumöråterväxt med en medianuppföljningstid av 18 månader, dvs. inga patienter hade behövt någon ytterligare behandling i form av strålbehandling, cytostatika eller operation. Detta är anmärkningsvärt goda resultat, som dock behöver verifieras i större patientmaterial. Flera liknande studier pågår runt om i världen, med olika typer av immunterapi. Immunterapi vid lokaliserad dMMR rektalcancer är ännu inte godkänd av FDA eller EMA, men i senaste versionen av NCCN:s riktlinjer (januari 2025) rekommenderas i första hand 6 månaders immunterapi (dostarlimab, nivolumab eller pembrolizumab) som primärbehandling av dMMR rektalcancer stadium T3–4 eller N1–2.
Behandling av icke-metastaserad dMMR rektalcancer är ett fält under snabb utveckling och där tydliga rekommendationer är svåra att ge. För att säkerställa en jämlik och patientsäker vård för denna patientgrupp bör därför alla patienter med dMMR rektalcancer M0 diskuteras och utvärderas på MDK vid universitetssjukhus för diskussion om bästa behandlingsstrategi. Initiativ har tagits till en svensk nationell studie innefattande patienter med icke-metastaserad dMMR rektalcancer som inte uppnår kriterier för konvertering. Vårdprogramgruppen återkommer med en revision av dessa riktlinjer när detaljer om ovan nämnda studie finns att tillgå.
Konverteringssituationer vid lokalt avancerad dMMR rektalcancer bör drivas på regional MDK med stöd av NVH-enhet för avancerad bäckenkirurgi (Stockholm, Göteborg eller Malmö) vid behov. En diskussion om bästa alternativen bör föras, inklusive övervägande av immunterapi. Behandlingsstrategin kan likna den vid konverteringssituationer i stadium IV, varför utförligare resonemang och riktlinjer för regimval och behandlingslängd finns i kapitlet om adjuvant behandling. Se avsnitt 14.4.2.2 Systemisk behandling vid potentiellt resektabla metastaser (konvertering).
Postoperativ strålbehandling
Postoperativ CRT (45–50,4 Gy) kan övervägas till patienter som opererats utan neoadjuvant strålbehandling, om PAD visar R1-resektion eller andra karakteristika som är förknippade med hög risk för lokalrecidiv. Ett alternativ för patienter som inte tidigare fått cytostatikabehandling är att i stället ge adjuvant cytostatika. Det är ofta att föredra, framför allt vid samtidig förekomst av faktorer som är associerade med ökad risk för fjärrmetastaser, såsom N+ eller EMVI+.
Rebestrålning
Rekommendationer
Nedanstående rekommendationer kan tjäna som vägledning, men behandlingen är alltid individuell. Hänsyn måste tas till tidsintervallet från föregående strålbehandling och tidigare given stråldos.
- Rebestrålning kan övervägas neoadjuvant inför kurativt syftande kirurgi, som definitiv strålbehandling av icke-operabla lokala recidiv eller som palliativ åtgärd.
- Rebestrålning bör ges med små avgränsade strålfält. Target utgörs av den totala tumörvolymen (GTV) med marginal. Det finns publicerade konsensusriktlinjer för hur target ska definieras vid rebestrålning 113 .
- Behandlingen ges med fördel med intensitetsmodulerad strålbehandling (IMRT), alternativt med protonbehandling.
- Samma doser rekommenderas efter tidigare SCRT som efter tidigare CRT: 1,8–2 Gy till slutdos 30–40 Gy + cytostatika (kapecitabin eller 5‑FU). Högre slutdoser kan övervägas vid icke-operabla recidiv. I rent palliativa situationer kan 4 Gy x 5 ges.
Knappt 5 % av patienterna som tidigare fått strålbehandling och genomgått resektionskirurgi för rektalcancer utvecklar lokalrecidiv. Frågan om rebestrålning kan då bli aktuell, antingen neoadjuvant inför kurativt syftande reoperation, som definitiv behandling eller som en rent palliativ åtgärd. Den viktigaste prognostiska faktorn i lokalrecidivsituationen är radikal (R0) salvagekirurgi 114 . Den 1 juli 2024 startade nationell högspecialiserad vård (NHV) för avancerad bäckenkirurgi, och i samband med detta en nationell MDK där patienter med lokalrecidiv med fördel kan diskuteras.
Definitionen av rebestrålning är en strålbehandling som överlappar med en tidigare given strålbehandling. Enligt senaste rekommendationerna från ESTRO och EORTC bör följande tas i beaktande vid ställningstagande till rebestrålning: patientens performance status, tumörkaraktäristika (histologi, lokalisation, recidiv in-field eller out-of field), information om eventuell aktiv onkologisk behandling och information om tidigare strålbehandling inklusive teknik, antal fraktioner, slutdos, tidsintervall från föregående behandling och eventuell bestående strålrelaterad toxicitet 115 .
Det finns inga randomiserade studier på området, men däremot litteraturgenomgångar som sammanfattar retrospektiva studier av patienter med lokalrecidiv 116 . Sammanfattningsvis fick patienterna i majoriteten av studierna hyperfraktionerad kemoradioterapi 1,2–1,5 Gy två gånger dagligen eller 1,8 Gy en gång per dag, CRT med totaldoser upp mot 30–40 Gy, med 2–4 cm marginal till total tumörvolym (GTV). Mindre marginaler till GTV (2 cm) gavs i mer moderna studier. R0-resektion uppnåddes hos 39–89% av patienterna, varav 50 % drabbades av re-recidiv. Medianöverlevnaden var 39–60 månader bland de opererade patienterna och 12–16 månader i den palliativa situationen. Cirka 9–20 % fick akuta grad 3–4-biverkningar. Sena strålrelaterade biverkningar hos icke-opererade patienter rapporterades i upp till 25 % av fallen.
Ett fåtal studier har rapporterat rebestrålning med protoner vid lokalrecidiv av rektalcancer, med doser upp till 64,8 Gy 117 118 . Samtliga rapporterar acceptabel förekomst av akut toxicitet grad 1–3 (14–60 %) och sen toxicitet grad 1–4 (14–43 %).
Sedan 2022 deltar Sverige i den randomiserade fas III-studien PelvEx II, som undersöker värdet av induktionscytostatika före CRT till patienter med lokalrecidiv av rektalcancer. I denna studie ges stråldos 2 Gy x 15 till tidigare strålbehandlade patienter och 2 Gy x 25 till dem som inte tidigare fått strålbehandling.
Alternativa stråltekniker
Brakyterapi
Brakyterapi har sällan använts vid rektalcancer i Sverige. Erfarenheter från olika internationella centrum visar dock att det finns en nisch i vissa kliniska situationer 119 . Nischen är så stor att kompetens för brakyterapi bör byggas upp på i första hand tre centrum i Sverige (Uppsala, Örebro och Stockholm). Verksamheten bör inte spridas på för många händer eftersom den kräver lämplig utrustning och personlig skicklighet. I Uppsala och Stockholm finns utrustning för kontaktterapi. Utrustning för endoluminal och interstitiell brakyterapi finns i Uppsala respektive Örebro.
Syftet med brakyterapi är att lokalt åstadkomma tillräckligt hög stråldos för att samtliga tumörceller lokalt kan eradikeras, och det används när andra alternativ är otillräckliga eller olämpliga. Samtidigt minskas stråldosen till riskorgan i närheten. Behandlingen är främst aktuell för patienter som är gamla eller har betydande samsjuklighet, eller för vilka abdominal kirurgi av andra orsaker (religiösa eller kulturella) inte är möjlig. Brakyterapin kan i vissa fall ges som enda behandling men den kompletteras ofta med extern kemoradioterapi mot regional sjukdom 109 .
De tekniker som främst kommer i fråga är brakyterapi med efterladdning (Iridium 192) som kan ges antingen endoluminalt eller interstitiellt (tumörer större än 35 mm) och kontaktterapi med kV-röntgenstrålar (så kallad Papillon-terapi) för tumörer upp till 30 mm i nedersta 10 cm (behöver kunna nås med rak skopi). Dessa tekniker kan bidra till att fler patienter kan få organbevarande behandling (se avsnitt 11.2.3 Organbevarande behandling ovan angående OPERA-studien).
Kontaktterapi kan ges som definitiv behandling, som boostbehandling eller vid rebestrålning enligt GEC‑ESTRO:s riktlinjer 119 .
- Efter lokal excision av T2/T1 sm 2–3 kan kontaktterapi ges som boost mot ärret i kombination med CRT eller endast SCRT beroende på AT. Target för den externa strålbehandlingen utgörs då endast av mesorektum.
- För T1–T3b N0/1-tumörer < 5 cm i diameter kan kontaktterapi användas som definitiv behandling i kombination med CRT eller SCRT inom ramen för CORRECT-studien (se avsnitt 11.2.3 Organbevarande behandling). För tumörer som är större än 3 cm inleds behandlingen med extern strålbehandling för att få en krympning, och kontaktterapi ska ges inom 2–4 veckor. T2/T4 N0/2-tumörer hos icke-operabla patienter kan behandlas på samma sätt utanför studien.
- Vid recidiv kan kontaktterapi provas om tumören är inom 10 cm från ändtarmsöppningen och inte större än 35 mm.
Protonbehandling
Målet med protonbehandling är att ge tumörinnehållande vävnad en adekvat stråldos, ibland så hög som möjligt, och intilliggande normalvävnad så liten stråldos som möjligt. Protonbehandling finns tillgänglig i Sverige sedan 2015 då den nationella anläggningen Skandionkliniken stod färdig för patientbehandlingar. Jämförande dosplaneringsstudier vid lokalt avancerad rektalcancer visar att det finns dosfördelar som kan vara kliniskt relevanta 120.
Sedan 2021 pågår en nationell protonstudie (PRORECT, prorect.se) där patienter som får SCRT och cytostatika ad modum LARCT-US-studien randomiseras till proton- eller fotonbehandling. Kontaktperson är Alexander Valdman, Karolinska Universitetssjukhuset.
Biverkningar
Akuta biverkningar
Det är väsentligt att strålbehandlingstekniken optimeras för att biverkningarna ska minimeras. Neoadjuvant strålbehandling ökar risken för infektioner i perineum efter en abdominoperineal rektumresektion (”rektumamputation”). Avseende anastomosrelaterade komplikationer efter låg främre resektion har vissa studier visat att strålbehandling ökar risken medan andra studier inte kunnat påvisa det.
SCRT kan orsaka smärtor i bäckenet med utstrålning ner i benen, beroende på en strålreaktion i sakrala nervplexa.
Den vanligaste biverkningen av neoadjuvant strålbehandling är diarré. Ofta tar det 1–2 veckor innan enteriten ger sig till känna. Vid SCRT och fördröjd kirurgi är det ganska vanligt med diarré under de första veckorna efter strålbehandling. I Stockholm III-studien ledde detta till att 7 % av patienterna lades in på sjukhus 106. För äldre och sköra patienter kan stråldosen till tunntarmar behöva reduceras för att minska risken för diarré. Loperamid bör förskrivas. I övrigt tolereras SCRT med fördröjd kirurgi som regel väl.
CRT ger mer akuta biverkningar än SCRT. Det är tillägget av cytostatika som adderar akuta biverkningar, vilket visades i LARCS-studien där akuta grad 3–4-biverkningar sågs hos 28 % av patienterna som fick CRT, jämfört med 6 % av dem med enbart lång strålbehandling 95. Det handlar framför allt om gastrointestinala biverkningar såsom diarré, illamående och kräkningar. I en polsk randomiserad studie sågs akuta biverkningar grad 3–4 hos 18 % efter CRT och hos 3 % efter SCRT med direktkirurgi 97. Dessa studier avspeglar toxiciteten med äldre stråltekniker. I RAPIDO-studiens CRT-arm sågs diarré grad 3–4 hos 9 % av patienterna.
Sena biverkningar
Fördjupad kunskap om sena biverkningar finns i Nationellt vårdprogram för bäckencancerrehabilitering. Riskorganen vid rektalcancerbestrålning är främst tarm och analsfinktrarna men också urinblåsa, inre genitalia, nerver, kärl och skelett. Patienter som strålbehandlats för rektalcancer har 50 % ökad risk att få försämrad analfunktion efter en främre resektion. Inkontinensbesvär är vanliga hos äldre människor som opererats för rektalcancer, även utan strålbehandling, och därför har denna ökade risk endast kunnat konstateras i långtidsuppföljning av studierna där patienterna självrapporterat symtom 97. Förekomsten av någon form av anala inkontinensbesvär ökar från cirka 40 % till cirka 60 % med strålbehandling. Andelen med mer påtagliga besvär med nattlig inkontinens ökar från cirka 8 % till 14 %. Det är inte känt om dessa besvär beror på direkt bestrålning av sfinktrarna eller påverkas av strålning av kvarvarande rektalstump eller nerver och kärl i lilla bäckenet, men de flesta studier har gjorts på patienter som bestrålats mot sfinktrarna. Det är viktigt att sfinktrarna inte bestrålas om inte tumören är så lågt belägen att en rektumamputation anses vara nödvändig.
Sekundära maligniteter
All strålbehandling är associerad med en risk för sekundära strålinducerade maligniteter. När strålbehandling ges i vuxen ålder är denna risk liten i absoluta tal, vilket sannolikt är förklaringen till att studier av patienter som fått strålbehandling för rektalcancer har visat skilda resultat 121 122 .
