Follikulärt lymfom
Bakgrund och orsaker
Follikulärt lymfom är det vanligaste indolenta nodala lymfomet, och utgör omkring 15 % av alla lymfom. Den högsta incidensen finns i Nordamerika och Västeuropa 18. I Sverige insjuknar drygt 250 nya patienter varje år 19. Sjukdomen är ovanligare i övriga delar av världen och i Nordamerika drabbas vita dubbelt så ofta som svarta eller asiatiska amerikaner 20. I Sverige är medianåldern vid diagnos 65 år men patienter i alla åldrar insjuknar 19. Till skillnad från övriga lymfom drabbar follikulärt lymfom lika ofta kvinnor som män 1920.
Sjukdomen stadieindelas liksom de flesta andra lymfom i enlighet med det system som föreslogs vid Ann Arbor-konferensen 1971 7. Vid diagnos uppvisar majoriteten både perifert och centralt lymfkörtelengagemang och ungefär två tredjedelar Ann Arbor stadium III eller IV 1922 Benmärgsengagemang vid diagnos ses hos ungefär 40 procent av patienterna 2223. I sällsynta fall finns follikulärt lymfom primärt i extranodal vävnad såsom hud, tolvfingertarm, äggstockar, bröst och testiklar 18.
Eftersom indolent follikulärt lymfom (WHO-grad 1, 2 och 3A) anses obotligt 18, behandlas patienter med spridd sjukdom endast om sjukdomen ger symtom eller växer. Sjukdomen är nyckfull och karaktäriseras av goda behandlingssvar och upprepade återfall, samtidigt som vissa patienter aldrig behöver behandlas. Den individuella överlevnaden efter diagnos är mycket varierande: från mindre än ett år till mer än 40 år. Emellertid har den genomsnittliga överlevnaden kraftigt förbättrats sedan rituximab infördes i primärbehandlingen.
Under 1990-talet var medianöverlevnadstiden nio år efter diagnos 24. I dag går inte medianöverlevnadstid att beräkna, men sedan 2003 är tioårsöverlevnaden respektive den relativa tioårsöverlevnaden för svenska patienter följande:
- yngre än 50 år: 90 % och 92 %
- 50–59 år: 78 % och 83 %
- 60–69 år: 68 % och 78 %
- 70 år och äldre: 32 % och 64 %
- Totalt: 59 % och 76 % 19.
Liksom vid övriga lymfom ses en ökad risk för follikulärt lymfom hos människor med autoimmuna sjukdomar, nära släktskap till andra lymfompatienter och lösningsmedelsutsatta yrken 2526. I motsats till de flesta andra lymfom uppvisar rökare något ökad risk 27. Patienter med follikulärt lymfom har också högre risk att utveckla andra cancerformer 28. Ingen av dessa statistiska associationer har praktisk klinisk betydelse, men rökare anmodas till rökstopp. Immunsuppression p.g.a. HIV eller njurtransplantation ökar inte risken för follikulärt lymfom 29.
En kromosomal translokation i en pre-B-cell i benmärgen förmodas vara det första steget i utvecklingen mot follikulärt lymfom: translokation t(14;18)(q32;q21) innebär överuttryck av det anti-apoptotiska proteinet BCL2 vilket skyddar cellen mot apoptos 30. Denna premaligna cell utvecklas normalt och migrerar till ett germinalcentrum (follikelcentrum) i en lymfkörtel. Bara var fjärde normal B-cell överlever antigensselektionen i germinalcentrumet, men cellen med t(14;18) svarar sämre på apoptossignaler, vilket innebär en långsam ackumulering av långlivade t(14;18)+ B-celler 31. Ett fåtal B-celler med t(14;18) kan påvisas hos mer än hälften av alla friska vuxna 32. Den premaligna cellens elakartade omvandling till ett manifest follikulärt lymfom sker således ytterst sällan (och förmodas kunna inträffa årtionden efter uppkomsten av den premaligna cellen) och äger rum i germinalcentrumet, varvid en t(14;18)+ B-cell förvärvar ytterligare karyotypi- eller punktmutationer 313334. Den follikulära lymfomcellen behåller flera egenskaper från den normala germinalcentrum-B-cellen, såsom class switch och somatisk hypermutering 3435 samt fortsatt kommunikation och beroende av närliggande T-celler och follikulära dendritiska celler (FDC) 36.
Kliniska prognosfaktorer
Rekommendation
- FLIPI, FLIPI-2 och beta2-mikroglobulin bör noteras vid diagnos och vid återfall.
FLIPI
Follicular Lympoma International Prognostic Index (FLIPI) från 2004 identifierade ett antal oberoende kliniska variabler som förutsade överlevnaden hos patienter med follikulärt lymfom. Indexet grundar sig på patienter som insjuknat mellan 1985 och 1992 8.
Fem ogynnsamma faktorer valdes ut:
- Ålder > 60 år
- Stadium III–IV
- Hb < 120 g/L
- Antal engagerade lymfkörtelstationer > 4
- LD > övre referensområdesgränsen.
Lymfkörtelstationerna beskrivs i figuren nedan.
FLIPI delade upp populationen i tre lika stora grupper med stor skillnad i tioårsöverlevnad: lågrisk (0–1 faktorer) 71 %, mellanrisk (2 faktorer) 51 % och högrisk (3–5 faktorer) 36 % 8. Det har visat sig att FLIPI även fungerar väl när det använts efter introduktionen av rituximab samt vid återfall 37.
FLIPI utgick från överlevnad hos patienter med follikulärt lymfom som insjuknat långt före introduktionen av rituximab och där vissa tillämpliga mått, t.ex. β2mikroglobulin och storleken på den största enskilda tumörmanifestationen, valdes bort, delvis för att underlag saknades på för många patienter.
Figur 1. Lymfkörtelstationer enligt FLIPI

Lymfkörtelstationer enligt FLIPI. Som exempel är pre-aurikulära och supraklavikulära lymfkörtlar på samma sida inom samma station. Armvecken och knävecken utgör separata lymfkörtelstationer vilket inte framgår av bilden, men av texten längst ned. Vid bilateralt engagemang av lymfknutor så räknas detta som två stationer.
FLIPI-2
En ny prognostisk utvärdering på rituximabbehandlade patienter utmynnade i FLIPI2 9, som innefattade följande fem negativa variabler med progressionsfri överlevnad (PFS) som utvärderingsmått:
- Ålder > 60 år
- Benmärgsengagemang
- Hb < 120 g/L
- Längsta diametern på största tumörmanifestationen > 6 cm
- β2-mikroglobulin > övre referensområdesgränsen
Det urspungliga FLIPI används i mycket större omfattning än FLIPI2 även om jämförelser visat att FLIPI2 är väl så bra för att förutsäga både PFS och total överlevnad 9. FLIPI2 torde dessutom vara lättare att använda för dagligt kliniskt bruk eftersom det använder ett enda röntgenmått i stället för antal engagerade lymfkörtelstationer 38.
PRIMA-PI eller β2-mikroglobulin samt LD
Prima-PI togs fram från PRIMA-studien i vilken man kunde visa att patienter med β2-mikroglobulin > 3 mg/l före behandling hade dålig PFS efter Rkemo + Runderhåll 39. Också vid Rsingelbehandling är β2mikroglobulin kopplat till sämre svar och kortare PFS 40. Man måste beakta att högt β2mikroglobulin också ses vid dålig njurfunktion, vilket kan påverka tolkningen av PFS-kurvor. Ett LD ≥ 1,5 x övre normalgränsen är också kopplat till dålig respons vid singel-rituximab 41. Dessutom har högt LD associerats till stor risk för tidigt återfall efter R-bendamustin 42.
POD24 och EFS24
POD24 (progression of disease inom 24 månader efter start av primärbehandling) samt EFS24 (event-free survival 24 månader efter start av primärbehandling) verkar vara en valid surrogatmarkör för långtidsöverlevnad (både OS och PFS), både efter R-kemo och R 4344, men är formellt ingen prognosfaktor.
Övrigt prognostiskt
Patienter som uppvisar komplett remission (CR) har längre PFS än de som enbart går i partiell remission (PR) 45.
Ett arbete som jämför FLIPI och FLIPI-2 lyfter fram att LD och β2-mikroglobulin låter sig användas i en mycket enkel modell med förekomst av 0, 1 eller 2 av dessa värden ovan referensområdesgränsen. β2-mikroglobulin tillverkas i alla kärnförande celler och stabiliserar den tertiära strukturen i MHC klass I-molekylen och har därmed en central immunologisk roll. β2-mikroglobulin spelar även en roll för maligna cellers överlevnad och proliferation. Tillsats av antikroppar mot β2-mikroglobulin kan framkalla apoptos i flera olika typer av lymfom 46, vilket gör molekylens relevans i FLIPI-2 mera rimlig.
Prognosfaktorer som inte är i bruk
Behandlingsutfall efter cytostatikabehandling mätt med PET/CT har rapporterats vara en bättre prognostisk markör än enbart CT för PFS och överlevnad 47.
Många prognostiska biomarkörer härrör från icke-maligna celler i immunsystemet. Den omedelbara föregångaren till follikulärt lymfom är en germinalcentrum-B-cell (follikelcenter-B-cell). Lymfomcellen behåller vissa av den premaligna cellens normala egenskaper, t.ex. en germinalcentrum-B-cellsfenotyp (CD10, CD20, CD79a, CD19 eller CD23 men inte CD5) samt ett kvarvarande beroende av den immunologiska mikromiljön. Både germinalcentrum-B-celler och follikulärt lymfom-cellers överlevnad gynnas av monocyter, follikulära hjälpar-T-celler 4849 och mesenkymala celler, särskilt follikulära dendritiska celler 5051. Lymfomcellerna motverkas av cytotoxiska T-celler 52 via olika signalvägar, t.ex. CD40-ligand, IL4, IFNγ och IL15 525354.
Vid analys av tumörvävnad har flera av dessa immunceller associerats med prognos. God prognos korrelerar med ett högt antal cytotoxiska 5556, FOXP3-positiva 565758 och PD-1-positiva 5659 T-celler i mikromiljön. Sämre prognos korrelerar med högre antal makrofager 5660 och hjälpar-T-celler 5661. Dessa studier har gjorts med olika metoder och på patienter med olika behandling varför de inte kan utgöra underlag för behandlingsrekommendationer, i synnerhet som de flesta vävnadsproverna kom från tiden före rituximab. Dessutom är det uppenbart att det är det follikulära lymfomet självt som driver sin mikromiljö 62. Ett exempel på detta är TNFRSF14, en gen som ofta är muterad i lymfomcellerna (1846 %) och en ogynnsam prognostisk faktor. Den kodar för ett transmembranprotein som både kan inhibera och stimulera T-celler 63, vilket ger en inblick i sjukdomens behov av och förmåga att manipulera sin mikromiljö.
Hos patienter som behandlas med monoklonala antikroppar har man inte sett att överlevnaden påverkas av mikromiljöns makrofager 64 eller T-celler 65. Således kan man anta att de ovanstående immuncellerna kan påverka tiden från sjukdomsuppkomst till behandlingsbehov, men att de har liten prediktiv betydelse vid modern terapi. Det finns också vissa tecken på att egenskaper i patientens normala immunsystem, utanför mikromiljön, har betydelse vid rituximabinnehållande behandling. Efter rituximab finns ett samband mellan bättre sjukdomsfri överlevnad och höga blodnivåer av lymfocyter 66 liksom av cytotoxiska T- och hjälpar-Tceller 65, och samtidigt ett samband mellan sämre sjukdomsfri överlevnad och höga nivåer av IL-2R och cytokinerna, IL-1RA, IL-12 och CXCL9 67.
Det är osäkert huruvida medfödda polymorfismer i gener för Fc-receptorer (med vilka immunceller hittar rituximab som bundits vid CD20-positiva celler) har prognostisk betydelse vid rituximabbehandling 6869. I de nordiska rituximab-interferon-prövningarna korrelerade högre grad av follikulärt lymfom (i skalan 1, 2 och 3A) till bättre behandlingssvar och sjukdomsfri överlevnad 70.
Det enskilt största hotet mot patientens liv och hälsa är transformation till aggressivt B-cellslymfom, vilket drabbar cirka 13–25 % av patienterna under de första tio åren (årlig risk 2–3 %) 117172737475. Det finns inga etablerade prediktorer för transformation. Risken har rapporterats öka med högt stadium 1173, LD 73, FLIPI 73, ålder 73, bulkig och extranodal sjukdom 76 och vaksam expektans 7273. I en annan studie rapporterades dock att vaksam expektans minskade risken för transformation 76. I ytterligare en annan studie minskades risken av tidig behandling med singel-rituximab 72.
Ett flertal subsignaturer i NF-kB pathway har associerats till transformation 77, liksom olika T-celler 6178 samt förlust av FDC-nätverk 79 i den immunologiska mikromiljön. Potentiella biomarkörer identifieras hela tiden 80. Translokation av MYC liksom mutationer i TP53 och BCL-2 är starkt kopplade till transformation per se, och i de fall då dessa genetiska skador föreligger redan före transformationen uppfattas de som starkt prognostiskt negativa 818283848586.
Speciella former
Primärt kutant follikelcenterlymfom
Detta lymfom, som också har de äldre benämningarna ”Crostis lymfom” och ”dorsalt retikulohistiocytom”, är ett B-cellslymfom med neoplastiska folliklar som oftast presenterar sig som ljusröda tumörer utan sår, på skalpen och ryggsidan av bålen. Även om primärt kutant follikelcenterlymfom är det vanligaste primärt kutana B-cellslymfomet är det betydligt mer sällsynt än follikulärt lymfom. Sjukdomen är en egen entitet och sorterar inte under follikulärt lymfom enligt WHO 87.
Follikulära lymfom kan också sitta enbart i huden och man bör skilja dessa (liksom diffust storcelligt B-cellslymfom av bentyp) från primärt kutana follikelcenterlymfom. Förutom den kliniska bilden särskiljer sig primärt kutana follikelcenterlymfom genom att de immunhistokemiskt oftast är BCL2-negativa.
För utredning och behandling, se Nationellt vårdprogram för hudlymfom.
Primärt duodenalt follikulärt lymfom
Liksom andra follikulära lymfom är duodenalt follikulärt lymfom positivt för BCL2 och t(14;18) 88. Mikroskopiskt finns inga stora olikheter jämfört med andra follikulära lymfom, och det klassas inte som en egen entitet av WHO. Tillståndet är sällsynt och den kliniska erfarenheten av det är störst i länder med gastroskopiska screening-program för ventrikelcancer (således är ungefär 50 % av alla rapporterade fall japanska). Det talar för att primärt duodenalt follikulärt lymfom är ytterst stillsamt (endast 15 % av patienterna har symtom vid diagnos i Japan) 89. I andra länder där gastroskopi utförts på annan indikation är självklart andelen symtomatiska patienter betydligt högre (78 %) 89. En mindre andel av patienterna med primärt duodenalt follikulärt lymfom uppvisar en klinisk bild som vid övriga follikulära lymfom, med progression, återfallsbenägenhet och transformation. Patienter med engagemang utanför tarm bör handläggas som övriga follikulära lymfom.
Primärt duodenalt follikulärt lymfom är nästan alltid begränsat till tarmslemhinnan. Dödligheten och fallen av progression i primärt duodenalt follikulärt lymfom är ytterst ringa. Man har aldrig lyckats påvisa någon överlevnadsvinst med att behandla lokaliserad sjukdom (varken med cytostatika, antikroppar eller lokal strålning), även om sjukdomen svarar på samma behandling som ges vid follikulärt lymfom 888990. Rekommendationen är därför vaksam exspektans; sjukdomen bör endast behandlas om den ger symtom eller tydligt progredierar. I en fransk registerstudie erbjöds 22 patienter med stadium IE-sjukdom av gastrointestinalt follikulärt lymfom (17 i duodenum) wait-and-watch: efter en median uppföljningstid på 5 år uppvisade nio patienter spontan komplett remission, 11 stabil sjukdom och en patient progress (en patient tappades bort från uppföljning); 7 patienter med stadium IIE- eller IV-sjukdom handlades som vanligt generellt follikulärt lymfom 91.
Follikulärt lymfom in situ (intrafollikulär neoplasi)
Förstadier till follikulärt lymfom finns beskrivna, då man i vävnad funnit en enstaka follikel med follikulärt lymfom men inget lymfom i det övriga preparatet. Om lymfomutredningen är negativ (radiologi och benmärg) krävs ingen ytterligare åtgärd.
Follikulärt lymfom grad 3B
Follikulärt lymfom grad 3B definieras av solida centroblastförband (> 15 intrafollikulära centroblaster i sjok utan mellanliggande centrocyter). Det är ett aggressivt men botbart Bcellslymfom och handläggs som ett aggressivt Bcellslymfom, inte som en indolent sjukdom. Detsamma gäller fall som är en blandning av grad 3B och annat aggressivt B-cellslymfom 23.
Primärbehandling
För utformning av enskilda regimer hänvisas till nationella regimbiblioteket 92.
Överväg om det finns någon klinisk prövning för patienten.
Behandlingsindikationer
Rekommendation
Förekomst av någon behandlingsindikation enligt nedan bör indicera behandling. Om man ändå väljer exspektans bör patienten följas mycket tätt. Organpåverkan är en absolut behandlingsindikation som kräver prompt åtgärd. Vid övriga indikationer finns ett visst tidsmässigt utrymme för terapistart.
Behandlingsindikationer:
- Symtomgivande sjukdom
- Cytopeni(er)
- Leukemiserat lymfom
- Massiv eller symtomgivande splenomegali
- Annan organpåverkan
- Bulkig sjukdom (> 6 cm enligt FLIPI-2) eller stor sjukdomsbörda
- Kontinuerlig eller snabb progress.
I litteraturen finns flera publicerade kriterier för behandling. De mest använda kommer från Groupe d’Etude des Lymphomes Folliculaire (GELF-kriterierna).
GELF-kriterierna anger följande behandlingsindikationer för follikulära lymfom:
- bulk > 7 cm
- ≥ 3 engagerade lymfkörtelstationer med vardera lymfkörtelförstoring om ≥ 3 cm
- förekomst av B-symtom
- betydande mjältförstoring eller cytopenier i blodet (LPK < 1.0 x 109/l eller trombocyter < 100/nl)
- pleuravätska eller ascites
- leukemiserat lymfom > 5/nl
- lymfomorsakat försämrat WHO-status ≥ 1 93.
Primärbehandling av lokaliserad sjukdom (stadium I och begränsat stadium II)
Rekommendation
- Stadieindelning bör ha gjorts med PET/CT (samt benmärgsbiopsi).
- Strålbehandling, 24 Gy (2 Gy x 12 fraktioner) (++++).
För patienter med lokaliserad sjukdom, traditionellt stadium I och II som kan inkluderas i ett strålfält, ges strålbehandling i botande syfte. Notera att PET/CT bör göras för att verifiera att det verkligen rör sig om begränsad utbredning innan man beslutar om strålning.
En randomiserad studie har visat att 24 Gy (2 Gy x 12) är lika verksamt som 40 Gy (2 Gy x 20) avseende behandlingssvar och progress inom behandlingsområdet. 94. Eftersom follikulärt lymfom kan vara ytterst strålkänsligt har även 24 Gy (2 Gy x 12) jämförts med 4 Gy (2 Gy x 2). Lågdos strålbehandling (2 Gy x 2) är en effektiv behandling, men den högre stråldosen gav bättre lokal kontroll och en längre remission varför denna dos bör användas vid lokaliserad sjukdom. Som palliation är dock 2 Gy x 2 en utmärkt och enkel behandling som också kan upprepas 95.
Exspektans kan inte rekommenderas, då en retrospektiv amerikansk studie visat bättre överlevnad hos strålbehandlade patienter 96. Man räknar med att ungefär hälften av patienterna med begränsad sjukdom botas med lokal strålningbehandling. 97. Det finns dock en studie som kan motivera användandet av vaksam exspektans när det är indicerat, t.ex. vid graviditet. Den visade goda resultat av enbart kirurgi för patienter med stadium I.
Om strålbehandling: Eftersom strålbehandlingen ges som enda behandling och inte i kombination med cytostatika kan man överväga en något större clinical target volume (CTV) för att även täcka in eventuell mikroskopisk sjukdom. Detta innebär att även normalstora körtlar i närheten av gross tumor volume (GTV) inkluderas i CTV.
Spridd sjukdom (II–IV) utan behandlingsindikation
Rekommendation
- Vaksam exspektans (++++).
Vaksam exspektans innebär regelbundna kliniska kontroller av patienten samt att patienten hör av sig om symtom uppstår.
I litteraturen finns inget som tyder på att patienter som saknar behandlingsindikation skulle ha en överlevnadsvinst av tidig behandlingsstart. Alltså kan man med fördel avvakta med behandling tills en behandlingsindikation uppträder. Det finns randomiserade studier både före 98 och efter 99 införandet av rituximab som inte visar någon överlevnadsfördel av att behandla asymtomatiska patienter med spridd sjukdom. En av studierna visade dessutom att 40 % av alla patienter över 70 år som vid diagnos saknade behandlingsindikation aldrig behövde någon behandling utan att de dog av andra orsaker än sitt lymfom. Spontan remission ses också hos upp till 20 % av patienterna som följs med vaksam exspektans 100.
Primärbehandling av spridd sjukdom med behandlingsindikation
Rekommendation
- Behandling i lämplig klinisk prövning eller
- Singel-rituximab, 4 veckovisa infusioner och vid behandlingssvar (minor response eller bättre) ytterligare 4 infusioner, 12 veckor efter start (+++) eller
- R2 (rituximab + lenalidomid; se nedan för dosering) (++++) eller
- R-bendamustin x 6 (++++) eller
- R-CHOP-21 x 6 (++++), följt av rituximabunderhåll varannan månad i 12 doser (+++).
- Vid aggressiv klinik eller organpåverkan som kräver prompt tumörreduktion bör singel-R ej användas.
Rituximab intravenöst ges alltid 375 mg/m2, både ensamt och i kombination.
Trots att det finns flera väl genomförda randomiserade studier för tidigare obehandlade patienter med behandlingsindikation råder det ingen samsyn om förstahandsvalet.
I Sverige ges ofta behandling med enbart rituximab, i syfte att helt undvika cytostatika. I en nordisk studie var 33 % av patienterna fortfarande i remission efter i median fem års uppföljning; för patienter som uppvisade gott behandlingssvar redan efter 4 infusioner var siffran 42 % 101. Liknande goda resultat efter singel-rituximab har publicerats av den schweiziska SAKK-gruppen 102. Ungefär 70 % av patienterna uppvisar minst partiell remission (PR) efter singel-rituximab. En samlad uppföljning efter 10 år av patienter som initialt fått antikroppar utan cytostatika visade en jämförbar överlevnad med PRIMA-studien och 38 % av patienter med follikulärt lymfom hade ännu inte fått någon kemoterapi 43. Rituximab ges i 4 veckovisa doser och interimutvärdering bör ske ca 8–12 veckor efter behandlingsstart, vid CR, PR eller minor response (MR) fortsätts med ytterligare 4 rituximabdoser, veckovis eller månadsvis.
För patienter som inte svarar på singel-rituximab kan man invänta ett sent svar (se också rituximab-refraktäritet, nedan).
Lenalidomid kombinerat med rituximab (R2) har visat sig ge mycket bättre PFS än enbart rituximab i bl a den nordisk-schweiziska studien SAKK 35/10 103; vid långtidsuppföljning var median PFS 9,3 år mot 2,3 år 104. I RELEVANCE-studien 105 verkade R2 i en annan dosering likvärdigt med RCHOP och RBenda, även vid 6 års uppföljning 106, men den långa behandlingstiden (120 veckor) rekommenderas inte i Sverige. R2 ger samma OS som R och Rkemo.
R2 kan således ges i enlighet med SAKK 35/10: lenalidomid 15 mg startas 2 veckor första dosen rituximab och avslutas 2 veckor efter den sista rituximabdosen, där rituximab ges vecka 1, 2, 3, 4 med utvärdering vecka 8–11 och rituximab därefter vecka 12, 13, 14, 15. Ett praktiskt R2-alternativ är att ge lenalidomid 15 mg dag 1-28 och rituximab dag 1, 8, 15, 22, därefter utvärdering 8 till 11 veckor efter start och vid respons ges rituximab vecka 12, 16, 20, 24 och samtidigt lenalidomid fr o m vecka 12 t.o.m. vecka 27, dvs. lenalidomid avslutas 3 v efter sista rituximabdosen. Båda sätten ger ungefär lika många dagar med lenalidomid men det andra alternativet innebär längre duration av rituximab i serum med samma antal doser.
Lenalidomid bör dosreduceras vid njurpåverkan (10 mg vid GFR 30–60) och vid cytopenier bör man också sänka dosen (samt ge tillväxtfaktorer). Preparatet kan behövas seponeras om det ger för stora besvär. Lenalidomid är teratogent (absolut icke till gravida och fertila av båda könen måste använda preventivmedel) och trombogent (trombosprofylax rekommenderas enligt lokala rutiner med t.ex. lågdos-DOAK, lågmolekylärt heparin eller acetylsalicylsyra). Lenalidomid ges med fördel som kvällstablett.
R-bendamustin ger också en kort total behandlingstid. I en randomiserad studie med R-bendamustin utan underhållsbehandling med rituximab hade patienterna efter en mediantid på drygt sju års ännu inte nått snittiden till nästa behandling. R-bendamustin var överlägset R-CHOP i en studie 107 och likvärdigt i en annan 108; i RELEVANCE-studien var median PFS ca 7 år 106. R-bendamustin har annan toxicitet än RCHOP (ej håravfall, mindre hjärttoxicitet men oftare djupare benmärgsstamcellsskada). Standarddosen för Bendamustin är 90 mg/ m2 dagligen i två dagar men kan till sköra patienter reduceras till 70 mg/ m2. Det finns visst stöd för att enbart ge 4 kurer Rbendamustin till patienter som tidigt uppnår CR (enligt PET/CT), vilket kanske särskilt kan övervägas till skörare patienter 109.
R-CHOP är överlägset CHOP utan rituximab 110. Progressionsfri överlevnad (PFS) kan förlängas efter behandling med R-CHOP genom underhållsbehandling med rituximab varannan månad. Median PFS är 10,5 år hos de som fick underhållsbehandling och 4,1 år hos dem som inte fick det. Skillnaden är så stor att rituximab-underhåll kan ges efter RCHOP även om ingen skillnad i totalöverlevnad ses (80 % efter 10 år i båda armarna) 111.
Det finns ingen god evidens för att ge rituximab-underhåll efter första linjens R-bendamustin. Underhåll har givit något bättre PFS 112 men till priset av fler allvarliga infektioner 113 och ingen förbättring av OS 112.
Efter singel-rituximab är återbehandling med rituximab vid tidigt återfall lika framgångsrik som underhållsbehandling med rituximab, varför underhållsbehandling inte rekommenderas i dessa fall 114.
Vid aggressivare klinik eller organpåverkan som kräver snabb tumörreduktion är singel-rituximab tveksamt. I stället rekommenderas R2 eller Rbendamustin eftersom man därmed sparar antracyklinutrymmet för behandling vid en eventuell framtida transformation. Hos patienter med sjukdom som ter sig kliniskt aggressiv bör transformation misstänkas. Här kan PET/CT ge vägledning för biopsi 4. Vid misstanke om transformation som inte kan verifieras rekommenderas RCHOP.
R-CVP rekommenderas inte, eftersom studier där patienter får RCVP visar sämre progressionsfri och allmän överlevnad än studier där patienter får singel-rituximab 101102115, även om direkta jämförelser saknas.
Gallium-studien 116117 visade bättre PFS för obinutuzumab-kemo än Rkemo (kemoterapi var bendamustin, CHOP eller CVP) följt av 2 års underhållsbehandling med respektive antikropp. I studien framkom oväntade problem med fatal toxicitet, särskilt infektioner, under underhållsfasen, i synnerhet hos patienter som erhållit bendamustin. Därför rekommenderas fortfarande inte antikroppsbehandling efter bendamustin. Studien visade ingen skillnad mellan antikropparna i totalöverlevnad eller respons efter induktionsbehandling. Därför rekommenderas i dagsläget rituximab som CD20-antikropp i primärbehandling.
Metabol CR vid PET efter R-kemo är en stark prediktor för längre PFS, varför patienter som ej uppvisar metabol CR efter R-kemo eventuellt kan bli föremål för ytterligare behandling. Ny biopsi kan övervägas 5.
Patienter med endast PR (eller ej metabol CR enligt PET) efter R-kemo kan bli föremål för ytterligare behandling.
Återfall/progress
Ett återfall bör verifieras med ny biopsi för att utesluta transformation till aggressivt lymfom. Biopsin bör tas från den snabbast växande körteln. Ny stadieindelning ska göras. Asymtomatiska återfall kan följas med vaksam exspektans. Överväg om det finns någon klinisk prövning för patienten.
Lokalt symtomgivande återfall/progress
Rekommendation
- Strålbehandling, 4 Gy (2 Gy x 2 fraktioner), alternativt 24 Gy (2 Gy x 12 fraktioner).
Vid lokaliserade, symtomgivande återfall har strålbehandling goda resultat 118. Även vid generellt återfall men endast en eller få symtomgivande lokal/er, kan strålbehandling väljas, då oftast i den låga doseringen.
Behandlingskrävande återfall/progress inom 2 år efter rituximab utan kemoterapi
Tidigt återfall, inom 2 år efter primärt rituximab utan kemoterapi
Rekommendation
- Behandling i lämplig klinisk prövning eller
- CD20ak-bendamustin x 6 (++) eller
- CD20ak-CHOP-21 x 6 (++) eller
- CD20ak-lenalidomid (+++), för dosering, se nedan.
- Om god respons efter CD20akCHOP, underhållsbehandling med rituximab var tredje månad, åtta doser (+++).
- Om tillväxten/återfallet kommer inom 6 månader efter avslutad primär singel-rituximab föreligger rituximab-refraktäritet (se avsnitt 10.7) och obinutzumab bör ges i stället för rituximab enligt avsnitt 10.5.4 (dock är autolog SCT ej indicerad för tidiga recidiv efter singel-rituximab).
Om patienten ej har erhållit bendamustin rekommenderas CD20ak-bendamustin i första hand, härlett från Rummels studie vid primärbehandling 107. Det saknas data för CD20ak-underhåll efter CD20-ak-bendamustin i återfallssituationen.
Efter CD20ak-CHOP bör underhållsbehandling med CD20ak ges 119. Randomiserade studier har visat bättre progressionsfri överlevnad efter tillägg av Runderhåll. I en meta-analys har man också sett en överlevnadsvinst 116, något som efter 10 år ej ännu setts i den randomiserade PRIMA-studien. Den regim som rekommenderas för rituximab-underhåll efter återfallsbehandling är en dos var 3:e månad i 2 år (8 doser). Observera att regimen skiljer sig från rituximab-underhåll efter primärbehandling där rekommendationen är behandling varannan månad (12 doser).
AUGMENT-studien 120 har god PFS och OS för rituximab-lenalidomid i recidivsituationen (om patienten ej tidigare har erhållit lenalidomid). Dosering i AUGMENT var rituximab dag 1, 8, 15, 22 i cykel 1, därefter dag 1 i cykel 2–5 (varje cykel var 28 dagar) och lenalidomid 20 mg dag 1–21 i alla 12 cykler. För dosreduktion och trombosprofylax, se förklaring i avsnitt 10.4.4. Man kan också välja att istf lenalidomid 20 mg dag 1–21 ge lenalidomid 15 mg dag 1–28 (dvs. kontinuerligt).
Om återfallet kommer inom 6 månader efter avslutad primär- eller underhållsbehandling betraktas sjukdomen som rituximab-refraktär, och obinutuzumab skall då användas i stället för rituximab (se avsnitt 10.7).
Behandlingskrävande återfall/progress mer än 2 år efter rituximab utan kemoterapi
Utan aggressiv klinik
Rekommendation
- Behandling i lämplig klinisk prövning eller
- Rituximab-lenalidomid (++++) eller
- Singel-rituximab (++) eller
- R-bendamustin (++).
AUGMENT-studien 120 har visat bättre PFS och OS för rituximab-lenalidomid (R2) än rituximab, vilket innebär att R2 enligt AUGMENT rekommenderas i första hand, särskilt om recidivet kommer tidigare snarare än sent; i samma situation kan även Rbendamustin övervägas. En betydande andel patienter med follikulära lymfom får mycket långa remissioner efter singel-rituximab-behandling. Denna behandling kan då upprepas enligt samma regim som vid primärbehandlingen.
Med aggressiv klinik
Rekommendation
- Behandling i lämplig klinisk prövning eller
- R-bendamustin x 6 (++) eller
- R-CHOP-21 x 6 (++).
- Om god respons efter R-CHOP, underhållsbehandling med rituximab var tredje månad, åtta doser (+++).
- Rituximab-lenalidomid (++++).
För kommentarer se avsnitt 10.5.2.1.
Behandlingskrävande återfall/progress inom 2 år efter första linjens R-kemoterapi
Rekommendation
- Behandling i lämplig klinisk prövning eller
- CD20ak-CHOP-21 om R-bendamustin i första linjen eller
- CD20ak-bendamustin om R-CHOP i första linjen (+++) eller
- CD20ak-lenalidomid (++++).
- Vid metabol CR, autolog SCT till biologiskt yngre patienter (++), övriga patienter med minst PR bör få CD20ak-underhållsbehandling i 2 år (++++); data saknas för underhållsbehandling efter bendamustin.
- Om sjukdomen är CD20+ men rituximab-refraktär (se avsnitt 10.7) bör CD20ak vara obinutuzumab, övriga patienter rituximab.
- Transformation bör uteslutas med ny biopsi, särskilt vid progress < 6 månader efter avslutad primär R-kemo.
Obinutuzumab i kombination med bendamustin till rituximab-refraktära har visat överlevnadsvinst jämfört med enbart bendamustin 121, och härlett från denna studie rekommenderas därför också tillägg av obinutuzumab till CHOP. AUGMENT-studien 120 har visat god OS och PFS med lenalidomid-tillägg till antikropp. Särskilt för äldre kan därför CD20ak och lenalidomid rekommenderas vid tidig svikt på R-kemo.
Ny biopsi, för att verifiera viabel tumör eller transformation, är särskilt viktig vid progression under eller strax efter R-kemo, vid dåligt metabolt svar (PET/CT) eller ej uppnådd PR (CT) efter första linjens R-kemo.
Underhållsbehandlingen ges i 2 år, var 3:e månad med rituximab eller varannan månad med obinutuzumab 119121. I återfallssituationen ges underhållsbehandling också efter obinutuzumab-bendamustin eftersom dessa patienter med recidiverande sjukdom har dokumenterad överlevnadsvinst med underhåll med obinutuzumab 121. R-bendamustin med efterföljande R-underhåll är en extrapolering från GADOLIN 121 samt EORTC 119 och R-underhåll efter R-Bendamustin har sålunda sämre evidens.
För diskussion angående autolog SCT, se Kapitel 19 Stamcellstransplantation.
Behandlingskrävande återfall/progress mer än 2 år efter första linjens R-kemoterapi
Rekommendation
- Behandling i lämplig klinisk prövning eller
- Vid stillsam klinik kan singel-rituximab övervägas (++) eller
- CD20ak-CHOP-21 om R-bendamustin i första linjen eller
- CD20ak-bendamustin om RCHOP i första linjen (+++) eller
- CD20ak-lenalidomid (++++).
- Hos patienter med respons, CD20ak-underhållsbehandling i 2 år (++++), dock finns inte data för R-underhåll efter R-bendamustin.
- Om sjukdomen är CD20+ men rituximab-refraktär (se avsnitt 10.7) bör CD20ak vara obinutuzumab, övriga patienter kan ges rituximab.
- Ny biopsi rekommenderas.
- Överväg stamcellsskörd om remission uppnås.
- Autolog SCT kan övervägas för patienter med aggressiv klinik och som uppnår metabol remission.
Behandling vid upprepade återfall och palliation
Rekommendation
- Behandling i lämplig klinisk prövning eller
- Remissionssyftande behandling med ny regim kan övervägas (t.ex. CD20ak kombinerad med bendamustin, CHO(E)P, lenalidomid, IME, DHAP, DHAO/DHAX, IKE, GDP eller GemOx) och, om remission uppnås, konsolidera med autolog eller allogen SCT (för indikationer, se avsnitt 19.2.1). Allogen SCT kan övervägas vid recidiv efter autolog SCT, liksom vid cytostatikrefraktär sjukdom (+++) eller
- Mosunetuzumab kan övervägas till patienter som fått återfall efter minst 2 linjer, för dosering, se avsnitt 10.6.1 nedan (+++) eller
- Idelalisib kan övervägas till patienter som fått återfall efter minst 2 linjer och som inte förväntas tolerera remissionssyftande terapi (+++).
- Extern strålbehandling mot symtomgivande lokaler kan övervägas vid behandlingskrävande stillsamt återfall samt för symtomkontroll (2 Gy x 2 eller 2 Gy x 12).
- Singel-rituximab kan övervägas vid stillsam klinik (+++).
- För sent palliativ fas, se nedan.
Idelalisib kan ge god sjukdomskontroll i många år men problemet är oftast dess biverkningar (transaminit, pneumonit, colit, dermatit, CMV-infektion) 122. Erfarenhet från senare PI3K-hämmare har visat att dosreduktion verkar minska de annars vanliga biverkningarna i denna preparatklass men med kvarstående klinisk nytta. Därför är det rimligt att om man uppnår respons efter en månads behandling, fortsätta med lägre doser idelalisib än vad FASS rekommenderar. En sjundedel av kumulativ standardveckodos har fungerat, dvs. 100 mg idelalisib tre dagar i veckan. Vid inflammatoriska biverkningar bör man utesluta CMV-reaktivering, pausa idelalisib och ge steroider under någon vecka. Därefter brukar det gå bra att återuppta läkemedlet igen.
Tillägg med CD19-antikroppen tafasitamab till R2 (enligt AUGMENT) har visat sig överlägsen R2 vid recidiverande FL med median PFS 22 mot 14 månader 123, men är i dagsläget inte godkänd vid denna sjukdom.
CAR-T-cellsbehandling på recidiverande eller refraktärt follikulärt lymfom har godkänts i USA samt i EU efter två (lisokabtagen-maraleucel samt tisagenlekleucel) eller tre (axikabtagen-ciloleucel) linjer av systemisk behandling. CAR-T är dock inte godkänt av NT-rådet och kan därför inte rekommenderas utanför studie. Det finns inga jämförande studier, men det är inte uppenbart att CAR-T-cellsbehandling skulle ge bättre PFS än autolog SCT.
I en palliativ situation kan man tänka sig att behandla med R-gemcitabin, R-klorambucil, och, i ett ännu mer palliativt läge, peroralt cyklofosfamid, trofosfamid eller klorambucil. Steroider kan också fungera. Många cytostatikaregimer kan vara aktiva vid follikulära lymfom och kan erbjuda patienten god palliation som tillägg till annan palliativ behandling.
Mosunetuzumab
Den bispecifika CD20/CD3-antikroppen (bsAk) mosunetuzumab är godkänd av NT-rådet som monoterapi i tredje eller senare linje för behandling av follikulärt lymfom hos patienter som har genomgått minst 2 systemiska behandlingslinjer vilka har innehållit CD20-antikropp och alkylerare. Dvs. det är godkänt för patienter som har genomgått R-CHOP plus R/G-Benda, R/R2 plus R/GBenda/CHOP, men inte för de som bara erhållit R plus R2. Strålning räknas inte.
Innan patienten övervägs för mosunetuzumab bör ny tumörbiopsi tas som dels utesluter transformation, dels bekräftar att lymfomet är CD20+ (antingen på cellytan eller intracellulärt). Det finns ingen åldersgräns för preparatet men man måste göra en rimlighetsbedömning map. förväntad överlevnad vad gäller patientens övriga sjuklighet 124.
Patienterna behandlas i 8 treveckorscykler; de som når CR avslutar behandling, medan de som når PR eller SD får totalt 17 cykler. Önskvärt är att så många patienter som möjligt når snabb CR, vilket dels är gynnsamt lymfomprognostiskt men också biverkningsmässigt eftersom längre tids behandling med bsAk medför tilltagande infektionsproblematik (se 10.6.2).
Vid andra bsAk har man sett en tydlig förbättring av CR-frekvensen genom att lenalidomid läggs till bsAk. Epcoritamab-singel gav CR 63 % för recidivpatienter 125 men efter tillägg med lenalidomid till epcoritamab sågs CR 86 % för recidivpatienter 126 och lenalidomid-tillägg gav också nästan identisk CR 85 % i tidigare obehandlade patienter 127. Också vid mosunetuzumab har lenalidomid-tillägg givit bättre svar: mosunetuzumab-singel gav CR 60 % för recidivpatienter 124, men mosunetuzumab-lenalidomid gav 77 % CR för recidivpatienter 128 och 81 % CR för tidigare obehandlade patienter 129; i det sista arbetet noterades att samtliga patienter utom en nådde CR snabbt, redan före cykel 4, vilket innebär att 17 cykler sällan behövdes.
Därför kan patienter som erhåller mosunetuzumab också övervägas få tillägg med lenalidomid.
Behandlingsschema
Behandlingsschemat för mosunetuzumab är i 3-veckorscykler:
Cykel 1: Dag 1 (C1D1): 1 mg. C1D8: 2 mg. C1D15: 60 mg (samtliga infusioner ges på minst 4 timmar).
Cykel 2: Dag 1 (C2D1): 60 mg (om de har tolererats väl ges denna och resterande doser på 2 timmar).
Cykel 3 och därefter: Dag 1: 30 mg.
Under samtliga doseringsdagar i Cykel 1 och 2 skall patienterna en timme före varje infusion ta 20 mg dexametason, 1 g paracetamol och 10 mg cetirizin. Därefter ges det bara om det har varit problem. Patienterna skall dricka rikligt med PO vätska under de tre första behandlingsveckorna (2-3 liter/dag). Före varje dos bör man utvärdera att ICANS inte föreligger, t.ex. med ICE score (se 10.6.2). Fysisk bedömning inför C1D1, C1D15 och C2D1, samt v.b. Kliniken som ger bsAk skall ha minst 2 doser tocilizumab tillgängligt på kliniken.
Patienter som får CRS eller ICANS (risk störst i patienter med mycket tumörbörda och särskilt C1D15-17) kan behöva extra dexametason 8-20 mg en-några dagar efter dosering. Tocilizumab ges vid CRS grad ≥ 2. Infektionsrisken blir kumulativt större ju längre patienten behandlats och det är vanligt med kroniska viroser och sekundära pneumonier i patienter som behandlas längre än 6 månader. Patienter får mycket svårt att eradikera virus och ibland måste man göra paus i bsAk-behandlingen om det är en mer patogen sort, t.ex. influenza, RS eller COVID19. Det finns också risk för svår virussjuklighet och för sekundära pneumonier. Man bör inte vara rädd att göra behandlingspaus i en patient v.b. om man vet att lymfomet redan har svarat. En del patienter kan behöva IVIG under behandlingen. Se också nedan för hantering av biverkningar av bsAk.
Om en dos i cykel 1 blir försenad i mer än 7 dagar skall den föregående dosen upprepas, innan man återgår till det planerade behandlingsschemat. Behandlingsavbrott efter C1D15 på ≥ 6 veckor innebär att mosunetuzumab måste återupptrappas med 1 mg dag 1 och 2 mg dag 8 och en vecka senare återuppta behandlingsdos enligt planerat schema.
Blodprover tas 1x/veckan under de första 8 veckorna, därefter kan det ofta glesas ut till inför varje dos. Tag blodstatus och CRP varje gång. Komplettera v b med ferritin och sIL2R (sCD25). Kontrollera immunglobulinnivåerna inför varje åb.
Tillägg med lenalidomid
Om lenalidomid läggs till rekommenderas doseringen 15 mg x 1 som äts varje kväll från cykel 2 dag 8 (C2D8) tom. 3 veckor efter sista dos mosunetuzumab. Patienter som får besvärliga lenalidomid-biverkningar kan behöva sänka dosen till 10 eller 5 mg eller sätta ut preparatet i förtid.
Övrig profylax
Patienterna skall också erhålla sedvanlig profylax mot PJP, HSV/VZV och trombos (lågdos-DOAK) om de får lenalidomid. Patienterna bör också ta 20 mg omeprazol de dagar de får högdossteroider samt dricka 2-3 l vatten.
Förslag till radiologiska utvärderingar + återbesök
Inför beh: PET/CT. Inför cykel 4: CT + ÅB. Efter cykel 8: PET/CT + ÅB (benmärgsprov v b för att bekräfta CR). Om förlängd behandling: inför cykel 12: CT + ÅB inför cykel 12. Efter cykel 17: PET/CT + ÅB (benmärgsprov v.b. för att bekräfta CR). Vid den första röntgenundersökningen kan man se en nedslående bild som motsvarar stabil sjukdom. PET kan då vara till hjälp men även en bild med ökad aktivitet i lesioner eller tom. nya små FDG+ förändringar är inte bevis för dåligt svar och om patienten inte har andra tecken på progress bör behandlingen fortsätta. Detta kallades i studierna för IR (indeterminate response) och de flesta patienterna uppnådde sedermera CR. Man måste överväga ny biopsi om man tror att det är progress. Det övervägande flertalet (>80%?) av reella progresser under CD20/CD3-bsAk har totalt CD20-negativt lymfom; CD20+ recidiv ses snarare efter att behandlingen har avslutats. Om man skulle påvisa CD20-positiva celler tidigt i behandlingen är det därför rimligt att fortsätta med den om patienten mår bra.
Om patienten får CD20+ recidiv efter mosunetuzumabs avslutande kan ny behandlingsomgång övervägas eftersom man i registreringsstudien återbehandlade en del patienter med återfall och såg 80% som responderade.
Biverkningar vid bsAk-behandling
Patienter som behandlas med bsAk skall ha T. Dexametason 4 mg i hemmet, samt paracetamol och ibuprofen.
Cytokinfrisättningssyndrom (CRS)
Besvärande CRS uppstår ffa i patienter med stor tumörbörda och särskilt dagen som första fulldos bsAk ges eller någon dag senare efter att man har slutat med steroider. Patienterna skall dricka rikligt med PO vätska under de tre första veckorna med behandling (2–3 liter/dag). Ibland ses CRS redan vid provdoserna. Den enklaste åtgärden vid CRS grad 1 är att ge paracetamol + ibuprofen + extra PO vätska samt förlänga steroidbehandlingen med någon/några dagar, om det behövs (Dexametason 8–20 mg).
Se tabell nedan för förklaring av CRS-gradering.
CRS grad 1: paracetamol 1000 mg + ibuprofen 800 mg (om kontraindikation saknas) + minst 2 liter vätska PO + ev. steroider (dessa kan avvaktas vid milda symptom).
CRS grad 2: patienten till sjukhus för att till steroider erhålla tillägg med tocilizumab 8 mg/kg. Tag först gärna HLH-prover samt blodstatus och CRP. Tocilizumab kan upprepas v.b. någon dag senare.
CRS grad 3–4: Om patienten behöver vasopressorstöd eller högflödessyrgas blir intensivvård aktuellt.
En CRS-grad 2–4-episod är inget hinder för att senare fortsätta behandlingen med bsAk ehuru med ökad vaksamhet och förlängt steroidskydd. Erfarenheten är att tocilizumab också fungerar profylaktiskt mot framtida episoder. Dessutom är CRS ett utryck för antitumoral aktivitet och risken för svår CRS är alls inte lika stor vid senare bsAk-doser då sjukdomsbördan oftast har krympt.En minoritet av patienterna får ett långvarigare inflammatoriskt tillstånd som pendlar mellan grad 1 och 2, med t.ex. problem med ascites, pleuravätska, trötthet eller muskelvärk. I dessa pat bör man prova med tocilizumab som verkar kunna bryta processen. Man bör också beakta ev. underliggande lågvirulent infektion, t.ex. COVID19 eller port-infektion.
Figur 2. Gradering av CRS och ICANS
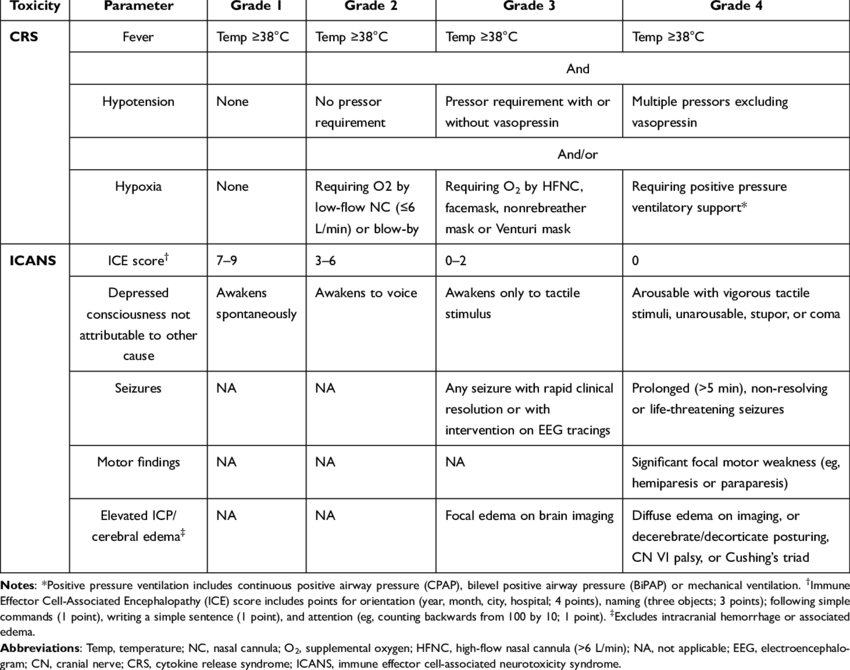
Referens: 130.
Immuneffektorcells-associerat neurotoxicitetssyndrom (ICANS)
Mild ICANS detekteras bäst genom att man genomför ICE-score 130.
- Orientering till år, månad, stad, sjukhus (4 poäng)
- Kunna namnge tre föremål (peka på penna, knapp, klocka) (3 poäng)
- Kunna följa enkel uppmaning (”Lyft ena handen!”) (1 poäng)
- Kunna skriva en enkel valfri mening (1 poäng)
- Kunna räkna baklänges från 100 i 10-talssteg (1 poäng); totalt: 10 poäng.
På telefon kan patienter som annars mår bra men har mild ICANS berätta att de t.ex. har fått tillfälligt svårt att lösa korsord eller köra bil vilket betraktas som en mild, övergående ICANS-ekvivalent (oftast samtidigt med CRS grad 1). Vid ICANS grad 1 ges/förlängs steroidbehandlingen med någon/några dagar. Vid ICANS grad 2-4 (detta är inte vanligt vid bsAk) måste patienten läggas in, undersökas med MR av hjärna, EEG och behandling bör ske i samråd med neurolog. Patienterna bör ha full ICE-poäng innan de får nästa dos bsAk.
CRS och ICANS graderas enligt Lee et al 130. Se figur 2.
Infektionsproblem vid bsAk
Alla patienter med bsAk skall ha profylax mot PJP och HSV/VZV. Initialt ses ingen påtaglig infektionsbenägenhet men under behandlingen får patienten ofta svårt att eradikera luftvägsvirus, vilka kan kvarstå under flera månader, i synnerhet om man fortsätter bsAkbehandlingen. I virusinfekterade patienter som har en tydlig remission bör man överväga, särskilt om grundsjukdomen är indolent, att göra paus i behandlingen för att få utläkning av t.ex. COVID19 eller influensa. Det kan vara klokt att ge någon dos IVIG (30-40 g) för att påskynda utläkning. Även andra virusaktiveringar har setts under bsAk-behandling t.ex. parvo B19 och därav plötsligt transfusionsbehov. Patienter som behandlas under mer än ett halvår-år kan ofta utveckla en kronisk funktionell Tcellsdysfunktion som ses som en kronisk förkylningskänsla med diverse virus i snorsug. Flera patienter behöver immunglobulinsubstitution (man bör regelbundet kontrollera IgG-nivåerna på pat under bsAk-beh) men trots detta är risken för sekundär pneumoni hög, och starta substitution om IgG < 4 g/l eller vid luftvägsinfektion eller kronisk viros även om IgG ligger bättre än 4.
Rituximab-refraktäritet
Rituximab-refraktäritet definieras som återfall eller progress inom 6 månader efter senaste rituximabdos eller sämre än partiell remission efter rituximabinnehållande behandling.
Vid rituximab-refraktär sjukdom har rituximab mycket tveksamt värde. För patienter som är aktuella för bendamustin har kombinationen obinutuzumab-bendamustin visat sig förbättra progressionsfri överlevnad mer än ett år jämfört med singel-bendamustin. För rituximab-refraktär CD20+ sjukdom rekommenderas därför tillägg med obinutuzumab.
Anti-CD20ak-biverkningar
Sen neutropeni (LON)
Efter behandling med rituximab (eller andra CD20-antikroppar inkl. CD3/CD20 bsAk) med eller utan cytostatika förekommer ibland sen neutropeni ”late onset neutropenia” (LON). LON (neutrofiler < 1,0/nl) har diagnosticerats hos 10–20 % av alla behandlade patienter. Mediantiden för debut av LON är 3 månader (1–6 månader) efter avslutad behandling.
LON är oftast ofarligt och spontant övergående 99. Om grav neutropeni uppträder (< 0,2/nl) rekommenderas enstaka doser med GCSF (+).
Rituximab-inducerade interstitiella lungförändringar (R-ILD)
Enstaka fall av interstitiella lungförändringar har rapporterats i samband med rituximab. Om progredierande andfåddhet uppstår utan infektion/lungembolism bör behandlingen med rituximab avbrytas och högdos steroider ges 100 (+).
Progressiv multifokal encefalopati (PML)
Enstaka fall av PML, utlöst av JC-virus, har setts och är förenat med mycket hög dödlighet. De immunologiska effekterna av långvarig anti-CD20-behandling bör också beaktas: man får inget antikroppssvar på vaccination under och flera månader efter rituximabbehandling och efter en tid inträder ofta hypogammaglobulinemi och benägenhet till luftvägsinfektioner. Allvarliga eller upprepade infektioner är ett fullgott skäl att avbryta rituximab-underhåll.
