Bakgrund och orsaker
Epidemiologi
I Sverige diagnostiseras varje år cirka 600 personer med en myeloproliferativ neoplasi Sammanfattning av den interaktiva årsrapporten för 2023 - MPN-registret. Det motsvarar en incidens på cirka 6,0 fall per 100 000 personår. Incidensen för PV är 1,9, för ET cirka 2,7, för PMF 0,9 och för MPN-U 0,5, samtliga per 100 000 personår. Incidensen är stabil över tid, se figur 1.
PV är lika vanligt hos män som hos kvinnor. PMF något vanligare hos män, medan ET och MPN-U är något vanligare hos kvinnor. Ålder är en stark riskfaktor för att utveckla MPN. Medianåldern vid diagnos är 69 år vid ET, 70 vid PV och 72 vid PMF och MPN-U. Cancercentrum.se - Nationellt kvalitetsregister för MPN
Figur 1. Ålderstandardiserad incidens per 100 000 personår över tid, 2020-2024, totalt MPN och fördelat på subtyp.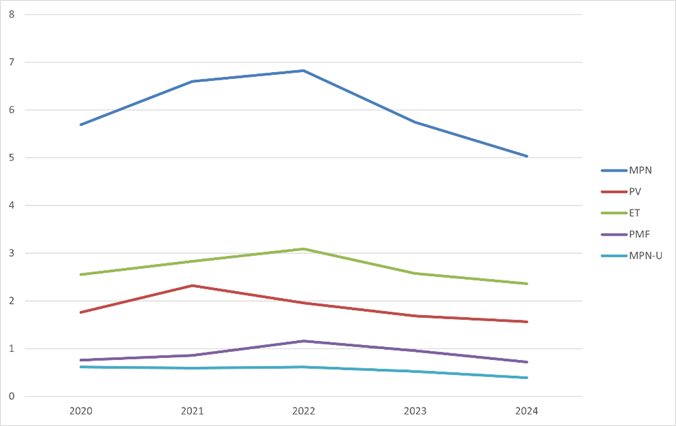 Tabell 2. Incidens per 100 000 personår för MPN, per ålderskategori.
Tabell 2. Incidens per 100 000 personår för MPN, per ålderskategori.
|
Ålder |
Antal MPN-diagnoser 2020-2024 |
Ojusterad incidens-rat / 100 000 personår (95 % konfidensintervall) |
|
<20 |
11 |
0,09 (0,05-0,16) |
|
20-39 |
177 |
1,30 (1,12-1,51) |
|
40-49 |
228 |
3,51 (3,08-4,00) |
|
50-59 |
406 |
6,12 (5,55-6,75) |
|
60-69 |
693 |
12,38 (11,49-13,34) |
|
70-79 |
1233 |
24,33 (23,01-25,73) |
|
≥ 80 |
722 |
24,99 (23,23-26,88) |
Etiologi och överlevnad
Molekylärgenetik
Idag finns kunskap om tre sjukdomsdrivande mutationer som samtliga är implementerade i diagnostik och har betydelse för prognos och trombosrisk. Mutationer i JAK2 (JAK2V617F vanligast) upptäcktes först och förekommer hos cirka 94 % med PV, och hos 50–64 % med ET och PMF enligt registerdata (interaktiv rapport MPN-registret, datauttag 2025-03). Mutationer i calreticulingenen (CALR) förekommer hos 20–35 % och MPL (MPLW515L/K) hos cirka 4 % av patienter med ET och PMF, se figur 2. CALR-mutationer är heterogena, och delas in i typ 1 (eller typ 1-liknande) samt typ 2 (eller typ 2-liknande) och övriga, och har betydelse för såväl sjukdomsfenotyp som prognos 3.
De sjukdomsdrivande mutationerna i dessa tre gener leder till en konstant aktivering i receptorerna för erytropoetin, trombopoetin och G-CSF. Patienter med ET och PMF utan någon av dessa mutationer benämns som trippelnegativa. Hos patienter med PV som är negativa för JAK2V617F kan mutation i JAK2-genen i exon 12 förekomma. Additiva genförändringar, till exempel ASXL1, TP53 och i diverse splitsningsgener, samt i vilken tidsmässig ordning de uppkommit kan förklara hur samma mutationer kan leda till de tre fenotypiskt olika sjukdomarna. Additiva genförändringar kan också ge ytterligare prognostisk information vid PMF 4.
Figur 2. Fördelningen av sjukdomsassocierade mutationer hos PV, ET resp. PMF.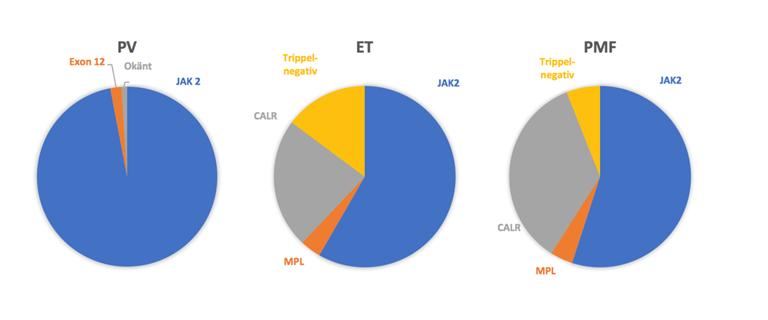
JAK-2 CHIP (clonal hematopoiesis of indeterminate potential)
CHIP definieras som närvaro av klonal hematopoes sekundär till en leukemogenisk mutation hos patient utan tecken på hematologiska maligniteter, inklusive frånvaro av dysplasi och cytopeni 5. Det är konstaterat att JAK2V617F-mutationen, som är den mest frekventa CH-relaterad genmutationen bland JAK2 mutationer, förekommer i 0,1-0,2 % av befolkningen utan myeloida maligniteter 678. Först nyligen har man dock börjat undersöka implikationerna av denna CHIP och dess eventuella roll i ökad trombosbenägenhet. Även om de flesta författare definierar CHIP som VAF>2 %, har studierna på JAK2 mutationer inkluderat lägre nivåer utifrån de olika metodernas detektionsgränser. CHIP JAK2V617F är associerad med hög risk för både venös och arteriell trombos, var god se kapitel 10 Trombos och Blödning.
Mekanismen är inte helt klarlagd, men autoimmunt och inflammatoriskt svar, verkar vara en viktig aspekt 9. Huruvida denna risk är kliniskt signifikant och i vilka situationer är en obesvarad fråga. Att CHIP förekommer i ökad frekvens bland äldre individer och att förekomst av JAK2 CHIP har visats vara associerad till rökning och högre alkoholkonsumtion 10 understryker att det föreligger en kombinerad effekt av flera riskfaktorer för denna riskökning. Samtidigt kan ökad incidens av CVD och VTE indikera att dessa patienter kommer att diagnostiseras med MPN senare, då man har sett ökad prevalens av vaskulära händelser hos patienter med MPN före det att diagnos ställs 6.
För närvarande finns det inte tillräckligt med evidens för att rekommendera åtgärder såsom primär profylax hos patienter med JAK2 CHIP, var god se kapitel Trombos och Blödning.
Ärftlighet och andra riskfaktorer
Etiologin bakom MPN är till största delen okänd. Att ha en förstagradssläkting med MPN ökar risken 1112 och familjär ansamling av fall förekommer men är ovanligt 13.
Nedärvda mutationer kan öka risken att drabbas, men ytterligare somatiska mutationer måste förvärvas för att sjukdomen ska utvecklas 12. Riskökningen baserad på ärftlighet bedöms sammanfattningsvis så pass liten att vi inte rekommenderar utredning av släkt, förutom vid stark misstanke om ärftlig form av MPN och planerad stamcellstransplantation där ett syskon kan vara aktuell som stamcellsdonator 13.
Autoimmun sjukdom, till exempel Crohns sjukdom, 15 eller högt BMI 16 ökar risken att drabbas. Det finns också studier som antyder en ökad risk att utveckla MPN hos aktiva rökare och tidigare rökare jämfört mot aldrig-rökare 17, vilket är tydligare visat hos kvinnor 1819. Vad gäller yrkesexponering, kemisk exponering och övriga levnadsvanor finns få samstämmiga resultat, men exponering för bensen verkar kunna öka risken för att utveckla MPN 20.
Överlevnad
Med modern behandling är den förväntade överlevnaden endast något förkortad vid ET, något ytterligare förkortad vid PV och mer markant förkortad om än väldigt variabel vid MF 21. Överlevnaden påverkas av såväl kliniska faktorer, till exempel förekomst av hjärt-kärlhändelser, som genetiska faktorer 22. Sedan JAK2-hämmarnas introduktion år 2014 har sannolikt överlevnaden förbättrats vid PMF 23.
