Epidemiologi
Epidemiologi och etiologi
Livmoderhalscancer är en av världens vanligaste cancersjukdomar bland kvinnor, med fler än 600 000 insjuknade och 340 000 döda årligen (Globocan 2020). Sjukdomen går att förebygga genom vaccination eller screening för att upptäcka och ta bort förstadier, men screening skyddar bara dem som deltar 6. Mer än 85 % av cancerfallen inträffar i låginkomstländer som har begränsade resurser till screening, tidig diagnostik och effektiv behandling; dödligheten är därför hög 7. Även i delar av Europa är incidensen och dödligheten hög 7, trots etablerade rekommendationer på EU-nivå. Cellprovtagningen är omfattande men oorganiserad, och deltagandet har blivit socialt snedfördelat och kvalitetssäkringen är ojämn 8.
Infektion med humant papillomvirus (HPV) är främsta orsaken till livmoderhalscancer 9. HPV är en sexuellt överförbar infektion (STI) som kan förvärvas i alla åldrar, men är vanligast vid 18 års ålder bland ovaccinerade kvinnor och något senare bland män 1011. I 60-årsåldern är endast cirka 5 % av den kvinnliga befolkningen positiv för någon av de onkogena HPV-typerna. Förekomsten av HPV i åldrarna 30–64 år är 9 % i medeltal 12. Det finns mer än 220 olika HPV-typer, men endast 12 typer är klassade som cancerframkallande (onkogena), och 1 typ (HPV 68) räknas som troligt karcinogen 1314.
De flesta HPV-infektioner läker ut, och en majoritet av den icke-vaccinerade befolkningen har någon gång i livet haft en HPV-infektion 11. Infektioner som är kontinuerligt påvisbara (persistenta) kan ge cellförändringar av alla grader, vilket är vanligast från tonåren och upp till 30-årsåldern 11. Även cellförändringarna kan läka ut, och bara en mindre andel utvecklas vidare till livmoderhalscancer. Persistent HPV-infektion är i princip alltid en förutsättning för utveckling av livmoderhalscancer.
En nyupptäckt HPV-infektion kan tänkas vara ett resultat av en smitta som skett för många år sedan 11, och det är därför inte meningsfullt att försöka identifiera smittkällan. HPV är oftast påvisbar i minst 5 år före uppkomsten av cancer 115.
Screening och tidig upptäckt
I Sverige började screening med cellprov för cytologi att införas 1967, och sedan 1977 finns en fungerande verksamhet i alla landsting (numera regioner) 16. Den första nationella rekommendationen om screening utfärdades 1967 17 och 1998 kom rekommendationer från Socialstyrelsen som gav ramar för screeningprogrammets utformning när det gäller testmetod, åldersgränser och testintervall 18. Riktlinjer för gynekologens roll i att utreda och behandla kvinnor med förstadier till livmoderhalscancer utarbetades 2010 av SFOG:s arbetsgrupp i ämnet 19. Screeningprogrammet uppdaterades 2015 av Socialstyrelsen, med fokus på byte av analysmetod till HPV för kvinnor över 30 år, höjd åldersgräns och förlängda intervall för kvinnor över 50 år. Utifrån dessa rekommendationer skrevs ett vårdprogram 2017 som för första gången omfattade hela screeningkedjan, inklusive den kliniska handläggningen av screeningfynd.
I Sverige sjönk incidensen och dödligheten i livmoderhalscancer kraftigt under de första 45 åren med screening. Sedan 2012 har dock incidensen ökat igen, särskilt från 2014 320, medan minskningen i dödlighet är oförändrad sedan 2012 21. Under 2014–2018 nyinsjuknade i genomsnitt 560 kvinnor per år, och 150 kvinnor avled årligen i livmoderhalscancer 22. Incidensökningen har framför allt skett hos kvinnor med ett tidigare normalt cellprov. För att motverka den förstärktes KVAST-dokumentet, och vårdprogrammet uppdaterades med ett förkortat intervall för HPV 16-positiva eller HPV 18-positiva kvinnor för vilka cellförändringar inte påvisats. Vårdprogrammet rekommenderar numera att kvinnor med HPV 16- och/eller HPV 18-infektion remitteras till kolposkopi oavsett cytologiresultat.
Figur 1. Incidens och mortalitet i livmoderhalscancer
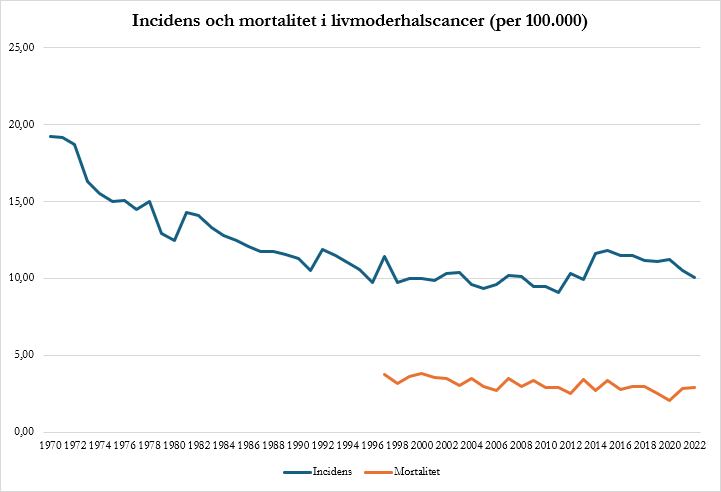
Källa: Socialstyrelsen, Statistikdatabas, 2023.
Uppskattningsvis har hälften av alla potentiella cancerfall förebyggts genom screening, och regelbundna screeningtester uppskattas minska risken för livmoderhalscancer med 90 % 2324. Otillräckligt deltagande i screening är fortfarande den viktigaste orsaken till livmoderhalscancer i Sverige 2025. Otillräcklig screening är främst associerad med sämre socioekonomisk situation, lägre utbildningsnivå, annat ursprung och boende i glesbygd (långt till närmaste provtagningsställe). Självprovtagning framstår alltså som en möjlighet till ökad tillgänglighet.
Cellprovtagning har haft störst effekt på incidensen av skivepitelcancer, följt av adenoskvamös cancer och andra ovanliga histologiska typer av livmoderhalscancer, när man jämför personer med två cellprover som analyserats för cytologi mot personer utan cellprover i de senaste två screeningintervallen. En viss effekt ses även på incidensen av adenokarcinom 11192225.
Screeningupptäckt livmoderhalscancer innebär tidigare diagnos och högre överlevnad. Prognosen för definitiv bot är bättre om diagnosen ställs i tidiga stadier. Cancerfall som är screeningupptäckta, det vill säga med ett cellprov taget utan symtom, har god prognos oavsett om kvinnan tidigare deltagit i screeningprogrammet eller inte. Detta talar emot att det är kvinnor med låg risk för att utveckla höggradiga cellförändringar och cancer som deltar i screening och att det är långsamväxande tumörer som upptäcks 26. Cancer som upptäcks på grund av symtom har också en bättre prognos för de kvinnor som deltagit i screening jämfört med de som inte deltagit.
Organiserad screening
Organiserad screening med individuella kallelser utifrån fastställda intervall ger bäst täckning och ger störst minskning av cancerincidensen 27. De svenska regionernas kallelsesystem bygger på tidigare provtagning, och erbjuder tid och plats för besök hos en barnmorska när det är dags för nästa provtagning, alternativt självprovtagning. Provtagning utan föregående kallelse (opportunistisk cellprovtagning) registreras i kallelsesystemet och gör att nästa kallelse skjuts fram i tiden 28.
För att följa utvecklingen i detalj och föreslå förbättringar i screeningprogrammet behövs kvalitetsregister över kallelser, utförda prover, sjuklighet och åtgärder. Mer om kvalitetssäkring finns i kapitel 12 Laboratorieanalyser: HPV-genotypning, cytologisk analys och histopatologisk diagnostik och kapitel 24 Kvalitetsuppföljning.
Screeningens effekt på cancerincidens och dödlighet i olika åldrar
Det är extremt ovanligt med invasiv cancer före 23 års ålder. HPV-infektion har varit mycket vanligt upp till 30-årsåldern, vilket har medfört att HPV-analys inte tidigare har använts som screeninganalys i den gruppen. Majoriteten av kvinnorna som kallas till screening vid 23 års ålder är numera vaccinerade mot HPV inom barnvaccinationsprogrammet, och därför har förekomsten av lesioner som orsakas av de HPV-typer som ingår i vaccinet minskat drastiskt 29. Det innebär att det positiva prediktiva värdet (PPV) har sjunkit för cytologi, eftersom PPV är direkt relaterat till prevalens vid oförändrad sensitivitet 30. Vid screening från cirka 25 års ålder har man påvisat en minskad incidens av invasiv cancer i 3 år efter ett prov som analyserats för cytologi. Screening syftar främst till att förebygga livmoderhalscancer, men hos unga kvinnor är hälsoeffekten framför allt att tumörer upptäcks i mikroinvasivt stadium, vilket möjliggör fertilitetsbevarande behandling, excision (tidigare kallat konisering) eller trakelektomi. Denna vinst ska vägas mot risken för överbehandling. Med ökande ålder ökar andelen med HPV-infektioner och cellförändringar som är persisterande.
Livmoderhalscancerfall hos äldre förknippas med hög dödlighet, främst för att de upptäcks sent i sjukdomsprocessen 31. Risken för att dö av sjukdomen är också mångfaldigt högre bland kvinnor som inte har deltagit i GCK fullt ut 26. Det finns gott vetenskapligt stöd för att äldre kvinnor som lämnat flera normala prover är väl skyddade mot livmoderhalscancer, om det senaste togs före 2010 i åldersintervallet 61–65 år 3233. Däremot ses en lägre sensitivitet vid cytologi som tagits senare, vilket innebär att kvinnor födda 1947–1952 (och de som var 70 år gamla 2017, då den första versionen av vårdprogrammet godkändes) inte bör tillåtas att lämna screeningprogrammet innan de har lämnat ett negativt HPV-prov.
Kvinnor som tidigare behandlats för höggradig dysplasi (CIN 3) har en accelererande risk för att insjukna och dö i livmoderhalscancer efter 60 års ålder 34. Andelen underscreenade har dock minskat med tiden, och numera har hela den kvinnliga befolkningen fått erbjudande om cellprovtagning under sin livstid.
