Kirurgisk behandling
Kirurgisk behandling av primärt invasivt melanom
Rekommendationer och evidens
- En sidomarginal på 10 mm vid utvidgad excision rekommenderas för melanom med tumörtjocklek ≤ 2,0 mm. (++++)
- En sidomarginal på 20 mm vid utvidgad excision rekommenderas för melanom med tumörtjocklek > 2,0 mm. (++++)
- Vid synkron regional metastasering (lymfkörtel eller in transit) räcker det med 10 mm vid utvidgad excision av det primära melanomet, oavsett tjocklek.
- För akrala lentiginösa melanom inklusive subunguala melanom finns inga randomiserade studier beträffande marginaler. (+)
Den kirurgiska behandlingen av ett primärt exciderat invasivt melanom inbegriper en utvidgad excision av hud och underhudsfett ända ner till nästa anatomiska lager såsom muskelfascia, perikondrium eller periost, med fri marginal i frisk vävnad runt tumören (ärret), för att säkerställa en komplett excision av eventuella utlöpare och närliggande mikroskopiska satelliter (se figur 3). Om det subkutana skiktet är väldigt tjockt (t.ex. vid lokalisation glutealt eller på lår, eller hos en överviktig patient) kan ett djup som motsvarar minst bredden på den utvidgade excisionen vara tillräckligt. In situ-melanom excideras ned i underhudsfettet. Även en in situ-komponent i periferin måste avlägsnas radikalt ned i underhudsfettet. Diagnosen bör bekräftas med en noggrann histopatologisk undersökning.
Nuvarande rekommendationer för minsta marginal till ärret där tumören suttit grundar sig på primärtumörens maximala tjocklek mätt enligt Breslow. Rekommenderad marginal i sidled till tumören vid diagnostisk excision, eller till ärret vid utvidgad excision, uppmäts och ritas ut före operationen och utgör det kliniska måttet. Marginalen för den utvidgade excisionen beräknas utan hänsynstagande till marginalen vid den primära diagnostiska excisionen. Det finns ett antal systematiska översiktsartiklar och randomiserade kontrollerade studier som ger vägledning om marginalerna vid primära melanom [162-171]. För in situ-melanom saknas randomiserade studier. Marginalen på 5 mm vid lentigo maligna (LM) har ofta visat sig vara tillräcklig i studier med Mohs kirurgi, men ibland kan större marginaler på upp till 10 mm vara nödvändigt på grund av diffus avgränsning [172]. I studierna har excisionsmarginalerna varit 6 respektive 9 mm – med säkrare radikalitet vid den större marginalen. Dysplastiskt nevus med höggradig dysplasi och melanom in situ tillhör samma kategori av höggradiga intermediära melanocytära tumörer enligt WHO 2023 [142]och MPATH-Dx 2.0 [143]och bör handläggas på samma sätt. För in situ-melanom är 2 mm histopatologisk marginal tillräcklig, och om denna marginal uppnåtts vid den diagnostiska excisionen behövs ingen ytterligare operation. En klinisk primär excisionsmarginal på 5 mm (vid den diagnostiska excisionen) ger i majoriteten av fallen en histopatologisk marginal på ≥ 2mm.
Långtidsuppföljning stödjer att 2 cm excisionsmarginal är säker för melanom > 2 mm i tumörtjocklek [165, 173]. En pågående studie randomiserar patienter med tumörtjocklek > 1 mm till antingen 10 mm eller 20 mm excisionsmarginal har nyligen startat (MelMarTII-studien) [174]. En svensk studie har nyligen startats (WiseOrWide) som randomiserar patienter med melanom ≤1 mm Breslowtjocklek och radikal primär excision (diagnostisk excision) med minst 1,5 mm histopatologisk marginal till ingen utvidgad excision alternativt utvidgad excision med 1 cm marginal [175].
Figur 4. Marginalen för den utvidgade excisionen beräknas utan hänsynstagande till marginalen vid den primära diagnostiska excisionen.
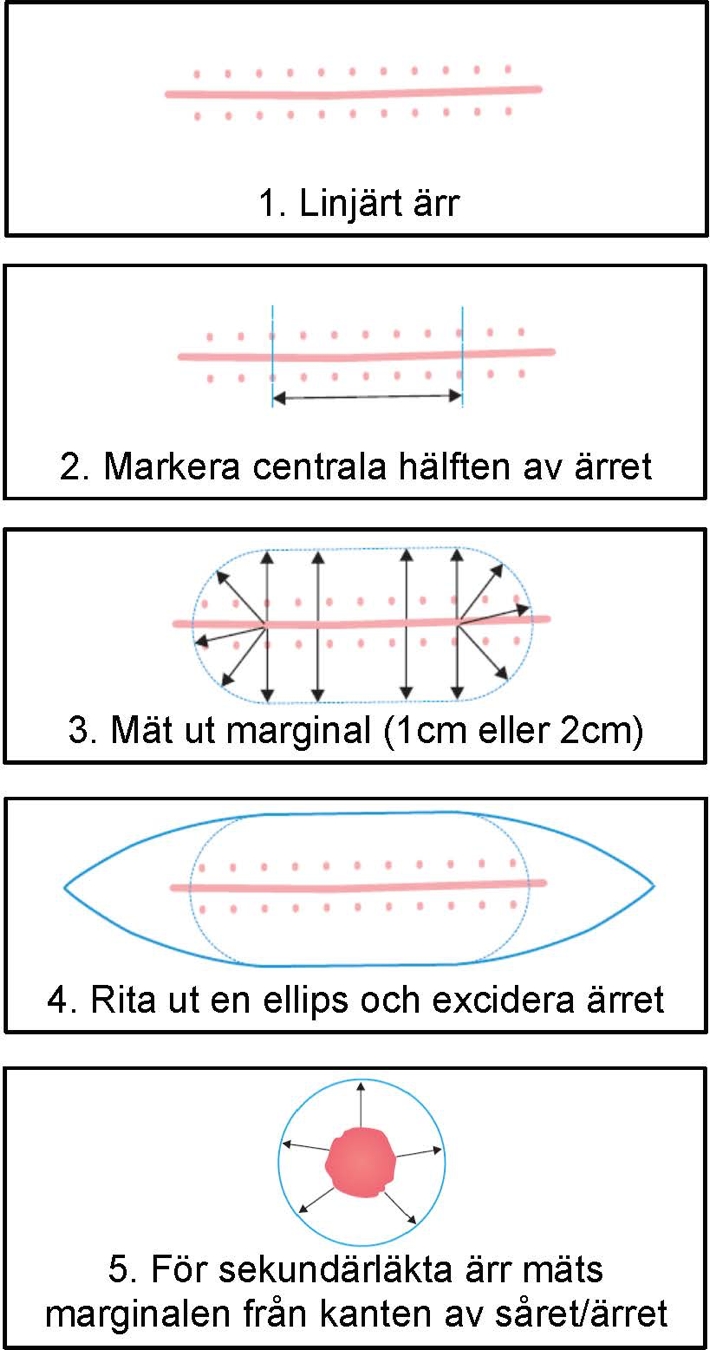
Om ärret efter den diagnostiska excisionen är linjärt (figur 4, bild 1) markeras den centrala hälften av ärret med linjal (figur 4, bild 2), varefter man markerar den planerade excisionsmarginalen vinkelrätt mot ärret. I varje ände av den centrala delen av ärret ritas därefter en halvcirkel ut med samma marginal (figur 4, bild 3), och en ellipsformad excision innefattande markeringen utritas slutligen (figur 4, bild 4). Om den diagnostiska excisionen lämnades att sekundärläka, mäts marginalen för den utvidgade excisionen från sårkanten (figur 4, bild 5). Den utvidgade excisionen görs vinkelrätt ner till nästa anatomiska plan, till exempel fascia eller periost. Strukturer såsom exempelvis större blodkärl och nervgrenar kan sparas om dessa inte misstänks involveras av tumören.
Vissa typer av melanom och primärlokaler kan kräva en modifiering av de rekommenderade sidomarginalerna. Mindre excisionsmarginaler än rekommenderat kan övervägas för melanom på särskilda lokaler såsom inom huvud- och halsområdet, akralt [176] eller vid ögonnära melanom [177, 178] För akrala lentiginösa melanom (ALM) anses att begränsade (funktionella) amputationer ger lika god överlevnad som mer radikala amputationer. Kunskapen är dock begränsad avseende marginaler för ALM, inklusive subunguala melanom. Dessa fall bör diskuteras på MDK och handläggas individuellt för ställningstagande till lämplig behandlingsstrategi [179]. Spitz melanocytom (atypisk Spitz tumör (AST)), Spitz tumör med oklar malignitetspotential (STUMP) och melanocytära tumörer med oklar malignitetspotential (MELTUMP) opereras med 5 mm klinisk marginal för att säkerställa 2 mm histopatologisk marginal, eller enligt beslut på MDK För vidare läsning, se exempelvis https://wiki.cancer.org.au/australia/Guidelines.
Med ögonnära melanom avses tumörer som är belägna nedanför ögonbrynet, medialt om laterala orbitakanten, superiort om inferiora orbitakanten och 1 cm nasalt om mediala kantus. Majoriteten av hudmelanom i ögonregionen förekommer i det nedre ögonlocket. Lentigo maligna (LM dvs in situ-melanom) kan vara associerat med primär förvärvad melanos i konjunktivan.
Vid melanom på ögonlocket görs en excision genom hela ögonlocket. Utanför ögonlocken görs excisionen genom hud och orbikularismuskel ner till nästa anatomiska lager, såsom det tunna fibrösa skiktet (septum) som är beläget anteriort om de orbitala fettkuddarna. Om melanomet sitter lateralt excideras hud och muskel ner till fascia. Såret kan lämnas öppet och ögat sluts tillfälligt med rikligt med ögonsalva och vid behov en suturtarsorafi, en salvkompress och ett tättslutande förband. Rekonstruktionen genomförs när radikal excision bekräftats med PAD.
Vid melanom in situ av typen lentigo maligna (LM) och lentigo maligna melanom (LMM) med stor utbredning kan i utvalda fall Buckybehandling respektive extern strålbehandling övervägas som primär behandling eller som tillägg till kirurgi i marginalsparande syfte. Behandlingen bör ske inom specialistvården (hudklinik eller onkologklinik) [180]. Stora och omfattande utbredningar av ögonnära LM, liksom fall med snäva histopatologiska marginaler, kan remitteras till hudläkare eller tas upp vid MDK för ställningstagande till primär eller postoperativ recidivprofylaktisk Buckybehandling[180]. I vissa fall kan även topikal behandling med imiquimod [181] övervägas.
Rekommendationer
- Marginalen bör mätas upp med linjal och tumören excideras vinkelrätt genom hela huden för tillräcklig marginal genom alla hudlager.
- Diagnostisk excision bör utföras med liten (2–5 mm) excisionsmarginal. Större primära excisioner än 5 mm påverkar påtagligt den utvidgade excisionens storlek och kan omöjliggöra primärsuturering.
- Vid utvidgad excision av invasiva melanom excideras all subkutan vävnad ner till fascia, perikondrium eller periost.
- De flesta utvidgade excisioner med 1 cm marginal kan göras i lokalanestesi som ett polikliniskt ingrepp.
- Vid såväl excisionsbiopsi som utvidgad excision bör patienten upplysas om eventuella komplikationer såsom sårinfektion, hematom, kantnekros, nedsatt hudsensibilitet och kosmetiskt störande ärr samt om att ytterligare kirurgi kan vara aktuell beroende på marginal.
- Patienter med melanom > 1,0 mm bör remitteras till en specialistklinik för ställningstagande till utvidgad excision med portvaktskörtelbiopsi.
Tabell 6. Kliniska med linjal uppmätta sidomarginaler som bör användas vid diagnostisk excision (excisionsbiopsi) respektive utvidgad excision.
|
Melanom (misstänkt, in situ och invasivt) |
Kliniska sidomarginaler |
|
Pigmenterad hudförändring, suspekt melanom |
Diagnostisk excision med 2–5 mm (radikal excision) |
|
In situ-melanom och dysplastiskt nevus med höggradig dysplasi, Spitz melanocytom (AST)*, STUMP* eller MELTUMP* |
5 mm (2 mm histopatologisk marginal) Vid LM 5–10 mm (2 mm histopatologisk marginal) |
|
Invasivt melanom, tumörtjocklek ≤ 2,0 mm |
10 mm vid utvidgad kirurgi. |
|
Invasivt melanom, tumörtjocklek > 2,0 mm |
20 mm vid utvidgad kirurgi. |
|
Invasivt melanom i huvud- och halsregionen > 2,0 mm |
10–20 mm (funktionell och ev. estetisk hänsyn) vid utvidgad kirurgi. |
|
Invasiva akrala lentiginösa och subunguala melanom (funktionell hänsyn ev. amputation) |
10–20 mm vid utvidgad kirurgi. |
|
Invasivt ögonnära melanom ≤ 1,0 mm. Invasivt ögonnära melanom > 1,0 mm. |
5 mm vid utvidgad kirurgi. 10 mm vid utvidgad kirurgi. |
*Kan med fördel diskuteras på MDK (se även avsnitt 9.1 Patologins roll i den diagnostiska processen och kapitel 10 Multidisciplinär konferens (MDK).
Portvaktskörtelbiopsi och lymfkörtelutrymning
Rekommendationer och evidens
- Patienten bör rekommenderas portvaktskörtelbiopsi oavsett lokal vid melanom > 1,0 mm (T2–T4) för bästa stadieindelning och prognostiska information. (++++)
- Diskutera noggrant fördelar och nackdelar med portvaktskörtelbiopsi med patienten samt utför åtgärden vid ett centrum med tillgång till specialister inom både kirurgi, nuklearmedicin och patologi.
- Vid metastaser i portvaktskörtlar rekommenderas inte kompletterande lymfkörtelutrymning. (++++)
- Om lymfkörtelutrymning inte har gjorts, rekommenderas uppföljning med klinisk kontroll samt ultraljud av den regionala lymfkörtelstationen var 6:e månad i 3 år. (+++)
- Misstänkt klinisk lymfkörtelmetastasering bör verifieras med cytologi.
- Före kirurgi av lymfkörtelmetastasering bör fjärrmetastasutredning med FDG-PET-DT (i andra hand DT) ske för att utesluta generaliserad sjukdom.
- Patienter med generaliserat melanom kan ibland bli aktuella för metastaskirurgi, men bör diskuteras på MDK inför ett sådant beslut.
- Registrering i IPÖ för melanom rekommenderas för patienter med konstaterat lokoregionalt återfall samt vid operation av lokoregionalt återfall Recidiv rapporteras via kvalitetsregistrets uppföljnings- och recidivformulär eller i IPÖ.
Portvaktskörteln
Portvaktskörteln är definitionsmässigt den första lymfkörteln som dränerar det hudområde där primärtumören sitter, och den är därför det bästa stället att selektivt leta efter metastasering [182]. Portvaktskörtelbiopsi kräver en skintigrafisk undersökning före operationen med injektion av kolloid som märkts med radioaktivt teknetium för visualisering av dränagevägar och lokalisation av portvaktskörteln. Detta är särskilt viktigt vid bålmelanom och huvud- och halsmelanom som kan ha flera alternativa dränagevägar. Vid huvud- och halsmelanom är SPECT (Single Photon Emission Computed Tomography), tillsammans med datortomografi (DT) indicerat, och det kan också adderas vid annan melanomlokalisation i de fall man inte har klart upptag vid dynamisk lymfskintigrafi.
Dessutom används en blå färg (Patent Blue V®) som injiceras på samma sätt som isotopen för att lättare identifiera portvaktskörtlar under operationen. Kombinationen av blå färg och teknetiuminmärkt kolloid rekommenderas.
Portvaktskörtlar definieras som de lymfkörtlar som är blåfärgade och de lymfkörtlar som är radioaktiva (där gränsen brukar anges som de lymfkörtlar med en radioaktivitet > 10 % av den mest radioaktiva lymfkörteln). De lymfkörtlar som är palpatoriskt eller visuellt starkt misstänkta för metastas bör också exstirperas för histopatologisk undersökning.
Se även avsnitt 11.3 Bilddiagnostik vid melanom.
Ett nära samarbete mellan kirurg, nuklearmedicinare och patolog krävs för att lyckas [8, 182]. En uppföljning av metodens introduktion i Sverige visar ett mycket varierat utfall lokalt som kan bero på felaktig skintigrafisk undersökning, oförmåga hos kirurgen att identifiera portvaktskörtlar eller bristande patologi [183]. Risken för överdiagnostik är liten, men kan bero på att benigna nevusceller, som uppges finnas i upp till 30 % av normala lymfkörtlar, misstolkas som infiltration av melanomceller [184]. Beroende på vilken radiokolloid som används kan tiden mellan skintigrafi och kirurgi spela roll, och en ny studie har visat en vinst med att göra skintigrafin samma dag som portvaktskörtelbiopsin, varför detta numera rekommenderas [185].
Portvaktskörtelbiopsi bör i största möjliga mån utföras i samma seans som den utvidgade excisionen. I de fall den primära diagnostiska excisionen kräver hudtransplantat eller hudlambå för täckning, pga. stor lesion eller lesion vid svår lokal, riskerar man ett förändrat lymfdränage från primärlokalen. För sådana patienter kan en biopsi för att verifiera melanomdiagnosen underlätta direkt definitiv åtgärd med utvidgad excision och portvaktskörtelbiopsi i samma seans.
Då portvaktskörtelbiopsi infördes hade man initialt svårare att uppnå likvärdiga resultat vid huvud- och halsmelanom. Det beror sannolikt på att dränagevägarna visar större variation i detta område och att portvaktskörteln ibland ligger i öronspottkörteln där försiktig dissektion krävs för att inte skada grenar av facialisnerven. För att underlätta den anatomiska lokalisationen av portvaktskörtlar i huvud- och halsregionen används även SPECT-DT, som ger en tredimensionell bild av radionuklidens fördelning [186]. Detta är viktigt på grund av varierande lymfdränage med multipla lymfkörtelstationer. Injektion av blå färg är inte obligatoriskt i huvud- och halsregionen, men kan framför allt vara av nytta vid lokalisation av portvaktskörtlar i parotis. Stora internationella rapporter har visat att resultaten inom huvud- och halsområdet nu är lika bra som för extremitets- och bålmelanom [187-190] och två svenska studier har bekräftat detta [191, 192].
Portvaktskörtelstatus är en stark prognostisk faktor med stort tilläggsvärde till tumörtjocklek [15, 193, 194]. Portvaktskörtelkirurgi medför i sig ingen överlevnadsvinst, men minskar risken för regionala återfall. Den ytterligare prognostiska informationen kan dock medföra andra uppföljningar och även postoperativ tilläggsbehandling, vilket kan påverka prognos. Portvaktskörtelkirurgi är ett minimalt kirurgiskt ingrepp, men nyttan måste alltid vägas mot vinsten hos exempelvis mycket gamla patienter eller patienter med avancerad komorbiditet [195].
Internationella riktlinjer anger att portvaktskörtelbiopsi rimligen bör erbjudas de subgrupper där omkring 5 % av patienterna kan förväntas ha en positiv portvaktskörtel. Det finns därför konsensus för att patienter med invasivt melanom > 1,0 mm (T2-melanom) bör rekommenderas portvaktskörtelbiopsi [195-197]. I Sverige rekommenderades tidigare även portvaktskörtelbiopsi vid tunna melanom med prognostiskt ogynnsamma karakteristika, såsom ulceration och/eller mitoser (motsvarande T1b-melanom enligt tidigare gällande AJCC 7). En genomgång av svenska data har dock inte tydligt kunnat identifiera en subgrupp bland tunna melanom (≤ 1,0 mm) med signifikant ökad risk för positiv portvaktskörtel [198]. Portvaktskörtelbiopsi rekommenderas således inte för tunna melanom tills vidare.
För de primära melanom där det konstateras mikrosatellitos eller satellitos vid histopatologisk undersökning av den diagnostiska excisionen rekommenderas som standard utvidgad excision och portvaktskörtelbiopsi för regional stadieindelning, trots att dessa patienter redan per definition är stadium III enligt AJCC 8. Dessa patienter är få och bör anmälas och diskuteras på MDK för definitiv utrednings- och behandlingsrekommendation [199, 200].
Två fas III-studier har publicerats som undersökt vinsten med att göra lymfkörtelutrymning vid positiv portvaktskörtel [139]. DeCOG-SLT-studien randomiserade 483 patienter med melanommetastas ≤ 1,0 mm i portvaktskörteln till antingen kompletterande lymfkörtelutrymning eller observation [201]. Vid lymfkörtelutrymning uppträdde färre regionala återfall (8,3 % respektive 14,6 %), men det fanns ingen skillnad i total eller melanomspecifik överlevnad efter 3 år. I MSLT-2-studien randomiserades 1 934 patienter med positiv portvaktskörtel till lymfkörtelutrymning (n = 967) eller observation med ultraljud (n = 967). Den melanomspecifika överlevnaden vid 3 år var 86 % i båda grupperna. Att avstå från lymfkörtelutrymning vid positiv portvaktskörtel har även undersökts retrospektivt i ett större internationellt material, och man såg här samma fynd som i MSLT-2, nämligen att det inte fanns någon vinst vad gäller överlevnad [202]. Tidigare rekommenderades att överväga kompletterande utrymning för patienter med högre risk för ytterligare körtelmetastaser i aktuell portvaktskörtellokal, exempelvis förekomst av extensiv periglandulär eller perikapsulär växt eller fler än tre positiva portvaktskörtlar. I en nyligen genomförd retrospektiv internationell studie har man dock inte kunnat påvisa någon överlevnadsvinst med kompletterande utrymning för dessa patienter med högriskprofil som inte uppfyllde kriterierna för att inkluderas i MSLT-2 studien (dvs. extrakapsulär växt, mikrosatellitos och/eller fler än 3 positiva portvaktskörtlar eller melanom i huvud-halsområdet), vilket stödjer ultraljudsuppföljning även för dessa patienter [203].
Sammanfattningsvis ger studierna stöd för att avstå från lymfkörtelutrymning vid positiv portvaktskörtel. De patienter som inte genomgår kompletterande körtelutrymning bör följas regelbundet med kliniska kontroller samt ultraljud av lokalen för portvaktskörteln var 6:e månad i 3 år. Alla patienter med positiv portvaktskörtel bör diskuteras på MDK.
Fjärrmetastasutredning före portvaktskörtelbiopsi rekommenderas generellt inte. Vid stadium III-sjukdom (≥ N1), före en eventuell lymfkörtelutrymning eller inför adjuvant systemisk onkologisk behandling rekommenderas dock radiologisk fjärrmetastasutredning. Se även avsnitt 11.2.3 Fjärrmetastasutredning.
Lymfkörtelutrymning
Patienter med cytologiverifierade lymfkörtelmetastaser (s.k. klinisk regional sjukdom) bör genomgå fjärrmetastasutredning. Om denna endast visar regional sjukdom bör lymfkörtelutrymning genomföras; exstirpation av enbart den misstänkta metastasen är ett otillräckligt kirurgiskt ingrepp [127, 204]. Om patienten tidigare opererats med portvaktskörtelbiopsi inkluderas om möjligt det gamla ärret efter det ingreppet vid lymfkörteldissektionen.
Vid halslymfkörtelmetastasering bör i första hand ett selektivt ingrepp göras [205]. Vilka och hur många halslymfkörtelstationer (regioner) som omfattas beror på lokalisation och antal patologiska lymfkörtlar. Man bör ange vilka regioner som utrymts och vilka anatomiska strukturer som sparats [206]. Undvik om möjligt en klassisk ”radical neck dissection” (där n. accessorius, v. jugularis externa och m. sternocleidomastoideus avlägsnas tillsammans med lymfkörtlar och fett), om inte metastasbördan och växtsättet indicerar detta.
Vid axillutrymning bör utrymningen omfatta nivå I–III. Dissektion medialt om mediala randen av musculus pectoralis minor garanterar att man nått upp i nivå III. En nyligen publicerad studie visade att ingen av patienterna som genomgick utrymning till följd av en positiv portvaktskörtel hade patologiska körtlar i nivå III, medan 17 % av patienterna som opererades pga. klinisk metastas hade patologiska körtlar i nivå III [207].
En inguinal lymfkörtelutrymning rekommenderas vid körtelmetastaser i ljumsken. Inguinal lymfkörtelutrymning innebär att avlägsna all vävnad med samtliga lymfkörtlar i trigonum inguinale (femorale) plus lymfkörtlar utefter proximala vena saphena magna, upp mot pubis och övre delen av den ytliga aponeurosen för musculus obliquus externus. PET-DT (positronemissionstomografi med DT) rekommenderas för bedömning av om de iliakala lymfkörtlarna bör tas med i utrymningen. Om PET-DT talar emot spridning behöver inte ingreppet utökas med en iliakal utrymning, eftersom detta bedöms öka risken för sårkomplikationer och lymfödem i benet.
Fjärrmetastasutredning
Patienter med lymfkörtelmetastas (både kliniskt upptäckt och vid positiv portvaktskörtel) bör genomgå fjärrmetastasutredning innan en eventuell lymfkörtelutrymning genomförs. Utredningen bör ske med helkropps-PET-DT med intravenös kontrastförstärkning omfattande området från hjässan till och med låren. Undersökningen bör inkludera benen om primärtumören var lokaliserad på nedre extremiteterna eller om det finns klinisk misstanke om spridning dit. Vid önskad kartläggning av eventuell metastasering till hjärnan krävs en separat DT hjärna, alternativt magnetresonanstomografi (MRT) hjärna som är en känsligare undersökning. För att fånga upp specifika lungfrågeställningar kan DT torax i inandat läge även utföras i samband med PET-DT. Som alternativ till fjärrmetastasutredning kan DT torax-buk, DT huvud-hals och DT hjärna utföras före lymfkörtelutrymningen.
Om patienten har generaliserad sjukdom bör patienten diskuteras på MDK för ställningstagande till systemisk behandling, och lymfkörtelutrymning behöver då inte genomföras.
Bilddiagnostik vid melanom
Vid malignt melanom görs en radiologisk utredning för att:
- kartlägga lymfatiskt avflöde från tumörområdet och identifiera portvaktskörteln
- påvisa metastasering till regionala lymfkörtlar
- påvisa fjärrmetastasering och synkrona tumörer
- upptäcka och kartlägga primärtumören där tumören inte är primärt exciderad eller tumörlokalisationen är okänd: dess storlek, läge, utbredning och infiltration i omgivande strukturer.
Metoderna för detta är portvaktskörtelskintigrafi, (DT), PET-DT, MRT och ultraljud.
Portvaktskörtelskintigrafi
Portvaktskörtelskintigrafi kartlägger lymfatiskt avflöde från tumörområdet och bör erbjudas patienter med invasivt melanom > 1,0 mm.
Portvaktskörteln är definitionsmässigt den första lymfkörteln som dränerar det hudområde där primärtumören sitter, och den är därför bästa stället att selektivt leta efter metastasering. Metoden innebär injektion av kolloid som märkts med radioaktivt teknetium för visualisering av dränagevägar och lokalisation av portvaktskörteln. Dessutom används en blå färg (Patent Blue V®) som injiceras på samma sätt som isotopen för att lättare identifiera portvaktskörteln under operationen. Kombinationen av blå färg och teknetiuminmärkt kolloid rekommenderas. Det är särskilt viktigt vid bålmelanom som kan ha flera alternativa dränagevägar.
Portvaktskörtlar definieras som de körtlar som är blåfärgade och de körtlar som är radioaktiva (där gränsen brukar anges som de lymfkörtlar med en radioaktivitet > 10 % av den mest radioaktiva körteln).
För säkrare anatomisk lokalisation av portvaktskörtlar i huvud- och halsregionen, och vid behov även på andra lokaler, används avbildning med SPECT, tillsammans med DT, som ger en anatomisk korrelation till teknetium-kolloidens fördelning. Detta är viktigt på grund av varierande lymfdränage med multipla lymfkörtelstationer. Injektion av blå färg är inte obligatoriskt i huvud- och halsregionen, men kan framför allt vara av nytta vid lokalisation av portvaktskörtlar i parotis.
Portvaktskörtelstatus är en stark prognostisk faktor med stort tilläggsvärde till tumörtjocklek.
Portvaktskörtelskintigrafi har följande fördelar:
- Metoden finns på många sjukhus och är oftast tillgänglig
- Metoden kartlägger lymfatiskt avflöde från tumörområdet
- Portvaktskörtelstatus är en stark prognostisk faktor med stort tilläggsvärde till tumörtjocklek
- Risken för klaustrofobi är minimal
- Pacemaker, nervstimulatorer m.m. utgör ingen kontraindikation.
Portvaktskörtelskintigrafi har följande nackdelar:
- Patienten utsätts för joniserande strålning.
- Undersökningen kartlägger lymfatisk avflödesväg, men ger i sig ingen information om tumörspridning. Detta kräver histopatologisk analys av bortopererade lymfkörtlar.
Datortomografi (DT)
Datortomografi är en datoruträknad röntgenbild som med modern multidetektorteknik ger bilder i valfria plan med valbar tjocklek av snitt. Den görs med intravenös kontrastmedelstillförsel och är en metod som snabbt avbildar stora delar av kroppen och kan påvisa klinisk ockult regional metastasering och/eller fjärrmetastasering.
En bildtagning räcker, som efteråt rekonstrueras till nya bilder i tre vinkelräta plan med valfri (oftast 2–3 mm) snittjocklek. Vid önskad kartläggning av eventuell metastasering till hjärnan krävs en separat undersökning med DT hjärna, planerad och utförd utifrån frågeställningen. DT hjärna kan också utföras tillsammans med DT torax-buk i samma undersökningssession.
DT har följande fördelar:
- Metoden finns på alla sjukhus, och den är oftast, till skillnad från PET-DT, tillgänglig snabbt och till ett relativt lågt pris.
- Hela kroppen kan avbildas vid samma undersökning.
- Bildtagningen går snabbare än vid PET-DT och MRT, vilket är en stor fördel för att undvika rörelseoskärpa.
- DT-tunneln är kortare och öppnare än vid PET-DT och MRT, vilket ger minimal risk för klaustrofobi.
- Pacemaker, nervstimulatorer m.m. utgör ingen kontraindikation, till skillnad från vid MRT.
- DT ger låg kostnad för avbildning.
DT har följande nackdelar:
- Patienten utsätts för joniserande strålning.
- Patienten får intravenöst kontrastmedel, som belastar njurarna.
- Tandfyllningar och annan metall i kroppen ger utbredda skymmande artefakter.
- Vävnadskontrasten är oftast något sämre än vid MRT. Välj därför MRT vid kartläggning av perineural eller intrakraniell tumörväxt.
- DT har sämre sensitivitet än PET-DT för att påvisa metastasering.
PET-DT
Metoden kombinerar positronemissionstomografi (PET) med DT och är en helkroppsundersökning. En positronemitterande radionuklid, fluor-18 (18F) med 110 minuters halveringstid, konjugeras med druvsockeranalogen deoxyglukos till fluorodeoxyglukos (FDG), vars metabolism man vill studera. Vävnadsupptaget beror på den höga metabola aktiviteten i tumörcellerna, men upptaget är inte tumörspecifikt, och även inflammatoriska förändringar och infektioner uppvisar FDG-upptag. PET avbildar FDG-fördelningen i kroppen, medan samtidig DT med diagnostisk kvalitet lokaliserar FDG-upptag och diagnostiserar och differentierar tumörvävnad från fysiologiska metabola fynd. DT i samband med PET ska optimalt utföras med intravenös kontrastförstärkning, men kan utföras med icke kontrastförstärkt lågdosprotokoll om det finns en aktuell (senaste veckorna) DT av hals-torax-buk med intravenös kontrastförstärkning.
PET-DT kombinerar således både funktionell och anatomisk information. Metoden kan därför med hög känslighet identifiera tumörer, metastaser och återfall. Inflammatoriska förändringar som uppstår efter kirurgi eller strålbehandling, eller av annan icke-tumörrelaterad orsak, kan emellertid ibland leda till falskt positiva eller falskt negativa fynd på PET-DT. Därför bör PET-DT helst utföras cirka 8–10 veckor efter utfört ingrepp. Om inte tidigare undersökning går att undvika, informera noggrant i remissens anamnestext vilken typ av ingrepp som blev utfört och när det utfördes för att undvika feltolkning. Vid uppföljning av patienter som är behandlade med immunterapi kan behandlingsorsakad inflammation ge upphov till ökat FDG-upptag i tumörförändringar och lätt storleksökning som kan betingas av inflammatoriska tillstånd eller representera pseudoprogress. Det är viktigt att fall med misstanke om inflammatorisk förändring eller pseudoprogress identifieras och följs upp vid MDK.
PET-DT har följande fördelar:
- PET-DT kan användas vid klinisk metastasmisstanke, för identifiering av okänd primärtumör och som behandlingskontroll.
- PET-DT kan användas för att stadieindela högrisktumörer.
- PET-DT kan användas för att utesluta eller konstatera generaliserad sjukdom hos patienter med positiv portvaktskörtel före kirurgi av körtelmetastasering för att utesluta generaliserad sjukdom.
- PET-DT har hög sensitivitet och högt negativt prediktivt värde.
PET-DT har följande nackdelar:
- Patienten får en extra hög stråldos eftersom positronstrålande isotop används utöver röntgenstrålning.
- Man tillför intravenöst kontrastmedel, som belastar njurarna.
- Positronstrålande isotoper är kortlivade, vilket gör att PET-DT kräver mycket logistik och därför inte är tillgänglig överallt.
- PET-DT är inte användbart för att bedöma tumörspridning till hjärnan pga. hjärnans höga glukosmetabolism. Här krävs kontrastförstärkt DT eller MRT.
- PET-DT kan ibland leda till kompletterande undersökningar pga. falskt positiva fynd.
- Mycket små eller nekrotiska metastaser är svårvärderade och kan leda till falskt negativa fynd.
- PET-DT ger högre kostnad för avbildning än DT och MRT.
Magnetisk resonanstomografi (MRT)
Magnetisk resonanstomografi är en undersökning som utförs i en stor (statisk) elektromagnet, i vilken spolar genererar temporära mindre fält. Metoden avbildar hur väteatomkärnor rör sig i de starka magnetfälten när de stimuleras av radiovågor.
MRT har följande fördelar:
- MRT kan användas som behandlingskontroll vid hjärnmetastasering.
- MRT ger mycket bra bildkontrast i mjukdelar och är därför bästa metod för att avbilda perineural tumörväxt, engagemang av hjärnhinnor och skallbasen och tumörutbredning i slemhinnorna samt för att påvisa återfall i tidigare opererade vävnad.
- Bedömningen av halsens lymfkörtelstationer kan utföras med MRT, särskilt hos unga, och om samtidigt avbildning av primär tumörutbredning i huvud- och halsregionen eftersträvas.
- Metalltandlagningar och tandimplantat ger vid MRT mindre utbredda artefakter än vid DT.
- Metoden ger ingen joniserande strålning till patienten.
MRT har följande nackdelar:
- MRT är mer tidskrävande än DT. Detta gör att t.ex. andning, sväljning och pulsationer kan ge rörelseartefakter, särskilt om undersökningsområdet är stort.
- MRT är inte en lämplig metod för att upptäcka lungmetastaser.
- MRT-tunneln är lång och trång; vissa patienter får en känsla av klaustrofobi.
- Pacemaker, cochleaimplantat, medicinpumpar m.m. kan utgöra kontraindikation mot MRT. För detaljer om MRT-säkerhet och olika implantat hänvisas till webbplatsen mrisafety.com av Frank Shellock.
- MRT ger högre kostnad för avbildning än DT men lägre än PET-DT.
Ultraljud
Ultraljud används för att följa patienter med positiv portvaktskörtel som inte genomgått körtelutrymning. Vid ultraljudsdiagnostik bör bedömning ske av lymfkörtelns form, arkitektur, storlek och ekogenicitet. Rund form, icke bevarad fetthilus och hypoekogenicitet ökar risken för metastasering. Lymfkörtelns storlek bör värderas i förhållande till lokalisation och övriga karakteristika. Exempelvis inger en 1,5 cm stor ljumsklymfkörtel med oval form, bevarad fetthilus och ordinär ekogenicitet låg sannolikhet för metastasering, jämfört med en 7 mm stor lågekogen, rund lymfkörtel utan bevarad fetthilus som är malignitetssuspekt. Storleksökning är ett observandum men bör värderas tillsammans med andra beskrivna karakteristika. Ultraljud är en säker, snabb och billig metod för vägledning vid biopsi av metastaser. Biopsi bör utföras efter granskning av tidigare DT eller PET-DT och planeras utifrån denna.
Ultraljud har följande fördelar:
- Ultraljud kan identifiera subkliniska metastaser i lymfkörtlar, även om sensitiviteten är låg.
- Ultraljud med intravenöst kontrastmedel kan göra det lättare att karakterisera metastasmisstänkta förändringar i parenkymatösa organ och ger möjlighet att vägleda biopsi av dessa.
- Ingen joniserande strålning används.
- Ultraljud ger låg kostnad för avbildning.
Ultraljud har följande nackdelar:
- Ultraljud avbildar ett begränsat område.
- Ultraljud är inte en lämplig metod för att upptäcka lungmetastaser.
Viktigt att notera om kontrastmedel
För detaljer om användning av kontrastmedel hänvisas till Svensk Förening för Medicinsk Radiologi: slf.se/sfmr.
Följande är viktigt att notera:
- Både jodkontrastmedel vid DT och gadoliniumkontrastmedel (Gd) vid MRT kan påverka njurfunktionen negativt. Vid skattad glomerulär filtrationshastighet (GFR) < 45 ml/min. eller andra multipla riskfaktorer för kontrastmedelsnefropati (KMN) bör man försöka undvika att utföra undersökningar samma dag. Om man vill utvärdera eventuell KMN och njurfunktionsnedsättning av en undersökning måste man vänta minst 2 dagar för förnyad kreatininprovtagning.
- Vid skattat GFR ≥ 60 ml/min. och inga andra riskfaktorer för KMN kan undersökningar med jod- och Gd-kontrastmedel utföras samma dag. Vid sena kontrastmedelsreaktioner blir det dock svårare att bedöma vilket kontrastmedel patienten kan ha reagerat emot.
- Vid kraftigt nedsatt njurfunktion GFR <30 ml/min. bör intravenös kontrastförstärkning helt undvikas vid DT eller PET-DT för att inte ytterligare skada njurarna. Vid GFR 30–45 ml/min. bör en individuell nytta-riskbedömning göras, och vid beslut om intravenös kontrastförstärkning behöver oftast kontrastmedelsmängden reduceras.
- Tillförsel av Gd-kontrastmedel vid nedsatt njurfunktion kan leda till den sällsynta men allvarliga komplikationen nefrogen systemisk fibros.
- Ange på remissen om patienten har nedsatt njurfunktion, diabetes, metforminbehandling eller kontrastmedelsallergi.
- Vid kontraindikation mot intravenöst kontrastmedel på DT och MRT, kan en MRT-undersökning utan intravenöst kontrastmedel ofta upptäcka tumör bättre än DT.
- DT-kontrastmedel bör inte ges vid misstänkt tyreoideacancer där behandling med radioaktiv jod kan komma i fråga.
Behandling vid lokoregionalt återfall
Rekommendationer och evidens
- Lokalt återfall efter icke-radikal primäroperation bör excideras enligt riktlinjerna för primärt melanom. (+/++)
- Lokalt återfall efter primäroperation med adekvata excisionsmarginaler bör endast excideras med histopatologiskt fria marginaler. (+/++)
- Kirurgi efter ett strikt lokalt återfall bör kombineras med portvaktskörtelbiopsi om detta inte gjordes i samband med den primära operationen. (+/++)
- Vid återfall eller kliniskt upptäckt regional körtelmetastasering rekommenderas neoadjuvant behandling följt av lymfkörtelutrymning efter utredning av fjärrmetastasering. (+++)
- Enstaka in transit-metastaser eller satellitmetastaser bör excideras med endast histopatologiskt fria marginaler. (+/++)
- Återfall med multipla eller snabbt växande in transit-metastaser på extremiteter bör i första hand behandlas med isolerad hyperterm perfusion. (+++)
- Vid inoperabla in transit-metastaser kan systemisk och/eller lokoregional behandling ges. (+\++)
- Registrering i IPÖ för melanom rekommenderas för patienter med konstaterat lokoregionalt återfall samt vid operation av lokoregionalt återfall Recidiv rapporteras via kvalitetsregistrets uppföljnings- och recidivformulär eller i IPÖ.
Lokala återfall förekommer hos ett par procent av alla patienter med melanom, och frekvensen ökar med tjockleken på den primära tumören. Man bör skilja mellan lokala återfall som beror på att primärtumören inte exciderats radikalt och de återfall som kommer trots adekvata marginaler vid utvidgad excision [208]. De senare (satellit- eller in transit-metastaser) beror på lymfogen spridning med en betydande negativ inverkan på överlevnaden [209-211].
Återfall i det primära ärrområdet
Återfall i ärrvävnaden efter inadekvat initial excision beror oftast på kvarvarande tumör efter den primära resektionen. Vanligtvis är huden i direkt anslutning till ärret engagerad. Samma rekommendationer som vid primärexcision bör följas om det är ett strikt lokalt återfall i ärrvävnaden. Återfallet klassificeras som stadium II-sjukdom [204] om fjärrmetastasutredningen enligt nedan utfaller negativ. Portvaktskörtelbiopsi kan övervägas om detta inte genomförts vid den primära operationen [212]. Återfallet klassas som en satellit- eller in transit-metastas om det finns ett avstånd med vanlig hud mellan ärret och återfallet. Återfall som bedöms som satellit- eller in transit-metastaser, se avsnitt 11.4.2 Satellitmetastaser och in transit-metastaser, klassificeras som stadium III-sjukdom om fjärrmetastasutredningen utfaller negativ.
Patienterna bör genomgå fjärrmetastasutredning med FDG-PET-DT (alternativt DT) enligt avsnitt 11.2.3 Fjärrmetastasutredning före en eventuell operation.
Satellitmetastaser och in transit-metastaser
Definitionsmässigt är satellitmetastaser lymfogena metastaser inom en radie på 2 cm från den primära tumören (ärret), och in transit-metastaser finns > 2 cm från den primära tumören [213]. Det finns dock ingen skillnad i prognos eller behandling, och båda tillstånden brukar numera därför klassificeras som in transit-metastaser och klassificeras som stadium III-sjukdom [209]. Patienterna bör genomgå fjärrmetastasutredning med FDG-PET-DT (alternativt DT) enligt avsnitt 11.2.3 Fjärrmetastasutredning före eventuell operation för att utesluta generaliserad sjukdom [204]. Behandlingens mål är lokoregional kontroll av sjukdomen, och radikal excision med histopatologiskt fria marginaler är det bästa sättet att hantera enstaka återfall [214]. Det finns inga belägg för att vida marginaler har betydelse. Portvaktskörtelbiopsi kan övervägas om detta inte gjorts tidigare [215].
Vid multipla eller frekventa återfall av in transit-metastaser bör patienten utredas för regional körtelmetastasering och fjärrmetastaser enligt avsnitt 11.2.3 Fjärrmetastasutredning. Återfallens lokalisation har betydelse för hur de bör hanteras. Vid lokalisation till extremiteter rekommenderas isolerad hyperterm perfusion (ILP) (se nedan). Behandlingen av utbredda och snabbt progredierande in transit-metastaser utanför extremiteterna är svår och måste individualiseras och diskuteras på MDK. Behandlingen omfattar i första hand systemisk behandling [214] alternativt lokala behandlingar, såsom strålbehandling [127], elektrokemoterapi [216] eller nya intratumorala injektioner med onkolytiskt virus (T-VEC) [217]. Se även avsnitt 12.3 Systemisk behandling vid spridd, icke-operabel sjukdom och kapitel 12 Systemisk behandling.
Lymfkörtelåterfall
Patienter som tidigare opererats för melanom bör alltid misstänkas ha körtelmetastaser om en patologiskt förstorad körtel upptäcks vid ett kontrollbesök. Utredning bör i första hand ske med finnålsbiopsi för att bekräfta diagnosen. En ultraljudsledd mellannålsbiopsi bör utföras om inte finnålspunktion ger diagnosen. Skulle man trots dessa åtgärder inte ha nått diagnos, men ändå misstänker metastas, kan man göra en kirurgisk biopsi. Snittföringen måste vara sådan att den inte påverkar möjligheterna till radikal utrymning av körtelstationen ”en bloc” [127, 214]. Kirurgisk biopsi tycks öka risken för nya återfall i operationsområdet och bör således helst undvikas [218].
Exstirpation av enbart den misstänkta metastasen är ett otillräckligt kirurgiskt ingrepp. Patienterna ska diskuteras på MDK avseende neoadjuvant behandling och patienten ska därefter genomgå lymfkörtelutrymning [127, 204]. Om patienten tidigare har opererats med lymfkörtelutrymning bör återfallet om möjligt excideras radikalt [204, 214].
Isolerad hyperterm perfusion (isolated limb perfusion, ILP)
Isolerad hyperterm perfusion (isolated limb perfusion, ILP) med melfalan (ett cytostatikum) är standardbehandling vid in transit-metastaser och satellitmetastaser på extremiteter [127, 204, 214]. Behandlingen ger objektiv respons hos cirka 90 % av patienterna, och komplett remission hos cirka 60 % [219]. Återfall efter tidigare ILP kan behandlas med ny ILP, och förväntad respons är väsentligen densamma som vid första behandlingen [220]. Tillägg av tumörnekrosfaktor alfa (TNF-alfa) till melfalan vid primär ILP ger inte högre respons eller längre behandlingssvar jämfört med enbart melfalan. Dock finns viss evidens för att TNF-alfa ger högre respons vid perfusion av stora tumörer (> 3 cm) och behandling av återfall efter tidigare ILP [214].
Vid radikalt exciderat förstagångsåterfall av in transit-metastaser har en prospektiv randomiserad studie visat en förlängd tid till lokalt återfall med tillägg av ILP som adjuvant behandling (sjukdomsfri överlevnad 10 jämfört med 17 månader), men ingen skillnad i total överlevnad [221]. Profylaktisk ILP vid högriskmelanom har i en randomiserad studie inte visat någon effekt på sjukdomsförloppet [222]. Adjuvant ILP rekommenderas därför inte som rutin, men kan övervägas vid täta återfall där den senaste excisionen exempelvis inte varit radikal.
ILP ger god palliation i form av lokal sjukdomskontroll, men förlänger inte överlevnaden vid återfall av extremitetsmelanom [214]. ILP har låg komplikationsfrekvens om den utförs vid centrum som är specialiserade på behandlingen [214, 223]. I Sverige är behandlingen centraliserad till Sahlgrenska Universitetssjukhuset i Göteborg.
Isolerad hyperterm infusion (isolated limb infusion, ILI) är ett annat och enklare sätt att ge regional cytostatikabehandling. Inga randomiserade studier har jämfört ILI med ILP. En studie som jämfört två större material visar en lägre respons för ILI men med samma typ av toxicitet. Således rekommenderas i första hand ILP.
Patienterna bör genomgå fjärrmetastasutredning med FDG-PET-DT (alternativt DT) enligt avsnitt 11.2.3 Fjärrmetastasutredning före en eventuell behandling med ILP.
