Utredning – diagnostik och tumörutbredning
Rekommendationer
- Vid lungcancer ses ofta ospecifika symtom. Hos patient med nytillkomna luftvägssymtom (t.ex. hosta eller andnöd) med en varaktighet av 6 veckor, särskilt hos rökare eller före detta rökare över 40 år, bröst- eller skuldersmärta utan annan förklaring eller blodig hosta, skall radiologisk undersökning av lungorna, i första hand DT, utföras frikostigt.
- Aldrig-rökare kan drabbas av lungcancer varför oklara luftvägssymtom även i denna grupp ska föranleda radiologisk undersökning.
- Enligt standardiserat vårdförlopp (SVF) föreligger välgrundad misstanke (VGM) om lungcancer vid något av följande: radiologisk misstanke om lungcancer, metastasfynd som ger misstanke om lungcancer, upprepad blodig hosta utan annan uppenbar orsak, obstruktion av vena cava superior eller recurrenspares.
- Vid VGM om lungcancer ska utredningen ske enligt riktlinjer för SVF och anpassas till patientens ålder och allmäntillstånd samt till den behandling som kan bli aktuell.
- Enligt SVF lungcancer ska ledtiden från VGM till operation eller strålbehandling vara < 44 dagar för 80 % av patienterna. Tid från VGM till start av läkemedelsbehandling ska vara < 40 dagar, och tid från VGM till start av icke tumörspecifik behandling (best supportive care) skall vara < 30 dagar.
- Om kurativ behandling kan bli aktuell är utredningens syfte att fastställa diagnos, tumörutbredning (stadium) och funktionsstatus.
- Om palliativ behandling kan bli aktuell är utredningens syfte att fastställa diagnos inklusive molekylärpatologisk typning, tumörutbredning (stadium) och performance status.
- PET-DT för påvisande av tumörutbredning är grundläggande undersökningar vid kurativ inriktning på utredningen.
- DT torax + övre buk görs för att påvisa tumörutbredning vid palliativ inriktning på utredningen.
- DT eller MRT hjärna bör göras vid lokalt avancerad sjukdom (Stadium III) och vid positiva behandlingsprediktiva mutationer och re-arrangemang även om CNS symtom ej föreligger.
- Provtagning av tumörmisstänkt förändring utförs oftast via bronkoskopi med EBUS alternativt DT-ledd punktion.
- Mediastinal provtagning bör i första hand ske med EBUS-TBNA (Endobronkiellt ultraljud-transbronkiell nålbiopsi), ev. i kombination med EUS-FNA (Endoskopiskt ultraljud med finnålspunktion).
- Inför ställningstagande till kirurgi rekommenderas noggrann bedömning av kardiellt och pulmonellt status inklusive bedömning av samsjuklighet.
- Lungfunktionsundersökning inklusive DLCO bör bestämmas inför beslut om kirurgi. Om FEV1- och DLCO-värden är > 80 % och ingen övrig samsjuklighet finns behöver ingen ytterligare preoperativ funktionsutredning utföras. Om FEV1 eller DLCO är < 80 % bör ytterligare funktionsutredning utföras.
- Alla patienter med nydiagnostiserad lungcancer bör diskuteras på MDK för behandlingsrekommendation.
- När patienten påbörjar en lungcancerutredning ska patienten tilldelas en kontaktsjuksköterska och en individuell vårdplan upprättas.
Utredning enligt standardiserat vårdförlopp (SVF)
I oktober 2015 togs ett nationellt beslut om att utredning av misstänkt lungcancer ska ske enligt ett standardiserat vårdförlopp (SVF). Se även www.cancercentrum.se. Våren 2016 implementerades SVF för lungcancer i hela landet. Enligt SVF ska följande föranleda misstanke om lungcancer och patienten remitteras till radiologisk undersökning av lungorna:
- nytillkomna luftvägssymtom (t.ex. hosta eller andnöd) med en varaktighet av 6 veckor hos rökare eller före detta rökare över 40 år
- bröst- eller skuldersmärta utan annan förklaring
- blodig hosta.
Eftersom patienter med lungcancer ofta har allvarliga ospecifika symtom kan även andra symtom väcka misstanke. (se även kapitel 7 Symtom och kliniska fynd) Generellt rekommenderas en låg tröskel för att utföra radiologiska undersökningar av lungorna vid oklara luftvägsbesvär, särskilt när ingen annan förklaring till symtomen föreligger. Risken för lungcancer är högre hos rökare och före detta rökare, men det är viktigt att komma ihåg att även personer som aldrig har rökt kan drabbas av sjukdomen. Rekommendationen om radiologisk undersökning vid oklara luftvägsbesvär, om någon annan förklaring till symtomen ej föreligger, gäller således alla patienter oavsett rökanamnes, detta för att om möjligt upptäcka lungcancer i ett tidigt skede.
Val av undersökningsmetod vid misstanke om lungcancer:
- Datortomografi (DT): Vid misstanke om lungcancer, även vid låg misstankegrad, bör en DT-undersökning utföras i första hand. Detta då små tumörer ofta inte ger symtom och att lungröntgen har låg sensitivitet för att upptäcka lungcancer i tidiga stadier [54]. Vid hög klinisk misstanke om lungcancer rekommenderas DT som förstahandsval.
- Lungröntgen: Lungröntgen används ofta på många andra frågeställningar som t ex pneumoni, pleuravätska eller pneumothorax och kan övervägas som ett första steg vid misstanke om lungcancer. Dock bör man vara medveten om att en negativ lungröntgen inte utesluter lungcancer och kan fördröja diagnosen avsevärt [55].
Radiologiska undersökningar spelar en viktig roll som filterfunktion för att identifiera patienter som behöver vidare utredning inom SVF.
Välgrundad misstanke (VGM) föreligger om något av kriterierna i tabell 9.2 är uppfyllda.
Tabell 9.2. Kriterier för välgrundad misstanke (om ett eller flera föreligger)
|
Bilddiagnostik som ger misstanke om lungcancer |
|
Metastasfynd som ger misstanke om lungcancer |
|
Upprepad blodig hosta utan annan uppenbar orsak, även vid normal röntgen |
|
Obstruktion av vena cava superior |
|
Recurrenspares |
Vid VGM för lungcancer föreligger, ska patienten omgående remitteras till en lungmedicinsk enhet för vidare utredning. I remissen ska finnas relevant information (se tabell 9.3).
Den som remitterar ska informera patienten om att
- det finns anledning att utreda cancermisstanke enligt standardiserat vårdförlopp
- det första steget i utredningen är en expertgranskning där man fattar beslut om fortsatt utredning
- cancermisstanken eventuellt kan komma att avskrivas utan att patienten blir kallad till utredning
- patienten kan komma att kallas till utredning snabbt och därför bör vara tillgänglig på telefon, och att sjukvården ofta ringer från dolt nummer.
Patienten ska också få veta
- vem som informerar patienten vid avskriven misstanke
- vad ett standardiserat vårdförlopp innebär och vad som händer i den inledande fasen
- vilka väntetider patienten kan förvänta sig.
Den som ger informationen ska så långt som möjligt försäkra sig om att patienten har förstått innehållet i, och betydelsen av, informationen. Informationen ska ges vid ett fysiskt möte om man inte kommit överens om annat. Informationen ska helst ges både muntligen och skriftligen. Patientinformationsbroschyr om SVF i allmänhet finns på flera språk och är tillgängligt på cancercentrums hemsida.
Tabell 9.3. Information i remissen till utredning av misstänkt lungcancer
|
Anamnes |
Vad som ligger till grund för välgrundad misstanke |
|
Genomförd utredning när remissen skrivs |
|
|
Rökanamnes |
|
|
Social situation och ev. språkhinder eller funktionsnedsättning |
|
|
Annan sjukdom som kan påverka utredning |
|
|
Allmäntillstånd (performance status) |
|
|
Aktuella symtom |
|
|
Om patienten står på antikoagulantia eller trombocythämmare. |
|
|
Uppgift om diabetes, hur välkontrollerad denna är och om patienten står på metformin (B-Glc måste vara < 10 för att PET-DT ska kunna göras). |
|
|
Aktuell längd, vikt och kreatininhalt |
|
|
Om patienten bedöms klara en poliklinisk utredning |
|
|
Tillgång till röntgenbilder |
Uppgift om var tidigare röntgenundersökningar utförts |
|
Kontaktuppgifter till patient |
Adress och telefonnummer |
Ledtid från VGM till operation eller strålbehandling skall vara < 44 dagar för 80 % av patienterna. Tid från VGM till start av läkemedelsbehandling ska vara < 40 dagar, och tid från VGM till start av icke tumörspecifik behandling (best supportive care) skall vara < 30 dagar. När patienten påbörjar en lungcancerutredning ska patienten tilldelas en kontaktsjuksköterska. Kontaktsjuksköterskan ska arbeta enligt en nationell arbetsbeskrivning, vilket bl.a. innebär att ansvara för att Min vårdplan upprättas och uppdateras samt för aktiva överlämningar. Kontaktsjuksköterskan kan närvara vid behandlingsbeslutet om patienten så önskar. Kontaktsjuksköterskan ska vid behov kunna förmedla kontakt med kurator eller annan rehabiliteringskompetens utifrån patientens behov, t.ex. kontakt med dietist eller stöd för rökavvänjning. När välgrundad misstanke om lungcancer föreligger ska utredningen ske enligt SVF – se figur 9.1 och tabell 9.4.
Figur 9.1 Utredningsförlopp SVF lungcancer

Tabell 9.4. Utredningsförlopp enligt SVF
|
Block A |
Block B |
|
Strukturerad remiss- och bildgranskning med planering av utredning |
Anamnes och klinisk undersökning, inkl. värdering av allmäntillstånd och samsjuklighet Spirometri och ev. CO-diff Blodprover Patienten tilldelas kontaktsjuksköterska Strukturerad bedömning av rehabiliteringsbehov inklusive levnadsvanor enl. vårdprogram |
|
Block C |
Block D |
|
Kurativ intention: PET-DT
Ej kurativ intention: DT thorax-övre buk |
För diagnos:
Inkl. morfologisk och molekylärpatologisk diagnostik enligt nationellt vårdprogram. För mediastinal staging:
|
|
Block E |
Block F |
|
Riktad undersökning, t.ex. annan bilddiagnostik eller punktion av metastas |
Utökad funktionsundersökning, t.ex. ergospirometri, regional lungfunktion, arbets-EKG, kardiologbedömning |
|
Block G |
Block H |
|
DT hjärna eller MR hjärna |
MDK |
Tabell 9.5. Utredningsförlopp enligt SVF, fortsättning
|
Resultat av Block A |
Åtgärd |
|
Misstanke om lungcancer kvarstår |
Block B, C samt D och/eller E utförs |
|
Misstanke om diagnos som inte omfattas av det standardiserade vårdförloppet, eller ingen diagnos |
Det standardiserade vårdförloppet avslutas och patienten remitteras eventuellt till relevant enhet för utredning. Besked om detta kan lämnas av inremitterande. |
|
Resultat av Block B, C och D/E |
Åtgärd |
|
Kurativ intention kvarstår men spirometri och CO-diff ger inte tillräcklig information om behandlingsrisk |
Block F utförs |
|
Kurativt syftande radio-kemoterapi kan vara aktuell |
Block G utförs |
|
Misstanke om diagnos som inte omfattas av det standardiserade vårdförloppet, eller ingen diagnos |
Det standardiserade vårdförloppet avslutas och patienten remitteras till relevant enhet för utredning |
|
Efter erforderliga undersökningar |
Åtgärd |
|
Tillräckligt underlag finns för behandlingsbeslut |
Block H utförs |
Anamnes
Korrekt bedömning förutsätter en noggrann anamnes med särskilt fokus på tobaksanamnes, yrkesanamnes, hereditet, samsjuklighet och symtombild.
Tobaksanamnes bör innehålla uppgifter om debutålder för rökning, tobakskonsumtion och tidpunkt för eventuellt rökstopp. Sammanlagd rökexponering kan anges i paketår: genomsnittligt antal cigaretter per dag/20 x antal rökår. Alla aktiva rökare bör rekommenderas rökstopp och erbjudas kontakt med en tobakspreventiv mottagning.
Yrkesanamnes bör omfatta eventuell exponering för asbest där risken att utsättas för asbest framförallt finns vid rivningsarbetare, VVS-installatörer, elektriker, snickare, golvläggare och takläggare eftersom asbest finns framförallt kvar i äldre byggnader och exponering av bostadsradon.
Förekomst av andra allvarliga sjukdomar, fr.a. kroniska hjärt- och lungsjukdomar har betydelse för behandlingsmöjligheterna och måste dokumenteras. Tidigare eller aktuell tumörsjukdom skall alltid efterfrågas.
En noggrann dokumentation av aktuella sjukdomssymtom omfattar lokala symtom såsom hosta, heshet och hemoptys, symtom som kan vara förknippade med tumörspridning såsom smärta och neurologiska besvär, samt allmänsymtom såsom viktnedgång och trötthet/orkeslöshet (se även kapitel 7 Symtom och kliniska fynd). Patientens performance status (PS) skall bestämmas, (se tabell 9.6) vid nybesök och fortlöpande under hela behandlingstiden.
Tabell 9.6. WHO-skalan för skattning av funktionsstatus
|
Grad |
Funktionsförmåga |
|
0 |
Klarar all normal aktivitet utan begränsningar |
|
1 |
Klarar lättare arbete men ej fysiskt ansträngande aktiviteter; helt uppegående |
|
2 |
Ambulatoriskt, klarar all egenvård men oförmögen att utföra något arbete; uppegående mer än 50 % av dagen |
|
3 |
Klarar endast begränsad egenvård; bunden till säng eller stol mer än 50 % av dagen |
|
4 |
Klarar ingen egenvård; helt sängbunden |
Klinisk undersökning
Korrekt stadieindelning förutsätter en grundläggande fysikalisk undersökning innefattande auskultation och perkussion av lungor, auskultation av hjärta, blodtryck, palpation av lymfkörtelstationer supraklavikulärt, på halsen och i axiller, palpation av buk och inspektion av hudkostym. I vissa fall upptäcks tumörmanifestationer som erbjuder enkla diagnostiska åtgärder, såsom punktion eller biopsi av en ytlig lymfkörtelmetastas eller subkutan metastas. Asymmetriska andningsljud, lokaliserade ronki eller ensidig dämpning kan vara tumörrelaterade fynd.
Smärtor i skuldra eller arm kan ibland vara tecken på en apikalt växande s.k. Pancoasttumör, med överväxt på revben, plexus brachialis och ev. sympatiska gränssträngen och ganglion stellatum. Heshet kan vara tecken på recurrenspares (se även kapitel 7 Symtom och kliniska fynd).
Blodprover
Vid nybesöket på lungmottagningen bör rutinprover såsom blodstatus, CRP, blödningsprover, leverenzymer, elektrolyter och kreatinin analyseras. Vid behandling med nefrotoxiska läkemedel ska njurfunktionen följas. Glomerulär filtrationshastighet (GFR) (bestämt med t ex Iohexol-clearance eller Cr-EDTA) är det bästa måttet för att bedöma njurfunktion. En skattning av GFR (estimerat GFR, eGFR) med hjälp av formler som är baserade på P-Cystatin C eller P-Kreatinin kan även användas (se även kunskapsbanken.cancercentrum.se/lakemedelsregimer/lungcancer). Tumörmarkörer i serum som karcinoembryonalt antigen (CEA) och neuronspecifikt enolas (NSE) har ett begränsat värde i diagnostiken av lungcancer och är inte motiverat i klinisk rutin.
Anrikning och analys av cirkulerande tumör dna (ctDNA) i plasma (sk liquid biopsy) är en teknik som genomgått en stark utveckling senaste decenniet och kan användas som komplement för genomisk profilering vid diagnos av lungcancer. I nuläget rekommenderas den dock ej rutinmässigt i klinisk rutin.
Bilddiagnostik
Med standardiserat vårdförlopp har fluoro-deoxy-glukos-positron-emissions-tomografi och datortomografi (FDG PET-DT) fått en mer framträdande roll för utredning av misstänkt lungcancer och skall utföras inför kurativt syftande behandling. Enligt det nationella kvalitetsregistret genomgår ca 60 % av patienterna utredning med PET-DT, och användandet är relativt lika i hela landet. I vissa fall kan symtom och alarmerande fynd på lungröntgen leda till att en initial utredning utförs med PET-DT där DT är utförd med diagnostisk kvalitet. I de flesta fall sker dock utredning med kontrastförstärkt DT torax inklusive övre buk ned till njurarnas nedre pol. DT bör vara utförd med tunna snitt (≤ 1 mm) för att bättre kunna värdera fynd och ge en noggrann storleksmätning. Största diametern på den misstänkta tumören ska anges, avrundat till hela mm. Ytterligare lungförändringar som är misstänkta för malignitet, t.ex. inväxt i mediastinum, skelett, pleura, perikard eller toraxvägg, noteras i svaret. Magnetisk resonanstomografi (MRT) kan vara av värde för att utvärdera överväxt och korrekt T-stadium, t.ex. utredning av tumörer apikalt i lungan med misstänkt inväxt i sympatiska nervsystemet, s.k. pancoasttumörer. Körtlar i hilus och mediastinum värderas storleksmässigt. Kort axelmått anges i mm och utseendet bedöms. Bevarat fetthilus är ofta ett benignt tecken. Position för metastasmisstänka körtlar, avvikande storlek eller utseende anges för N-klassificering. Malignitetsmisstänkta förändringar i kontralaterala lungan, skelett, parenkymatösa organ i övre buk, skelett och ev. pleura och perikardvätska noteras i svaret och används för att kunna ange korrekt M-klassificering.
Lymfkörtelmetastaser är vanligare om tumören är solid och/eller centralt växande [56]. Hos patienter utan förstorade lymfkörtlar i mediastinum finner man lymfkörtelmetastaser i ca 20 % av fallen och förstorade lymfkörtlar kan även vara benigna. DT som enda undersökning har följaktligen för låg sensitivitet och specificitet för en säker bedömning av N-stadium. Om mediastinal metastasering är avgörande för behandlingsbeslutet bör DT därför kompletteras med PET-DT och ev. invasiv diagnostik (se avsnitt 9.7 Mediastinal stadieindelning). PET-DT har en hög sensitivitet och negativt prediktivt värde, så en negativ PET-DT innebär att sannolikheten för spridning till lymfkörtlar i mediastinum och hili är låg. Metoden kan inte säkert skilja mellan inflammation och malignitet utan speglar graden av glukosmetabolism i förändringen. Fynd med högt FDG-upptag, som är PET-positiva, ska därför verifieras cytologiskt eller histopatologiskt. Långsamväxande tumörer med låg metabol aktivitet, såsom vissa adenokarcinom och karcinoider, kan också vara FDG PET DT-negativa. Vid misstanke om lungcarcinoid rekommenderas vidare utredning med somatostatinreceptor PET/DT samt kontroll av kromogranin A, 5-HIAA och eventuellt S-kortisol och ACTH. Se avsnitt 19.1 Karcinoider.
Ofta upptäcks radiologiska förändringar med oklar patologisk signifikans i levern. Vidare radiologisk karakterisering av sådana förändringar kan utföras med MRT-undersökning, ultraljudsundersökning eller DT-undersökning. Undersökningsmetoderna har olika för- och nackdelar. Vilken metod som lämpar sig bäst i det individuella fallet beror på t ex förändringens lokalisation, storlek, utseende på DT, patientens njurfunktion, undersökningsmetodernas tillgänglighet osv och kan diskuteras med en radiolog.
Vidare utredningar av förstorade binjurar sker enligt lokala rutiner. Binjureförändringar som är runda eller ovala, välavgränsade och med homogen täthet ≤ 10 Hounsfieldenheter (HU) på nativa DT-bilder talar starkt för benign genes. Om högt upptag vid PET-DT kan detta vara falskt positivt då även benigna barkadenom kan ha högt upptag. Om binjureförändringen ej har förhöjt FDG-upptag är detta ofta sant negativt pga. högt negativt prediktivt värde (NPV) för metoden. Binjuren kan även provtas via EUS för att verifiera eventuell spridning.
MRT är en känslig metod för att värdera skelettförändringar. Tillsammans med utseende på DT är det ofta möjligt att värdera sannolikheten för ev. metastas. PET-DT är också en bra metod för att detektera skelettmetastaser pga det ofta förekommande förhöjda FDG upptaget i metastaser [57].
DT hjärna med kontrastmedel (och skelettalgoritm) ska göras i primärutredningen vid icke-småcellig lungcancerstadium III inför beslut om kurativt syftande radiokemoterapi, hos individer med avancerad lungcancer med påvisade tumördrivande mutationer, samt ska övervägas redan i primärutredningen av småcellig lungcancer (SCLC). Om DT hjärna med kontrastmedel ej är konklusiv bör MRT hjärna utföras. Vid SCLC har 10–15 % asymtomatiska hjärnmetastaser vid diagnos [58]. I övriga fall görs DT/MRT hjärna vid kliniska tecken på hjärnmetastaser. MRT har högre sensitivitet för att påvisa små hjärnmetastaser och leptomeningeal karcinomatos, och bör väljas om detektion av sådana är avgörande för handläggningen.
Fynd av solitära eller enstaka hjärnmetastaser på DT bör verifieras med MRT, då kirurgi eller stereotaktisk strålbehandling av metastaserna kan bli aktuell om spridningen är begränsad.
MRT är också värdefullt vid kartläggning av Pancoasttumörer, och vid neurologiska symtom som indikerar misstänkt inväxt i spinalkanalen eller nervrotspåverkan (se kapitel 7 Symtom och kliniska fynd) [58].
Bronkoskopi
Flexibel bronkoskopi ingår i rutinutredning av lungcancer och bör utföras efter DT torax eller PET-DT. Undersökningen fyller tre viktiga funktioner:
- Verifiera diagnosen genom histologisk och/eller cytologisk provtagning.
- Bedöma tumörens endobronkiella utbredning (inkl. larynx och trakea) vilket är en viktig del av underlaget för stadieindelningen. Fynd av stämbandspares innebär nästan alltid tumörspridning till mediastinum, och klassas som T4.
- Utföra transbronkiell provtagning från mediastinala lymfkörtlar, för N-klassifikation i stadieindelningen.
Kontraindikationer mot bronkoskopi innefattar instabil koronarischemi, grav hypoxi eller pågående antikoagulantiabehandling, t.ex. Waran, NOAK eller behandling med högdos lågmolekylärt heparin som ej kan sättas ut tillfälligt. Efter akut hjärtinfarkt bör man avvakta med bronkoskopi i minst 4 veckor, men individuell bedömning i samråd med en kardiolog rekommenderas.
Vid förstorade lymfkörtlar eller tumörmisstänkta förändringar i mediastinum är EBUS (endobronchial ultrasound) en väletablerad metod för diagnostik. EBUS-TBNA (Transbronkiell finnålspunktion) är en vedertagen diagnostisk metod. Mediastinal kryobiopsi (TBMCB) är en ny metod som kan utgöra ett viktigt komplement vid diagnostik av spridda tumörer och behov av biopsimaterial för framför allt PDL1-analys, särskilt om det inte går att få biopsimaterial från annan tumörförändring [59]. Se 9.7 Mediastinal stadieindelning.
Vid makroskopiskt tumörfynd tas tångbiopsier alternativt kryobiopsier. Lokal instillation av adrenalin används ibland på vissa håll, i syfte att minska risken för blödningar. För att kompensera för små biopsier vid flexibel bronkoskopi rekommenderas att man tar multipla biopsier (minst 3–4) från tumörområdet. Man bör undvika att biopsera nekrotiska tumörpartier. Vid perifer tumörlokalisation, där tumören inte kan ses direkt via bronkoskopet, kan biopsier tas med ledning av genomlysning. Radiellt ultraljud i genomlysning ökar möjligheten att få biopsier hos en patient med perifer tumör [60]. Elektromagnetisk navigation (EMN) kan också vara ett alternativ till transtorakal nålpunktion hos patienter med perifert lokaliserade tumörer. Denna metodik används i nuläget endast vid enstaka centrum i Sverige. Perifera tumörer som uppenbart inte kan nås via bronkoskopi, kan som regel utredas primärt med DT- eller ultraljudsledd transtorakal biopsi.
Borstprov innebär att man med hjälp av en liten borste, via bronkoskopet, river loss celler från tumörens yta. Om tumören är lättblödande kan besvärande blödning uppstå i samband med borstprov, men i övrigt är riskerna med denna provtagningsmetod små. Vid perifer tumörlokalisation förbättras utbytet avsevärt med genomlysningsstyrd provtagning. Aspiration av bronkialsekret, bronksköljning eller bronkoalveolärt lavage (BAL) är andra metoder för cytologisk provtagning.
Mediastinal stadieindelning
Rekommendation för mediastinal stadieindelning inför kurativ behandling
PET-DT inkl. diagnostisk DT av torax är grundläggande undersökning.
Mediastinal provtagning, i första hand EBUS-TBNA, ev. i kombination med EUS-FNA, i andra hand mediastinoskopi, rekommenderas om något av följande föreligger:
- PET-positiva lymfkörtlar i N1-, N2- eller N3-position
- PET-negativa mediastinala lymfkörtlar
- cN1 – radiologiskt förstorade N1-körtlar
- tumör > 3 cm oavsett lokalisation (oftast adenokarcinom med högt FDG-upptag)
Mediastinal provtagning behövs inte vid:
- PET-positiv tumör ≤ 3 cm, i perifera tredjedelen av lungan, och PET-negativa, icke-förstorade lymfkörtlar N0.
EBUS/EUS
För provtagning av mediastinala lymfkörtlar rekommenderas i första hand transbronkiell nålbiopsi (TBNA) med ledning av endobronkiellt ultraljud (EBUS). TBNA kan i vissa fall utföras utan EBUS, t.ex. vid indirekta tumörfynd utan endobronkiellt genombrott (central tumörkompression), och vid fynd av större lymfkörtlar på DT eller PET-DT, framför allt subkarinalt.
EBUS-TBNA utförs med ett specialiserat bronkoskop utrustat med ultraljudsprob och nålsystem för realtidskontroll vid punktion. Undersökningen utförs vanligtvis polikliniskt på samma sätt som ordinär bronkoskopi.
Vanligtvis inleds undersökningen med vanlig bronkoskopi för att inspektera luftvägarna och applicera lokalanestetika, följt av EBUS-undersökningen i samma seans. Preparaten vid EBUS-TBNA är cytologiska, varför upprepade punktioner rekommenderas för att erhålla tillräckligt material för diagnostik. Provet från punktionen bör hanteras så att cellblock kan skapas, vilket ökar de diagnostiska möjligheterna. Vid den cytologiska provtagningen bör, om möjligt, cytodiagnostiker närvara för att bedöma provets representativitet (ROSE = rapid on site examination).
EBUS kan användas på olika sätt. För det första kan det göras en diagnostisk EBUS där material tas från parabronkiella körtlar förhistologisk diagnostik inklusive molekylärpatologisk testning [61].
För det andra görs EBUS vid enstaka PET-positiva körtlar, t.ex. i N2- eller N3-position, i syfte att verifiera förekomst av maligna celler inför behandlingsbeslut om t.ex. kirurgi. I detta fall används EBUS som en riktad staging, dvs. riktat mot ett begränsat antal i förväg radiologiskt kartlagda lymfkörtelstationer.
För det tredje rekommenderas EBUS för staging i dess strikta betydelse, enligt ESMO-guidelines (se fig. 9.2) för cytologisk/PAD verifikation av lymfkörtlar i mediastinum [62]. Mediastinal staging utförs genom att först punktera lymfkörtlar i N3-position, därefter i N2-position och slutligen i N1. Minimikravet enligt internationella riktlinjer är provtagning av körtlar i position 4L, 7 och 4R. Detta kan kompletterat med 2L + R samt övriga förstorade och/eller PET-positiva körtlar (se figur 9.3). Körtlar i position 5, 8 och 9 nås inte via EBUS utan undersökningen måste kompletteras med EUS/EUS-B.
EUS utförs via esofagus med ett gastrovideoskop utrustat på samma sätt som ultraljudsbronkoskopet. EUS kan även utföras med EBUS-bronkoskopet och kallas då EUS-B. Kombination EBUS och EUS erbjuder en nästan komplett mediastinum stadieindelning och kan ytterligare minska behovet av kirurgisk mediastinoskopi [61, 63]. Mediastinal staging rekommenderas även vid PET-negativa lymfkörtlar i mediastinum om tumören är stor (> 3 cm) eller om radiologiskt förstorade lymfkörtlar föreligger trots PET-negativitet. I dessa fall riktas EBUS mot de mediastinala N2-/N3-körtlar som radiologiskt/metabolt inte är avvikande men kan visualiseras med ultraljud (se figur 9.2). Syftet med EBUS för staging är att kontrollera om det trots negativ radiologi ändå finns spridning till mediastinala lymfkörtlar, vilket kan påverka behandlingsrekommendationen. Mediastinal provtagning behövs inte vid en liten (≤ 3 cm) PET-positiv tumör som ligger i perifera tredjedelen av lungan och där inga förstorade eller PET-positiva lymfkörtlar kan påvisas (N0).
Vid perifert liggande tumör kan EBUS för staging kombineras med radiellt ultraljud i genomlysning, vilket möjliggör diagnostisk av både primärtumör och staging i samma seans. Vid lyckat utfall behöver patienten då endast genomgå ett diagnostiskt ingrepp. Komplikationer till provtagning vid bronkoskopi/EBUS omfattar främst blödningar. Fatala blödningar har beskrivits efter biopsi av centralt belägna tumörer. Mediastinit är en ovanlig men allvarlig komplikation efter EBUS/EUS. Vid symtom som feber, bröstsmärta eller sjukdomskänsla hos en patient som nyligen genomgått mediastinal provtagning bör mediastinit övervägas och antibiotikabehandling påbörjas. Vid transbronkiella biopsier av perifera tumörer förekommer, förutom blödning, även risk för pneumotorax. Det är viktigt att bronkoskopisten under lugna förhållanden tränar ”wedging” av bronkoskopet och ballongtamponad som metoder för att hantera oväntade blödningskomplikationer.
Enligt nationella riktlinjer för lungcancervård har kombinationen av EBUS och EUS en stark prioritet. EBUS-TBNA är i dag förstahandsmetod för preoperativ invasiv mediastinal stadieindelning framför mediastinoskopi.
kvalitetsregistret (Thor) har endast cirka 20% av opererade patienter genomgått preoperativ invasiv lymfkörteldiagnostik.
Figur 9.2. Mediastinal staging hos patienter med NSCLC inför kurativt syftande behandling. Algoritm modifierad från ESMO-guidelines.
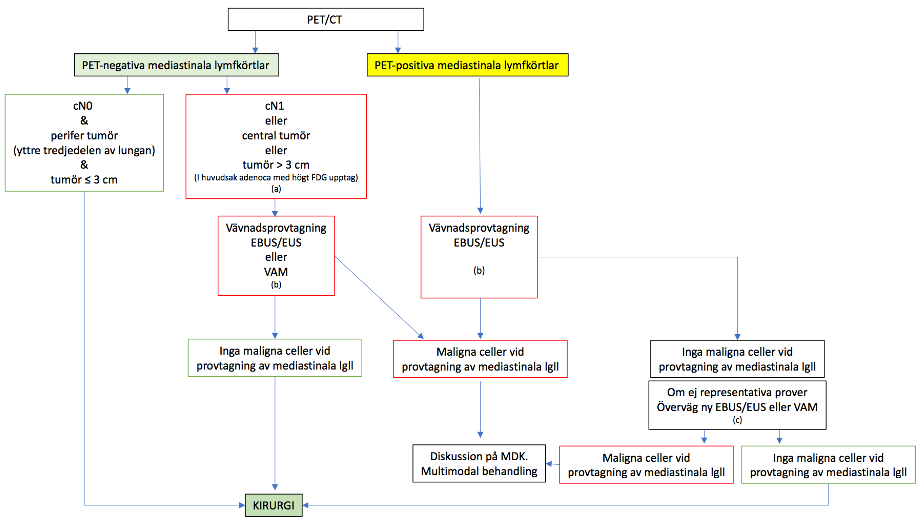
(a) Invasiv staging bör övervägas om tumör > 3 cm trots PET-negativa mediastinala lymfkörtlar. Dessa tumörer är oftast adenokarcinom med högt FDG-upptag.
(b) Minimalinvasiva tekniker såsom EBUS/EUS rekommenderas i första hand.
(c) Om negativa prover vid EBUS/EUS, kontrollera om de är representativa prover och överväg ny EBUS/EUS eller VAM (videoassisterad mediastinoskopi) som vid lymfkörtelsampling har ett högre negativt prediktivt värde jämfört med EBUS/EUS finnålspunktion.
Figur 9.3. Lymfkörtelstationer nåbara med EBUS, EUS och anterior mediastinoskopi

Transtorakal lungpunktion
Transtorakal punktionsprovtagning (TTNA) av lungtumör rekommenderas för diagnostik av små och/eller perifert belägna tumörer där bronkoskopi inte har givit diagnos, eller där bronkoskopisk diagnostik bedöms ha låg sannolikhet att lyckas.
TTNA kan utföras med stöd av datortomografi eller ultraljud. Ultraljud är begränsat till tumörer med subpleural lokalisation och förekomst av akustiskt fönster. I vissa fall kan tvåplansgenomlysning vara tillräckligt. Punktion kan utföras med finnål (25–22 Gauge) för cytologisk provtagning eller med skärande mellannål (20–18 Gauge) för histopatologisk undersökning. Mellannålsbiopsier är alltid att föredra ur diagnostisk synvinkel, men valet av metod måste balanseras mot risken för komplikationer. Inför planerad operation kan finnålspunktion vara tillräckligt. Det diagnostiska utfallet beror på tumörens lokalisation och storlek.
Den vanligaste komplikation vid transtorakal punktion är pneumotorax som förekommer i upp till 1/3 av alla ingrepp, vanligast vid central tumörlokalisation. Risken för pneumotorax ökar vid samtidigt emfysem. I vissa fall krävs behandling med pleuradränage eller exsufflation. Andra komplikationer inkluderar hemoptys, lungblödning och, i sällsynta fall, luftemboli.
Sputumcytologi
Sputumcytologi är en andrahandsmetod för morfologisk diagnostik och används främst för patienter som är för sjuka för att genomgå sedvanlig utredning med bronkoskopi eller transtorakal biopsi. Ett representativt sputumprov kännetecknas av förekomst av alveolära makrofager i provet. För att förbättra möjligheten att få representativa prover kan inhalation av hyperton koksaltlösning före provtagningen användas, tillsammans med andningsgymnastik och hostteknik under ledning av fysioterapeut.
Övrig metastasutredning
Rekommendation
PET-DT eller DT av torax och övre delen av buken utgör grunden för stadieindelningen. Vid tveksamheter kring metastasering kan utredningen behöva förstärkas enligt nedan.
Pleuradiagnostik
Pleurakarcinos klassas i det gällande stadieindelningssystemet som metastatisk sjukdom (M1a), och utgör en av de vanligaste spridningslokalerna vid lungcancer. Pleura är också en vanlig metastaslokal vid andra tumörformer, och fynd av ensidig malign pleuravätska kan utgöra ett differentialdiagnostiskt problem. Den diagnostiska träffsäkerheten med cytologisk provtagning vid pleurakarcinos är endast ca 50 %. Stora mängder vätska och upprepad provtagning ökar sensitiviteten. Om pleura-engagemang är det enda fyndet som indicerar en spridd sjukdom bör torakoskopi med riktade pleurabiopsier utföras. Andra provtagnings-möjligheter inkluderar DT- eller UL-ledd transtorakal mellannålsbiopsi av pleura.
Intraabdominella metastaser
Om man med radiologiska metoder inte med tillräcklig säkerhet kan fastställa eller avfärda metastasering till bukorgan kan DT- eller UL-ledd biopsering genomföras. Provtagning via laparoskopi kan övervägas i enstaka fall. Vänster binjure kan med fördel punkteras via EUS.
Benmärgsundersökning
Benmärgsundersökning med cristabiopsi rekommenderades tidigare som rutinundersökning för stadieindelning vid småcellig lungcancer, men utförs i dag endast vid kliniskt misstänkt benmärgskarcinos. Samvariationen med skelettmetastasering är hög men inte 100 %.
Ytliga metastaser
Misstänkta perifera metastaser, t.ex. i huden eller en ytligt liggande lymfkörtel, bör punkteras eller biopseras för diagnostik. Biopsi eller exstirpation för histologisk diagnos föredras framför cytologisk provtagning om detta är möjligt och utfallet har betydelse för behandlingsbeslutet.
Explorativ torakotomi
Explorativ torakotomi eller VATS kan övervägas i de fall där cancermisstanken kvarstår men ej har verifierats med cytologi eller PAD, patienten ur funktionssynpunkt har normal operationsrisk och tumören är möjlig att resecera. Om möjligt görs först en kilexcision med fryssnitt för peroperativ diagnos. Om lungcancerdiagnosen då verifieras görs sedvanlig lobektomi och lymfkörtelsampling eller dissektion (se kapitel 12 Kirurgisk behandling).
Preoperativ funktionsbedömning inför ställningstagande till lungcancerkirurgi
Sammanfattande rekommendationer
Preoperativ funktionsutredning inkluderande dynamisk spirometri och klinisk bedömning kan ge en grov vägledning om operationsrisken. En samlad bedömning av alla riskfaktorer bör dock ske, och vid tveksamhet om funktionell operabilitet bör utredningen kompletteras med mer avancerade metoder. Riskbedömning vad gäller postoperativ morbiditet och mortalitet kan göras med hjälp av olika modeller. Det finns dock ingen modell som är validerad i en cancerpopulation.
- Faktorer, utöver nedsatt lungfunktion, bör beaktas och utgörs bland annat av rökning, övervikt (BMI > 30), grav undervikt och annan samsjuklighet
- Vid sammanvägning av riskfaktorer måste slutligen risken med operativt ingrepp ställas i relation till alternativa behandlingsmetoder och naturalförloppet vid icke behandlad sjukdom.
- Vid icke-metastaserad NSCLC är det kardiopulmonella faktorer och annan samsjuklighet som är avgörande för valet av behandling.
- Inför ställningstagande till kirurgi rekommenderas noggrann bedömning av kardiellt och pulmonellt status inklusive bedömning av samsjuklighet och rökstopp.
- Lungfunktionsundersökning inklusive DLCO bör bestämmas inför beslut om kirurgi.
- Om FEV1 och DLCO-värden > 80 % och ingen övrig samsjuklighet finns behöver ingen ytterligare preoperativ funktionsutredning utföras.
- Om FEV1 eller DLCO < 80 % bör ytterligare funktionsutredning utföras, se algoritm.
- Bedömning av aerob kapacitet med ergospirometri ger förbättrad möjlighet att urskilja patienter med ökad risk för postoperativ mortalitet och morbiditet.
- Inför planerad pulmektomi rekommenderas, förutom FEV1 och DLCO, också ventilationsperfusionsskintigrafi för beräkning av ppo-värden och arbetsEKG/ergospirometri för kardiopulmonell riskvärdering.
- Behandling av samsjuklighet ska optimeras innan kirurgi.
Figur 9.4 Preoperativ funktionsutredning inför lungcancerkirurgi
 Algoritm adapterad efter Brunelli A et al. Chest 2013.
Algoritm adapterad efter Brunelli A et al. Chest 2013.
Klinisk bedömning
Klinisk bedömning, inkluderande anamnes och status, är viktiga faktorer för att avgöra om patienten är kandidat för lungkirurgi. Riskfaktorer, utöver nedsatt lungfunktion, bör beaktas och utgörs bland annat av rökning, övervikt (BMI > 30), grav undervikt och annan samsjuklighet. Samsjuklighet såsom hjärt–kärlsjukdom och annan lungsjukdom, exempelvis KOL och lungfibros är vanligt förekommande hos patienter med lungcancer. Samsjuklighet är förknippad med ökad perioperativ mortalitet och kan ha påverkan på val av diagnostik och behandlingsval och behöver därför identiferas och behandlas [64].
Arbetsprov
Kardiell riskbedömning utgör en viktig del i den preoperativa bedömningen. I det tidigare nationella vårdprogrammet var arbets-EKG obligatoriskt för individer > 55 år inför ställningstagande till kirurgi. Internationella riktlinjer har dock gått ifrån detta [62] och den nuvarande rekommendationen grundas på om patienten har anamnes på icke-stabil hjärtsjukdom eller inte tidigare känd angina. I dessa fall rekommenderas remiss för arbets-EKG alternativt ergospirometri samt vid behov kardiologbedömning. Arbetsprov behöver således inte rutinmässigt utföras hos en anamnestiskt hjärtfrisk patient inför lobektomi. Inför planerad pulmektomi kvarstår rekommendationen om arbets-EKG alternativt ergospirometri oavsett anamnes och ålder.
Dynamisk spirometri och CO-diffusionskapacitet (DLCO)
Samtliga patienter som övervägs för eventuell kirurgi bör göra dynamisk spirometri inkluderande beräkning av CO-diffusionskapacitet (DLCO). Patienter som är hjärtfriska eller har en stabil, välbehandlad hjärtsjukdom samt på spirometri FEV1 och DLCO får > 80 % av förväntat värde kan vanligen accepteras för kirurgi upp till pulmektomi. Det förordnas dock att man på samtliga patienter utför beräkning av predikterat postoperativ FEV1 (ppoFEV1) respektive DLCO (ppoDLCO) [65]. Beräkning/prediktering av ppoFEV1 och ppoDLCO kan göras olika sätt, dels genom enkel skattning (pulmektomi ~ 50 % reduktion av uppmätt preoperativ funktion respektive lobektomi ~ 20 % reduktion), dels enligt matematisk modell alternativt med hjälp av ventilations-perfusionskintigrafi. Om ppoFEV1 och ppoDLCO > 60 % bedöms patienten som låg risk och kan accepteras för kirurgi utan ytterligare utredning. Om ppoFEV1 och/eller ppo-DLCO < 60 % behövs kompletterande undersökningar (13) (se även algoritmer).
Ergospirometri
Om ppo-FEV1 eller ppo-DLCO < 60 % bör ergospirometri övervägas. Bedömning av aerob kapacitet ger bättre möjlighet att urskilja patienter med ökad risk för postoperativ mortalitet och morbiditet. Ett maximalt syreupptag (VO2 max) på > 20 ml/kg/min. kvalificerar för pulmektomi och värden < 10 ml/kg/min. indikerar hög risk vid all kirurgi [65-67]. Patienter med värden på 10–20 ml/kg/min. utgör en intermediär grupp och där kan analys av CO2-produktion i relation till minutventilation (VE/VCO2 slope) bestämmas och ge ytterligare vägledning [65]. En nyligen publicerad retrospektiv svensk kohortstudie ger stöd för att användning av ventilatorisk effektivitet (VE/VCO2 –slope) kan förbättra riskstratifiering i patientgruppen med maximalt syreupptag i imtervallet 10–20 ml/kg/min. [68]. Sammantaget erbjuder ergospirometri stöd i riskvärderingen, och syftet med undersökningen är att kunna inkludera patienter med nedsatt lung eller diffusionskapacitet som annars exkluderats för lungkirurgi.
Trapptest
Trappstest som ett led i preoperativ bedömning används redan på flera kliniker i Sverige. Det föreligger skillnader regionalt i vilken omfattning metoden används. Trappstest kan användas som screeninginstrument inför ställningstagande till ergospirometri, framför allt i gruppen med ppo-FEV1 eller ppo-DLCO 30–60 % [69] (se algoritmer). Tidigare studier har påvisat en hög korrelation mellan trapptest och VO2-max mätt med ergospirometri (r = 0,7). Gränsen 22 meter i höjdled uppvisar ett positivt prediktivt värde på 86 % för att förutsäga en VO2 peak på 15 ml/kg/min [70].
En systematisk översikt från 2020 har undersökt relationen mellan trapptest med gränsen 10 m i höjdled och postoperativa komplikationer. Man fann att det var användbart som ett potentiellt screeningverktyg inför lungcancerkirurgi samt inför eventuell vidare utredning med ergospirometri [71].
Trapptest är en enkel och snabb metod och kräver relativt lite personal och utrustning. Det finns dock begränsningar för användbarheten. Det föreligger svårigheter att utföra testet på ett standardiserat sätt. Varaktigheten av trapptestet och i vilken hastighet promenaden/trappgången ska ske varierar i olika studier. Vidare råder oklarheter kring vilka kriterier som gäller för avbrytande av test, vilket också varierat från studie till studie. Därutöver kan patienter med olika samsjukligheter (t.ex. muskuloskeletala sjukdomar, neurologiska abnormiteter och perifer vaskulär insufficiens) i många fall inte utföra testet.
Pulmektomi
Pulmektomi är ett omfattande ingrepp där högersidig pulmektomi är mer riskfyllt jämfört med vänstersidig pulmektomi [72]. Dynamisk spirometri inkluderande beräkning av CO-diffusionskapacitet (DLCO) ingår för samtliga patienter som planeras för kirurgi. Historiskt har ett absolutvärde på FEV1 används, där 2 liter ansetts vara gränsvärdet för att utföra pulmektomi. Predikterat postoperativt FEV1 % av normalvärde är dock ett bättre värde, då detta tar hänsyn till ålder, kön och längd. Inför planerad pulmektomi rekommenderas ventilations/perfusionsskintigrafi för att beräkna postoperativ FEV1. Anledningen är att det inte sällan finns ett visst mått av mismatch mellan ventilation och perfusion, där ppoFEV1-värdet kan bli falskt lågt om enbart spirometri används som beräkningsgrund. För kardiopulmonell riskvärdering rekommenderas ergospirometri inför pulmektomi.
Formler för beräkning av postoperativ lungfunktion
Formel för beräkning av ppoFEV1 vid lobektomi eller bilobektomi:
ppoFEV1 = preoperativ FEV1 x (1 - y / Z)
Preoperativ FEV1 uppmäts som det bästa postbronkdilatoriska värdet. Antalet funktionella lungsegment som ska avlägsnas är y och det totala antalet funktionella segment är Z.
Det totala antalet segment för båda lungorna är 19 (10 i höger lunga [tre i övre, två i mitten, fem i nedre] och nio i vänster lunga [fem i övre och fyra i nedre]).
Formel för beräkning av ppoFEV1 vid pulmektomi:
ppoFEV1 = preoperativ FEV1 x (1 - fraktion av total perfusion i planerad resekerad lunga)
Preoperativ FEV1 tas som det bästa uppmätta värdet post bronkdilatation (post-BD).
En kvantitativ radionukleidperfusionsundersökning utförs för att mäta fraktionen av total perfusion för den resekerade lungan.
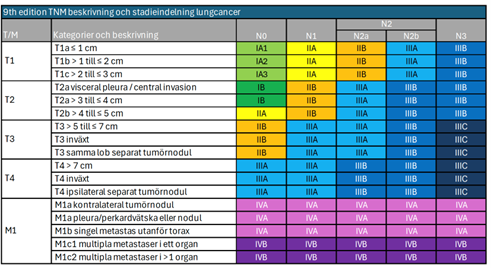
Stadieindelning
Stadieindelning av lungcancer har två huvudsyften: vägledning för behandlingsval och bedömning av prognos. Stadieindelningen är också en förutsättning för korrekt värdering av behandlingsresultaten, särskilt vad gäller överlevnaden.
Som underlag för stadieindelningen används en TNM-klassifikation som beskriver primärtumörens utbredning (T), eventuella körtelmetastaser (N) och förekomst av eventuell fjärrmetastasering (M). Den kliniska TNM-klassifikationen (cTNM) beskriver tumörutbredningen före en eventuell operation. Klassifikationen beskriver inte vilka undersökningar som ska ingå som underlag för en klassificering, vilket kan medföra skillnader i precision mellan olika material. I normalfallet är dock en utredning med DT av torax och övre buk samt en bronkoskopi att betrakta som basal utredning för att få en rimligt korrekt klinisk klassificering. Inför kurativt syftande behandling rekommenderas även PET-DT och i vissa fall DT eller MR av hjärna. I fall där ingen behandling planeras kan stadieindelningen ibland baseras på lungröntgen och klinisk undersökning, vilket förstås är en osäker grund. Efter en eventuell operation kan ytterligare information erhållas som kan påvisa en mindre eller mer omfattande tumörutbredning än den kliniska TNM-klassificeringen. Denna anges som patologiskt TNM-status (pTNM).
Efter en klassifikation enligt TNM grupperas de olika TNM-kategorierna i sammanfattande stadier. Denna stadieindelning revideras med jämna mellanrum. Den senaste revideringen, nionde upplagan infördes i Sverige 2025. Förändringar i den senaste versionen inkluderar:
- En mer detaljerad klassifikation av primärtumörens storlek.
- Uppdelning av N2-kategorin i N2a (enkelstation) och N2b (flerstation), vilket reflekterar olika prognostiska implikationer.
- Uppdelning av M1c-kategorin i M1c1 (multipla metastaser i ett organsystem) och M1c2 (metastaser i flera organsystem).
N-klassifikationen har uppdaterats för att bättre återspegla prognostiska skillnader och behandlingsalternativ. Den sammanfattande stadieindelningen har också reviderats för att inkludera dessa förändringar.
Sedan 7:e upplagan omfattas även småcellig lungcancer av TNM-klassifikationen. Tidigare tillämpades ett förenklat stadieindelningssystem för småcellig lungcancer, där man skilde mellan begränsad sjukdom (limited disease, LD) och utbredd sjukdom (extensive disease, ED). Begränsad sjukdom (LD) motsvaras i det nuvarande systemet av T1–4 N0–3 M0, med undantag av T3–4 som orsakas av multipla lungnoduli som inte ryms i ett tolererbart strålfält. Utbredd sjukdom (ED) är numera all fjärrmetastatisk sjukdom (M1a/b) och T3–4 som är orsakad av multipla lungmetastaser.
Den åttonde TNM klassifikationen [73] ersätts nu av den nionde upplagan, vilken sammanfattas i nedanstående tabell och figur.
TNM-klassifikation (UICC/IASCLC 9:e upplagan 2025)
|
T – primärtumör |
|
|
TX |
Primärtumör ej bedömbar eller påvisad genom fynd av maligna celler i sputum eller bronksköljvätska och inte synlig med radiologiska metoder eller vid bronkoskopi |
|
T0 |
Ingen påvisbar primärtumör |
|
Tis |
Carcinoma in situ |
|
T1 |
Tumör med största diameter 3 cm omgiven av lunga eller visceral pleura, utan belägg för växt i huvudbronk eller stambronk
|
|
T1mi |
Minimalt invasivt adenocarcinom |
|
T1a |
≤ 1 cm i största diameter |
|
T1b |
> 1 ≤ 2 cm |
|
T1c |
> 2 ≤ 3 cm |
|
T2 |
Tumör med någon av följande egenskaper:
|
|
T2a |
|
|
T2b |
Tumör > 4 ≤ 5 cm i största diameter |
|
T3 |
Tumör med någon av följande egenskaper:
|
|
T4 |
Tumör med någon av följande egenskaper:
|
|
N – regionala lymfkörtlar |
|
|
NX |
Regionala lymfkörtlar ej bedömbara |
|
N0 |
Inga regionala lymfkörtelmetastaser |
|
N1 |
Metastasering till ipsilateral peribronkiell lymfkörtlar och/eller ipsilateral hiluskörtel, inklusive direkt inväxt i lymfkörtel |
|
N2 |
Metastasering till ipsilateral mediastinal och/eller subkarinal lymfkörtel/körtlar |
|
N2a |
Singel N2 station |
|
N2b |
Multipla N2 stationer |
|
N3 |
Metastasering till kontralateral mediastinal, kontralateral hilär, ipsi- eller kontralateral skalenuseller supraklavikulär lymfkörtel/körtlar |
Sammanfattande stadieindelning baserad på TNM-klassifikation enligt UICC/IASLC 9:e upplaga