Kategorisering av tumören
Patologins roll i den diagnostiska processen
Histopatologisk undersökning av operationspreparat syftar till att klassificera njurtumören och därmed avge en diagnos samt att värdera andra parametrar av prognostiskt eller prediktivt värde enligt punkt 9.5 nedan. Dessutom ska bedömning ske av om det operativa ingreppet är radikalt eller ej. Slutligen utgör undersökningen grund för att fastställa patologiskt tumörstadium enligt pTNM-klassifikationssystemet 53. Den senaste TNM-versionen som upprättades av UICC 2017 används i dag. Fullständigt TNM-stadium bestäms efter syntes av resultaten från kliniska, histopatologiska och radiologiska undersökningar. Se bilaga 2 Stadieindelning (UICC 2017, 8th ed).
Aktuell klassifikation av njurtumörer beskrivs i den periodiskt utgivna WHO-klassifikationen, där den femte och senaste utgåvan publicerades 2022 54. Njurtumörer definieras fortfarande huvudsakligen efter histopatologiska drag (figur 8), även om genetiska och molekylära data får allt tydligare roller. De tre vanligaste njurcancertyperna är: klarcellig njurcancer (60–75 %), papillär njurcancer (13–20 %) och kromofob njurcancer (cirka 5 %). Papillär njurcancer delades tidigare enligt rekommendation från WHO in i typ 1 och typ 2 men det görs inte längre enligt den senaste utgåvan.
Ytterligare en ändring är att tumörtypen ”clear cell papillary renal cells tumour” (ca 3 % av njurtumörer hos vuxna) ersätter den tidigare tumörtypen ”clear cell papillary renal cell carcinoma” (klarcelligt papillärt renalcellskarcinom), eftersom den har en indolent beteende.
Mer ovanliga tumörtyper är collecting duct carcinoma och SMARCB1-deficient medullary carcinoma som står för < 1 % av njurcancerfallen. Dessa är mycket aggressiva med dålig prognos.
Andra njurcancertyper (till exempel molekylärdefinierade TFE3-rearranged, TFBE-altered, fumarate hydratase deficient eller succinate dehydrogenase-deficient RCC) är ovanliga och behandlas i vissa fall annorlunda än de tre vanligaste njurcancertyperna.
Andra icke-njurcellscancertyper i njuren såsom njurbäckencancer, sarkom och Wilms tumör omfattas inte av detta vårdprogram och har kliniska och terapeutiska särdrag jämfört med njurcancer. Exempelvis ska patienter med Wilms tumör handläggas omgående av onkolog för adjuvant cytostatikabehandling utan att invänta MDK 55. Kännedom av benigna tumörers morfologi (exempelvis renalt onkocytom 6–9 %, angiomyolipom cirka 1 %) är också viktiga för adekvat diagnos och även i ärftliga syndrom.
Figur 8. Histologiskt utseende hos de vanligaste njurtumörerna. (hematoxylin och eosininfärgning, storleksskala bar 100 µm).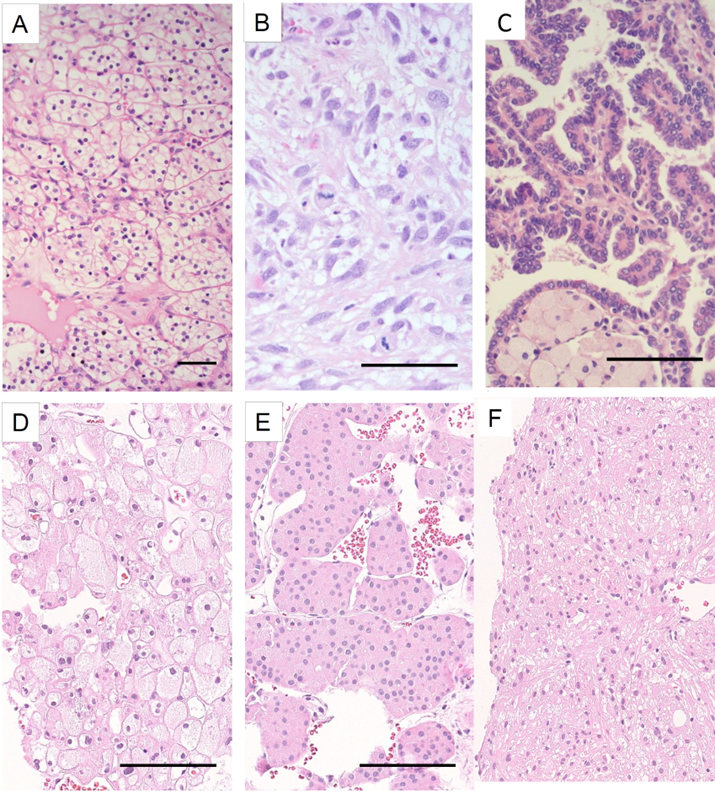
- Klarcellig njurcancer med karakteristiskt klar (tom) cytoplasma och uttalad kärl/kapillärtäthet.
- Sarkomatoid differentiering av klarcellig njurcancer. Det noteras spolformade, sarkom-liknande celler med avsevärd kärnpleomorfism och flera mitoser.
- Papillär njurcancer med papillärt växtsätt och små cytoplasmafattiga celler med små runda cellkärnor med basal lokalisation. Endast ringa kärnpleomorfism. Skumceller (lipidfyllda makrofager) ses i ett avsnitt av cancervävnaden.
- Kromofob njurcancer med karakteristisk morfologi. Det ses större celler med granulär eller vit cytoplasma och tydliga plasmamembran, som brukar beskrivas som växtcellsliknande, jämte mindre cancerceller med rosa cytoplasma. Stromat är sparsamt med glesa kärl.
- Onkocytom är den vanligaste benigna njurtumören. Det ses celler med granulär eosinofil cytoplasma och minimal kärnpleomorfism.
- Angiomyolipom är den vanligaste mesenkymala tumören i njure. Den visar en blandning av spolformade glattmuskelceller, dåligt formade blodkärl och fettceller (ej med på bild).
Gradering av njurcancer
Den klassiska graderingsprincipen för njurcancer var tidigare kärngradering enligt Fuhrman, som tillämpades på klarcellig och papillär njurcancer 56. I grunden så tar detta system fasta på graden av kärnpleomorfism, som skattas efter tre parametrar. I den WHO-klassifikation som utgavs 2016 57 presenterades ett snarlikt system, som kvarstår i WHO 2022 58. Det nya systemet kallas WHO/ISUP-gradering och har större reproducerbarhet, då det enbart fokuserar på nukleolens storlek och färg. Grad 1–3 motsvarar enligt ISUP ökande nukleolstorlek och färgskifte hos nukleolen, medan grad 4 är samma som i Fuhrmansystemet samt inkluderar rabdoid och sarkomatoid differentiering (tabell 3). Även ISUP-systemet är tänkt att användas enbart för klarcellig och papillär njurcancer. Fördelen med ISUP-gradering anges vara minskad interobservervariabilitet vid bedömningen. Figur 9 visar klarcellig njurcancer med ISUP grad 1–4.
Tabell 3. WHO/ISUP-klassifikation för gradering av klarcellig och papillär njurcancer.
|
Grade |
Beskrivning |
|
G1 |
Inga eller små och basofila nukleoler vid 400 x förstoring |
|
G2 |
Tydliga och eosinofila nukleoler vid 400 x förstoring och synliga men ej prominenta vid 100 x förstoring |
|
G3 |
Stora, prominenta, eosinofila nukleoler vid 100 x förstoring |
|
G4 |
Uttalad kärnpleomorfism, flerkärniga jätteceller och/eller rabdoid och/eller sarkomatoid differentiering |
Figur 9. Fall av klarcellig njurcancer som visar WHO/ISUP grad 1–4 (hematoxylin- och eosininfärgning, storleksskala bar 50 µm).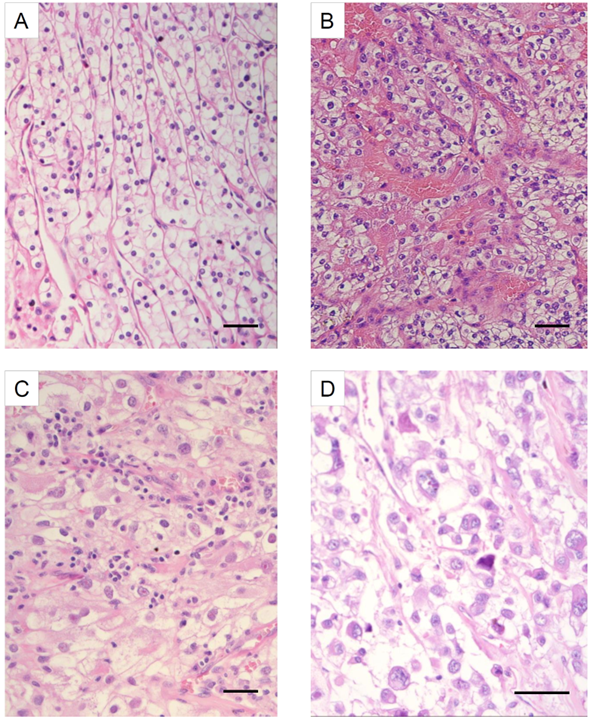
- WHO/ISUP grad 1 med små runda cellkärnor och osynligt nukleol vid 400 x förstoring.
- WHO/ISUP grad 2 med något större kärnor, och synliga nukleoler vid 400 x förstoring.
- WHO/ISUP grad 3 med makronukleoler tydligt synliga vid 100 x förstoring. Dessutom är nukleolerna röda (eosinofila).
- WHO/ISUP grad 4. Här ses utpräglad kärnpleomorfism med irreguljära cellkärnor och mycket prominent, ofta eosinofil nukleol.
Anvisningar för provtagarens hantering av provet
Nefrektomier och resektioner
Operationspreparatet hanteras enligt lokala överenskommelser mellan patologavdelning och opererande klinik och kan antingen skickas i formalin eller färskt. Tidig formalinfixering eller snabb transport är viktig, då fördröjd fixering (autolys) kan inverka negativt på senare analyser såsom immunhistokemi och molekylärpatologi. Njurvenen liksom uretären bör alltid märkas ut. På preparat som inskickas i formalin bör klinikern lägga ett fixeringssnitt från lateralsidan men som ej går igenom hela njuren. Snittet får ej gå igenom hilusområdet då detta försvårar bedömningen för patologen. Som fixativ rekommenderas buffrad formalin 10 % (formaldehyd 4 %). Använd en volym motsvarande minst 10 gånger preparatvikten. Om färskfrusen vävnad ska kunna tas till biobank måste operationspreparatet skickas färskt (eventuellt på is) och tiden för avstängning av tillförande kärl (ischemis inträdande) noteras. Färskfrusen vävnad är att föredra när det gäller molekylärgenetiska analyser (t.ex. NGS), eftersom formalinfixeringen degraderar DNA/RNA och inducerar artefaktiva basmutationer. NGS på formalinfixerad vävnad har dock blivit standard och ger i de flesta fall adekvata resultat.
Njurbiopsier
Vi hänvisar till avsnitt 8.6 Biopsi ovan för fullödig genomgång av biopsiproceduren. Finnålspunktion bör användas endast då mellannålsbiopsi inte kan göras. Ovan anges den vanligaste nålkalibern till 18G, men ur histologisk synvinkel är 16G att föredra, då chansen att få representativt material och därigenom konklusiv diagnos ökar. Oavsett så placeras biopsimaterialet direkt i kärl innehållande formalin. Om biopsierna är tagna från olika lokaler så ska detta anges tydligt och preparatburkarna märkas med siffor vilka i remissen förses med förklarande text.
Anamnestisk remissinformation
Remissen bör innehålla upplysningar av relevans för den patologiska bedömningen. Minimum är: sidoangivelse, beskrivning av de olika fraktionerna och kliniskt TNM-stadium (tabell 4), ev. ventromb. Om binjuren medföljer så ska detta anges. Klinisk diagnos, relevanta tidigare fynd och eventuell behandling som kan påverka bedömningen (ablation, resektion, strålning etc.) bör anges. Om patienten har konstaterad eller misstänkt ärftlig tumörsjukdom är det värdefullt om denna information anges. Behållaren med njurpreparatet och eventuellt andra preparatfraktioner ska samtliga märkas med patientuppgifter och kopplas till remissens uppgifter om fraktionerna.
Klassificering av tumören
Det tekniska omhändertagandet av nefrektomier och njurresektioner på patologavdelningen finns beskrivet i detalj i ett så kallat KVAST-dokument som uppdateras kontinuerligt med ungefär samma intervall som WHO-böckerna och finns att tillgå via Svensk förening för patologi.
Patologens utlåtande ska alltid innehålla följande uppgifter:
- preparattyp (nefrektomi/resektion)
- tumörstorlek (mm)
- tumörtyp (WHO)
- tumörbeskrivning: % nekros (förekomst av nekros har prognostiskt värde i samtliga cancrar utom i papillär njurcancer; i klarcellig RCC är omfattande nekros (> 10 %) kopplat till sämre prognos), förekomst av sarkomatoid/rabdoid differentiering, samt allmän beskrivning
- WHO/ISUP-grad
- tumörinfiltration: hilusfett, perirenal fettväv/igenom Gerotas fascia
- tumörväxt i njurven, segmentala grenar: ja/nej
- lymfovaskulär tumörväxt: ja/nej
- tumörväxt i binjure: (direkt tumöröverväxt eller metastas)
- lymfkörtlar: antal undersökta varav med metastas
- radikal resektion: (ja/nej/ej bedömbar)
- övrig njurvävnad: (ange om annan patologi förekommer)
- pTNM.
Svarsutlåtandet kan presenteras i fri text, men användande av standardiserad svarsmall rekommenderas starkt. KVAST-dokumentet för njurcancer innehåller ett exempel på svarsmall som redan används i stora delar av Sverige.
Tabell 4. TNM-stadiegruppering, där tumörstorlek baseras på DT eller MRT.
|
Stage I |
T1 |
N0 |
M0 |
|
Stage II |
T2 |
N0 |
M0 |
|
Stage III |
T3 |
N0 |
M0 |
|
|
T1, 2, 3 |
N1 |
M0 |
|
Stage IV |
T4 |
Any N |
M0 |
|
|
Any T |
Any N |
M1 |
Källa: Brierley et al. 53.
