Kategorisering av tumören
Stadieindelning
Stadieindelning av livmoderhalscancer enligt TNM och FIGO år 2018 [51]
|
TNM |
FIGO |
|
|
T1 |
Stadium I |
Tumör begränsad till cervix. Ingen hänsyn tas till utbredning i corpus. |
|
T1a |
Stadium IA |
Endast mikroskopiskt identifierad stromainvasion.a |
|
T1a1 |
Stadium IA1 |
Invasionsdjup ≤ 3 mm. |
|
T1a2 |
Stadium IA2 |
Invasionsdjup > 3 mm och ≤ 5 mm. |
|
T1b |
Stadium IB |
Mikroskopiska lesioner större än stadium IA eller makroskopiska lesioner begränsade till cervix. |
|
T1b1 |
Stadium IB1 |
Makroskopiska lesioner med invasionsdjup > 5 mm och/eller synlig tumör ≤ 2 cm i största dimension. |
|
T1b2 |
Stadium IB2 |
Makroskopiska lesioner > 2 cm och ≤ 4 cm i största dimension. |
|
T1b3 |
Stadium IB3 |
Makroskopiska lesioner > 4 cm |
|
T2 |
Stadium II |
Utbredning utanför cervix/corpus, men har inte nått bäckenväggen eller nedre 1/3 av vagina. |
|
T2a |
Stadium IIA |
Växt i övre 2/3 av vagina men inte i parametrier. |
|
T2a1 |
Stadium IIA1 |
Klinisk tumör med största diameter ≤ 4 cm. |
|
T2a2 |
Stadium IIA2 |
Klinisk tumör med diameter > 4 cm. |
|
T2b |
Stadium IIB |
Utväxt i parametrier. |
|
T3 |
Stadium III |
Utbredning till bäckenväggen eller nedre 1/3 av vagina. Hydronefros eller tyst njure utan annan känd orsak. Pelvina och/eller paraaortala lymfkörtelmetastaser.b |
|
T3a |
Stadium IIIA |
Tumör har nått nedre 1/3 av vagina men inte bäckenväggen. |
|
T3b |
Stadium IIIB |
Tumör har nått bäckenväggen och/eller hydronefros och/eller tyst njure. |
|
|
Stadium IIIC |
Tumör med metastas i pelvina/paraaortala lymfkörtlar (inklusive mikrometastaser)C oavsett tumörstorlek och utbredning. |
|
TXdN1e |
Stadium IIIC1 |
Enbart pelvina lymfkörtelmetastaser. |
|
TXN2 |
Stadium IIIC2 |
Paraaortala lymfkörtelmetastaser. |
|
T4 |
Stadium IV |
Tumörutbredning utanför lilla bäckenet och/eller klinisk överväxt på blås- eller rektalslemhinna. |
|
T4 |
Stadium IVA |
Överväxt på intilliggande organ. |
|
TXNXM1f |
Stadium IVB |
Fjärrmetastasering. |
a Bilddiagnostik och histopatologiska fynd får användas som komplement till kliniska undersökningsfynd i alla stadier. Histopatologi ersätter alltid kliniska fynd och/eller bilddiagnostik.
b Tillägg av r (för radiologi) eller p (för patologi) beskriver hur stadium IIIC fastställts (t.ex. anger IIIC1r att radiologi använts för stadieindelningen och IIIC2p patologi).
c Förekomst av isolerade tumörceller ändrar inte stadiet men ska registreras.
d X refererar här till alla substadier för både T och N.
e Tillägg med ”mi” kan göras för mikrometastaser (> 0,2–≤ 2 mm) eller ”sn” för metastas upptäckt genom portvaktskörtelbiopsi.
f Exkluderar metastaser till vagina, pelvin serosa och adnexa.
Ockult livmoderhalscancer (oväntad diagnos av livmoderhalscancer vid kirurgi med annan indikation) kan inte stadieindelas enligt FIGO, i stället används TNM-klassifikationen (t.ex. pT1b1) för adekvat informationsöverföring mellan vårdgivare, men registreras som okänt stadium.
Stadieindelning av invasiv vaginalcancer enligt AJCC*, TNM och FIGO klassifikationen fr.o.m. 2023-01-01 [112]
*Tidigare FIGO klassifikation, se bilaga 7.
|
AJCC |
TNM |
FIGO |
|
|
|
TX |
|
Primärtumör kan ej bedömas |
|
|
T0 |
|
Inga hållpunkter för primärtumör |
|
|
Tis |
0 |
Cancer in situ, intraepitelial neoplasi grad III (VAIN III) |
|
IA |
T1a |
I |
Tumören begränsad till vaginalväggen ≤2.0cm(infiltrationsdjup ≥2,5mm) Mikroinvasiv cancer infiltrationsdjup <2,5mm) |
|
IB |
T1b |
I |
Tumören begränsad till vaginalväggen >2.0cm |
|
IIA |
T2a |
II |
Tumören engagerar subvaginal vävnad, men når inte bäckenväggen tumörstorlek ≤2.0cm |
|
IIB |
T2b |
II |
Tumören engagerar subvaginal vävnad, men når inte bäckenväggen tumörstorlek >2.0cm |
|
III |
T1-T3 |
III |
Tumören växer ut på bäckenväggen och/eller nedväxt i nedre 1/3 av vagina och/eller hydronefros. Spridning till lymfkörtlar i bäckenet eller ljumskar (N1) |
|
III |
T3 |
III |
Tumören växer ut på bäckenväggen och/eller nedväxt i nedre 1/3 av vagina och/eller hydronefros. Ingen spridning till lymfkörtlar |
|
|
|
IV |
Tumören har spridit sig utanför bäckenet eller involverar angränsande organ (blåsa och tarm) |
|
IVA |
T4 |
IVA |
Tumören växer över på närliggande organ (blåsa och/eller tarm) |
|
IVB |
T1-T4 N0-1 M1 |
IVB |
Fjärrmetastaser föreligger |
*American Joint Committee on Cancer
Gäller fr.o.m. 2023-01-01 (även för registrering i kvalitetsregistret).
Patologi
Klassifikationen inom histopatologi för livmoderhals- och vaginalcancer grundar sig på World Health Organization Classification of Tumours of the Female Genital Tract, 2014 113. För utförlig information, se vidare bilaga 8, KVAST-dokument, Cervix histopatologi.
Patologins roll i den diagnostiska processen
Patologens uppgift är att utifrån insänt material komma fram till en histopatologisk diagnos som klinikerna kan använda till att bedöma prognos och därmed vidare handläggning av patienten. Patologen gör en sammantagen morfologisk bedömning av förändringarnas utbredning och gradering som förutsätter kliniska data på remissen samt tillräcklig mängd och kvalitet på det insända materialet. I den diagnostiska processen är därför kommunikation mellan klinikerna och patologen av största vikt.
Anvisningar för provtagarens hantering av provet
Biopsi
- Biopsier och skrapmaterial fixeras i 10 % neutral buffrad formalin (4 % formaldehyd).
- Biopsier fästa på papper kan underlätta orientering på laboratoriet.
- Mycket små biopsier är svåra att orientera och omhänderta optimalt.
Slyngkon
Det är optimalt om en ”hel” slyngkon öppnas vid kl. 12 i färskt tillstånd och nålas på korkplatta. Om detta görs av operatören eller på labb beror på om konen kan skickas färsk till labb inom tillräckligt kort tid för att inte riskera autolys. Hantering av en oöppnad och fixerad kon är mindre optimalt. Om konen går sönder eller tas ut i flera delar är ändå montering av värde, för att underlätta orienteringen av preparatstyckena. I så fall anges orienteringen av de uppnålade fragmenten av inremitterande läkare.
Små och tunna slyng- eller laserpreparat uppvisar ofta termiska skador i resektionsytorna. Slemhinnan och underliggande stroma krymper olika mycket vid fixering vilket leder till att preparatet kan deformeras. Preparatet blir då svårt att orientera vid hanteringen på laboratoriet, och detta kan inverka negativt på bedömbarheten, i synnerhet avseende HSIL/AIS-relation till resektionsytorna.
I en ”hel” kon orienterad enligt remiss och uppnålad på kork, kan resektionsytorna oftast bedömas och orienteras på ett bra och säkert sätt.
Koniseringsmaterial
- Slyngexcisioner bör öppnas och nålas upp på korkplatta med den epitelbeklädda ytan uppåt. Även små och tunna excisionspreparat samt preparat i flera delar nålas upp.
- Excisionens endocervikala preparatkant bör markeras, om preparatet kan orienteras.
- Preparat som av någon anledning inte kan öppnas nålas även dessa upp på korkskiva.
Hysterektomi
Det är optimalt om rutiner finns för transport av färskt operationspreparat från operationssalen till patolog-labb, och att labbet får resurser och utrymme för säkert omhändertagande av färska preparat. Om transporten kan ske under samma dag kan preparatet skickas direkt. Om labbet är stängt kan preparatet förvaras i kylskåp i +4° C under natten och sedan transporteras till nästa dag.
Det är viktigt att ett preparat inte står ofixerat i rumstemperatur. Ett preparat bör inte heller stå i +4° C mer än 24 timmar. Uterus bör öppnas för att möjliggöra bra fixering med formalin. Det finns flera sätt att öppna en uterus och i bästa fall utvecklas lokala rutiner för detta.
Anamnestisk remissinformation
Informationen på remissen bör vara läslig och rätt placerad i enligt med lokala bestämmelser.
För optimal morfologisk bedömning krävs i anamnesdelen:
- Klinisk frågeställning och indikation för åtgärden.
- tidigare behandling
- Relevanta tidigare PAD och relevanta uppgifter om cervikal screening-sjukhistoria (om tillgänglig).
- graviditet, smittsamma sjukdomar, amningsatrofi, gestagenbehandling.
- Klinisk beskrivning av förändringen/förändringarna.
- Kolposkopiskt fynd (ev. SWEDE-score), alt “blinda” biopsier och eventuell kolposkopisk misstanke om invasivitet.
- Vid biopsier: om patienten är 27 år eller yngre och det behövs indelning i HSIL (CIN2) och HSIL (CIN3) anges det med fördel i anamnesen.
I PAD-svaret bör anges:
- Tumörtyp
- Tumörstorlek
- Invasionsdjup
- Eventuell kärlinvasion
- Tumörfria marginaler mot djupet och sidoresektionskanterna.
- Antal lymfkörtlar totalt resp. med metastas, från respektive lymfkörtelstation.
Portvaktskörtelbiopsi
Sentinel node: Det saknas evidens för att rekommendera ett specifikt protokoll för snittning av sentinel node. Här följer ett förslag på hantering: Sentinel node snittas i minst 3 nivåer, förslagsvis med 200 µm mellan snittnivåerna och ett snitt färgas med bred cytokeratinfärgning (till exempel CKAE1/AE3 eller MNF116).
Möjligheten att identifiera mikrometastaser förbättras om flera snittnivåer undersöks och IHC för cytokeratin (Diaz 2011). Förekomst av metastas eller isolerade tumörceller (≤ 0,2 mm eller < 200 tumörceller) rapporteras.
PDL1-analys
Inför ställningstagande till behandling med Pembrolizumab ska invasiv tumörvävnad analyseras avseende PD-L1 uttryck med combined positive score (CPS) 114. CPS definieras som antalet infärgade viabla tumörceller och tumörassocierade immunceller (lymfocyter/makrofager) dividerat med antalet viabla tumörceller på snittet. Kvoten multipliceras sedan med 100 för att få CPS-värdet. Positiva tumörceller har komplett eller partiell membranös infärgning medan positiva immunceller har membranös eller cytoplasmatisk infärgning. Resultatet bör rapporteras som PD-L1 positiv (CPS > 1), eller PD-L1 negativ (CPS < 1).
Skivepitelförändringar i cervix
Icke-invasiva skivepitelförändringar i cervix
Klassifikationen inom histopatologi grundar sig på World Health Organization Classification of Tumours of the Female Genital Tract, 2020, som rekommenderar indelning i låggradiga och höggradiga skivepitellesioner alltså LSIL och HSIL.
Vid LSIL ses i de ytliga delarna av epitelet HPV-påverkan i form av koilocytos (stora, multinukleära och viruspåverkade celler). Histomorfologiskt kan man se en proliferation av basala och parabasala celler som kan vara minimal, men som även kan sträcka sig upp till en tredjedel av epitelets tjocklek (Fig PAT-2). Mitoser ses mest inom de mer parabasala delarna av epitelet. LSIL kan orsakas av infektion med alla typer av HPV. Cirka 60% är negativa eller fläckvis positiva vid immunfärgning för p16, men cirka 40% är positiva.
Skivepitelförändringar som inte uppfyller kriterierna för LSIL är icke-diagnostiska för HPV-infektion, och bör diagnostiseras som normalt skivepitel eller med beskrivande diagnos (t ex "normalt/icke dysplastiskt skivepitel").
Morfologin vid HSIL ses som en proliferation av atypiska, ofta hyperkromatiska, keratinocyter, med ökad ökad kärn-cytoplasma-ratio, och oregelbundna kärnmembran samt förekomst av mitoser, även atypiska. Vid HSIL, tidigare CIN2, finns atypiska basaloida celler i högst 2/3 av skivepitelet med koilocyter mot ytan och vid HSIL, tidigare CIN3, finns atypiska celler upp i översta tredjedelen av skivepitelet. Mitoser ses ofta i mellersta och/eller ytliga tredjedelen av epitelet. HSIL är oftast positiv vid immunfärgning för p16, dock finns enstaka undantag, varför färgning av uppenbart HSIL(CIN3) inte rekommenderas.
Vid diagnos av HSIL på biopsi hos en patient som är 27 år eller yngre, där morfologin motsvarar det som i det tidigare klassifikationssystemet kallas "CIN2", kan benämningen HSIL(CIN2) vara relevant. Beroende på samlade kliniska och patologiska faktorer kan kvinnan följas med expektans.
Figur 6. Cervixepitel med olika dysplasi-grader och övergång i cancer 115.
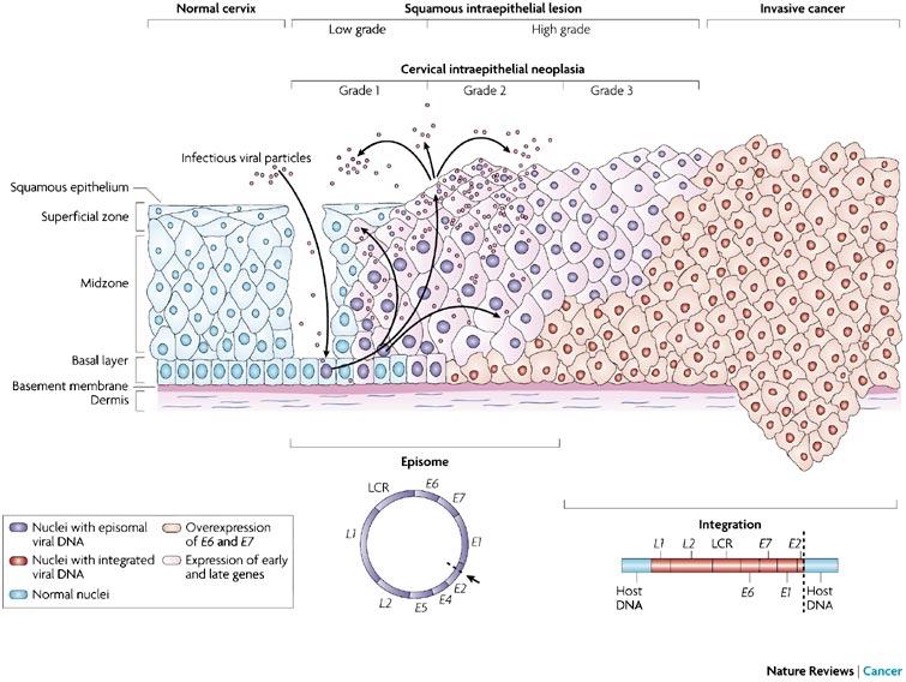
Invasiv skivepitelcancer i cervix
|
Skivepitelcancer, HPV-associerad |
|
Skivepitelcancer, HPV-oberoende |
Majoriteten (95 %) av skivepitelcancerfallen i cervix är HPV-orsakade; p16-färgning och/eller molekylär subtypning av HPV rekommenderas för att avgöra om ett fall är HPV-associerat eller inte.
Histologiskt växtmönster, HPV-typ eller tumörgrad förefaller ej ha prognostisk betydelse, däremot diagnosticeras ofta HPV-oberoende skivepitelcancer i avancerat stadium vilket medför sämre överlevnad.
Glandulär neoplasi i cervix
Adenokarcinom in situ (AIS)
Merparten av cervikala adenocarcinom, minst 94 %, är HPV-relaterade, vanligast är typerna 16 och 18. HPV-typ 18 är vanligare i den glandulära neoplastiska processen än typ 16. Det finns dessutom varianter med intestinal, gastrisk m.fl. differentiering som ofta är HPV-negativa.
Invasivt adenokarcinom, HPV-associerat
|
Adenocarcinom, HPV-associerat, vanlig typ |
|
Adenocarcinom, HPV-associerat, mucinös typ |
Majoriteten av alla endocervikala adenocarcinom orsakas av HPV 16, 18 eller 45. De HPV-associerade adenocarcinomen delas in i vanlig- och mucinös typ.
Växtmönster
HPV-associerade adenocarcinom klassificeras enligt WHO 2020 i tre grupper baserat på växtmönster (Silvasystemet). Destruktiv invasion har visat sig vara kopplat till högre risk för lymfkörtelmetastaser, högre återfallsrisk och sämre överlevnad (Diaz 2013, Roma 2015).
Mönster A (icke destruktiv invasion)
Detta mönster karaktäriseras av välavgränsade, rundade körtlar samt avsaknad av LVSI och solid växt. Inne i körtlarna kan mönstret vara komplext (kribriformt eller papillärt). Gränsdragningen mellan AIS och invasivt adenocarcinom med mönster A kan vara mycket svår, den är också dåligt reproducerbar. Svårvärderade fall kan svaras ut som ”möjlig invasion” med måttangivelse.
Mönster B (tidig/fokal destruktiv invasion)
Foci av cellgrupper eller enskilda celler ligger i desmoplastiskt eller inflammerat stroma skilda från de rundade körtlarna. Dessa foci kan vara enstaka eller multipla. Kärlinväxt kan förekomma, men inte solid tumörväxt.
Mönster C (diffus destruktiv invasion)
Diffus invasion med utbredd desmoplastisk reaktion. Körtlarna är ofta spretiga. Konfluerande växt av körtlar/papiller eller mucinsjöar som upptar mer än ett 5 mm stort område räknas också som typ C mönster.
Adenocarcinom, HPV-oberoende
|
Adenocarcinom, HPV-oberoende, gastrisk typ |
|
Adenocarcinom, HPV-oberoende, klarcellig typ |
|
Adenocarcinom, HPV-oberoende, mesonefrisk typ |
|
Endometrioid cancer |
|
Adenocarcinom, HPV-oberoende, UNS |
|
Endocervikalt adenokarcinom, vanlig typ |
|
Mucinös cancer, UNS |
|
Mucinös cancer, gastrisk typ |
|
Mucinös cancer, intestinal typ |
|
Mucinös cancer, signetringscell-typ |
|
Villoglandulär cancer |
|
Endometrioid cancer |
|
Klarcellig cancer |
|
Serös cancer |
|
Mesonefrisk cancer |
Övriga epiteliala tumörer
|
Adenoskvamös cancer |
|
Adenoidcystisk cancer |
|
Neuroendokrina tumörer |
|
Adenoid basalcellscancer |
Patologi vid vaginalcancer
För övrig text om vaginalcancer, se kapitel 11 Primär vaginalcancer.
Vid operation
Preparatet nålas upp på en korkskiva för att minska deformering. (Obs! Använd inte frigolitplatta som inte släpper fram formalinet och inte håller nålarna på plats.) Bifoga en skiss över orienteringen. Preparatet fixeras i formalinmängd (4–6 % buffrad formalin) motsvarande 10 ggr volymen (sedvanlig metod).
Vid utskärning:
Mät preparat och tumör samt minsta avståndet till resektionskanterna. Bitar tas från djupaste tumörväxten, största tumörutbredningen samt minsta resektionskanterna mot sidokanterna och mot djupet.
I PAD-svaret bör anges:
- Tumörtyp och differentieringsgrad.
- Yt-utbredning.
- Invasionsdjup
- Tumörfria marginaler mot djupet och sidoresektionskanterna.
- Antal lymfkörtlar totalt resp. med metastas, från respektive lymfkörtelstation.
Skivepitelcancer
Skivepitelcancer i vagina delas på samma sätt som i cervix in i HPV-associerad och HPV-oberoende tumör . Majoriteten av fallen är HPV-orsakade.
För diagnos krävs frånvaro av samtidig cancer i vulva eller cervix, samt minst 5 års marginal till tidigare cervix- eller vulvacancer.
Olika subtyper finns, t.ex. verrukös, vårtig, papillär och basaloid. Den mest frekventa tumörtypen är medelhögt differentierad icke keratiniserande skivepitelcancer.
Prognos:
Kliniskt stadium är viktigast. HPV-associerade tumörer har bättre prognos än HPV-oberoende.
Klarcellscancer
Vaginal klarcellscancer är mycket sällsynt. Två tredjedelar av patienterna är yngre än 40 år. Viss koppling finns till DES-påverkan in utero (diethylstilbestrol).
Tumörer utvecklas vanligen anteriort och i övre tredjedelen av vagina.
Oftast tubulocystiskt alternativt solitt eller blandat växtsätt. Den dominerande celltypen är vanligen celler med ljus/klar cytoplasma som innehåller riklig mängd intracytoplasmatiskt glykogen eller ”hobnail-celler” med sparsam cytoplasma, men flata celler. Vakuoler eller eosinofil, granulär cytoplasma finns också. Cellkärnan visar varierande grad av atypi. Låg mitotisk aktivitet.
Slem kan ses i lumen men inte intracytoplasmatiskt.
Differentialdiagnoser: Mikroglandulär hyperplasi, Arias-Stellas fenomen, endodermal sinustumör, metastatisk njurcancer.
Immunhistokemi: Positiv för CK7, CAM5.2, 34beta E12, CEA, CA-125 och HNF-1b med varierande positivitet för ER och negativitet för CK20 och PR.
Övriga adenocarcinom
Övriga adenokarcinom i vagina är ovanliga:
- Endometrioid cancer
- Mucinös cancer
- Mesonefrisk cancer
- Adenoskvamös cancer
- Höggradig neuroendokrin cancer
Övriga
Övriga tumörer i vagina är mycket ovanliga.
Mesenchymala tumörer
- Leiomyosarkom
- Rabdomyosarkom
- Embryonalt rabdomyosarkom
- Odifferentierat sarkom
Bifasiska tumörer
- Adenosarkom
- Karcinosarkom
Malignt melanom
Ovanlig tumör i vagina (ca 4 % av maligna tumörer i vagina).
Hanteras som motsvarande hudtumör.
