Primär vaginalcancer
Epidemiologi
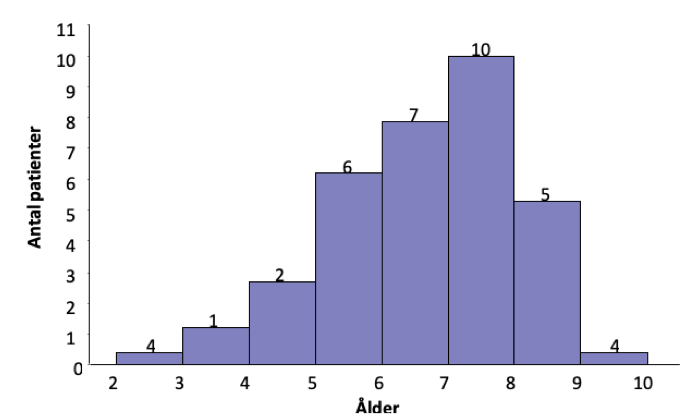
Primär vaginalcancer (PVC) är relativt sällsynt och utgör cirka 1–2 % av alla gynekologiska maligniteter 298. Sedan Cancerregistret startade 1958 har incidensen i Sverige varit ganska stabil med 30–40 rapporterade fall per år (0,6 fall per 100 000 kvinnor i Sverige år 2016) . Högst incidens i världen har påvisats i Sydamerika, bland svarta i USA och i Indien. PVC drabbar oftast äldre postmenopausala kvinnor med en incidenstopp vid 70–79 år (figur 13) Gunderson, 2013 #597}. Endast cirka 15 % är yngre än 50 år vid diagnos 300.
Se Cancerincidens på fem kontinenter, Volume XI (CI5 XI): World Health Organization.
Figur 13. Ålder vid diagnos hos patienter med vaginalcancer. Medelålder 67 år (spridning 22–93 år). Data från Radiumhemmets material omfattande 341 patienter behandlade 1956–1996.
Etiologi och riskfaktorer
Kännedom om epidemiologi och etiologi är bristfällig, då studier i litteraturen grundas på relativt små retrospektiva material (ofta färre än 100 fall) och endast några få fall–kontroll-studier finns 301302303304. Flera disponerande faktorer har framhållits och man har antagit att vaginal- och livmoderhalscancer har liknande etiologi.
Liksom livmoderhalscancer är PVC sannolikt i hög grad relaterat till infektion med humant papillomvirus (HPV), vilket har påvisats i cirka 65–75 % av PVC-fallen, där högrisk-HPV16 är vanligast (54–59 %) 305306307. I vaginala dysplasier (VaIN) har HPV påvisats i nästan samtliga fall. I en metaanalys av 14 studier fann man en genomsnittlig HPV-förekomst på 100 %, 90,1 % respektive 69,9 % i 107 VaIN 1, 191 VaIN 2–3 och 136 PVC 305. I en internationell studie analyserades 189 VaIN 2–3 och 408 PVC från 31 länder där man påvisade HPV-förekomst i 74 % av PVC och i 96 % av VaIN 2–3 306.
Vanliga bakgrundsfaktorer hos patienter med PVC är tidigare cervixdysplasi (CIN), vaginal dysplasi (VaIN), invasiv livmoderhalscancer, strålbehandling mot bäckenet samt tidigare hysterektomi. Cirka 30 % av patienterna har haft cervixdysplasi eller invasiv livmoderhalscancer mer än fem år tidigare 303308, se Cancerincidens på fem kontinenter, Volume XI (CI5 XI): World Health Organization. Av kvinnor med vaginal dysplasi har 80 % haft samtidig, tidigare eller efterföljande CIN eller VIN 309310. Detta stöder teorin om multifokalt förekommande epiteliala dysplasier samt neoplasier i cervix, vagina och vulva 300311 samt också antagandet att cancer i cervix och vagina (samt även vulva) har liknande etiologi.
Cirka 50 % av patienterna med PVC har genomgått total hysterektomi 304312313314. I posthysterektomigruppen är det vanligare att vaginaltumören är lokaliserad till övre tredjedelen av vagina än hos de icke hysterektomerade (62–75 % och 34–38 % vardera) 313315.
Tänkbara mekanismer för uppkomst av PVC hos en patient tidigare behandlad för CIN eller livmoderhalscancer är ockult resttumör, persisterande HPV-infektion, strålinducerad cancer eller en ny primärcancer hos en högriskindivid.
Det har i litteraturen diskuterats om kvinnor som genomgått total hysterektomi bör följas med cellprov, men då risken att utveckla PVC är mycket liten anses detta inte kostnadseffektivt. Däremot med hänsyn till den ofta multifokala karaktären av dysplasier i cervix och vagina bör kvinnor hysterektomerade p.g.a. CIN 3 följas med dubbelanalys (HPV-test och cytologi) 31316. För rekommendationer se kapitel 14 Uppföljning.
De för livmoderhalscancer välkända riskfaktorerna innebär sannolikt också ökad risk för PVC 303304.
Andra riskfaktorer beskrivna i litteraturen är kronisk irritation och trauma till vagina (orsakat av prolaps, ringbehandling under lång tid, vaginalplastik, multiparitet > 5) samt hormonella faktorer (nulliparitet, sen menarche, tidig menopaus), men inga säkra samband finns.
En viktig skillnad mellan vaginal- och livmoderhalscancer är att de uppträder i olika åldersgrupper.
Patologi och hantering av operationspreparat
Se avsnitt 7.2 Patologi vid vaginalcancer. I analogi med diskussioner kring förändrad terminologi vid cervixdysplasi (från CIN 1–3, till LSIL/HSIL) pågår liknande diskussioner kring vaginaldysplasi (från VaIN 1–3, till LSIL/HSIL). Se vidare avsnitt 7.1.7 Skivepitelförändringar i cervix.
Melanom i vagina är mycket ovanligt. Multidisciplinär handläggning, se patologiavsnittet.
Prognostiska faktorer
Den enligt litteraturen viktigaste prognostiska faktorn är kliniskt stadium, som beskriver djupet av tumörväxt in i vaginas vägg och omgivande vävnad. Shah et al. (SEER, 2 149 fall) visade att stadium, tumörstorlek, ålder och behandlingstyp signifikant påverkar överlevnaden vid PVC 317. Flera studier har påvisat att en tumörstorlek på ≤ 4 cm är associerat med bättre överlevnad än en tumörstorlek på > 4 cm 312317318319320.
Det finns motstridiga uppgifter i litteraturen beträffande den prognostiska betydelsen av histologi, differentieringsgrad och tumörlokalisation i vagina. Däremot har de icke-epiteliala maligniteterna melanom och sarkom i vagina mycket dålig prognos med hög risk för lokalt återfall och fjärrmetastaser 317321. Av de från ytepitelet utgående tumörerna har adenokarcinom i några studier påvisats ha sämre prognos jämfört med skivepitelcancer 321. Chyle och medarbetare påvisade signifikant högre risk för lokalt återfall, fjärrmetastaser samt sämre 10-årsöverlevnad vid adenokarcinom jämfört med skivepitelcancer 312.
Spridning till lymfkörtlar i ljumskarna vid diagnos är starkt korrelerat till dålig prognos samt även inväxt i septum rektovaginale vilket indikerar ett mer aggressivt växtsätt. I en studie av Pingley och medarbetare omfattande 134 patienter var 5-årsöverlevnaden vid negativa och positiva lymfkörtlar i ljumskarna 56 % respektive 33 %. Vid positiva körtlar var tumören lokaliserad till nedre tredjedelen av vagina i samtliga fall 322.
Kännedomen om histopatologiska och molekylärbiologiska prognosfaktorer vid PVC är bristfällig, men sammanställd kunskap finns publicerad i litteraturen 308323. PVC uppvisar hög proliferationsaktivitet, högt uttryck av p21 och lågt uttryck av p53 och pRb. Liksom vid livmoderhalscancer är sannolikt p53 och pRb framför allt funktionellt inaktiverade av virala onkogena proteiner (E6 och E7) från HPV (humant papillomvirus) 16 och 18 och endast i mindre utsträckning till följd av genmutation. I några fall har överuttryck av EGFR och c-erbB2 påvisats. De flesta PVC uppvisar aneuploid DNA-profil och frekventa kromosomala avvikelser ofta lokaliserade till kromosom 3q liksom vid livmoderhalscancer. Prognostisk betydelse av ovanstående biologiska markörer har inte observerats eller utvärderats. Senare studier har påvisat en positiv korrelation mellan högt uttryck av p16INK4A och förekomst av HPV i PVC. HPV-positivitet har också associerats med bättre prognos 324325326 samt likaledes högt uttryck av p16INK4A 327328.
Proteomikstudier på PVC har visat signifikant olika proteinuttryck i PVC, livmoderhalscancer och normal vaginalvävnad, och med hjälp av dessa proteiner har de tre vävnadstyperna korrekt klassificerats i tre grupper 329. Fortsatta proteomikstudier med större material kan bidra till att hitta specifika proteinuttryck för diagnostik, prognos och behandlingsval.
Klassifikation och stadieindelning
Primär PVC definieras som en tumör enbart lokaliserad till vagina. Tumörer med samtidigt engagemang av cervix, vulva eller uretra klassificeras som cervix-, vulva- respektive uretracancer. Stadieindelningen av PVC är klinisk och sker enligt FIGO-klassifikationen 321330. TNM-klassifikationen är ett annat stadieindelningssystem utarbetat av AJCC (American Joint Committee on Cancer).
Radiologisk utredning med MRT och DT eller PET/DT rekommenderas för kartläggning av tumörutbredningen. Resultaten av de radiologiska undersökningarna får dock inte påverka den kliniska stadieindelningen, men ska vägas in vid behandlingsplaneringen (framför allt förekomst av misstänkta lymfkörtelmetastaser).
Den nuvarande stadieindelningen av PVC enligt FIGO antogs 1963. Stadium IV har senare subgrupperats till IVA och IVB (tabell 1). Modifiering har föreslagits av stadium II till IIA (tumören växer submuköst i vagina, men inte ut i parametrier) och IIB (tumören involverar parametriet, men når inte ut till bäckenväggen) 331332. Denna uppdelning har dock inte genomförts då den inte visat sig ha någon prognostisk betydelse. . Tumörstorleken är inte heller närmare specificerad i FIGO -klassifikationen. Studier har dock visat att tumörstorlek korrelerar starkt till överlevnad (se avsnitt 11.4 Prognostiska faktorer). I TNM- och AJCC-klassifikationerna har man delat upp stadium I och II beroende på tumörstorlek ≤ 2 cm och > 2 cm (se avsnitt 7.1.2). TNM-klassifikationen rekommenderas som komplement till FIGO.
För stadieindelning, se avsnitt 7.1.2 Stadieindelning av vaginalcancer enligt AJCC, TNM 333 och FIGO år 2009 112334.
Spridningsvägar
PVC sprider sig primärt till regionala lymfkörtlar och per continuitatem till närliggande organ (uretra, urinblåsa och rektum). I avancerade fall kan fistlar bildas mellan de närliggande organen och vagina.
Den lymfogena spridningen av en tumör i vagina beror i huvudsak på var tumören är lokaliserad. Övre 2/3 av vagina dräneras lymfatiskt på motsvarande sätt som cervix, dvs. huvudsakligen till lymfkörtlarna i bäckenet, medan nedre 1/3 av vagina dräneras på motsvarande sätt som vulva, dvs. huvudsakligen till lymfkörtlarna i ljumskarna, men även till de pelvina körtlarna. Eftersom det lymfatiska dränaget av vagina består av ett utbrett anastomoserande nätverk av lymfkärl i mukosa, submukosa och muskularis, torde dock spridning kunna ske till alla lymfkörtelstationer oavsett tumörlokalisation.
Incidensen av lymfkörtelmetastaser vid PVC är inte välstuderad. Enligt retrospektiva studier förekommer metastaser i bäckenkörtlar i upp till 30 % av fallen vid diagnos med ökad risk vid mer avancerat stadium samt ökad tumörutbredning i vagina (stadium I 6–14 %, stadium II 26–32 %) 335336. Metastaser i inguinala körtlar har påvisats i 10–38 % av fallen vid tumörväxt i vaginas distala tredjedel 336337. Om det inte förelåg tumörväxt i nedre tredjedelen hade 0 % av patienterna spridning till inguinala körtlar 336337 samt 0 % fick återfall i inguinala körtlar 312332338339. Spridning till paraaortala körtlar är mindre vanligt, men det är ökad risk om det föreligger metastaser i bäckenkörtlar.
Hematogen spridning är ovanligt, men fjärrmetastaser kan förekomma i lungor, lever och skelett.
Symtom
Blödning eller flytning är det vanligaste symtomet. I tidiga stadier kan symtom saknas (cirka 10 % av fallen) och tumören upptäcks vid rutinundersökning eller på grund av cellförändringar i cellprov. I sena stadier tillkommer andra symtom oftast orsakade av tryck från tumören såsom tyngdkänsla, smärta, bilateral bensvullnad och besvär från urinblåsa och rektum. Symtomatologin är ofta direkt relaterad till tumörens storlek och lokalisation i vagina. Vid tumörer i främre vaginalväggen överväger symtom från urinblåsan som trängningar och smärta, medan tumörer i bakväggen ofta ger symtom från tarmen, förstoppning, tenesmer eller smärtsam defekation.
Primär PVC är vid diagnos vanligtvis lokaliserad i övre tredjedelen av vagina, i vaginaltoppen eller i bakväggen.
Diagnostik
Diagnosen invasiv PVC fastställs genom biopsi. Bedömning av tumörutbredning inför stadieindelning och behandling sker på liknande sätt som vid livmoderhalscancer, dvs. undersökning i narkos samt magnetresonanstomografi (MRT) av lilla bäckenet och datortomografi (DT) av buk och thorax bör ingå i utredningen för att studera tumörutbredning och spridning till lymfkörtlar. Cystoskopi och rektoskopi utförs endast vid misstanke om tumöröverväxt till urinblåsa och tarm. Differentiering av högt belägen vaginalcancer mot livmoderhalscancer kan vara svår. Applicering av vaginal gel inför MRT-undersökningen underlättar bildtolkningen för radiologen och kan ibland underlätta diagnostik av vaginala fistlar i förbindelse med urinblåsa eller tarm.
MRT är överlägset bättre än DT när det gäller bedömning av tumörens storlek, utbredning och karaktär, men när det gäller säkerheten i bedömningen av patologiska lymfkörtlar anses DT vara likvärdig med MRT 340. Två små studier på PVC med 23 och 29 patienter vardera har visat att FDG-PET-DT är säkrare när det gäller diagnostik av primärtumören i vagina, patologiska lymfkörtlar och fjärrmetastaser än DT 341342.
Portvaktskörtelbiopsi har beskrivits vid primär och recidiverande PVC, för att selektera patienter till lämplig behandling. Studierna omfattar totalt endast fem patienter varför värdet vid PVC är oklart 343344.
Behandling
Allmänna synpunkter
Strålbehandling utgör den primära behandlingen i de flesta fall av PVC. Med hänsyn till de närliggande organen uretra, urinblåsa och tarm har kirurgi en mycket begränsad roll vid primärbehandling.
Med förbättrad strålbehandlingsteknik de senaste 50 åren har överlevnaden för patienter med PVC förbättrats påtagligt. Genom att kombinera brachyterapi (BT) och extern strålbehandling (EBRT) har man erhållit ökad lokal kontroll och förbättrade behandlingsresultat utan att antalet komplikationer ökat 308321345346. Bildbaserad (image-guided) adaptiv brachyterapi (IGABT) vid PVC ger ytterligare förbättrade resultat 347348.
Liksom vid livmoderhalscancer har användandet av radiokemoterapi (kombinerad cytostatika- och strålbehandling) vid PVC ökat påtagligt de senaste åren. Enligt en amerikansk databasstudie (NCDB, National Cancer Data Base) omfattande 8 222 patienter med PVC observerades en ökning av kombinerad cytostatika- och strålbehandling från 20 % till 60 % mellan 1998 och 2011. Man påvisade också en ökad total 5-årsöverlevnad i alla stadier med kombinerad cytostatika- och strålbehandling jämfört med strålbehandling enbart (totalt 6,9 %), och störst effekt på överlevnaden fann man i stadium II–IVA 346. Rekommendationen är därför att patienter med kurativt syftande primär behandling samt med gott allmäntillstånd bör erhålla kombinerad cytostatika- och strålbehandling samt IGABT på motsvarande sätt som vid livmoderhalscancer.
Kirurgisk primärbehandling kan övervägas i vissa fall av stadium I (se nedan) och i stadium IVA med vesiko- eller rektovaginal fistel 308321349. I det senare fallet innebär den kirurgiska behandlingen behov av att utföra olika grader av bäckenexenteration med vaginektomi samt borttagande av urinblåsa och/eller tarm med efterföljande uro- och tarmstomier som orsakar hög sjuklighet för patienten. Avancerad kirurgisk behandling reserveras därför oftast för centrala återfall inom tidigare strålbehandlat område.
Cytostatikabehandling enbart används huvudsakligen på palliativ indikation.
Behandlingsprinciperna följer ofta principerna vid livmoderhals- och vulvacancer, där hänsyn måste tas till patientens ålder, stadium, lokalisation och storlek av vaginaltumören.
Strålbehandling
När det gäller strålbehandlingsteknik, targetdefinitioner, stråldoser till tumör och lymfkörtlar, toleransdoser, behandlingsprinciper, total behandlingstid, organrörelser, anemi och rökning, gäller i princip samma riktlinjer som vid livmoderhalscancer. Studier visar att stråldoser till tumören på > 70 Gy är signifikant korrelerat till ökad OS 308319339345350 men stråldoser på > 72 Gy är relaterat till ökad frekvens av grad 3–4-biverkningar 308319. I analogi med definitiv strålbehandling vid livmoderhalscancer, kan man anta att man bör eftersträva stråldoser på ≥ 85 Gy (EQD2) till HR-CTV, men detta är inte studerat vid PVC, beroende på små patientmaterial, och är ofta inte möjligt med hänsyn tagen till OAR.
Antal brachybehandlingar 308351 samt behandlingstid mindre än 9 veckor 308 var oberoende positiva prognosvariabler i andra studier. De flesta hittills publicerade studier har använt fyrfältsteknik vid EBRT, men i en studie fann man god lokal kontroll samt låg biverkningsfrekvens med IMRT 308319, varför IMRT/VMAT bör eftersträvas även vid PVC såsom vid livmoderhalscancer.
Bildbaserad adaptiv brachyterapi (IGABT)
Resultat från en review artikel och en retrospektiv multicenterstudie har nyligen publicerats där man har undersökt resultatet av nuvarande standardbehandling för PVC med radio(kemo)terapi och IGABT. Resultaten indikerar att IGABT ger bättre lokal kontroll med mindre eller likvärdig toxicitet jämfört med konventionell brachyterapi, särskilt vid mer avancerade tumörer 352353.
I review artikeln sammanställdes resultat från sex små monocentriska studier där man påvisade lokal kontroll på 82–93 % och total överlevnad på 62–91 % efter 2 år. Median dos till den kliniska targetvolymen (CTV): 79 Gy (spridning 73–86 Gy) och allvarlig toxicitet efter 3 år: 2–23 % 352.
I den retrospektiva observationella multicenterstudien (RetroEMBRAVE) inkluderade fem europeiska centra totalt 148 konsekutiva patienter med T1-T4 tumörer, som följdes i median 29 månader (IQR25-57). Efter två samt fem års uppföljning fann man lokal kontroll hos 86 % och 89 % av patienterna, den sjukdomsfria överlevnaden (DFS) var 73 % och 66 % och totala överlevnaden (OS) var 79 % och 68 % respektive. Mediandosen till CTV D90 var 80 Gy EQD2 (IQR 73,0–85,2). Man fann förbättrad lokal kontroll hos T2-T4 tumörer vid doser till CTV på > 80 Gy jämfört med < 80 Gy EQD2 (92 % vs 75 % vid 2 år, p = 0,036). Inget dos-effekt-förhållande påvisades hos små T1 tumörer. Grad 3 toxicitet påvisades hos 17 % av patienterna. Lymfkörtelstatus var den enda oberoende prognosfaktorn för DFS (p = 0,013), med signifikant lägre DFS hos lymfkörtelpositiva jämfört med lymfkörtelnegativa patienter (55 % vs 82 %) 353.
GEC ESTRO gruppen har nyligen utarbetat ett targetkoncept för MRT baserad IGABT vid vaginalcancer med följande targetvolymer: GTV-Tres, CTV-THR och CTV-TIR 354.
En prospektiv multicenterstudie (EMBRAVE) har initierats där targetkoncept för IGABT vid PVC, dos-effekt-förhållanden och toxicitet skall studeras.
Med hänsyn till alltmer avancerad strålbehandlingsteknik vid PVC samt sjukdomens sällsynthet rekommenderas att dessa fall tas upp till diskussion i den nationella strålgruppen.
Cytostatikabehandling
Se också rekommendationer för livmoderhalscancer.
Kännedom om effektiva cytostatika vid vaginalcancer är begränsad. Endast ett fåtal studier finns i litteraturen. I en fas II GOG-studie behandlades 22 patienter med progredierande eller recidiverande PVC med cisplatin (50 mg/m2 var tredje vecka). Man fann en viss effekt, speciellt hos patienter med skivepitelcancer 355. Andra cytostatika där studier visat effekt är paklitaxel och bleomycin, båda i kombination med cisplatin 356357.
Eftersom PVC liknar livmoderhalscancer när det gäller histologi, etiologi och naturalförlopp används ofta samma cytostatikaregimer som vid livmoderhalscancer. Liksom vid livmoderhalscancer rekommenderas kombinerad cytostatika- och strålbehandling med cisplatin veckovis till patienter med kurativt syftande primär behandling 346358359. Kombinerad cytostatika- och strålbehandling med 5-fluorouracil eller mitomycin-C har också visat effekt vid PVC 360.
Neoadjuvant cytostatikabehandling (med cisplatinbaserad kombinationsbehandling) efterföljt av radikal kirurgi har beskrivits ge goda resultat vid PCV stadium II 357361, men liksom vid livmoderhalscancer medför detta ofta även postoperativ strålbehandling och därmed ökad sjuklighet.
Vid primärt metastaserande eller recidiverande PVC är förstahandsvalet ofta cisplatin som singeldrog eller som kombinationsbehandling med ett annat cytostatikum (t.ex. paklitaxel). Kombinationsbehandling rekommenderas till patienter som erhållit cisplatin konkomitant med strålbehandling för bättre effekt, eftersom studier på livmoderhalscancer visat sämre effekt av cisplatin som singelbehandling hos dessa patienter.
Behandling stadium I
Strålbehandling och kirurgi har likvärdiga resultat med en 5-årsöverlevnad på 36–100 % (EBRT + brachyterapi), 44–100 % (brachyterapi enbart) och 56–90 % (kirurgi) 308321349, för mer information se hemsidan för National Cancer Institute.
Ovanstående resultat är svårvärderade då studierna framför allt gällande kirurgi är baserade på små och retrospektiva material, därtill är det oftast de mer gynnsamma fallen som utvalts till kirurgi. Strålbehandling rekommenderas i första hand vid stadium I, men kirurgi kan övervägas i selekterade fall (enligt nedan). Behandlingsvalet avgörs utifrån storlek och utbredning av tumören i vagina samt patientrelaterade faktorer.
Strålbehandling
Vid större tumörer (> 0,5 cm i tjocklek) rekommenderas kombinationsbehandling med brachyterapi och EBRT p.g.a. hög risk för spridning paravaginalt samt till bäckenkörtlar. Den externa strålbehandlingen ges mot vagina (med cirka 4 cm marginal till tumören) och pelvina lymfkörtlar till 45–50 Gy (EQD2). Därefter ges strålbehandling mot ett reducerat område motsvarande resttumören (boost) med BT (IGABT, se avsnitt 11.9.1.2) och/eller EBRT beroende på storlek och utbredning av resttumören. Brachyterapin kan ges med intrakavitär eller interstitiell teknik upp till en totaldos (inkl. EBRT) på 75–85 Gy (EQD2) till vaginalmukosan eller tumörvolymen 362. Om brachyterapi inte är aktuellt ges boost med EBRT mot tumörområdet upp till en total dos på minst 65–70 Gy (EQD2) 312318363, ev. som SIB (simultan integrerad boost), se nedan och avsnitt 10.3.1.1.2. Vid tumörengagemang av nedre tredjedelen av vagina bör även ljumskkörtlarna inkluderas i strålfältet. Kombinerad cytostatika- och strålbehandling med i första hand cisplatin rekommenderas till patienter med gott allmäntillstånd.
Små ytliga tumörer (< 0,5 cm tjocklek) kan behandlas antingen med enbart intrakavitär brachyterapi till en dos av 60–65 Gy till vaginalmukosan/tumören 308332349364365366 (National Cancer Institute), eller kombinationsbehandling med brachyterapi och EBRT 312321351363. Behandlingsvalet bör ske med hänsyn till patientens ålder och samsjuklighet.
Kirurgi
Tumörer i övre delen av vagina som engagerar bakre fornix eller sidofornices kan behandlas på liknande sätt som livmoderhalscancer med radikal (abdominell/robotassisterad) hysterektomi, pelvin lymfkörtelutrymning samt partiell vaginektomi.
Tumörer i nedre delen av vagina kan behandlas på liknande sätt som vulvacancer med partiell vaginektomi/vulvektomi och utrymning av lymfkörtlar i båda ljumskarna.
Vid snäva resektionsränder (< 1 cm) 308 eller lymfkörtelmetastaser bör postoperativ strålbehandling eller kombinerad cytostatika- och strålbehandling ges 308349367 (National Cancer Institute).
Behandling stadium II
Strålbehandling utgör standardbehandling för de flesta patienter med vaginalcancer i stadium II, men kirurgi kan övervägas i enstaka fall. I en översiktsartikel fann man en 5-årsöverlevnad på 13–84 % vid kombinationsbehandling med EBRT och BT, 50–60 % med BT enbart, samt 49–70 % med kirurgisk behandling 349.
Kombinerad cytostatika- och strålbehandling bör övervägas i de flesta fall hos patienter med gott allmäntillstånd 346. Strålbehandling ges som en kombination av EBRT och BT (IGABT, se avsnitt 11.9.1.1 Strålbehandling). Den externa strålbehandlingen ges mot hela vagina och pelvina lymfkörtlar upp till 45–50 Gy (EQD2). Därefter ges boost med BT och/eller EBRT beroende på storlek och utbredning av resttumören. Den totala dosen till tumörvolymen (BT och EBRT) bör uppgå till minst 75–85 Gy (EQD2). För bäst lokal kontroll bör boost med BT eftersträvas när så är möjligt, eftersom högre dos till tumörvolymen kan uppnås med sparande av stråldos till riskorgan (OAR) 209. Tillägg av interstitiell (IS) brachyterapi till intrakavitär (vaginal) BT kan övervägas. Om BT inte är möjligt ges boost med EBRT till en tumördos på minst 65–70 Gy (EQD2) 363. Om det redan vid behandlingsstart beslutas att BT inte kommer att ges, rekommenderas integrerad extern boost (SIB, simultan integrerad boost) för doseskalering till tumören och minskad stråldos till OAR (se även avsnitt 10.3.1.1.2). Vid tumörengagemang av nedre tredjedelen av vagina bör även ljumskkörtlarna inkluderas i strålfältet.
I vissa fall kan radikal kirurgi (radikal vaginektomi eller bäckenexenteration) samt lymfkörtelutrymning i bäckenet och/eller ljumskar (vid tumör i nedre tredjedelen) förekomma. Postoperativ strålbehandling eller kombinerad cytostatika- och strålbehandling bör övervägas vid icke-tumörfria resektionsränder eller lymfkörtelmetastaser.
Behandling stadium III–IVA
Här krävs en mer individualiserad behandling. Vid jämförelse av olika behandlingar fann man en 5-årsöverlevnad på 8–80 % med EBRT + BT (460 patienter behandlade 1977–2008), och 47–100 % vid kirurgisk behandling (24 fall som genomgått bäckenexenteration) 391. En kombination av olika behandlingsmodaliteter (strålbehandling, kirurgi, cytostatikabehandling) har beskrivits ge resultat med en 5-årsöverlevnad på 60–70 % 347.
I stadium III–IVA utgör strålbehandling dock den primära standardbehandlingen i de allra flesta fall, där kombinerad cytostatika- och strålbehandling bör övervägas vid gott allmäntillstånd. Strålbehandlingen ges oftast med EBRT enbart där man efter 45–50 Gy (EQD2) mot tumörvolymen och pelvina körtlar ger fortsatt EBRT mot ett reducerat fält (boost) inkluderande resttumör upp till minst 65–70 Gy (EQD2) 393, alternativt som SIB (simultan integrerad boost).
Vid resttumör i distala vagina är det ofta svårt att uppnå optimala doser med hänsyn till ökad strålkänslighet av vaginalslemhinnan och till OAR (uretra och rektum); här kan interstitiell BT övervägas 363. Vid lymfkörtelmetastaser i bäcken eller ljumskar bör EBRT ges till en dos av 55–64 Gy till körtlarna beroende på storlek.
Behandling stadium IVB
Vid stadium IVB med fjärrmetastaser blir behandlingen oftast primär cytostatikabehandling (cisplatinkombination), eventuellt efterföljt av strålbehandling mot bäcken och vagina. I dessa fall rör det sig vanligtvis om palliativ behandling 308349. Behandlingsriktlinjerna följer de vid cervixcancer, se avsnitt 10.4 Spridd sjukdom, fjärrmetastaser, cytostatikabehandling vid återfall. Tillägg av pembrolizumab till platinumbaserad cytostatika kan således övervägas för patienter med PD-L1 ≥ 1 enligt ”combined positive score” (CPS)-metoden.
Uppföljning
Uppföljningen följer rekommendationerna för livmoderhalscancer; se kapitel 14 Uppföljning.
Behandlingskomplikationer och seneffekter av behandling
Dessa skiljer sig i stort inte från livmoderhalscancer; se kapitel 13 Omvårdnad och rehabilitering.
Allvarliga komplikationer är vanligtvis relaterade till tumörstadium, typ av behandling, strålbehandlad volym, stråldos och dosrat. Studier har visat att övre delen av vagina samt vaginas framvägg tolererade högre stråldoser än nedre delen av vagina samt att biverkningarna minskar vid ökad fraktionering och lägre fraktionsdos av brachyterapi 190368369370. Risken för akuta och sena strålreaktioner är större vid dubbla behandlingsmodaliteter, dvs. för patienter som även genomgått hysterektomi eller annan bukkirurgi. Andra faktorer som ökar risken för komplikationer är hög ålder, inflammatorisk tarmsjukdom, bindvävssjukdom och dålig cirkulation.
Prognos och återfall
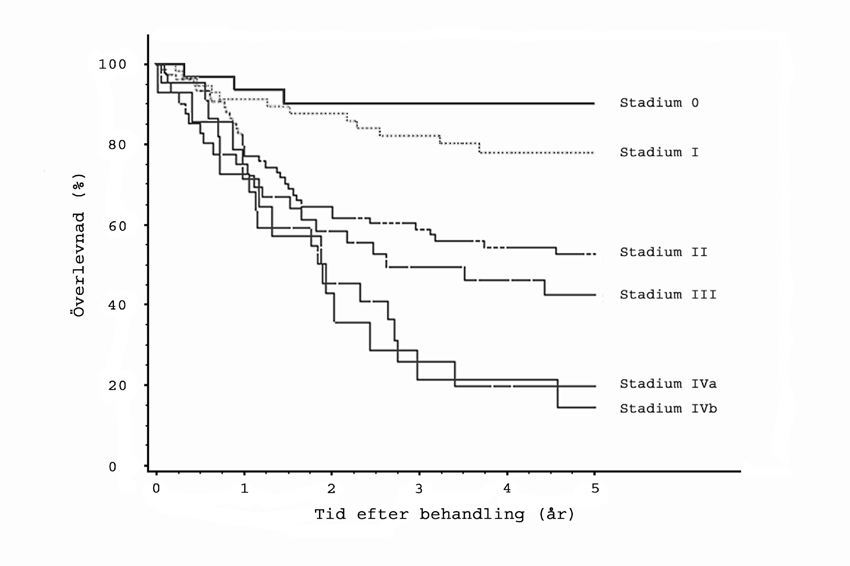
Den totala 5-årsöverlevnaden vid PVC är cirka 53 % 334. Överlevnaden har ökat med cirka 30 % de senaste 50 åren, men är fortfarande sämre än vid livmoderhalscancer. I Annual Report vol 26 har den totala 5-årsöverlevnaden i respektive stadium (I, II, III, IVA och IVB) rapporterats till cirka 77 %, 52 %, 42 %, 20 % och 13 % 334. NCI:s SEER-program omfattande 2 149 fall av PVC rapporterade 2009 en sjukdomsspecifik 5-årsöverlevnad på 84 %, 75 % och 57 % i stadium I, II resp. III 317. Perez och medarbetare beskrev 1999 sjukdomsspecifik 10‑årsöverlevnad i en studie baserad på 212 huvudsakligen strålbehandlade patienter till 80 %, 55 %, 35 %, 38 % och 0 % i stadium I, IIA, IIB, III och IV (stadium II uppdelades i IIA med paravaginal utbredning och IIB med parametrieinväxt) 332.
Figur 14. Total överlevnad i förhållande till stadium av 245 fall av vaginalcancer behandlade 1999–2001 på olika internationella cancercentrum. Annual Report 2006.
Prognosen vid återfall av PVC är mycket dålig med en rapporterad 5-årsöverlevnad på cirka 12–15 % 312313. De flesta återfall uppträder inom 2 år efter avslutad behandling. Återfallen är i > 80 % lokala eller lokoregionala 299312332363371. Fjärrmetastaser vid återfall är betydligt mindre vanligt. Vid lokalt recidiverande eller persisterande PVC efter tidigare strålbehandling kan radikal kirurgi (bäckenexenteration) ge långtidsöverlevnad hos patienter med gott allmäntillstånd 372373374. Vid fjärrmetastaserande återfall blir det oftast aktuellt med cytostatikabehandling och för dessa patienter är prognosen mycket dålig. Behandlingsriktlinjerna vid återfall följer de vid cervixcancer, se avsnitt 10.4 Spridd sjukdom, fjärrmetastaser, cytostatikabehandling vid återfall. Behandling med cemiplimab kan således övervägas vid återfall efter platinumbaserad cytostatika hos patient som ej tidigare erhållit pembrolizumab i första linjen.
