Utredning
Sammanfattning
Diagnos verifieras alltid histologiskt med
- biopsi för lokalt synlig eller avancerad tumör
- konisering och cervixabrasio för mikroskopiska tumörer.
Utredning*
- Stadium IA1: Ingen bilddiagnostisk utredning.
- Stadium ≥ IA2 och vid stadium IA1 med lymfkärlinväxt (LVSI): DT thorax-buk och MRT av lilla bäckenet samt v.b. komplettera med högkvalificerat ultraljud av lilla bäckenet.
- För patienter som primärt ska erhålla kurativt syftande strålbehandling kompletteras utredningen med PET-DT thorax-buk och MRT om det inte gjorts tidigare.
- PET-DT utförs alltid vid småcellig neuroendokrin histologi.
- Grundprincipen är PIN (palpation i narkos) för klinisk bedömning.
- Vid stadium ≤ IA2 kan man avstå från PIN.
*För neuroendokrina tumörer (NEC), se avsnitt 10.7 Neuroendokrin livmoderhalscancer (NEC).
Primärutredning
Vid misstanke om livmoderhalscancer är det nödvändigt att ta vävnadsprov för att ställa diagnos, dvs. cytologi räcker inte. Vid synlig eller lokalt avancerad tumör tas biopsi. För diagnosen mikroskopisk cancer krävs PAD-svar på konpreparat. För att kunna fastslå att det är stadium IA1 eller IA2 krävs att tumören är radikalt avlägsnad avseende infiltrationsdjup och materialet granskat av en referenspatolog.
Remiss för bilddiagnostisk utredning skrivs så snart det finns information nog för att kunna ta ställning och patienten informerats om att det kommer att ske.
Vid stark klinisk misstanke, vid stadium IA1 med lymfkärlinväxt (LVSI) och vid stadium IA2 och högre görs DT av buk och thorax samt MRT av lilla bäckenet. På de kliniker där det finns tillgång till högspecialiserat ultraljud kan denna undersökning komplettera MRT vid tidiga tumörer som led i utredningen inför eventuell kirurgi, eller ersätta MRT vid kontraindikationer mot undersökning i magnetfält. PET-DT utförs på patienter som primärt ska erhålla definitiv strålbehandling, och vid neuroendokrin småcellig histologi.
Det går inte att uteslutande på stadium bestämma primär behandlingsmodalitet, även om grundprincipen är att patienter med stadium IB3, IIA2–IVA primärt erhåller kombinerad cytostatika- och strålbehandling. Det är inte ovanligt att patienter med tidigare stadium primärt erhåller definitiv strålbehandling på grund av att man bedömer att de inte är lämpliga för radikal kirurgi (patientkaraktäristika eller tumörkaraktäristika). Det är i så fall viktigt att komplettera med PET-DT samt MRT om detta inte gjorts tidigare.
Stadieindelning enligt FIGO 2018 utgörs av en kombination av kliniska undersökningsfynd, bilddiagnostik samt histopatologi innan eventuell behandling 51. Det reviderade FIGO 2018 uttrycker en intention att överbrygga gapet mellan den globalt nödvändiga formalistiska stadieindelningen och pågående klinisk praxis i resursstarka sjukvårdsenheter att använda avancerad bilddiagnostik.
Patienter som diagnostiserats med livmoderhalscancer bör erbjudas hivtest då aids visserligen är en ovanlig underliggande faktor, men som är viktig att känna till då patienterna annars får en bristfällig och felaktig behandling 52. Livmoderhalscancer i kombination med hivsmitta medför aidsdiagnos.
Det finns inga tumörmarkörer i blod eller serum som kan rekommenderas vid utredning eller uppföljning av livmoderhalscancer, p.g.a. bristande specificitet och sensitivitet. Studier pågår angående t.ex. SCC-Ag (squamous cell cancer antigen) med undergrupper för skivepitelcancer och MICA (Major Histocompatibility Complex (MHC) class I chain-related gene A) för adenokarcinom.
Handläggning enligt standardiserat vårdförlopp (SVF)
Rekommendationer
- Om den gynekologiska undersökningen visar en synlig tumör på livmoderhalsen ska biopsier tas och SVF startas utan att PAD-svaret inväntas.
- Vid kolposkopisk misstanke om mikroinvasiv livmoderhalscancer bör snabbsvar begäras på histopatologisk undersökning av biopsi eller excisionspreparat.
- När histopatologisk undersökning på biopsi eller excisionspreparat visar invasiv livmoderhalscancer startas SVF.
Figur 4. Översikt över vårdkedja, utredning och behandling av livmoderhalscancer, inklusive målnivåer och ledtider.
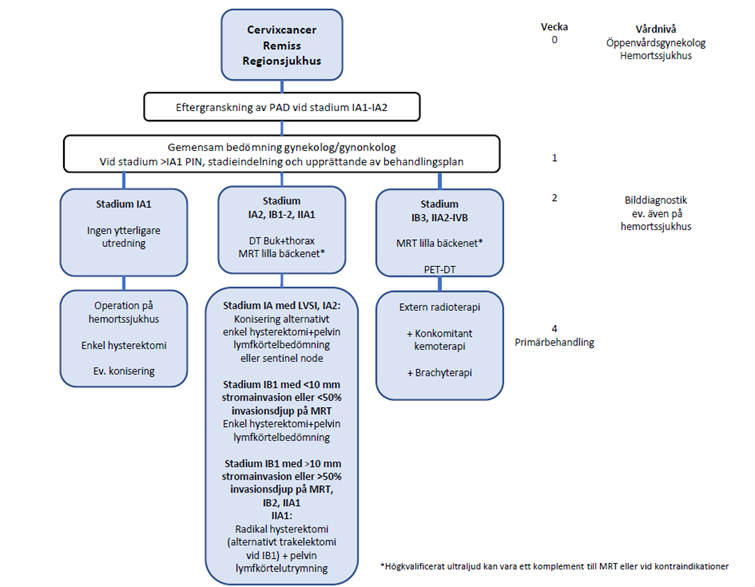
Vid stark klinisk misstanke om livmoderhalscancer vid gynekologisk undersökning startas SVF. Biopsi tas och remissen till histopatologisk undersökning märks SVF. MRT lilla bäckenet beställs och remissen märks SVF. Det kan lokalt vara så att det är den regionala enheten för gynekologisk cancer som skriver remissen. B-Hb, S-kreatinin, längd och vikt mäts. Remiss utfärdas till regional enhet för gynekologisk cancer med sådan rutin att remissen är mottagen senast nästföljande dag. Remissen bör innehålla alla uppgifter enligt SVF. Kvinnan ges information enligt riktlinjerna för SVF och kontaktsjuksköterska.
Vid kolposkopisk misstanke om mikroinvasiv livmoderhalscancer bör snabbsvar begäras på histopatologisk undersökning av biopsi eller excisionspreparat.
När histopatologisk undersökning på biopsi eller excisionspreparat visar invasiv livmoderhalscancer bör SVF startas enligt ovan, med undantaget att vid stadium IA1 beställs ingen bilddiagnostik, såvida inte lymfkärlinväxt (LVSI) eller högmalign histopatologi föreligger. För stadium IA1–A2 begärs eftergranskning av den histopatologiska undersökningen av referenspatolog. Remittering för eftergranskning görs enligt regionala riktlinjer.
Vid utredning av screeningfynd kan livmoderhalscancer upptäckas vid kolposkopi, i biopsi eller i excisionspreparat. Enligt statistik från NKCx diagnostiserades 29 % av all livmoderhalscancer i Sverige 2002–2011 vid utredning av screeningfynd. Hos kvinnor under 35 år var 54 % av all livmoderhalscancer screeningupptäckt. Screeningupptäckt livmoderhalscancer utgjorde 85 % av de fall som behandlades fertilitetsbevarande med konisering eller trakelektomi.
Kolposkopisten bör därför ha god kunskap om det nationella vårdprogrammet för livmoderhalscancer och det standardiserade vårdförlopp för livmoderhalscancer som är framtaget och fastställt. Ovanstående rekommendationer sammanfattar vad kolposkopisten bör göra enligt SVF vid välgrundad misstanke om livmoderhalscancer.
Enligt SVF bör patienten få en namngiven kontaktsjuksköterska senast i samband med att tid ges för utredning på en regional enhet för gynekologisk cancer. Många enheter som handlägger utredning av screeningprover har en dysplasisjuksköterska. Denna bör ha goda kunskaper om livmoderhalscancer och bör kunna fungera som kontaktsjuksköterska från start av SVF tills ansvaret överlämnas till en kontaktsjuksköterska på en regional enhet för gynekologisk cancer.
Palpation i narkos (PIN)
Vid palpation i narkos undersöker en gynonkolog och gynekolog tillsammans patienten för stadieindelning och för att bilda sig en uppfattning av om patienten primärt ska behandlas med strålbehandling eller kirurgi. Undersökningen är viktig för att fatta beslut om rätt behandling. Vid undersökningen inspekteras portio och vagina, och tumörens utbredning makroskopiskt både på portio och till parametrier anges, samt om den växer över på vagina och i så fall hur långt ner i vagina respektive hur utbrett i parametrier. Med bimanuell palpation bedöms cervix storlek, och största tumörbredd anges i centimeter. Det är viktigt att palpera både rektalt och vaginalt då det ger en möjlighet att bedöma växt i parametrier och om tumören växer ut mot bäckenväggen.
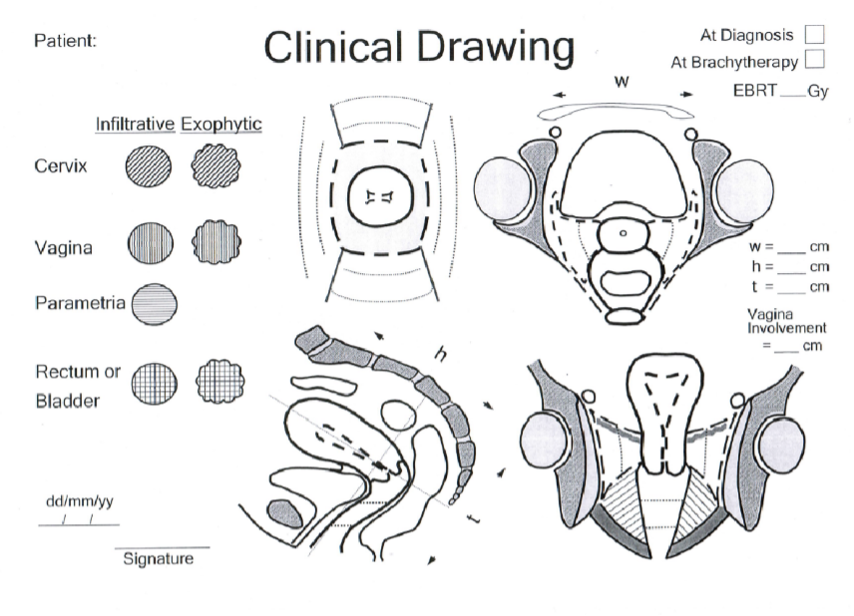
På de patienter som ska erhålla strålbehandling sätts optimalt två markörer (anteriort/posteriort, guldstift) i tumören och vid vaginal utbredning även vid nedre begränsningen av tumören i vagina. För att kunna värdera effekten av den externa strålbehandlingen inför brachyterapi är det viktigt att ange tumörstorlek enligt mallen i EMBRACE-protokollet. Se vidare avsnitt 10.3.1.5 Brachyterapi (BT) och bilaga 2.
Figur 5. Klinisk teckningsmall från EMBRACE. Finns även som bilaga för nedladdning.
 FIGO anger att en grundlig gynekologisk undersökning är obligatorisk, men inte att den måste göras i narkos. Cystoskopi och rektoskopi rekommenderas om patienten har symtom från blåsa eller rektum. Eventuell spridning till dessa lokaler måste verifieras histopatologiskt för att ett högre stadium kan sättas .
FIGO anger att en grundlig gynekologisk undersökning är obligatorisk, men inte att den måste göras i narkos. Cystoskopi och rektoskopi rekommenderas om patienten har symtom från blåsa eller rektum. Eventuell spridning till dessa lokaler måste verifieras histopatologiskt för att ett högre stadium kan sättas .
PIN är inte nödvändigt vid stadium IA.
Cystoskopi har ett begränsat diagnostiskt värde i sig och har ersatts av MRT. Se vidare angående sensitivitet i avsnitt 6.4 Bilddiagnostik. De patienter som har misstanke om blåsengagemang vid MRT remitteras till en urolog för att där göra cystoskopi med möjlighet till biopsi. Likaså bör MRT-misstänkta fynd i rektum-sigmoideum föranleda rektoskopi med biopsi.
Bilddiagnostik
Rekommendationer vid nyupptäckt livmoderhalscancer
- Ingen bilddiagnostik vid stadium IA1 utan lymfkärlinväxt (LVSI).
- För övriga tumörer utförs MRT av lilla bäckenet.
- Vid tumörer < 4 cm utan misstanke om parametrieinväxt utförs DT thorax-buk.
- Vid tumörer ≥ 4 cm eller vid misstänkt parametrieinväxt utförs FDG-PET-DT thorax-buk.
- Vid småcellig neuroendokrin livmoderhalscancer utförs FDG-PET-DT thorax-buk oavsett tumörstorlek.
- Högkvalificerat gynekologiskt ultraljud kan vara ett komplement till MRT vid stadium upp till IB, i synnerhet inför trakelektomi och tumörer < 1 cm som kan vara svåra att visualisera med MRT.
- Vid kontraindikationer mot MRT kan undersökningen ersättas av högkvalificerat ultraljud.
Bild- och funktionsdiagnostiska metoder kan ge värdefull information som del i beslutsunderlaget till den kliniska handläggningen av patienter med konstaterad livmoderhalscancer. Exempel på metoder är magnetresonanstomografi (MRT), transvaginalt ultraljud (TVS), datortomografi (DT) och positronemissionstomografi-DT (PET-DT). Med dessa metoder kan man påvisa prognostiskt viktiga faktorer såsom tumörstorlek, inväxt i närliggande strukturer/organ samt lymfkörtelmetastaser.
Enligt FIGO 2009 uppmuntrades användning av DT och MRT för att bedöma tumörvolym och parametrieinvasion, om metoderna fanns tillgängliga 54. I den reviderade versionen av FIGO 2018 har stadieindelningen ändrats och bilddiagnostik implementerats 51.
Magnetresonanstomografi (MRT)
Av de olika metoderna inom bild- och funktionsmedicin är MRT den som med högst vävnadsdistinktion och specificitet avbildar lilla bäckenet med organ och därmed ger mest komplett bild av den lokala tumörutbredningen. MRT har en god potential att påvisa överväxt till corpus uteri, urinblåsa, tarm eller bäckenväggar (bäckenmuskulatur eller iliacakärl, ofta med dilaterade uretärer). Frånvaro av urinblåse- eller tarmengagemang kan med hög tillförlitlighet avgöras, vilket gör att cystoskopi eller endoskopi kan undvaras 555657. Om vaginal kontrast (10–20 ml steril ultraljudsgel) appliceras inför undersökningen ger MRT även en god visualisering av vaginal nedväxt av tumören 58. MRT kan med hög säkerhet bedöma tumörväxt i den nedre tredjedelen av vagina, men är sämre än klinisk undersökning på att identifiera tumörväxt i fornix 59. Förstorade lymfkörtlar (korta axeln i transaxialplanet > 1 cm) kan identifieras och lokaliseras 6061. MRT ger en detaljerad kartbild av lokal tumörväxt och förstorade lymfkörtlar vid planering av riktad extern strålbehandling 62.
MRT är bättre än DT samt klinisk undersökning för att bedöma tumörstorlek samt engagemang av corpus uteri. Däremot är MRT inte tillfredsställande för att bedöma intracervikal utbredning av tumörer som är < 1 cm 6364. Tumörmått kan med hög precision anges med MRT, med mindre än 5 mm skillnad i största diameter mätt med MRT jämfört med det patologiska preparatet i 93 % av fallen 59. Avståndet till inre modermunnen kan anges 65 och definieras som den nivå där uterinaartärerna går in i uterus.
Den för behandlingsbeslut viktiga skiljelinjen mellan tumörväxt begränsad till cervix (stadium IB) och invasion till angränsande parametrium (stadium IIB) bedöms för stadieindelning i enlighet med FIGO:s regler via klinisk undersökning, alltså inspektion och palpation i narkos (PIN). Dock kan MRT-fynd påverka valet av primär behandling, t.ex. om MRT påvisar parametrieinväxt som inte palperats. Cervixtumörer > 1 cm är väl synliga på MRT och det går att visualisera lokal spridning.
En systematisk litteraturgranskning och metaanalys som belyser den diagnostiska tillförlitligheten av klinisk undersökning och MRT, inkluderande 3 254 patienter, har genomförts av Thomeer et al. 66. MRT visade sig vara mer tillförlitligt för stadieindelning än klinisk undersökning trots att studier med äldre och i dag suboptimal undersökningsteknik var inkluderade.
Resultatet kan sammanfattas i följande punkter:
- MRT har högre sensitivitet (84 %) jämfört med klinisk undersökning (40 %) att bedöma parametrieinväxt och avancerad sjukdom (79 versus 53 %).
- MRT och klinisk undersökning har jämförbar hög specificitet (över 90 %) för ovanstående bedömningar.
- Användandet av nyare MRT-teknik (såsom utvecklade sekvenser, starkare magnetfält, extra ytspolar) och snitt-tjocklek 5 mm eller mindre har ett positivt inflytande på studieresultatet (högre diagnostisk tillförlitlighet).
En systematisk litteraturgranskning och metaanalys om MRT-detektion av parametrieinväxt vid livmoderhalscancer, som innefattar litteratur mellan 2012 och 2016 om sammanlagt 1 028 patienter 67. Analysen visar att MRT har en hög tillförlitlighet att påvisa/utesluta parametrieinväxt med sensitivitet 76 % och specificitet 94 %, med data som talar för att hög magnetfältstyrka (3 Tesla) och diffusion förbättrar resultaten.
Positivt prediktiva värden avseende parametrieinväxt spretar mellan 37 och 89 %, vilket speglar en viss risk att misstolka en reaktion med ödem i tumörperiferin som invasion 68697071727374757677. Negativt prediktiva värden är höga, 94–95 % 5978. Ett MRT-utlåtande om att parametrieinväxt inte föreligger, d.v.s. att det kvarstår en intakt perifer ring av cervixstroma, har således mycket hög tillförlitlighet. Sammantaget har MRT en hög tillförlitlighet (80–97 %) vid bedömning av parametriell infiltration 5978.
Tillförlitligheten att diagnostisera lymfkörtelmetastaser med MRT är enligt en systematisk metaanalys jämförbar med DT, med en sensitivitet på endast 56 % och en specificitet på 91 % 61.
I Stockholm bedrevs en retrospektiv studie för att undersöka betydelsen av att addera MRT till den kliniska stadieindelningen av livmoderhalscancer. 183 kvinnor inkluderades under åren 2003–2006. Slutsatserna var att MRT både påverkar behandlingsplanering och i vissa fall stadieindelning enligt FIGO, men att betydelsen är mer uppenbar vid mer avancerade stadier och för patienter där den kliniska undersökningen försvåras av exempelvis obesitas. Därtill identifierades också värdet av MRT som en del av beslutsunderlaget när fertilitetsbevarande kirurgi övervägs för yngre kvinnor 79.
Nuförtiden används diffusionsviktad avbildning (DWI) som rutin vid MRT-undersökningar av gynekologiska tumörsjukdomar. DWI bygger på detektion av signaler från vattenmolekylers varierande restriktion i rörlighet, beroende av bland annat celltäthet och cellmembraners funktion. Solida expansiviteter som uppvisar inskränkt diffusion är med hög sannolikhet maligna om det inte finns kliniska hållpunkter för infektiös eller inflammatorisk process 8081. Dessvärre gäller detta inte lymfkörtlar, som vanligen uppvisar hög DWI-signal oavsett om de är normala eller metastaser. För livmoderhalscancer kan DWI, i kombination med morfologiska MRT-bilder, öka den diagnostiska tillförlitligheten avseende att bedöma lokal växt av primärtumören och detektera resttumör eller återfall 82.
MRT vid utvärdering av behandling
Avseende MRT som utvärdering är den viktigaste prognostiska faktorn under kombinerad cytostatika- och strålbehandling hur fort tumörens volym minskar 83. Det har visats att 5-årig återfallsfrihet uppnås i 84–100 % av fallen om tumörstorleken minskar med 80 % under strålbehandling (36–50 Gy) 8485. Bildtagning har då skett 4–5 veckor in i behandlingen.
Att bedöma resttumörer efter kombinerad cytostatika- och strålbehandling är svårt med MRT, men det har påvisats en sensitivitet för detta på 78 % vid undersökning 4–6 veckor efter strålbehandling 86. Dock såg man i EMBRACE-I 2023 att 74 % (60/81) av patienterna med möjlig resttumör 3 månader efter behandling uppnådde lokal kontroll efter 6–9 månader utan att ha fått ytterligare behandling, och man drog slutsatsen att man kan överväga att följa dessa patienter med gynekologisk undersökning och MRT 87. European Society of Urogenital Radiology (ESUR) har inte uppnått konsensus om den optimala tidpunkten för första uppföljande undersökning, men majoriteten av författarna rekommenderade en första uppföljning efter 3–6 månader 6082.
En holländsk multicenterstudie av lokalstatus hos 107 patienter efter kombinerad cytostatika- och strålbehandling visar att MRT med DWI ger jämförbar/kompletterande information till klinisk undersökning och att DWI bör ingå (men kvantitativ mätning av så kallade ADC-värden vid DWI under den tidiga post-terapeutiska perioden har begränsat värde) 88.
Det pågår forskning som pekar på att graden av diffusionsinskränkning i tumören under behandling kan ha prognostisk valör och därmed underlätta beslut om intensifierad behandling 83.
Transvaginalt ultraljud (TVS)
I förhållande till MRT är ultraljud en snabb, kostnadseffektiv (ca 1/3 av kostnaden) och lättillgänglig metod som inte kräver någon förberedelse för patienten, men som liksom vid MRT kräver hög kompetens av utföraren/bedömaren.
Vid definitiv strålbehandling är det nödvändigt att få reproducerbar och överförbar bilddiagnostik för targetritning, varför ultraljud har begränsat värde.
Med transvaginalt ultraljud kommer man mycket nära tumören. Med dagens moderna högupplösta givare får man därmed en mycket god bild av tumören. Med power-Doppler-ultraljud kan man direkt se tumörens kärlrikedom. Studier har visat att de flesta cervixtumörer är mycket välvaskulariserade, vilket kan vara en hjälp vid diagnostiken eftersom vissa tumörer, framför allt adenokarcinom, kan vara svåra att avgränsa med enbart gråskaleultraljud 89.
Ultraljudsdiagnostik erbjuder dessutom specifika möjligheter då det är en dynamisk teknik. Cervixtumörer är hårda och genom att trycka med givaren mot cervix kan man få en ytterligare uppfattning om tumörens begränsning. Även när man bedömer överväxt på blåsa, tarm och parametrier använder man sig av ”the sliding organ sign” för att avgöra om det föreligger överväxt (vävnaden är fixerad till tumören) eller inte (vävnaden glider undan). Vid stora lättblödande tumörer kan det vara en fördel att undersöka transrektalt för att inte orsaka stor blödning. Det krävs god vana för att kunna bedöma tumörutbredningen med ultraljud. Vid större tumörcentrum med specialiserade second opinion-ultraljudsmottagningar finns denna kompetens. För att upprätthålla kompetensen är det dock av högsta vikt att regelbundet undersöka patienter med livmoderhalscancer och att systematiskt kvalitetssäkra verksamheten. Högkvalificerat ultraljud definieras som den verksamhet som bedrivs vid dessa centrum.
Flera studier har visat att gynekologiskt ultraljud har jämförbar diagnostisk tillförlitlighet med MRT för att bedöma lokal tumörutbredning 7690919293. Några studier har visat att ultraljud är bättre än MRT på att hitta små (< 1 cm) tumörer 7694 och en stor multicenterstudie visade att ultraljud har en signifikant högre specificitet än MRT för att bedöma parametrieinväxt (agreement för ultraljud 97 %, MRT 90 %, p = 0,001), framför allt beroende på en lägre andel falskt positiva fall (ultraljud 2 %, MRT 8 %, p < 0,001) 94. En brist med denna studie är att den bara inkluderade patienter med mindre tumörer som genomgick kirurgi.
I multicenterstudien tittade man även på möjligheten att detektera lymfkörtelmetastaser. Kvinnor med uppenbart ”bulky nodes” hade redan exkluderats eftersom de inte kunde bli föremål för kirurgi.
Bland de resterande hade 27 % LNM (lymfkörtelmetastas), och sensitiviteten för detektion av LNM var 43 % och specificiteten 96 % 95. En förklaring till den relativt låga sensitiviteten var att de allra flesta metastaserna var mikrometastaser i till synes normalstora lymfkörtlar. Ultraljudsledd transvaginal eller transrektal mellannålsbiopsi är också en värdefull teknik vid misstanke om återfall eller inkomplett svar vid kombinerad cytostatika- och strålbehandling.
Datortomografi (DT)
I Sverige finns DT tillgängligt på alla röntgenavdelningar och metoden har helt ersatt traditionell urografi. Hydronefros och urinvägsanomalier kan påvisas även utan intravenös tillförsel av kontrastmedel, men om kontrastmedel administreras enligt protokoll som genererar bilder med kontrast i utsöndringsfas (så kallad DT-urografi) visualiseras urinvägarna bättre. Förstorade lymfkörtlar (korta axeln i transaxialplanet > 1 cm) kan lokaliseras. Storlekskriteriet ger låg sensitivitet, 50 %, men god specificitet på 92 % 61. Metastatisk fjärrspridning till exempelvis lever och lungor är ovanligt när livmoderhalscancer upptäckts, men det är av stor vikt att påvisa om så ändå skulle vara fallet och därför bör DT-undersökningen innefatta hela levern och thorax. Tumörgenomväxt i tarmen kan i viss mån påvisas med DT enligt rutin, men vid mer specifik frågeställning om rektum-sigmoideumöverväxt bör man i första hand utföra MRT av lilla bäckenet 57.
Positronemissionstomografi-datortomografi (PET-DT) med FDG
Dagens generation av PET-DT-utrustningar har en DT-del i klass med standard-DT-maskiner både vad gäller bildkvalitet och strålningsreducerande funktioner. Om PET-DT-undersökningen utförs med diagnostisk kvalitet (stråldos) och intravenöst kontrastmedel kan den ersätta en separat DT-undersökning och ger samtidigt värdefull information vid tolkningen av undersökningens PET-del beträffande upptaget av 18-fluorodeoxyglukos (FDG). Genom att protokollenligt utföra PET-DT direkt kan dubbelundersökningar (DT + PET-DT) undvikas, vilket både reducerar stråldos och utredningstid (förutsatt att tillgången på PET-DT är tillgodosedd).
Utöver visuell bedömning kan man även mäta FDG-upptaget kvantitativt (SUV, standardized uptake value), vilket kan användas vid uppföljning efter behandling (behandlingssvar).
Livmoderhalscancer uppvisar generellt ett kraftigt FDG-upptag men detektionssäkerheten minskar om tumörerna är små. Var den gränsen går är avhängigt PET-DT-systemets prestanda.
Ett lågt (eller lägre) FDG-upptag ses hos tumörer med låg celltäthet eller glukosmetabolism 83.
PET-DT med FDG vid neuroendokrin cancer (NEC) i cervix rekommenderas, p.g.a. denna tumörforms spridningsmönster med hög risk för fjärrmetastaser även vid begränsad storlek på primärtumören. Observera att ordinarie FDG-PET avses och inte 5-HTP-PET eller somatostatinreceptor PET (DOTATOC, DOTATATE eller DOTANOC), dessa PET-farmaka används vid NET, neuroendokrina tumörer, i framför allt GI-kanal och pankreas. PET/MR används ännu inte i klinisk praxis, men flera studier pågår och metoden kan med fördel användas hos gravida kvinnor för att minska stråldosen till fostret.
Stadieindelning före behandling
Det finns inga data som stödjer användande av FDG-PET-DT för att bedöma primärtumörens utbredning (T-stadium).
PET-DT har rapporterats kunna detektera metastasering i normalstora lymfkörtlar i storleksintervallet 5–9 mm, vilket konventionell DT och MRT inte klarar, men mikrometastasering till lymfkörtlar kan inte uteslutas trots avsaknad av FDG-upptag. PET-DT har således en högre diagnostisk tillförlitlighet avseende att påvisa lymfkörtelmetastasering vid livmoderhalscancer än både DT och MRT, med en sensitivitet på 75–82 % och en specificitet på 95–99 % enligt tre metaanalyser 619697. I en dansk prospektiv multicenterstudie genomgick sammanlagt 103 kvinnor med tidiga stadier av livmoderhalscancer (<4 cm tumördiameter) PET-DT kombinerat med portvaktskörtelprovtagning för att påvisa eventuella lymfkörtelmetastaser 98. Studien visade en mycket låg sensitivitet för PET-DT (14,8%) och författarna konkluderade att modaliteten inte tillför diagnostiskt värde för denna patientgrupp. Det finns en ny studie som visar att [68Ga]Ga-FAPI-04 PET/MR har ett signifikant högre diagnostiskt värde än [18F]FDG PET/CT avseende lymfkörtelmetastaser hos patienter med stadium ≤ 2a2 (European Journal of Nuclear Medicine and Molecular Imaging (2024) 51:1163–1172).
Planering inför strålbehandling
I en systematisk översikt visades att PET-DT i tillägg till MRT eller DT ledde till förändrat strålområde hos 11–19 % av patienterna 99. Författarna påpekar att fler studier behövs för att identifiera vilka patienter som har mest nytta av metoden.
I en prospektiv studie som inkluderade 452 patienter med livmoderhalscancer, där 135 erhöll PET-DT-guidad intensitetsmodulerad strålbehandling och övriga konventionell strålbehandling, visades att PET-DT-intensitetsmodulerad strålbehandling gav bättre överlevnad och mindre strålningsrelaterad sjuklighet än kontrollgruppen 100.
Utvärdering av behandling
Tumörens FDG-upptag före behandling korrelerar väl med överlevnaden 83101. Kidd et al. visade att 5-årsöverlevnaden var 95 % hos patienter med primärtumörer vars upptag understeg 5,2 i SUV-max. Tumörer med SUV-max mellan 5,2 och 13,3 hade en 5-årsöverlevnad på 70 %. SUV-max i primärtumören på > 13,3 var associerat med 44 % 5-årsöverlevnad. Detta oberoende av behandlingsstrategi eller övriga riskfaktorer. En metaanalys med 1 854 patienter konkluderade att FDG-upptag, både före och efter behandling, kan ge information om prognos och identifiera patienter som behöver mer aggressiv behandling. I dag används inte detta i klinisk verksamhet.
Komplett FDG-upptagsreduktion (dvs komplett metabol respons) under strålbehandling är starkt associerat med sjukdomsfri överlevnad 102. Partiell metabol respons är mer svårbedömbart, men kan indicera behov av utökad eller förlängd behandling.
Chung et al. har funnit att en kontroll med PET-DT efter avslutad behandling kan ge värdefull prognostisk information 103. Patienter som 10–16 veckor efter strålbehandling uppvisar en komplett metabol respons enligt PET-DT har i en retrospektiv studie av 173 patienter visats ha en återfallsfri 5-årsöverlevnad på 73 % 104.
PET-DT har enligt fyra systematiska översikter en sensitivitet att påvisa kliniskt misstänkt lokalt eller regionalt återfall på 82–96 % och en specificitet på 81–98 % 96105106107. PET-DT anges dock som ej säkert kostnadseffektivt för att bedöma återfall 106.
Primärutredning av diagnostiserad livmoderhalscancer
Vid nyupptäckt livmoderhalscancer (undantaget stadium IA1 utan LVSI) utförs MRT av lilla bäckenet för att kartlägga den lokala tumörutbredningen och kompletteras med DT thorax-buk för att påvisa eventuell fjärrspridning. Högkvalificerat gynekologiskt ultraljud kan vara ett komplement vid tumörer upp till stadium IB alternativt ersätta MRT om kontraindikationer finns. Vid tumörer som palperas större än 4 cm (≥ IB3) eller kliniskt misstänks ha spridits utanför cervix (≥ IIA2) utförs MRT kombinerat med PET-DT som underlag för stråldosplanering.
Av remissen bör det framgå om och när patienten är koniserad, då detta kan ge artefakter. Det bör även framgå om det föreligger högrisk-histologi, om patienten tidigare är opererad i buk eller bäcken eller har genomgått strålbehandling, om och var det finns tidigare bilddiagnostiska undersökningar samt om det finns kontraindikationer för de olika undersökningarna, t.ex. kontrastmedelsallergi, njursvikt eller vissa typer av pacemaker eller andra implantat.
Den bilddiagnostiska utredningen av patienter med diagnostiserad livmoderhalscancer bör i första hand utföras på det sjukhus där patienten behandlas för sin tumörsjukdom. Där måste finnas högkvalitativ teknisk utrustning i kombination med radiologisk kompetens inom gynekologisk onkologi eller gynekologer med second opinion-kompetens inom högkvalificerat gynekologiskt ultraljud. Det är nödvändigt att det finns möjligheter för bilddiagnostiker att föra en dialog med den behandlande läkaren. Alla undersökningar bör lagras digitalt i PACS så att eftergranskning är möjlig. Ultraljudsundersökningar bör lagras både som stillbilder, videoklipp och vid behov även 3D-volymer. Bildmaterial behöver kunna demonstreras på multidisciplinära konferenser där den sammanlagda bedömningen inför behandlingsbeslut görs.
Lokal tumörutbredning
MRT av lilla bäckenet är standardundersökning vid bedömning av lokal tumörutbredning.
Eftersom patienter med avancerade tumörer inte genomgår kirurgi finns det otillräcklig evidens för hur tillförlitlig imaging egentligen är hos dessa patienter. Det är emellertid inte hos dessa patienter som tumören kan vara svår att se eller bedöma eftersom stora tumörer ofta syns väldigt väl med både ultraljud och MRT. Det finns studier som talar för att ultraljud inte är speciellt bra på att detektera lymfkörtelmetastaser även om specificiteten är mycket hög .
MRT av små tumörer (< IB1) har begränsningar, eftersom tumören inte säkert kan påvisas, medan ultraljud även kan visualisera tumörer < 1 cm . Ultraljud är också bättre vid bedömning av stromainvasionsdjup än MRT. Ultraljud har högre positivt prediktivt värde än MRT (ultraljud 77 %, MRT 39 %) medan båda metoderna har ett högt negativt prediktivt värde (ultraljud 98 %, MRT 97 %) för bedömning av parametrieinväxt, enligt en stor multicenterstudie . Således kan båda metoderna med stor säkerhet utesluta parametrieinväxt, men det finns en risk för att tumörutbredningen överdiagnostiseras, vilket sannolikt beror på ödem eller stromareaktion vid tumörperiferin.
Utlåtandet bör innehålla följande (oavsett undersökningsmetod):
- Tumörstorlek (diameter i 3 plan).
- Gradering av stromainvasionen <> 50%
- Parametrieinväxt
- Engagemang av corpus uteri.
- Överväxt på vagina, urinblåsa, tarm och bäckenväggar.
- Hydrouretär eller hydronefros.
- Förekomst och läge av metastasmisstänkta lymfkörtlar.
- Vid fertilitetsbevarande kirurgi anges även avståndet från tumören till inre modermunnen.
MRT
Utgående från ESUR:s riktlinjer (European Society of Urogential Radiology) 6082 bör MRT-undersökningen av lilla bäckenet inkludera följande:
- Patienten bör vara fastande minst fyra timmar före undersökningen samt erhålla tarmmotorikhämmande medel (t.ex. skopolamin, buscopan eller glukagon) i samband med undersökningen för att undvika störande rörelseartefakter i bilderna.
- Fältstyrka minst 1,5T.
- Ytspolar (phased array coils).
- Axial T1-viktad sekvens.
- T2-viktade högupplösta sekvenser axialt och sagitellt med litet FOV (bildfält 20–25 cm) och 3–5 mm snitt-tjocklek.
- Axial oblique T2-viktad sekvens vinkelrätt mot cervixkanalen.
- Coronal T2-viktad sekvens parallell med cervixkanalen (för optimal framställning av parametrieinväxt).
Idealiskt används 512 x 512 matris, dock minst 400 x 400.
Kontrastförstärkning är också valfritt, eftersom det inte förbättrar bedömningen av tumörutbredningen 60109. Vaginal kontrast (10–20 ml steril ultraljudsgel) kan appliceras inför undersökningen för att öka möjligheten till radiologisk värdering av tumörnedväxt i vagina.
Detaljerad rekommendation för MR-protokoll för undersökning av cervixcancer med ett appendix för vinklade MR-bilder finner man på Metodböcker – Svensk Förening för Medicinsk Radiologi (slf.se).
Transvaginalt ultraljud (TVS)
Vid en systematisk bedömning med ultraljud mäts tumören i 3 dimensioner och man anger hur djupt tumören invaderar stromat (< 1/3, 1/3–2/3 eller > 2/3) och parametrieinvasion (ja/nej). Undersökningen utförs transvaginalt eller transrektalt. Transrektal undersökning kan vara en fördel vid stora lättblödande tumörer. Man letar även efter uppenbart förstorade lymfkörtlar, både vaginalt eller transrektalt och abdominellt.
Vid små tumörer (< 2 cm) där det kan bli aktuellt med fertilitetsbevarande behandling anger man även avståndet från tumörens övre begränsning till inre modermunnen. Den fria marginalen bör vara åtminstone 1 cm. Inre modermunnen bedöms enklast med 3D-ultraljud, men kan även göras genom att framställa ett lätt oblikt plan där man ser både tumörens kraniala begränsning och uterusartären. Parametrieinvasion klassificeras och graderas enligt Fischerova 110.
Tumörspridning
DT av thorax och buk med intravenöst kontrastmedel alternativt PET-DT utförs för bedömning av retroperitoneala lymfkörtelmetastaser och förekomst av fjärrmetastaser, och inkluderar bedömning av uretäranatomi och urinavflöde inför behandlingsplanering. Vid bildtolkningen behövs kännedom om tumörens histologi och lokala utbredning, varför denna information bör anges i remissen eller på annat sätt finnas tillgänglig. I de fall kontrastmedel inte kan användas vid DT kan PET-DT utföras utan kontrastmedel och då ge en god bedömning av retroperitoneala körtlar, hydronefros etc.
I utlåtandet ingår bedömning av retroperitoneala lymfkörtlar med nivåbestämning i förhållande till de större kärlen eller andra välkända anatomiska landmärken, såsom kotkroppar, samt om patologiska lymfkörtlar finns ovan njurvensnivå. Enligt ESUR:s riktlinjer bedöms lymfkörtlar som patologiskt förstorade om den korta axeln i transaxiala planet överstiger 10 mm, men enligt en aktuell amerikansk översiktsartikel kan motsvarande gränsmått skärpas till 8 mm för pelvina lymfkörtlar 60111. Som komplement till storlekskriteriet bedöms även lymfkörtlars form och struktur. Hydronefros samt avvikande uretär- eller kärlanatomi anges, liksom eventuell fjärrspridning till lever, lungor och skelett.
