Diagnosgrupper
Läppcancer
Översikt
|
ICD-10 |
|
|
Överläpp |
C00.0 |
|
Underläpp |
C00.1 |
|
Kommissur (munvinkel) |
C00.6 |
|
Ospecificerad del av läpp |
C00.2 |
|
Övergripande läppcancer |
C00.8 |
|
Ospecificerad läppcancer |
C00.9 |
Anatomi
Läppcancer utgår från det läppröda som börjar vid övergången från hudkanten och slutar där slemhinnan börjar på insidan av läppen.
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning enligt UICC, TNM classification of malignant tumours, 8th edition, 2017 212.
Kliniska T-kategorier (cTNM 8)
|
T |
Storlek, utbredning |
|
T1 |
Tumör ≤ 2 cm med ≤ 5 mm infiltrationsdjup |
|
T2 |
Tumör ≤ 2 cm med infiltrationsdjup > 5 mm men ≤ 10 mm eller > 2 cm och ≤ 4 cm med ≤ 10 mm infiltrationsdjup |
|
T3 |
> 4 cm eller > 10 mm infiltrationsdjup |
|
T4a |
Tumör som växer genom kortikalt ben (ej enbart erosion), nervus alveolaris inferior, munbotten eller hud (till kind eller näsa) |
|
T4b |
Tumör som växer in i masticator space, pterygoidplattor eller skallbas, eller växt runt arteria carotis interna |
Kliniska N-kategorier (cTNM 8)
|
N |
Storlek, utbredning |
|
N1 |
En ipsilateral körtel ≤ 3 cm utan extranodal utbredning |
|
N2a |
En ipsilateral körtel > 3 cm men ≤ 6 cm utan extranodal utbredning |
|
N2b |
Multipla ipsilaterala körtlar, ingen > 6 cm och utan extranodal utbredning |
|
N2c |
Kontralateral eller bilaterala körtlar, ingen > 6 cm och utan extranodal utbredning |
|
N3a |
En körtel > 6 cm utan extranodal utbredning |
|
N3b |
Körtel eller körtlar med extranodal utbredning |
Klinisk stadieindelning (cTNM 8)
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
III |
IVA |
IVB |
|
T2 |
II |
III |
IVA |
IVB |
|
T3 |
III |
III |
IVA |
IVB |
|
T4a |
IVA |
IVA |
IVA |
IVB |
|
T4b |
IVB |
IVB |
IVB |
IVB |
M1 är alltid stadium IVC
Epidemiologi och incidens
Läppcancer utgör drygt 9,3 % av all HH-cancer.
Under perioden 2008–2021 diagnostiserades totalt 1937 fall. Jämfört med 1970-talet är detta en minskning med cirka 20 %. Den stora minskningen gäller män medan det skett en ökning för kvinnor. Under de senaste 10 åren har incidensen dock varit oförändrad.
Tumörformen är fortsatt vanligare bland män (58 %) men har gått ner från 90 % i början av 1970-talet. Medianåldern vid diagnos är 75 år för män och 76 år för kvinnor.
Av all läppcancer är 82 % lokaliserad till underläppen, oftast centralt. Cancer på överläppen förekommer i 8,4 % av fallen, och under 1 % finns i kommissuren (munvinkeln). I SweHNCR har 8,9 % angetts som ospecificerad cancer eller med övergripande växt (figur 14).
Enligt SweHNCR diagnostiserades 82 % med T1-tumörer under perioden 2008–2021, 14 % med T2 och 2 % med T3–T4-tumörer och 2,7 % hade metastas på halsen vid diagnos.
Figur 14. Fördelning av läge för läppcancer 2008–2021, andel fall.
Etiologi
Känd etiologisk faktor är solexponering 213
Patologi
Den vanligaste tumörformen vid läppcancer är skivepitelcancer (SCC) som uppvisar histologiska egenskaper som är identiska med konventionell oral SCC (se avsnitt 19.2.1.5) eller andra SCC vid huvud- och halscancer. Vanligtvis är läppens SCC högt differentierad och associerad med ett kraftigt inflammatoriskt infiltrat där man ofta kan notera aktinisk keratos eller cheilit med skivepitelsdysplasi med övergång i en invasiv cancer. De flesta av dessa tumörer uppträder hos män. Prediktionsstället för SCC vid cancer i underläppen är vid vermilions gräns, dvs det läpprödas övergång till hud.
Symtom
Patienterna söker oftast vård för ett kvarstående sår eller tumör på läppen.
Utredning
Klinisk utredning
Cancermisstänkta förändringar på läppen utreds med stansbiopsi eller provexcision. Utredningen omfattar klinisk palpation av halsens mjukdelar och lymfkörtlar inklusive bimanuell palpation av nivå Ia och Ib.
Tumörer större än T1N0 ska diskuteras på MDK.
Radiologisk utredning
Klinisk T1-tumör:
- Eventuellt ultraljudsundersökning med finnålspunktion (UL-FNAC) av halsens lymfkörtlar.
Klinisk T2–T4-tumör:
- DT av huvud, hals och thorax.
- MRT av primärtumörområdet när T-stadium är svårvärderat med DT.
- Eventuellt UL-FNAC av halsens lymfkörtlar styrd av tidigare DT.
- Vid T3–T4-tumörer rekommenderas PET-CT med diagnostisk DT-kvalitet.
Radiologisk utredning av läppcancer är aktuell vid klinisk misstanke om metastaser eller en primärtumör i kategori T2 och större.
DT av huvud, hals och thorax är förstahandsvalet 214.
MRT är ett alternativ till DT om kontrastmedel inte kan ges eller om området störs av tandfyllningsartefakter 55. Vid uttalad misstanke om metastasering kan man använda FDG-PET-CT av huvud, hals, thorax och buk för att utesluta eller kartlägga fjärrmetastasering 215.
Behandling
Primärtumör
Enligt SweHNCR (2008–2021) behandlades 88 % av patienterna med kirurgi, 8 % med strålbehandling, 4 % med kirurgi kombinerat med strålbehandling med eller utan medicinsk tumörbehandling.
Kirurgi är förstahandsvalet vid läppcancer. Vid T1-tumörer utan tecken på lymfkörtelengagemang excideras tumören och patienten behöver inte tas upp på MDK. Excisionen bör göras med minst 8 mm marginal i form av kilexcision, förskjuten kilexcision, W-excision eller trappstegsplastik 216217. Omkring 50 % av underläppen kan excideras med bibehållen funktion. Om en större resektion behövs går det att använda förskjutningslambå, rotationslambå eller fri vaskulariserad lambå i rekonstruktionssyfte. För protesbärare är det viktigt att beakta munstorleken postoperativt.
En marginal på 5 mm i fixerat tillstånd betraktas som radikalt, och vid mindre marginal bör reoperation övervägas, alternativt diskuteras på MDK.
Strålbehandling, extern eller i kombination med brakyterapi, är ett alternativ till kirurgi vid behandling där kirurgi kan förväntas ge dålig funktion och eller kosmetiska problem.
Regionala lymfkörtlar
Läppcancer sprider sig i första hand till submentala eller submandibulära lymfkörtlar (nivå I), men det är ovanligt vid T1-tumör. Riskfaktorer för regional spridning är högre T-klassifikation, cancer på överläppen 218 och perineural växt. Vid större tumörer (> T1) utan tecken på regional metastasering kan man överväga en profylaktisk behandling av halsens lymfkörtlar, men evidensen för denna åtgärd är otillräcklig.
Vid känd lymfkörtelmetastasering utförs en halslymfkörtelutrymning och därefter postoperativ strålbehandling.
Uppföljning
Rekommendation:
Alla patienter med läppcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker och hemortssjukhuset.
Kontrollen ska även omfatta bimanuell palpation av submentala och submandibulära lymfkörtlar.
År 1–2
Under de första 2 åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 kontrolleras stadium I-patienter en gång årligen och stadium II-IV var 6:e månad.
Prognos
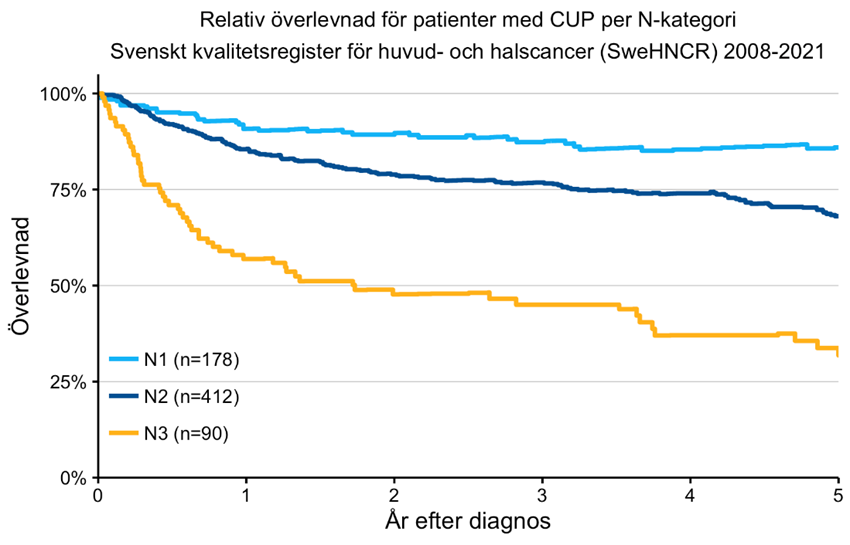
- De flesta tumörerna är små vid diagnos och prognosen är mycket god. Den relativa 5-årsöverlevnaden för all läppcancer är 91,2 % (SweHNCR) men försämras vid mer avancerat tumörstadium (figur 15).
- Överlevnad för stadium I 95 % (92 %–98 %)
- Överlevnad stadium II 74 % (65 %–85 %)
- Överlevnad stadium III och IV har tillsammans en överlevnad på 70 % (55 %–88 %).
Figur 15. Relativ överlevnad för patienter med läppcancer, per stadium.
Munhålecancer
Översikt

|
ICD-10 |
|
|
Tunga |
C02.0, C02.1, C02.2, C02.3, C02.8 C02.9 |
|
Gingiva |
C03.0, C03.1, C03.9 |
|
Munbotten |
C04.0, C04.1, C04.8, C04.9 |
|
Bucca |
C06.0, C00.3, C00.4 |
|
Hårda gommen |
C05.0 |
|
Övrig munhåla |
C06.1, C06.2, C06.8, C06.9 |
Anatomi
Munhålan begränsas framåt av läpparna. Buccan är kindens och läpparnas insida som gränsar mot det läppröda och sträcker sig bakåt till den främre gombågen, som utgör bakre begränsning mot svalget. Trigonum retromolare utgör den bakersta delen av gingivalslemhinnan i underkäken. Gränsen till tungbasen går mellan de främre gombågarna utmed papillae circumvallatae. Hela den rörliga delen av tungan ligger i munhålan, medan tungbasen, gombågarna, mjuka gommen och uvula tillhör orofarynx. Munbotten är området mellan alveolarutskottet och tungan.
Munhålecancer indelas i tung-, gingival-, munbotten-, buckal- och gomcancer (hårda gommen). Om tumören har växt över till flera anatomiska regioner i munhålan klassificeras den efter det område där den har sin största utbredning. Cancer i slemhinnan på alveolarutskottet i över- och underkäken klassificeras som gingivalcancer.
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning enligt UICC, TNM classification of malignant tumours, 8th edition, 2017 212.
Kliniska T-kategorier (cTNM 8)
|
|
Storlek, utbredning |
|
T1 |
Tumör ≤ 2 cm med ≤ 5 mm infiltrationsdjup |
|
T2 |
Tumör ≤ 2 cm med infiltrationsdjup > 5 mm men ≤ 10 mm eller > 2 cm och ≤ 4 cm med ≤ 10 mm infiltrationsdjup |
|
T3 |
Tumör > 4 cm eller > 10 mm infiltrationsdjup |
|
T4a |
Tumör som växer genom kortikalt ben (ej enbart erosion) i under- eller överkäke, eller växer in i hud i ansiktet |
|
T4b |
Tumör som växer in i mastikatoriska rummet, pterygoidplattor, skallbas, eller växt runt arteria carotis interna |
Kliniska N-kategorier (cTNM 8)
|
|
Storlek, utbredning |
|
N1 |
En ipsilateral körtel ≤ 3 cm utan extranodal utbredning |
|
N2a |
En ipsilateral körtel > 3 cm men ≤ 6 cm utan extranodal utbredning |
|
N2b |
Multipla ipsilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N2c |
Kontralateral eller bilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N3a |
En körtel > 6 cm utan extranodal utbredning |
|
N3b |
Körtel eller körtlar med extranodal utbredning |
Klinisk stadieindelning (cTNM 8)
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
III |
IVA |
IVB |
|
T2 |
II |
III |
IVA |
IVB |
|
T3 |
III |
III |
IVA |
IVB |
|
T4a |
IVA |
IVA |
IVA |
IVB |
|
T4b |
IVB |
IVB |
IVB |
IVB |
M1 är alltid stadium IVC.
Epidemiologi och incidens
Munhålecancer är tillsammans med orofarynxcancer den vanligaste cancerformen inom huvud- och halsområdet. Under åren 2008–2021 ökade incidensen av munhålecancer med cirka 30 % (genomsnitt 2,3 % per år) och 489 fall registrerades 2021. År 2008–2021 var 48 % kvinnor och 52 % män. Medianålder vid insjuknandet var 68 år för män och 72 år för kvinnor (SweHNCR). Tungcancer dominerar och utgör 41,3 % av all munhålecancer medan cancer i hårda gommen är förhållandevis ovanlig (figur 16). Beroende på sublokalisation i munhålan upptäcks tumörerna i olika stadier (figur 17). Vid diagnos ses spridning till regionala lymfkörtlar (N1–N3) i 24 % av fallen (SweHNCR 2008–2021).
Figur 16. Fördelning av läge för munhålecancer, andel fall 2008–2021.
Figur 17. Fördelning av stadium per läge för munhålecan cer, andel fall 2008–2021.
Etiologi
Rökning och överkonsumtion av alkohol är välkända etiologiska faktorer för munhålecancer, men studier har inte kunnat påvisa att svenskt snus ökar risken. Dålig munhälsa är en oberoende riskfaktor. Humant papillomvirus (HPV) påvisas mindre ofta än vid orofarynxcancer och dess etiologiska betydelse för cancer i munhålan är inte helt klarlagd. I många fall identifieras ingen klar etiologisk faktor.
Patologi
Den vanligaste tumörformen i munhålan är oral skivepitelcancer (OSCC) (93 %). Cancerformen har samma histologiska egenskaper som andra SCC vid huvud- och halscancer, vilka företräds i varierande grad av skivepitelsdysplasi 219. En mindre andel är maligna spottkörteltumörer (se avsnitt 19.13). Enstaka fall med mukosala maligna melanom (slemhinnemelanom) förekommer också samt en del andra ovanliga tumörformer.
De flesta OSCC är måttligt eller högt differentierade; lågt differentierad OSCC är mindre frekvent förekommande. Högt differentierad OSCC tenderar att invadera underliggande stroma expansivt och karakteriseras av att tumören bildar nästen, trabeklar eller öar. Dessa strukturer består av stora celler med eosinofil cytoplasma, prominenta intercellulära bryggor och runda kärnor som kan vara tydligt hyperkromatiska. Dyskeratotiska celler och hornpärlor noteras. Cellulär och kärnpleomorfism, hyperkromasi och mitotiska strukturer (inklusive atypiska former) ökar den histologiska graden.
Lågt differentierade OSCC är oftast finkolviga till växtsättet med små öar eller ”single cells”-infiltration vid den invasiva tumörfronten. Intravasal och perineural tumörväxt är mer vanlig hos lågt differentierade tumörer 220221222223. I lågt differentierade OSCC kan den skivepitelskaraktären vara minimal eller obefintlig, så ofta krävs immunhistokemisk bekräftelse för att med säkerhet kunna ställa diagnos. De vanligaste markörerna som används är bredspektrumcytokeratin CK AE1/AE3, CKMNF116 och OSCAR, dessutom kan CK5/6, p63 och p40 används i samma syfte (se avsnitt 8.2.2.5).
Histologiska markörer såsom tumörinfiltrationsmönster, lymfovaskulär invasion, perineuralväxt, invasionsdjup och beninvasion har en inverkan på överlevnaden och bör rapporteras i patologisvaret 62224.
Symtom
Det vanligaste symtomet är ett kvarstående sår i munnen. En slemhinneklädd tumör kan också visa sig vara cancer. Värk, trismus och/eller svårighet att tugga är senare symtom när tumören är stor eller växer in i underliggande ben. Om tumören engagerar alveolarutskottet kan patienter med tandprotes uppleva att den inte passar. Många patienter med gingivalcancer vänder sig först till sin tandläkare. Det är inte ovanligt att patienten har ringa besvär, vilket gör att diagnosen fördröjs.
Utredning
Klinisk utredning
Vid det första besöket på en ÖNH-klinik är det lämpligt att göra en biopsi från tumören för en histopatologisk diagnos. Palpatoriskt misstänkta lymfkörtelmetastaser på halsen ska finnålspunkteras, med fördel ultraljudslett. Mellannålsbiopsi kan vara ett alternativ men öppen biopsi ska undvikas.
Tumörens utseende, lokalisation och utbredning ska beskrivas och helst dokumenteras med foto eller beskrivas i en tumörschablon. Risken för kontralateral körtelmetastasering bör beaktas. Fortsatt handläggning innebär radiologisk utredning och vid behov undersökning under narkos med biopsi, palpation och bedömning av resektabilitet.
Man bör undvika en excisionsbiopsi eftersom tumörens ursprungliga utbredning kan bli svår att lokalisera, vilket försvårar senare kirurgisk behandling.
Radiologisk utredning
- DT av huvud, hals och thorax.
- MRT av primärtumörområdet och skallbas när T-stadium är svårvärderat med DT, samt i tumörlokaler med stor risk för perineural tumörspridning.
- Vid T1 och T2 tumörer utan kliniska tecken på regional spridning kan sentinel node scintigrafi utföras efter beslut på MDK.
- Eventuellt UL-FNAC av halsens lymfkörtlar.
- Vid T3–T4-tumörer rekommenderas PET-CT med diagnostisk DT-kvalitet.
Syftet med den radiologiska utredningen är att kartlägga tumörutbredningen, eventuell bendestruktion och perineural-, regional- eller fjärrspridning.
DT av huvud, hals och thorax med kontrast är förstahandsvalet. En serie med gapande mun bör utföras som tillägg till bildserie med stängd mun, det minskar störningar från metallartefakter och skärper diagnostiken. Vid buckala tumörer kan en extra bildserie med ”puffed cheek”-teknik (patienten blåser upp munhålan och svalget med luft mot stängda läppar) utlinjera den primära tumörväxten i slemhinnan och ge en bättre bedömning av eventuell överväxt på alveolarutskottet.
MRT är indicerat om primärtumörens utbredning är svår att definiera med DT och klinisk undersökning. MRT ger ofta mer information om lokal utbredning och benmärgsengagemang, samt kan bättre än DT detektera perineural spridning 55.
Observera att en radiologisk undersökning inte bör användas för att bedöma invasionsdjup utan enbart tumörtjocklek.
Portvaktskörtelskintigrafi kartlägger lymfatiskt avflöde från tumörområdet. Metoden bör erbjudas patienter med resektabla tumörer i munhålan utan kliniskt påvisad spridning. För utförlig beskrivning av metoden se bilaga 1 Tekniska rekommendationer vid radiologisk utredning.
UL-FNAC ger möjlighet att diagnostisera metastaser i små lymfkörtlar på halsen, och kan användas frikostigt då munhålecancrar ofta metastaserar tidigt. Ultraljudsundersökningen bör vara vägledd av tidigare DT eller MRT.
Vid avancerade tumörer eller där mutilerande kirurgi kan vara aktuell, har PET-CT ett stort värde för lokoregional stadieindelning och detektion av fjärrmetastaser 56.
Vid återfall eller residualtumör kan en kombination av MRT, som inkluderar diffusionsviktad sekvens, och PET-CT vara av värde för att differentiera mellan postterapeutiska förändringar och kvarvarande tumör 225.
Behandling
Munhålecancer är vanligt förekommande och det finns randomiserade studier, men trots detta saknas tydlig evidens för valet av bästa behandling 226227228 och behandlingstraditionerna varierar.
Under perioden 2008–2021 behandlades 46 % av patienterna med oral cancer (alla tumörlokaler och stadier) med enbart kirurgi och 34 % behandlades med kirurgi i kombination med pre- eller postoperativ strålbehandling. Cytostatika gavs i kombination med annan behandling i 5 % av fallen (SweHNCR).
Det vanligaste är att kirurgi rekommenderas för de mindre munhåletumörerna och en kombinationsbehandling vid ett mer avancerat stadium. Det tillgängliga vetenskapliga underlaget visar inte säkert huruvida strålbehandling, vid stadium III–IV, bör föregå eller följa kirurgi. Både i Sverige och globalt är dock kirurgi följt av postoperativ strålbehandling vanligast. Den diagnostiska aspekten (pTNM) utgör ett argument för primär kirurgi följt av postoperativ strålbehandling. Samma behandlingssekvens kan även rekommenderas vid N+ sjukdom
Primärtumör
Avgörande för beslutet om kirurgisk behandling är om primärtumören bedöms vara möjlig att radikalt avlägsna med bevarad rimlig postoperativ funktion, i vissa fall med rekonstruktion. Med radikalitet avses 5 mm marginal i fixerat tillstånd, vilket motsvarar 8–10 mm vid operationstillfället 216. Vid benengagemang eller misstanke om benengagemang, se avsnitt 19.4.2.2.1.
Vid tveksam eller bristfällig radikalitet <5 mm måste man överväga en utvidgad resektion i första hand, och som alternativ kan postoperativ strålbehandling ges 217.
Om patienten inte bedöms som operabel eller tumören resektabel rekommenderas i första hand kurativt syftande strålbehandling, eventuellt med tillägg av medicinsk tumörbehandling.
Behandling av regionala lymfkörtlar
N0
Cirka 20–25 % av patienterna med T1–T2N0-tumörer har vid diagnos ockult regional metastasering, det vill säga regional spridning som inte diagnostiseras trots adekvat klinisk och radiologisk utredning 229230231232233. Därför rekommenderas primärt en aktiv behandling av halsens lymfkörtlar, antingen med diagnostisk lymfkörtelutrymning av minst region I–III, eller med strålbehandling av halsens lymfkörtelstationer 234. Båda behandlingsalternativen minskar risken för regionala återfall.
Om en diagnostisk lymfkörtelutrymning påvisar regional metastasering, rekommenderas postoperativ strålbehandling. Om det finns periglandulär växt kan det vara indicerat med ett tillägg av konkomitant cisplatin 226235.
Sentinel node-biopsi är ett alternativ till diagnostisk halskörtelutrymning 66. Vid sentinel node-biopsi avlägsnas portvaktskörtlar oavsett sida och region. Vid positiv sentinel node-biopsi rekommenderas kompletterande kirurgisk och/eller strålbehandling med eller utan tillägg av konkomitant cisplatin 236.
Utifrån riskfaktorer, exempelvis invasionsdjup, perineural växt och knappa marginaler, kan tillägg av postoperativ strålbehandling övervägas även vid stadium 2 237.
N+
Regional spridning vid diagnos innebär en tumörsjukdom i stadium III eller IV. I dag rekommenderas i första hand kirurgi med lymfkörtelutrymning följt av strålbehandling. Strålbehandling följt av kirurgi kan övervägas i utvalda fall 227228.
Vid regional metastasering, där kirurgi inte är aktuell, ges en kurativ dos strålbehandling mot engagerade körtelstationer och en profylaktisk dos mot övriga stationer bilateralt.
Medicinsk tumörbehandling
Konkomitant cisplatin bör övervägas veckovis som tillägg till den postoperativa strålbehandlingen till patienter med WHO:s performance status 0–1, om radikalitet inte uppnåddes vid primäroperationen och/eller vid regional metastasering med periglandulär växt 99. Cisplatin kan även ges konkomitant med fulldos strålbehandling i de fall där tumören bedöms vara icke resektabel. Vid kontraindikationer för cisplatin, se avsnitt 11.3.3 Medicinsk tumörbehandling.
Uppföljning
Rekommendation:
Alla patienter med munhålecancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Kontrollerna efter behandlingen syftar till att tidigt upptäcka lokoregionala återfall samt behandla och stödja patienterna i sin cancerrehabilitering med de problem som kvarstår, såsom nutritionssvårigheter, smärta, försämrat tal, försämrad bettfunktion. Ett annat syfte är att bedöma behovet av psykosocialt stöd. Hos strålbehandlade patienter följs eventuella seneffekter, som till exempel osteoradionekros och tyroideafunktion.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden för all cancer i munhålan är 62,2 % och prognosen varierar beroende på tumörlokal. Överlevnaden är högst för patienter med cancer i hårda gommen och lägst för dem med munbottencancer (SweHNCR 2008–2021), se figur 18. Spridningen är stor beroende på tumörens stadium vid diagnosen, se figur 19.
Figur 18. Relativ överlevnad för patienter med munhålecancer.
Figur 19. Relativ överlevnad för patienter med munhålecancer (stadium enl. UICC 7th)
Tungcancer
Översikt
Bild: se avsnitt 19.2 Munhålecancer
|
ICD-10 |
|
|
Tungrygg och tungrand |
C02.0, C02.1 |
|
Tungans undersida |
C02.2 |
|
Tunga övergripande växt eller icke specificerad lokalisation |
C02.3, C02.8, C02.9 |
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning finns i avsnitt 19.2.1.2 Munhålecancer.
Tungcancer är den vanligaste tumören i munhålan, cirka 175 nya fall diagnostiseras årligen. Tumören växer oftast längs tungranden. Enligt SweHNCR är två tredjedelar av tungcancerfallen i stadium I–II vid diagnos, men ockult metastasering är vanligt förekommande.
Patologi
Den dominerande tumörformen vid tungcancer är liksom vid andra tumörer i munhålan konventionell keratiniserande SCC (se avsnitt 19.2.1.5 för närmare beskrivning). Dessa tumörer kan fokalt invadera djupt i underliggande skelettmuskulatur, varför extensiv undersökning av operationspreparat ofta behövs.
Behandling
Primärtumör
Kirurgi, det vill säga partiell tungresektion eller hemiglossektomi, utförs om tumören bedöms vara resektabel med god marginal. I de fall rekonstruktion bedöms vara indicerad kan man använda en fri vaskulariserad lambå.
Kirurgi brukar inte rekommenderas i de fall där operation i princip skulle innebära en total glossektomi, men kan övervägas 238.
Halsens lymfkörtlar
Aktiv behandling av N0 hals rekommenderas eftersom ockult metastasering är vanlig. Vid mycket ytliga T1-tumörer kan aktiv exspektans i undantagsfall övervägas 239.
Stadium I och II
Rekommenderad behandling är kirurgi av primärtumören med diagnostisk ipsilateral körtelutrymning (minst nivå I–III). Sentinel node-diagnostik med eventuell efterföljande halskörtelutrymning är ett annat alternativ 240. Adjuvant strålbehandling av halsens lymfkörtlar (oftast I–III) kan också ges, vilket dock omöjliggör bedömning av pTNM.
Vid pT2N0 med ogynnsamma egenskaper i PAD (växtsätt ”worst pattern of invasion”, perineural växt, snäv marginal, inväxt i kärl) kan man överväga postoperativ strålbehandling 233.
Stadium III och IV
Vid stadium III och IV rekommenderas vanligen kombinationsbehandling med kirurgi av primärtumör och halslymfkörtelutrymning följd av strålbehandling mot både primärtumörområde och hals; oftast ges kurativ strålbehandling med eller utan konkomitant cytostatika mot primärtumörområdet och ipsilateralt mot halsen samt profylaktisk dos mot kontralaterala halsen.
Preoperativ kartläggning av lymfflödet kan övervägas till exempel med lymfscintigrafi.
För patienter som inte lämpar sig för kirurgi kan kurativt syftande strålbehandling med konkomitant cytostatika övervägas.
Uppföljning
Rekommendation:
Alla patienter med tungcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden vid tungcancer är 64,7 %, men det är stora skillnader beroende på stadium, se figur 20.
Figur 20. Relativ överlevnad för patienter med tungcancr (stadium enl. UICC 7th)
Gingivalcancer i mandibel eller maxilla
Översikt
Bild: se avsnitt 19.2 Munhålecancer.
|
ICD-10 |
|
|
Gingivomaxillär cancer |
C03.0 |
|
Gingivomandibulär cancer |
C03.1 |
|
Gingivalcancer ospecificerad |
C03.9 |
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning finns i avsnitt 19.2.1.2 Munhålecancer.
Antal fall med gingivalcancer har ökat kraftigt under perioden 2008–2021 från ca 70 årligen till cirka 115 fall, se figur 21.
Figur 21. Antal fall av gingivalcancer registrerade i SweHNCR, per diagnosår 2008–2021.
Nära två tredjedelar av tumörerna är gingivomandibulära och en tredjedel gingivomaxillära. De diagnostiseras ofta i ett avancerat stadium då de har invaderat underliggande ben i mandibel eller maxilla. Risken för benengagemang ökar vid betandat alveolarutskott.
Benengagemang kan vara av erosiv typ (tryck från tumör utan invasiv växt) eller invasiv. Bedömning av benengagemang baseras på klinisk och röntgenologisk undersökning. Behandlingen modifieras med hänsyn till om benengagemang misstänks eller är verifierat.
Det är också vanligt med utbredning till bucca och munbotten.
Vid diagnos var fördelningen mellan stadierna enligt följande: stadium I: 17 %, stadium II: 13 %, stadium III: 6 % och stadium IV: 63 % (SweHNCR 2008–2021).
Patologi
Den vanligast förekommande tumörformen för denna lokalisation är konventionell högt till medelhögt differentierad keratiniserande SCC. Därtill ses andra mindre vanligt förekommande tumörformer (se avsnitt 19.2.1.5 för närmare beskrivning).
Behandling
Mindre tumörer
Mindre tumörer i stadium I–II behandlas med kirurgisk exstirpation, och vid osäkerhet om benengagemang bör man göra en partiell resektion av underliggande ben, en så kallad lådresektion (marginalresektion). Lådresektion kan också övervägas om det endast finns radiologiska tecken på mycket ytlig påverkan av alveolärt ben. Rekonstruktion med tandimplantat för tandersättningar kan ske primärt eller i ett senare skede.
Resektionsgränser
Resektionsgräns bör vara minst 10 mm från klinisk och radiologisk tumör.
Kirurgi vid avancerade tumörer
Vid avancerad gingivalcancer är en kombinerad behandling med kirurgisk resektion och strålbehandling med eller utan konkomitant cytostatika vedertagen.
Benengagemang
Vid verifierat benengagemang rekommenderas vanligen segmentell benresektion (kontinuitetsavbrott), framför allt vid inväxt i märgrummet eller vid tumörväxt i atrofisk mandibel. Vid inväxt i märgrummet kan öar av tumörförband finnas inom hela mandibelhöjden, bedömningen ska också göras med hänsyn till eventuell perineural spridning.
Gingivalcancer i mandibel
En rekonstruktion behöver göras efter kirurgi vid större defekter av mjukvävnad samt efter kirurgisk resektion med ett kontinuitetsavbrott i mandibel. Valet av rekonstruktionsmetod ska anpassas till patientens status och förutsättningar att klara en lång operation och efterföljande konvalescens. I det ideala fallet återställer man mandibelns kontinuitet med en senare installation av titanfixturer för tandersättningar i syfte att få ett fungerande bett. Målsättningen är att behålla tumörkirurgisk radikalitet och optimera den postoperativa funktionen. För protetisk rehabilitering bör patienten tidigt även bedömas av oral protetiker.
Gingivalcancer i maxilla
Vid tumörväxt i maxilla bör man göra en partiell resektion eller maxillektomi. Direktrekonstruktion kan ske med lambå, men ett alternativ till detta är obturatorprotes.
Den histopatologiska analysen av resektatet ska omfatta urkalkat ben för att säkerställa kirurgiska resektionsränder.
Halsens lymfkörtlar
Risken för regional metastasering till halsen är mindre vid gingivomaxillär cancer jämfört med gingivomandibulär cancer och övrig oral cancer.
Vid gingivomandibulär cancer kan sentinel node-diagnostik med eventuell efterföljande halskörtelutrymning eller diagnostisk halslymfkörtelutrymning övervägas även vid mindre tumörer.
Adjuvant strålbehandling av halsens lymfkörtlar (oftast I–III) kan övervägas i utvalda fall, vilket dock omöjliggör bedömning av pTNM.
Vid gingivomaxillär cancer T1–T2 och frånvaro av såväl klinisk som radiologisk regional spridning, det vill säga N0 hals, kan man överväga att inte behandla halsen 241.
För behandlingen av halsen i övrigt, se avsnitt 19.2.4 munhålecancer.
Uppföljning
Rekommendation:
Alla patienter med gingivalcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Dessa patienter följs även av käkkirurg eller specialisttandvård för att kontrollera bettfunktionen. Hos strålbehandlade patienter följs utveckling och eventuell behandling av seneffekter, till exempel osteoradionekros.
År 1–2
Under de första 2 åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden vid gingivomandibulär cancer är 54,6 % och vid gingivomaxillär cancer 61,7 % (se figur 22). Tumörer i stadium I har god prognos (se figur 23).
Figur 22. Relativ överlevnad för patienter med gingivalcancer, per läge.
Figur 23. Relativ överlevnad för patienter med gingivacancer, per stadium.
Munbottencancer
Översikt
Bild: se avsnitt 19.2 Munhålecancer
|
ICD-10 |
|
|
Munbotten främre delen |
C04.0 |
|
Munbotten lateral del |
C04.1 |
|
Munbotten övergripande växt eller icke specificerad lokalisation |
C04.8, C04.9 |
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning, se avsnitt 19.2 Munhålecancer.
Under åren 2008–2021 diagnostiserades cirka 50 fall per år av munbottencancer med följande stadiefördelning: I: 33,4 %, II: 20,0 %, III: 11,5 % och IV: 34,8 % (SweHNCR).
Patologi
Konventionell keratiniserande SCC av högt till medelhögt differentierad typ dominerar vid munbottencancer. Därtill ses andra mindre vanligt förekommande tumörformer (se avsnitt 19.2.1.5 för närmare beskrivning).
Behandling
Primärtumör
Kirurgi utförs då tumören bedöms vara resektabel och patienten kan få god funktion postoperativt. Ibland behövs en kirurgisk resektion av intilliggande mandibel, för att uppnå en tillräcklig marginal, även om det inte finns några tecken på benengagemang eller bendestruktion.
I de fall rekonstruktion bedöms vara indicerad kan man till exempel använda en fri vaskulariserad lambå.
Om patienten inte lämpar sig för kirurgi kan kurativt syftande strålbehandling, med eller utan konkomitant cytostatika, övervägas i andra hand.
Halsens lymfkörtlar
Aktiv behandling av N0 hals rekommenderas eftersom ockult metastasering är vanlig. Vid mycket ytliga T1-tumörer kan aktiv exspektans i undantagsfall övervägas, se avsnitt 19.2 Munhålecancer.
Stadium I och II
För tumörer i stadium I och II finns för närvarande två behandlingsalternativ av halsen. Kirurgisk behandling av primärtumören och diagnostisk halslymfkörtelutrymning, unilateralt eller bilateralt beroende på tumörlokalisation (minst nivå I–III). Sentinel node-biopsi kan användas som ett diagnostiskt verktyg för beslut om behandling av eventuella halskörtelmetastaser. Kirurgi av primärtumören och profylaktisk strålbehandling av halsen kan ges, men omöjliggör bedömning av pTNM.
Stadium III och IV
Vid stadium III och IV rekommenderas kirurgi av primärtumören, körtelutrymning av halsen och postoperativ strålbehandling mot primärtumörområde och hals. Kurativt syftande strålbehandling med konkomitant cytostatika kan övervägas om patienten av olika skäl inte bedöms vara operabel.
Uppföljning
Rekommendation:
Alla patienter med munbottencancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden är 51 % vid munbottencancer. Överlevnaden varierar beroende på stadium (figur 24).
Figur 24. Relativ överlevnad för patienter med munbottencancer (stadium enl. UICC 7th)
Buckalcancer
Översikt
Bild: se avsnitt 19.2 Munhålecancer
|
ICD-10 |
|
|
Övre och nedre läppens insida, mucosa |
C00.3, C00.4 |
|
Kindens insida |
C06.0 |
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning, se avsnitt 19.2 Munhålecancer.
Varje år diagnostiseras drygt 50 patienter med buckalcancer, varav omkring 70 % har stadium I eller II (SweHNCR 2008–2021).
Patologi
Den vanligast förekommande tumörformen för buckalcancer är konventionell högt till medelhögt differentierad keratiniserande SCC. Därtill ses andra mindre vanligt förekommande tumörformer (se avsnitt 19.2.1.5 för närmare beskrivning).
Behandling
Primärtumör
Primärtumörer behandlas med kirurgi i de fall tumören bedöms som resektabel med god marginal och patienten kan få acceptabel postoperativ funktion. I vissa fall kan man behöva göra en partiell kirurgisk resektion av intilliggande ben, för att uppnå en tillräcklig marginal. Rekonstruktion med lambå kan övervägas.
Stadium I och II
För tumörer i stadium I och II rekommenderas i första hand kirurgisk behandling av primärtumören med diagnostisk körtelutrymning av halsen (minst nivå I–III). Sentinel node-diagnostik med eventuell efterföljande halskörtelutrymning är ett alternativ. Adjuvant strålbehandling av halsens lymfkörtlar (oftast I–III) kan också ges, vilket dock omöjliggör bedömning av pTNM.
Stadium III och IV
Vid stadium III och IV rekommenderas vanligen en kombinationsbehandling med resektion av primärtumören, halslymfkörtelutryming med eventuell rekonstruktion, samt postoperativ strålbehandling mot både primärtumör och hals med eller utan konkomitant cytostatika.
Strålbehandling med eller utan cytostatika kan övervägas vid icke resektabla tumörer.
Uppföljning
Rekommendation:
Alla patienter med buckalcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden är 74 % vid buckalcancer. Överlevnaden vid tumörer i stadium I är mycket god (figur 25).
Figur 25. Relativ överlevnad för patienter med buckalcancer (stadium enl. UICC 7th)
Cancer i hårda gommen
Översikt
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning, se avsnitt 19.2 Munhålecancer.
Cancer i hårda gommen är ovanlig. Varje år diagnostiseras 10–20 nya fall, varav cirka hälften i stadium I (SweHNCR 2008–2021). Till skillnad från övriga lokaler i munhålan är spottkörtelcancer i hårda gommen vanligare (65 %) än skivepitelcancer (32 %). I stadium I och II är 23 % skivepitelcancer och i stadium III och IV 46 %.
Patologi
Den vanligast förekommande tumörformen för cancer i hårda gommen är spottkörtelcancer. Den keratiniserande skivepitelcancern är oftast högt till medelhögt differentierad. Därtill ses andra mindre vanligt förekommande tumörformer (till exempel slemhinnemelanom) (se avsnitt 19.2.1.5 för närmare beskrivning).
Behandling
Primär tumör
Majoriteten av patienterna diagnostiseras med en T1- eller T2-tumör, det vill säga utan påvisade skelettdestruktioner. Vid spottkörteltumör ska eventuell perineural tumörväxt beaktas. Radikal kirurgi medför ofta att en del av benet måste inkluderas för att få en tillfredsställande marginal. Rekonstruktion eller protes kan bli aktuellt.
Halsens lymfkörtlar
Regional metastasering är ovanligt vid cancer i hårda gommen och det finns få studier om huruvida profylaktisk behandling av N0 hals är nödvändig. Hittills har man oftast avstått från profylaktisk behandling av halsen vid en lägre T-kategori.
Sentinel node-biopsi av halslymfkörtlar är inte ett självklart alternativ vid cancer i hårda gommen beroende på den höga andelen spottkörtelcancer och den relativt låga frekvensen halslymfkörtelmetastaser.
Stadium I–II
Vid cancer i hårda gommen utan känd metastasering till halsen rekommenderas kirurgisk behandling av primärtumören.
Stadium III–IV
Vid cancer i hårda gommen rekommenderas kirurgisk behandling av primärtumören.
Vid lymfkörtelmetastasering bör körtelutrymning göras samt postoperativ strålbehandling ges.
Vid T3–T4 utan lymfkörtelmetastasering rekommenderas postoperativ strålbehandling med eller utan konkomitant cytostatika mot primärtumör och ipsilateralt mot halsen.
Alternativet är fulldos strålbehandling med konkomitant cytostatika av primärtumören och ipsilateralt mot halsen samt profylaktisk strålbehandling mot kontralaterala sidan, vid icke resektabla tumörer.
Uppföljning
Rekommendation:
Alla patienter med cancer i hårda gommen bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
För protetisk rehabilitering bör patienten tidigt även bedömas av oral protetiker för utprovning av gomplatta och rekonstruktion av bettfunktion.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
För vissa typer av spottkörtelcancer, exempelvis adenoidcystisk cancer, kan längre uppföljning vara aktuell.
Prognos
Den relativa 5-årsöverlevnaden är 82 % vid cancer i hårda gommen. Överlevnaden per stadium visas i figur 26.
Figur 26. Relativ överlevnad för patienter med cancer i hårda gommen (stadium enl. UICC 7th)
Övrig cancer i munhålan
Översikt
Bild: se avsnitt 19.2 Munhålecancer
|
ICD-10 |
|
|
Trigonum retromolare |
C06.2 |
|
Sulcus bucco-alveolaris |
C06.1 |
|
Övergripande växt eller icke specificerad malign tumör i munhålan |
C06.8, C06.9 |
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning, se avsnitt 19.2 Munhålecancer.
Till gruppen ”övrig cancer i munhålan” räknas de tumörer som inte inkluderas i de övriga tumörlokalerna i munhålan. Cirka 20 fall per år registreras enligt SweHNCR, varav de största grupperna är tumörer retromolart, tumörer med övergripande växt i munhålan där epicentrum inte kan fastställas och tumörer med ospecificerad tumörlokal. Drygt 50 % diagnostiseras i stadium IV.
Patologi
Den vanligast förekommande tumörformen för övrig cancer i munhålan är konentionell högt till medelhögt differentierad keratiniserande SCC. Därtill ses andra mindre vanligt förekommande tumörformer (se avsnitt 19.2.1.5 för närmare beskrivning).
Behandling
Dessa tumörer bedöms och behandlas individuellt i enlighet med behandlingsprinciperna för munhålecancer.
Uppföljning
Rekommendation:
Alla patienter med övrig cancer i munhåla bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden för patienter med övrig munhålecancer är 53 % enligt SweHNCR 2008–2021. Relativ överlevnad per stadium visas i figur 27.
Figur 27. Relativ överlevnad för patienter med övrig cancer i övrig del av munhålan (stadium enl. UICC 7th)
Orofarynxcancer
Översikt

|
ICD-10 |
|
|
Tonsill |
C09.0, C09.8, C09.9 |
|
Tungbas |
C01.9 |
|
Gombåge |
C09.1 |
|
Mjuka gommens yta mot munhåla |
C05.1, C05.8, C05.9 |
|
Uvula (gomspene) |
C05.2, |
|
Bakre svalgväggen mellan mjuka gommens projektion när den stänger mot nasofarynx och nedåt till gränsen mot sinus piriformis och postkrikoidala rummet |
C10.0, C10.2, C10.3, C10.8, C10.9. |
Observera!
C02.4 malign tumör i tungtonsill ska inte användas utan registreras som C01.9 malign tumör i tungbasen.
Anatomi
Orofarynx (mellansvalget) omfattar mjuka gommen och främre gombågarna, och sträcker sig ner till tungbenet. Den övre begränsningen utgörs av mjuka gommens projektion mot bakre svalgväggen vid sväljning.
TNM-klassifikation och stadieindelning
Klassificeringen av orofarynxcancer skiljer sig åt mellan p16-positiva och p16-negativa tumörer. p16-analys är obligat vid utredning av orofarynxcancer och styr klassifikationen, p16 är en vedertagen surrogatmarkör för HPV-status.
Kliniska T-kategorier (cTNM 8)
Orofarynx p16-negativa eller ej klassade tumörer
|
T |
Storlek, utbredning |
|
T1 |
Tumör ≤ 2 cm |
|
T2 |
Tumör > 2 cm och ≤ 4 cm |
|
T3 |
Tumör > 4 cm, eller utbredning till epiglottis linguala yta |
|
T4a |
Tumör som växer in i någon av följande: larynx, djup/extrinsic tungmuskulatur, mediala pterygoiden, hårda gommen eller mandibeln |
|
T4b |
Tumör som växer in i någon av följande: laterala pterygoideusmuskeln, pterygoidplattan, laterala nasofarynx, skallbasen, tumörväxt runt arteria carotis |
Kliniska N-kategorier (cTNM 8)
Orofarynx p16-negativa eller ej klassade tumörer
|
N |
Storlek, utbredning |
|
N1 |
En ipsilateral körtel ≤ 3 cm utan extranodal utbredning |
|
N2a |
En ipsilateral körtel > 3 cm och ≤ 6 cm utan extranodal utbredning |
|
N2b |
Multipla ipsilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N2c |
Kontralateral eller bilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N3a |
Körtel > 6 cm utan extranodal utbredning |
|
N3b |
Körtel eller körtlar med extranodal utbredning |
Klinisk stadieindelning (cTNM 8)
Orofarynx p16-negativa eller ej klassade tumörer
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
III |
IVA |
IVB |
|
T2 |
II |
III |
IVA |
IVB |
|
T3 |
III |
III |
IVA |
IVB |
|
T4a |
IVA |
IVA |
IVA |
IVB |
|
T4b |
IVB |
IVB |
IVB |
IVB |
M1 är alltid stadium IVC
Kliniska T-kategorier (cTNM 8)
Orofarynx p16-positiva tumörer
|
T |
Storlek, utbredning |
|
T1 |
Tumör ≤ 2 cm |
|
T2 |
Tumör > 2 cm och ≤ 4 cm |
|
T3 |
Tumör > 4 cm, eller utbredning till epiglottis linguala yta |
|
T4 |
Tumör som växer in i någon av följande: larynx, djup tungmuskulatur, mediala pterygoideusmuskeln, hårda gommen, mandibel, laterala pterygoideusmuskeln, pterygoidplattorna, laterala nasofarynx, skallbasen, växt runt arteria carotis |
Kliniska N-kategorier (cTNM 8)
Orofarynx p16-positiva tumörer
|
T |
Storlek, utbredning |
|
N1 |
Körtel eller körtlar unilateralt ≤ 6 cm |
|
N2 |
Kontralateral eller bilaterala körtlar ≤ 6 cm |
|
N3 |
Körtel eller körtlar > 6 cm |
Klinisk stadieindelning
Orofarynx p16-positiva tumörer
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
I |
II |
III |
|
T2 |
I |
I |
II |
III |
|
T3 |
II |
II |
II |
III |
|
T4 |
III |
III |
III |
III |
M1 är alltid stadium IV.
Epidemiologi och incidens
Under åren 2008–2021 rapporterades 5 641 nya fall av orofarynxcancer, varav 523 nya fall 2021. Incidensen av orofarynxcancer ökar och drygt två tredjedelar av de som drabbas är män. Orofarynxcancer är tillsammans med munhålecancer den vanligaste tumörlokalisationen vid HH-cancer. Medianålder för insjuknande är 63 år. Av de 523 fallen 2021 analyserades 493 med avseende på HPV/p16, och 408 (83 %) var positiva. Figur 28 visar fördelningen av de olika tumörlokalisationerna vid orofarynxcancer. Figur 29 visar andelen fall med lymfkörtelmetastasering vid olika T-stadier. Figur 30 visar fördelningen av p16-positiva/negativa tumörer och N0/N+ för de tre tumörlokalisationerna vid orofarynxcancer.
Figur 28. Fördelningen av orofarynxcancer avseende tumörlokalisation, 2008–2021.
Figur 29. Orofarynx-, tonsill-, och tungbascancer samt övrig orofarynxcancer fördelat på T1–T4 samt N0 och N+, 2008–2021.
Figur 30. Orofarynxcancer, tonsill-, tungbas- och övrig orofarynxcancer fördelat på p16-positiva/negativa tumörer samt N0 och N+, 2008–2021
Patologi
Den dominerande tumörformen är skivepitelcancer som utgör mer än 90 % av fallen. Därtill förekommer enstaka spottkörteltumörer (se avsnitt 19.13.1.3) samt hematolymfoida tumörer.
Numera är HPV en etablerad och vedertagen riskfaktor för orofaryngeal skivepitelcancer (OPSCC) samt avgörande för stadieindelningen. Detta har även lett till att WHO rekommenderar indelning av OPSCC i två kategorier: HPV-positiv OPSCC och HPV-negativ OPSCC. p16-överuttryck anses som en godtagbar surrogatmarkör för HPV och färgning för p16 rekommenderas i den senaste AJCC/UICC-stadieindelningen [182] Immunhistokemisk färgning för p16 ska därför utföras vid all orofarynxcancer, och bör även kompletteras med HPV-analys (PCR eller in situ hybridisering).
HPV-positiv OPSCC karaktäriseras morfologiskt av icke-keratiniserande skivepitelcancer som växer i nästen i ett lymfoitt stroma. Tumörcellerna är ofta basaloida med ett högt kärn- eller cytoplasmaratio, och såväl mitotiska och apoptotiska strukturer är lättfunna. Keratinisering förekommer ofta sparsamt eller saknas. Tumörgradering utförs ej och prekursorlesion ses mycket sällan [53].
HPV-negativ OPSCC liknar morfologiskt keratiniserande skivepitelcancer lokaliserad i munhåla (se avsnitt 19.2.1.5). Prekursorlesion noteras ofta.
Den genetiska profilen skiljer sig även mellan HPV-positiv och HPV-negativ OPSCC. Det har visats i flera studier att HPV-positiv OPSCC härbärgerar totalt färre mutationer än HPV-negativ OPSCC, något som förklarats med att färre mutationer behövs för karcinogenes på grund av aktiviteten av de virala onkoproteinerna E6 och E7 [242, 243].
Symtom
Initiala symtom kan ofta vara ensidiga och diffusa, med obehag från halsen, ”främmande kropp”-känsla, sväljningsbesvär och smärta, ibland med utstrålning till örat.
Patienten kan även söka för asymmetri eller ulceration i svalget. Vid mer avancerat stadium ses uttalade sväljningsbesvär med viktnedgång, dålig andedräkt (foetor ex ore) och svårighet att artikulera (dysartri).
Många patienter söker vård för lymfkörtelförstoring på halsen som enda symtom, och det är inte ovanligt att primärtumören upptäcks först efter en tonsillektomi eller biopsi av tungbasen.
Utredning
Klinisk utredning
Den kliniska utredningen består av:
- biopsi från primärtumören för PAD, p16/HPV-analys och eventuellt HPV-typning
- vid behov finnål för aspirationscytologi alternativt mellannål för vävnadsbiopsi från misstänkta lymfkörtelfynd
- undersökning med palpation och skopi, eventuellt under narkos.
Radiologisk utredning
- DT av huvud, hals och thorax.
- MRT över tumörområdet när T-stadium bedöms vara svårvärderat vid DT.
- Eventuell UL-FNAC av halsens lymfkörtlar.
DT är förstahandsval för att avbilda primärtumör och regional metastasering eller fjärrmetastasering. En serie med gapande mun bör utföras som tillägg till bildserie med stängd mun, det minskar störningar från metallartefakter och skärper diagnostiken.
MRT erbjuder överlägsen kartläggning av engagemanget av mjukdelar intill tumören och perineural spridning, och bör därför användas frikostigt när T-stadium bedöms vara svårvärderat 55.
Lymfkörtelmetastaser avbildas väl med såväl DT som MRT och är ofta cystiska eller nekrotiska vid p16-positiva tumörer 244. För diagnostik av extrakapsulär växt vid p16-negativa tumörer kan både DT och MRT användas och ger då stöd till den kliniska bedömningen 55.
UL-FNAC ger möjlighet att diagnostisera metastaser i små lymfkörtlar på halsen, och bör vara vägledd av tidigare DT.
PET-CT är värdefull vid kartläggning av regionala lymfkörtelmetastaser inklusive engagemang av retrofaryngeala lymfkörtlar 245, för att upptäcka fjärrmetastaser och synkron primärtumör. Däremot har PET-CT inga fördelar jämfört med MRT vid kartläggning av primärtumören. PET-CT har högt negativt prediktivt värde för att utesluta kvarvarande viabel tumör eller återfallstumör och har därför ett stort värde i uppföljningen av behandlingsresultat vid regional lymfkörtelmetastasering både för HPV-positiva och för HPV-negativa tumörer, och kan minska antalet lymfkörtelutrymningar 215246.
HPV+ orofarynxtumörer behöver ofta mer än 12 veckor för att uppnå komplett radiologisk respons såväl på konventionell imaging som på PET-CT. I litteraturen finns olika åsikter om när PET-CT bör upprepas, tiden varierar mellan 4 och 6 månader efter avslutad behandling 247248. Med MRT går det att göra en anatomisk kartläggning vid återfall 249. MR-diffusion är av värde för att differentiera mellan postterapeutiska förändringar och kvarvarande tumör.
Behandling
Strålbehandling
Strålbehandling till kurativ dos är den huvudsakliga behandlingen, och rotationsteknik och SIB är förstahandsvalet för att minska belastning till normalvävnad, se avsnitt 11.3.1 Strålbehandling.
Vid lateraliserade mindre tonsilltumörer (T1–T2) med begränsad samsidig körtelmetastasering kan ipsilateral strålbehandling övervägas 250251. I övriga, mer avancerade fall bör man strålbehandla minst ytterligare en lymfkörtelstation utöver känd metastasering, och på motsatt sida till profylaktisk dos, åtminstone nivå II–III.
Cytostatikabehandling
Konkomitant cytostatikabehandling med veckodos cisplatin kan övervägas till patienter med tumörstadium III–IV avseende p16-negativa tumörer och stadium II-III för p16-positiva. Internationellt har konkomitant strål- och cytostatikabehandling med cisplatin rekommenderats, med en överlevnadsvinst som är dokumenterad i metaanalysen 82, se avsnitt 11.3.3 Medicinsk tumörbehandling. Metaanalysen tog inte hänsyn till HPV-status och därför kan man inte dra några slutsatser om den nuvarande stadieindelningen (TNM 8). I Sverige har behandlingstraditionen varierat över landet, med olika mycket cytostatikabehandling. TNM 8 baserar sig på behandlingsresultat utan känt HPV-status. Det kan därför finnas fog för cytostatikabehandling även för patienter med HPV-positiv tumör och lågt stadium men med stor tumörbörda. Om det finns kontraindikationer mot cisplatin kan man överväga konkomitant behandling med karboplatin. 94. Ett annat alternativ är behandling med EGFR-antikropp (cetuximab), men evidensnivån när det gäller överlevnadsvinst är låg och baseras på en randomiserad studie 95.
Neoadjuvant cytostatikabehandling kan ha en tumörkrympande effekt inför kurativt syftande strålbehandling, men det finns inga övertygande data för en överlevnadsvinst så detta rekommenderas enbart i utvalda fall. Någon effekt av adjuvant cytostatikabehandling är inte visad, se avsnitt 11.3.3 Medicinsk tumörbehandling.
Kirurgisk behandling
Cancer i uvula och mjuka gommen (T1) behandlas med kirurgi om de förväntade röst- och sväljbesvären postoperativt bedöms bli rimliga 252253. Primär kirurgi mot tonsill- eller tungbascancer (T1–T2) kan övervägas (se nedan), men blir sällan aktuell då skivepitelcancer inom dessa lokalisationer oftast diagnostiseras med metastaser på halsen, se figur 29.
Öppen kirurgi vid orofarynxcancer är tekniskt svår och kan ge betydande morbiditet även vid små tumörer. Användning av TORS (Trans-Oral Robotic Surgery) respektive TLM (Transoral Laser Microendoscopic Surgery) teknik kan minska den kirurgiska morbiditeten. Flera randomiserade studier av primär kirurgi kontra cytostatika- och strålbehandling pågår. Likaså saknas konsensus idag för vilka patienter som bör rekommenderas postoperativ strålbehandling efter kirurgi. Sammanfattningsvis kan dock lokal kirurgi med TORS som enda behandlingsmodalitet vara ett behandlingsalternativ i utvalda fall av patienter med orofarynxcancer T1 (-T2) N0. För patienter med orofarynxcancer som inte är av skivepiteltyp (till exempel spottkörtelcancer) är kirurgi alltid förstahandsvalet.
Om det finns misstankar om kvarvarande tumör på halsen efter slutförd strålbehandling vid PET-CT utförd minst 12 veckor efter behandlingsavslut görs en kompletterande halslymfkörtelutrymning, förutsatt att komplett remission av primärtumören har uppnåtts. Antalet kompletterande lymfkörtelutrymningar har minskat kraftigt under de senaste åren.
Behandlingsutvärdering
Utvärderingen görs dels kliniskt, vid behov under narkos, dels radiologiskt.
Den radiologiska utvärderingen görs med DT, MRT eller PET-CT. PET bör tidigast göras 12 veckor efter avslutad behandling, se avsnitt 19.9.3.2.
Uppföljning
Rekommendation:
Alla patienter med orofarynxcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Uppföljning sker med kliniska kontroller. De flesta återfallen debuterar inom 2 år och lokoregionala återfall är vanligast. Det finns inga säkra belägg, eller konsensusrekommendationer, för regelbunden radiologi under uppföljningen efter konstaterad tumörfrihet.
Förutom utvärdering av tumörkontroll är uppföljning av biverkningar och rehabiliteringsbehov viktiga syften efter genomgången behandling.
Årliga kontroller av sköldkörtelfunktionen.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Mediantid till sjukdomsåterfall har rapporterats vara 7–12 månader, med 9–13 % lokoregionala återfall vid HPV-positiv cancer jämfört med 23–26 % vid HPV-negativ cancer. Andelen patienter som får isolerad fjärrmetastasering har angetts vara 6–15 % utan säker skillnad mellan HPV-positiv och HPV-negativ sjukdom. Överlevnaden efter återfall är signifikant längre för patienter med HPV-positiv cancer 254255.
Den relativa 5-årsöverlevnaden för hela diagnosgruppen är enligt SweHNCR 72 % och vid kurativt syftande behandling 78 %.
Prognosen för olika lokalisationer samt i relation till HPV-status visas i figurerna 31 och 32. Eftersom 5-årsdata för tumörklassifikation enligt TNM 8 ännu inte finns, redovisas inte överlevnadskurvor per stadium.
Figur 31. Relativ överlevnad för patienter med orofarynxcancer
per lokalisation.
Figur 32. Relativ överlevnad orofaryngealcancer HPV-positiv jämfört med HPV-negativ.
Nasofarynxcancer
Översikt

|
ICD-10 |
|
|
Övre vägg |
C11.0 |
|
Bakre vägg |
C11.1 |
|
Lateral vägg inklusive fossa Rosenmüller |
C11.2 |
|
Inferiora väggen, dvs mjuka gommens övre yta |
C11.3 |
|
Övergripande växt eller icke specificerad lokalisation |
C11.8, C11.9 |
Anatomi
Nasofarynx begränsas uppåt och bakåt av sfenoid-clivusbasen, främre bågen av atlas och axis. Framåt begränsas den av näsans koaner och nedåt av den övre ytan av mjuka gommen. De laterala väggarna består av tubarostierna och fossa Rosenmüller. Nasofarynx täcks av luftvägsepitel det vill säga cilierat pseudostratifierat cylindriskt epitel. Tumörer i nasofarynx utgår oftast från slemhinnan i fossa Rosenmüller och kan via skallbasen invadera kranialnerver och temporalloberna. I slemhinnan finns ett nätverk av lymfkärl med korsat dränage till retrofaryngeala och cervikala lymfkörtlar.
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning enligt UICC, TNM classification of malignant tumours, 8th edition, 2017 212.
Kliniska T-kategorier (cTNM 8)
|
T |
Storlek, utbredning |
|
|
T1 |
Tumör begränsad till nasofarynx, eller utbredning till orofarynx och/eller näskaviteten, utan parafaryngeal utbredning |
|
|
T2 |
Tumör med parafaryngeal utbredning och/eller växt in i mediala pterygoideusmuskeln, laterala pterygoideusmuskeln och/eller prevertebrala muskler |
|
|
T3 |
Skelettengagemang i skallbasen, halskotor, processus pterygoideus och/eller bihålor |
|
|
T4
|
Intrakraniell utbredning och/eller kranialnervsengagemang, växt i hypofarynx, orbita, parotiskörtel och/eller växt utanför laterala ytan av laterala pterygoideusmuskeln |
|
Kliniska N-kategorier (cTNM 8)
|
N |
Storlek, utbredning |
|
N1 |
Unilaterala cervikala körtlar och/eller unilaterala eller bilaterala retrofaryngeala körtlar, ≤ 6 cm, ovan krikoidbroskets nedre begränsning |
|
N2 |
Bilaterala cervikala körtlar ≤ 6 cm ovan krikoidbroskets nedre begränsning |
|
N3 |
Körtel eller körtlar > 6 cm och/eller utbredning nedom krikoidbroskets nedre begränsning |
Klinisk stadieindelning (cTNM 8)
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
II |
III |
IVA |
|
T2 |
II |
II |
III |
IVA |
|
T3 |
III |
III |
III |
IVA |
|
T4 |
IVA |
IVA |
IVA |
IVA |
M1 är alltid stadium IVB
Epidemiologi och incidens
Incidensen i västvärlden är låg, under 1 per 100 000 invånare och år, medan incidensen är mycket högre i till exempel delar av Asien, se avsnitt 4.1 Epidemiologi. I Sverige diagnostiseras drygt 30 nya fall av nasofarynxcancer per år, vilket motsvarar 0,3–0,4 per 100 000 invånare. Under åren 2008–2021 rapporterades 463 nya fall till SweHNCR, varav 304 män. Medianålder vid diagnos var 59 år. Majoriteten upptäcks i ett avancerat stadium, se figur 33.
Figur 33. Nasofarynxcancer andel per stadium och kön enligt TNM 2008–2021
Det är svårt att överföra resultat från internationella studier till svenska förhållanden. Icke-keratiniserande karcinom (typ 2) dominerar globalt och särskilt i de endemiska områdena i Asien. Andelen keratiniserade karcinom (WHO typ 1), som har lägre antalkopior av viralt EBV mRNA, är 11 % i den nordiska befolkningen jämfört med 0,2 % i södra Kina 256.
Etiologi
Tobak och alkohol har betydelse för utvecklingen av keratiniserande karcinom (typ 1) medan viktiga riskfaktorer för övrig nasofarynxcancer är EBV-infektion (Epstein-Barr-virus), genetisk predisposition och kost samt en kombination av dessa 13257.
Patologi
I SweHNCR är 70 % av nasofarynxcancerfallen skivepitelcancer. Nasofarynxkarcinom indelas i tre undergrupper enligt WHO-fascikeln: icke-keratiniserande skivepitelcancer (SCC), keratiniserande SCC och basaloid SCC 258.
Icke-keratiniserande SCC kan delas in i ytterligare två subtyper: differentierad respektive odifferentierad subtyp, varav odifferentierad typ är den vanligaste. Basaloid SCC är ovanlig som primärtumör i nasofarynx.
Det är inte helt klarlagt huruvida histopatologisk typ (icke-keratiniserande SCC respektive keratiniserande SCC) är avgörande för prognos. Patienter med keratiniserande SCC tenderar att ha tumörer som är mer lokalt avancerade – men mindre benägna att metastasera. Vidare är eventuell variation mellan typerna vad gäller respons till strålbehandling omdebatterad. Epstein-Barr-virus (EBV) har associerats till icke-keratiniserande SCC och viss mån basaloid SCC; denna association är mer uttalad i endemiska områden. EBV-infektion anses vara nödvändig men inte tillräcklig för att utveckla dessa tumörer. Därtill har en association mellan vissa icke-keratiniserande SCC och HPV föreslagits. EBV ses sällan i keratiniserande SCC 258.
Symtom
Det vanligaste debutsymtomet är en förstorad knuta eller lymfkörtel på halsen. Andra är smärta i örat, ensidig hörselnedsättning, nästäppa och näsblödning. Vid ensidig otosalpingit utan föregående infektion bör nasofarynx undersökas för att utesluta tumör, även hos yngre patienter. Kranialnervspåverkan är tecken på skallbasengagemang. 75 % av patienterna som insjuknade i nasofarynxcancer år 2008–2021 hade vid diagnosen metastasering till halsens lymfkörtlar (SweHNCR). Primär fjärrmetastasering (M1) sågs hos 5 % av patienterna.
Utredning
Klinisk utredning
Den kliniska utredningen består av
- biopsi från primärtumören för PAD och EBV-analys
- vid behov finnål för aspirationscytologi alternativt mellannål för vävnadsbiopsi från misstänkta lymfkörtelfynd
- undersökning med palpation och skopi eventuellt under narkos.
Om tumören är EBV-positiv bör man påvisa och kvantifiera EBV-DNA i serum, som ett baslinjevärde för behandlingsbedömning och uppföljning 259257260.
Radiologisk utredning
- DT av huvud, hals och thorax samt MRT av primärtumörområdet.
- PET-CT bör inkluderas i primärutredning.
- Eventuellt UL-FNAC av halsens lymfkörtlar.
Vid nasofarynxcancer baseras T-stadium inte på tumörstorlek utan endast på lokal utbredning och engagemang av närliggande strukturer. Därför krävs både DT och MRT för att bedöma tumörens utbredning och spridning 55
Halsens lymfkörtlar ingår i utredningen med DT av hals och thorax 215. De retrofaryngeala körtlarna är ofta involverade, de avbildas bäst med MRT som även kan användas för att differentiera mellan skivepitelcancer och andra förändringar i nasofarynx 261.
Patienter med nasofarynxcancer har en signifikant högre risk för fjärrmetastaser än de med andra typer av HH-cancer. PET-CT med diagnostisk CT kan därför utföras som första undersökningsmetod i stället för enbart DT av hals och thorax 262.
UL-FNAC ger möjlighet att diagnostisera metastaser i små lymfkörtlar på halsen och bör vara vägledd av tidigare DT.
Vid återfall eller residual tumör rekommenderas MR med diffusion för att värdera primärtumörområdet. PET-CT har högt negativt prediktivt värde för att utesluta kvarvarande viabel tumör eller återfall när MRT är svårtolkad.
Behandling
Strålbehandling
Strålbehandling är den huvudsakliga behandlingen, och rotationsteknik och SIB är förstahandsvalet för att minska belastning till normalvävnad, se avsnitt 11.3.1 Extern strålbehandling.
Vid strålbehandling av halsens lymfkörtelstationer bör man alltid överväga att ge profylaktisk dos till nivåer II–V bilateralt samt till retrofaryngeala körtlar.
Det är komplicerat att strålbehandla lokalt avancerade tumörer på grund av närheten till strålkänsliga strukturer såsom hjärnstam, ögon och synnerv samt temporallober.
Medicinsk behandling
Kliniska studier samt metaanalyser har påvisat att tillägg av cytostatikabehandling ökar 5-årsöverlevnaden för patienter med lokoregionalt avancerade tumörer (stadium II–IV), 87263264265. Starkast evidens finns för konkomitant kemoterapi 264. För patienter med stadium III-IV har man visat både minskad risk för återfall och förbättrad överlevnad med tillägg av induktionskemoterapi 266267. Enligt SweHNCR, 2008–2021, har 65 % av alla patienter med nasofarynxcancer fått medicinsk behandling.
Vid tumörer i stadium II–IV rekommenderas konkomitant cisplatin veckovis. Induktionscytostatikabehandling bör övervägas till patienter i gott allmäntillstånd, med tumörstadium III–IV, se avsnitt 11.3.3 Medicinsk tumörbehandling 259266268.
Kirurgisk behandling
I enstaka fall kan man utföra radikal kirurgi mot primärtumören 269.
Om det finns misstankar om kvarvarande tumör på halsen efter slutförd strålbehandling görs en kompletterande halslymfkörtelutrymning, förutsatt att komplett remission av primärtumören har uppnåtts.
Behandlingsutvärdering
Behandlingen utvärderas kliniskt med endoskopisk undersökning samt röntgenologiskt med MRT, DT eller PET-CT. PET-CT bör inte genomföras förrän tidigast 12 veckor efter avslutad behandling, se avsnitt 8.2.3 Radiologisk diagnostik.
Man bör vara aktiv med recidivdiagnostik i uppföljningen samt följa EBV-DNA i serum vid EBV-positiv tumör, eftersom behandlingsmöjligheterna vid recidiv och fjärrmetastasering är bättre än vid andra huvud- och halscancerlokalisationer.
Behandling av återfall
Vid ett lokalt återfall kan man överväga en kurativt syftande rebestrålning, med konventionell extern strålbehandling eller protonstrålbehandling. I vissa fall kan dessa behandlingar föregås av cytostatikabehandling. Kirurgi kan bli aktuellt, till exempel med så kallad ”maxillary swing”-teknik 269 eller endoskopisk teknik 270271.
Patienter med fjärrmetastasering kan erbjudas medicinsk onkologisk behandling, se avsnitt 11.3.3 Medicinsk tumörbehandling.
Uppföljning
Rekommendation:
Alla patienter med nasofarynxcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Se 19.10.4.4 Behandlingsutvärdering.
Patienter med nasofarynxcancer behandlas ofta med stora strålvolymer, vilket ökar risken för långdragna strålinducerade biverkningar, se avsnitt 15.5. Utöver kontroll av sköldkörtelfunktionen bör även hypofysfunktionen följas om den har ingått i strålvolymen.
Vid EBV-positiv tumör med positiv baseline serologi bör EBV-DNA i serum kvantifieras efter avslutad behandling och därefter årligen 259.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden enligt SweHNCR, 2008–2021, var 78 % vid kurativt syftande behandling för diagnosgruppen; 86 % för kvinnor och 74 % för män. Relativ överlevnad per stadium och kön visas i figur 34 och 35.
Figur 34. Relativ överlevnad för patienter med nasofarynxcancer, per stadium (UICC 7th)
Figur 35. Relativ överlevnad, per kön.
Hypofarynxcancer
Översikt

|
ICD-10 |
|
|
Sinus piriformis |
C12.9 |
|
Postkrikoidala rummet |
C13.0 |
|
Aryepiglottiska vecket, hypofaryngeala delen |
C13.1 |
|
Bakre hypofarynxväggen |
C13.2 |
|
Övergripande växt |
C13.8 |
|
Icke specificerad lokalisation (NOS) |
C13.9 |
Anatomi
Hypofarynx utgör den nedre delen av svalget. Området börjar i höjd med tungbenet och sträcker sig ned till matstrupsingången. Hypofarynx ligger bakom struphuvudet som det också delvis omsluter och omfattar tre subsites (regioner): bakre hypofarynxväggen, sinus piriformis och det postkrikoidala området. Bakre hypofarynxväggen sträcker sig från valleculas golvnivå till dorsala arybrosknivån, och det postkrikoidala området sträcker sig därifrån ner till esofagusingången. Sinus piriformis övre gräns utgörs av plica faryngoepiglottica och dess väggar bildas av en lateral vägg, en medial vägg och en framvägg. Området sträcker sig till esofagusingången och det begränsas lateralt av tyreoideabrosket och medialt av laterala ytan på plica aryepiglottica samt av kannbrosk och krikoidbrosk.
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning enligt UICC, TNM classification of malignant tumours, 8th edition, 2017 212.
Kliniska T-kategorier (cTNM 8)
|
T |
Hypofarynx |
|
T1 |
Tumör begränsad till en subsite* i hypofarynx och/eller ≤ 2 cm i sin största utbredning. |
|
T2 |
Tumör som växer in i mer än en subsite i hypofarynx eller in i en intilliggande subsite eller mäter > 2 cm men ≤ 4 cm, utan fixering av hemilarynx. |
|
T3 |
Tumör > 4 cm eller med fixering av hemilarynx eller utbredning till esofagus. |
|
T4a |
Tumör som växer in i något av de följande: sköldbrosk, ringbrosk, tungben, sköldkörteln, matstrupen eller halsens mjukdelar (inkluderar raka halsmuskler och subkutant fett). |
|
T4b |
Tumör som växer in i prevertebrala fascian, växt runt arteria carotis eller växer in i mediastinala strukturer. |
*Subsites hypofarynx: Postkrikoidala ytan, recessus piriformis och bakre farynxväggen
Kliniska N-kategorier (cTNM 8)
|
N |
Storlek, utbredning |
|
N1 |
En ipsilateral körtel ≤ 3 cm utan extranodal utbredning |
|
N2a |
En ipsilateral körtel > 3 cm och ≤ 6 cm utan extranodal utbredning |
|
N2b |
Multipla ipsilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N2c |
Kontralateral eller bilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N3a |
Körtel > 6 cm utan extranodal utbredning |
|
N3b |
Körtel eller körtel med extranodal utbredning |
Klinisk stadieindelning (cTNM 8)
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
III |
IVA |
IVB |
|
T2 |
II |
III |
IVA |
IVB |
|
T3 |
III |
III |
IVA |
IVB |
|
T4a |
IVA |
IVA |
IVA |
IVB |
|
T4b |
IVB |
IVB |
IVB |
IVB |
M1 är alltid stadium IVC.
Incidens
Under perioden 2008–2021 diagnostiserades 858 fall av hypofarynxcancer i Sverige, vilket motsvarar cirka 60 fall per år, enligt SweHNCR. Av patienterna var 77 % män och 23 % kvinnor. Två tredjedelar av fallen var i stadium IV.
Hypofarynxcancer diagnostiseras ofta i ett avancerat stadium, och övergripande växt (C13.8) och icke specificerad lokalisation (C13.9) är de vanligaste angivna undergrupperna se figur 36. Den vanligaste exakta angivna tumörlokalisationen är sinus piriformis (25 % enligt SweHNCR).
Figur 36. Lokalisation för hypofarynxcancer 2008–2021, andel i procent.
Etiologi
Tobaksrökning och alkoholöverkonsumtion är de huvudsakliga riskfaktorerna. Var för sig innebär de en riskökning och tillsammans verkar de synergistiskt.
Patologi
Den vanligast förekommande tumörformen i hypofarynx är skivepitelcancer (SCC) av olika histologiska varianter såsom konventionellt, verruköst, basaloitt, spolcelligt, adenoskvamöst och lymfoepitelialt karcinom. Förutom SCC förekommer även spottkörtelderiverad cancer, neuroendokrina tumörer, sarkom och hematolymfoida tumörer i mindre utsträckning.
Symtom
Hypofarynxcancer ger ofta ensidig halssmärta, obehag vid sväljning och sväljsvårigheter. Knuta eller förstorad lymfkörtel på halsen kan vara debutsymtom, liksom heshet. Båda tyder på ett avancerat tumörstadium.
De initiala symtomen är ofta diffusa och det är lätt att missa de subtila kliniska fynden eftersom området är relativt svårundersökt. Vid diagnostillfället har symtomen vanligtvis funnits under en längre tid och de flesta patienter har gått ner i vikt. Många patienter har en hög grad av samsjuklighet och påverkat allmäntillstånd.
Utredning
Klinisk utredning
Vid misstanke om malignitet i hypofarynx ska anamnesen innehålla uppgifter om viktnedgång och röstkvalitet. Stämbandens rörlighet vad gäller abduktion- och adduktion ska anges och gärna videodokumenteras.
Patienten bör under narkos genomgå en endoskopisk undersökning av de övre luftvägarna och esofagus, för att kartlägga tumörutbredningen och ta biopsier för PAD. Skopin omfattar hypofarynx, larynx, trakea och övre esofagus. FNAC från metastasmisstänkta lymfkörtlar bör utföras vid behov. Inför MDK ska resektabiliteten bedömas och dokumenteras.
Radiologisk utredning
- DT av huvud, hals och thorax.
- Eventuellt MRT av primärtumörområdet.
- Eventuellt UL-FNAC av halsens lymfkörtlar.
- Eventuellt PET-CT.
DT är en bra metod för att detektera och kartlägga primärtumör i hypofarynx, regionala lymfkörtlar på halsen, fjärrmetastasering till thorax och synkron cancer. Destruktioner i förkalkade larynxbrosk syns väl på DT.
MRT av primärtumörområdet kan göra det lättare att bedöma tumör-utbredning och inväxt i omgivande strukturer, till exempel i larynxbrosk och genom prevertebral fascia 55.
UL-FNAC ger möjlighet att diagnostisera metastaser i små lymfkörtlar på halsen, och bör vara vägledd av tidigare DT.
PET-CT kan användas för att stadieindela stora tumörer, särskilt när man planerar omfattande kirurgi. PET-CT kan inte användas för att bedöma eventuell tumörinvasion i brosk.
Behandling
- Sjukdomen är ofta avancerad vid diagnos varför kurativt syftande strålbehandling rekommenderas. Medicinsk tilläggsbehandling bör övervägas vid stadium III–IV.
- Vid resektabel tumör bör kirurgi övervägas.
Extern strålbehandling till kurativ dos är oftast förstahandsvalet. Risken för ockult lymfkörtelmetastasering är stor även vid klinisk N0-sjukdom, och därför bör profylaktisk strålbehandling ges bilateralt mot halsens lymfkörtlar. Om patientens allmäntillstånd tillåter kan man överväga medicinsk tilläggsbehandling vid tumörstadium III–IV.
Vid kvarvarande palpabel lymfkörtel på halsen, efter avslutad strålbehandling eller kvarvarande patologisk körtel vid radiologisk undersökning, bör en lymfkörtelutrymning göras.
Vid begränsade tumörer kan endoskopisk kirurgi vara aktuellt. Vid perineural och/eller kärlinväxt samt vid otillräckliga marginaler ges postoperativ strålbehandling. Om tumören bedöms som resektabel kan en kombinerad behandling med primär kirurgi med laryngo-hypofaryngektomi och rekonstruktion samt halslymfkörtelutrymning och postoperativ strålbehandling erbjudas. Salvagekirurgi kan vara aktuellt i utvalda fall.
Uppföljning
Rekommendation:
Alla patienter med hypofarynxcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Efter behandlingen kan PET-CT användas för att identifiera metabol aktivitet i residualtumör och för att tidigt upptäcka återfall.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden för patienter med hypofarynxcancer är 27 %. 30 % av patienterna behandlas palliativt enligt SweHNCR. Den relativa överlevnaden per stadium visas i figur 37.
Figur 37. Relativ överlevnad för patienter med hypofarynxcancer 2008–2021, per stadium (UICC 7)
Larynxcancer
Översikt


|
ICD-10 |
|
|
Främre (linguala) ytan av struplock (epiglottis) |
C10.1 |
|
Stämband (glottis) |
C32.0 |
|
Supraglottis (inklusive laryngeala ytan av epiglottis) |
C32.1 |
|
Subglottis * |
C32.2 |
|
Larynxbrosk |
C32.3 |
|
Övergripande växt |
C32.8 |
|
Icke specificerad lokalisation |
C32.9 |
* Området från 5 mm nedom stämbandskanten till krikoidbroskets nedre kant.
Anatomi
Larynx indelas i tre regioner: glottis (stämbandsplanet), supraglottis (regionen ovan stämbandsplanet, med fickband och struplock) och subglottis (regionen från och med 5 mm nedom stämbandens slutningsplan, alternativt 10 mm under glottis överkant, alternativt krikoidbroskets övre kant). Tumörer som utgår från larynxbrosket har en egen ICD-10-kod; de är mycket ovanliga och histologiskt är de vanligen sarkom.
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning enligt UICC, TNM classification of malignant tumours, 8th edition, 2017 212.
Kliniska T-kategorier (cTNM 8)
Glottis
|
T |
Storlek, utbredning |
|
T1 |
Tumör begränsad till stämband med normal rörlighet (kan involvera bakre eller främre kommissuren). T1a: Tumören är begränsad till ena stämbandet. T1b: Tumören involverar båda stämbanden. |
|
T2 |
Tumör med utbredning till supraglottis och/eller subglottis och/eller ger nedsatt stämbandsrörlighet. |
|
T3 |
Tumör begränsad till larynx med fixering av stämband och/eller växer in i paraglottiska rummet och/eller inre kortikalis av tyreoideabrosket |
|
T4a |
Tumör som växer genom yttre kortikalis av tyreoideabrosket och/eller växer in i vävnader utanför larynx, t.ex. trakea, halsens mjukdelar inkluderande tungans djupa muskulatur (genioglossus, hyoglossus, palatoglossus och styloglossus), de raka halsmusklerna, sköldkörtel eller matstrupe. |
|
T4b |
Tumör med växet in i prevertebrala rummet, runt arteria carotis eller i mediastinala strukturer. |
Kliniska T-kategorier (cTNM 8)
Supraglottis
|
T |
Storlek, utbredning |
|
T1 |
Tumör begränsad till en subsite* med normal stämbandsrörlighet. |
|
T2 |
Tumör som växer in i slemhinnan till mer än en intilliggande subsite* i supraglottis eller glottis, eller en region utanför supraglottis (t.ex. mukosa i tungbas, vallecula eller sinus piriformis medial vägg) utan fixering av stämband. |
|
T3 |
Tumör begränsad till larynx med fixering av stämband och/eller växer in i något av följande: postkrikoidalt, pre-epiglottiska rummet, paraglottiska rummet och/eller inre kortikalis av tyreoideabrosket. |
|
T4a |
Tumör som växer genom tyreoideabrosket och/eller växt in i vävnader utanför larynx, t.ex. trakea, halsens mjukdelar inkluderande tungans djupa muskulatur (genioglossus, hyoglossus, palatoglossus och styloglossus), de raka halsmusklerna, sköldkörtel eller matstrupe. |
|
T4b |
Tumör som växer in i prevertebrala rummet, runt arteria carotis eller i mediastinala strukturer. |
* Subsites supraglottis: Epiglottis inkl. ytan på tungbasen, aryepiglottiska vecket, aryteniodbrosken, epigottis under hyoid, falska stämbanden
Kliniska T-kategorier (cTNM 8)
Subglottis
|
T |
Storlek, utbredning |
|
T1 |
Tumör begränsad till subglottis. |
|
T2 |
Tumör med utbredning till stämband, med eller utan nedsatt stämbandsrörlighet. |
|
T3 |
Tumör begränsad till larynx med fixering av stämband. |
|
T4a |
Tumör som växer in i krikoid eller tyreoideabrosket och/eller växt in i vävnader utanför larynx, t.ex. trakea, halsens mjukdelar inkluderande tungans djupa muskulatur (genioglossus, hyoglossus, palatoglossus och styloglossus), de raka halsmusklerna, sköldkörtel eller matstrupe. |
|
T4b |
Tumör som växer in i prevertebrala rummet, runt arteria carotis eller i mediastinala strukturer. |
Kliniska N-kategorier (cTNM 8)
Larynx
|
N |
Storlek, utbredning |
|
N1 |
En ipsilateral körtel ≤ 3 cm utan extranodal utbredning |
|
N2a |
En ipsilateral körtel > 3 cm och ≤ 6 cm utan extranodal utbredning |
|
N2b |
Multipla ipsilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N2c |
Kontralateral eller bilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N3a |
Körtel > 6 cm utan extranodal utbredning |
|
N3b |
Körtel eller körtlar med extranodal utbredning |
Klinisk stadieindelning (cTNM 8)
Larynx
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
III |
IVA |
IVB |
|
T2 |
II |
III |
IVA |
IVB |
|
T3 |
III |
III |
IVA |
IVB |
|
T4a |
IVA |
IVA |
IVA |
IVB |
|
T4b |
IVB |
IVB |
IVB |
IVB |
M1 är alltid stadium IVC.
Patologi
Den vanligast förekommande tumörformen i larynx är skivepitelcancer (SCC) av olika histologiska varianter. Därtill ses även ovanliga tumörer såsom spottkörtelderiverad cancer, neuroendokrina tumörer, sarkom och hematolymfoida tumörer.
Glottisk Tis (carcinoma in situ) har en D-diagnos (D02.0).
Etiologi och incidens
Incidens
Under perioden 2008–2021 diagnostiserades 2 503 larynxcancerfall i Sverige enligt SweHNCR, vilket innebär 180 fall per år. Incidensen har minskat för män sedan 1970-talet, men varit ganska oförändrad över tid för kvinnor, se figur 38.
Cancern är oftast lokaliserad till stämbandsplanet (68 %), supraglottisk cancer 24 %, subglottisk cancer är ovanlig (2 %). Det finns en stor könsskillnad och de flesta med glottisk och supraglottisk cancer är män, se figur 39. Medianålder vid diagnos är 69 år.
Etiologi
Larynx exponeras för karcinogener från både inandningsluften och födan. Var för sig bidrar tobaksrökning och alkoholförtäring till en markant ökning av incidensen, och i kombination har de en synergistisk effekt 272. Det finns stora variationer i incidensen av glottisk respektive supraglottisk cancer i olika länder 273.
Figur 38. Förekomst av larynxcancer 1970–2020, uppdelat på kön.
Figur 39. Antalet fall av larynxcancer 2008–2021, uppdelat på läge och kön (n = 2503).
Vid diagnos är hälften av de glottiska T1, medan mer än hälften av de supraglottiska är T3–T4, se figur 40.
Vid glottisk cancer är det ovanligt med regional metastasering även vid lokalt avancerade tumörer. Metastaser till halslymfkörtlar är betydligt vanligare vid supraglottisk cancer och utgör ofta debutsymtom.
Figur 40. T-kategori per lokalisation för patienter med larynxcancer 2008–2021.
Symtom
Glottiska tumörer ger heshet och diagnostiseras därför ofta i ett tidigt stadium. Smärta, värk mot örat och luftvägshinder är vanligtvis sena symtom.
Vid supraglottisk cancer är sväljningssmärta och/eller knuta på halsen vanliga debutsymtom. Andra vanliga symtom är dysfagi och viktnedgång, aspiration och luftvägshinder.
Subglottiska tumörer ger ofta heshet och ibland stridorös andning.
Utredning
Klinisk utredning
Den kliniska utredningen omfattar ÖNH-status inklusive röstkvalitet samt indirekt laryngoskopi av larynx och stroboskopi. Stämbandens rörlighet vad gäller abduktion och adduktion bör anges och gärna videodokumenteras. Misstänkta lymfkörtelmetastaser bör utredas med FNAC. En logoped bör konsulteras under utredningen. Rökvanor bör registreras.
Om vakenlaryngoskopin visar en kliniskt misstänkt cancer där det är uppenbart att den är resektabel kan man med fördel planera direkt för en terapeutisk excisionsbiopsi i narkos utan föregående biopsi. Vid mikrolaryngoskopi under narkos inspekteras det subglottiska och det supraglottiska rummet, stämbanden samt främre kommissuren och hypofarynxingången.
Vid kliniskt misstänkt cancer hos patient med dåligt allmäntillstånd eller tumör med stor utbredning, kan ibland biopsi i lokalbedövning säkerställa diagnosen.
Radiologisk utredning
- DT av huvud, hals och thorax, med tunna snitt över larynx
- Ev. MRT av primärtumörområdet
- Ev. UL-FNAC av halsens lymfkörtlar
DT är en bra metod för att detektera och kartlägga cancer i larynx samt regionala lymfkörtlar på halsen, fjärrmetastasering till thorax och synkron cancer. Destruktioner i förkalkade larynxbrosk syns väl på DT. Destruktioner i icke förkalkade brosk avbildas bäst med DT med dubbelenergiteknik eller spectral DT 274. DT ska utföras medan patienten andas lugnt så att stämbanden står öppna.
MRT av primärtumörområdet kan göra det lättare att bedöma tumörutbredning och inväxt i omgivande strukturer till exempel genom prevertebral fascia 54. Utvärdering av invasion i brosk med MRT är möjlig men kan vara problematisk på grund av rörelseartefakter och risk för övervärdering av broskinvasion 275.
UL-FNAC ger möjlighet att diagnostisera metastaser i små lymfkörtlar på halsen, och bör vara vägledd av tidigare DT.
Behandling
Glottisk larynxcancer
Glottisk Tis (carcinoma in situ, D02.0)
Primärbehandlingen är vanligen kirurgisk med excision (endoskopiskt med sax eller CO2-laser).
Glottisk T1 N0
Stämbandscancer behandlas kirurgiskt endoskopiskt (eventuellt med CO2-laser) eller med extern strålbehandling. Internationell litteratur liksom data från SweHNCR talar för att metoderna ger likvärdig tumörkontroll 276. Vid små tumörer är kirurgi sannolikt likvärdigt med strålbehandling avseende röstfunktionen.276277278
Strålbehandling ges mot primärtumör till kurativ dos utan någon profylaktisk bestrålning av halsens lymfkörtlar. Viss hypofraktionering är möjlig, se avsnitt 11.3.1.3.
Vid kirurgisk behandling påverkas rösten beroende på hur stor del av stämbandet som tas bort. Vid radikalt utförd excision ges inte någon postoperativ strålbehandling. Möjligheten till extern strålbehandling kvarstår efter utförd kirurgi.
Glottisk T2 N0
Strålbehandling mot primärtumören ges till kurativ dos och med bestrålning av halsens lymfkörtlar till profylaktisk dos mot nivå III bilateralt. Vid utbredning supra- eller subglottiskt kan man överväga nivå 2–4a och eventuellt nivå 6. 279.
I selekterade fall kan det bli aktuellt att behandla med endoskopisk laserkirurgi. 280.
Glottisk T2 N1–N3 och T3 N0–N3
Strålbehandling mot primärtumören ges till kurativ dos mot de engagerade lokalerna (T och N), och med profylaktisk dos till nivå II–IV bilateralt.
Konkomitant medicinsk behandling kan övervägas.
Om man inte får komplett respons lokalt och/eller regionalt görs en laryngektomi och/eller lymfkörtelutrymning.
Mot bakgrund av att det finns en indikation på att överlevnaden kan vara bättre om laryngektomi utförs primärt kan man vid T3-cancer överväga primär laryngektomi och postoperativ strålbehandling 281282.
Glottisk T4 N0–N3
Om tumören bedöms resektabel rekommenderas laryngektomi och halslymfkörtelutrymning med en modifierad radikal neck vid cN+. Vid cN0 kan en selektiv neck övervägas.
Postoperativ strålbehandling ges till 60–68 Gy. Om patienten har histopatologiska riskfaktorer (bristande radikalitet, extrakapsulär växt etc.) kan medicinsk tilläggsbehandling övervägas.
Om patienten bedöms inoperabel rekommenderas fulldos strålbehandling, eventuellt i kombination med medicinsk behandling.
Supraglottisk larynxcancer
Supraglottisk T1–T3 N0–N3
Strålbehandling ges till kurativ dos mot de engagerade lokalerna (T och N), med profylaktisk dos till nivå II–IVa bilateralt. Vid stadium III–IV kan man överväga konkomitant medicinsk behandling.
Vid stadium I och II kan endoskopisk eller robotassisterad kirurgi övervägas i selekterade fall 283284.
Vid inkomplett respons lokalt och/eller regionalt rekommenderas laryngektomi och/eller lymfkörtelutrymning.
Supraglottisk T4 N0–N3
Om tumören bedöms resektabel är laryngektomi förstahandsalternativ, kompletterad med halslymfkörtelutrymning vid N+.
Postoperativ strålbehandling ges till 60–68 Gy, och vid histopatologiska riskfaktorer (bristande radikalitet, extrakapsulär växt etc.) kan man överväga en medicinsk tilläggsbehandling.
Vid samsjuklighet där patienten inte kan sövas ges fulldos strålbehandling, eventuellt i kombination med medicinsk behandling.
Subglottisk larynxcancer
För primär subglottisk cancer finns det inga specifika riktlinjer eftersom fallen är få 285. I princip är den onkologiska behandlingen densamma som vid supraglottisk cancer i motsvarande stadium men med en större marginal kaudalt på grund av risken för paratrakeal metastasering i nivå VI.
Larynxcancer vid icke-skivepitelcancer
Vid spottkörtelcancer, till exempel adenoidcystisk cancer, har strålbehandling sämre effekt varför kirurgisk behandling kan vara förstahandsalternativ, såsom endoskopisk laserkirurgi, TORS, eller laryngektomi 283.
Behandlingsutvärdering och rehabilitering
Behandlingsutvärdering
Efter genomgången primär strålbehandling bör effekten av behandlingen bedömas lokalt och regionalt för att ta ställning till eventuellt behov av salvagekirurgi.
Behandlingsresultatet för primärtumören värderas med laryngoskopi. Vid misstanke om residualtumör görs laryngoskopi i narkos för biopsitagning, efter bilddiagnostik.
Röstfunktion och rehabilitering
Alla behandlande centrum ska ha ett program för rehabilitering.
Före behandling
Patienten bör få information om den planerade behandlingens konsekvenser. Logoped bör göra en bedömning av kommunikation och sväljning samt förklara hur röst-, svälj- och luktfunktionen kan påverkas av behandlingen. Före laryngektomi bör patienten erbjudas att träffa en laryngektomerad person.
Efter genomgången behandling
Påverkan av röst-, lukt- och sväljfunktion är vanlig, se avsnitt 15.5.10 röst- och talpåverkan.
Efter laryngektomi behöver patienten ett alternativt sätt att kommunicera. De möjligheter som finns är röstventil, vibratortal (röstgenerator) och matstrupstal. De flesta patienter förses med röstventil som placeras i en kirurgiskt åstadkommen fistel mellan luftstrupen och matstrupen, som oftast utförs under laryngektomin.
Sväljsvårigheter är mycket vanligt efter laryngektomi. Orsaker kan vara både nedsatt rörlighet i sväljmuskulatur och eller fibrotisering, se avsnitt 15.5.3 dysfagi. Förträngningar i faryngoesofageala segmentet kan lindras med ballongdilatationer.
Luktrehabiliteringen utförs med fördel parallellt med röstrehabiliteringen med tekniken Nasal Airflow Inducing Maneuver (NAIM), också kallad ”artig gäspning” 156.
Stomat på halsen medför också att patienten måste anpassa sig vid vissa aktiviteter, till exempel dusch och bad. Perioden omedelbart efter operationen är ofta besvärlig och psykiskt ansträngande.
Observandum vid laryngektomi
Vid postoperativ strålbehandling efter primär laryngektomi bör man tänka på att klisterplattan till stomafiltret inte kan användas på grund av ökad hudreaktion. Patienterna utrustas därför med en trakealtub, vilket ger ett sämre röstventiltal. Vid strålbehandlingstillfällena kan man lägga bolusmaterial på huden vid stomat för att få full dostäckning i hudplanet och minska risken för stomaåterfall. Den ökade dosen i huden ger mer lokal strålreaktion.
Laryngektomi efter strålbehandling medför ökad risk för fistelbildning 286.
Uppföljning
Rekommendation:
Alla patienter med larynxcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Det är en fördel om larynx kan undersökas med stroboskopi och filmdokumenteras vid kontrollerna.
Efter behandlingen av avancerad larynxcancer kan PET-CT användas för att identifiera en residualtumör och/eller upptäcka återfall. PET-CT bör utföras tidigast 12 veckor efter avslutad behandling 287.
Strålbehandling mot halsen kan ge hypotyreos (10–57 %) 288. Tyreoideafunktionen bör kontrolleras regelbundet med början cirka 1 år efter avslutad behandling.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden för larynxcancer är 67 % enligt SweHNCR. Överlevnaden skiljer sig åt beroende på tumörlokal, se figur 41. Överlevnad per stadium för glottisk och supraglottisk cancer visas i figur 42–43.
Figur 41. Relativ överlevnad för patienter med larynxcancer fördelat på tumörlokal
Figur 42. Relativ överlevnad för patienter med glottisk larynxcancer, per stadium (UICC 7th)
Figur 43. Relativ överlevnad för supraglottisk larynxcancer, per stadium (UICC 7th)
Spottkörtelcancer
Översikt

|
ICD-10 |
|
|
Glandula parotis (öronspottkörtel) |
C07.9 |
|
Glandula submandibularis (spottkörtel under käken) |
C08.0 |
|
Glandula sublingualis (spottkörtel under tungan) |
C08.1 |
Tumörer i de små spottkörtlarna klassificeras utifrån var de sitter och ingår inte här.
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning enligt UICC, TNM classification of malignant tumours, 8th edition, 2017 212.
Kliniska T-kategorier (cTNM 8)
|
T |
Storlek, utbredning |
|
T1 |
Tumör ≤ 2 cm, ingen tumörväxt utanför spottkörtelparenkymet, kliniskt eller makroskopiskt |
|
T2 |
Tumör > 2 cm och ≤ 4 cm, ingen tumörväxt utanför spottkörtelparenkymet, kliniskt eller makroskopiskt |
|
T3 |
Tumör > 4 cm och/eller tumörväxt utanför spottkörtelparenkymet, kliniskt eller makroskopiskt |
|
T4a |
Tumör som växer in i hud, mandibel, hörselgång och/eller facialisnerv |
|
T4b |
Tumör med växt i skallbas och/eller pterygoidplatta och/eller växt runt arteria carotis |
Kliniska N-kategorier (cTNM 8)
|
N |
Storlek, utbredning |
|
N1 |
En ipsilateral körtel ≤ 3 cm utan extranodal utbredning |
|
N2a |
En ipsilateral körtel > 3 cm och ≤ 6 cm, utan extranodal utbredning |
|
N2b |
Multipla ipsilaterala körtlar, ingen > 6 cm, utan extranodal utbredning |
|
N2c |
Kontralateral eller bilaterala körtlar, ingen > 6 cm, utan extranodal utbredning |
|
N3a |
Körtel > 6 cm utan extranodal utbredning |
|
N3b |
Körtel eller körtlar med klinisk extranodal utbredning |
Klinisk stadieindelning (cTNM 8)
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
III |
IVA |
IVB |
|
T2 |
II |
III |
IVA |
IVB |
|
T3 |
III |
III |
IVA |
IVB |
|
T4a |
IVA |
IVA |
IVA |
IVB |
|
T4b |
IVB |
IVB |
IVB |
IVB |
M1 är alltid stadium IVC.
Epidemiologi, etiologi och incidens
Incidens
Enligt SweHNCR diagnostiseras cirka 110 nya fall av spottkörtelcancer per år, vilket utgör cirka 7 % av all HH-cancer. Tumörer i parotis är vanligast, se figur 44. För stadieindelning, se figur 45. Spottkörtelcancer förekommer lika ofta hos män som hos kvinnor.
Medelåldern vid diagnos är 68 år, men förekommer även hos unga individer och barn.
Etiologi
Tidigare strålbehandling mot området ökar risken för spottkörtelcancer 289.
Figur 44. Andel fall per lokalisation för spottkörtelcancer, 2008–2021.
Figur 45. Stadiefördelning per lokalisation för spottkörtelcancer, 2008–2021 (UICC 7th).
Patologi
Maligna spottkörteltumörer är en morfologiskt heterogen grupp av tumörer som ofta kan vara svårdiagnostiserade mikromorfologiskt. Enligt den senaste WHO-klassificeringen från 2017 förekommer >20 undergrupper med varierande malignitetsgrad, vilken även kan variera inom tumörundergruppen 258290. Det är därför viktigt att malignitetsgraderingen av spottkörteltumörer oavsett subtyp diskuteras med patolog. Nedan beskrivs de vanligaste histologiska typerna i SweHNCR.
Adenokarcinom, NOS (20 %)
Vanligaste lokalisationen för denna tumörform är parotiskörteln och den inkluderar ett flertal varianter där patologen inte kan ställa en mer specifik histopatologisk diagnos. Andra vanliga typer som salivary duct-karcinom, höggradig mucoepidermoid cancer och sekundärt adenokarcinom bör uteslutas med hjälp av immunhistokemi. Adenokarcinom UNS bör malignitetsgraderas histologiskt på en tregradig skala på basen av cellulär atypi, mitosförekomst samt förekomst av körtelformationer, där höggradig tumör utgör den mest maligna tumörformen med sämre överlevnad 258.
Mukoepidermoid cancer (15 %)
Parotis är den vanligaste lokalisationen för denna tumörform. Histologiskt karakteriseras mukoepidermoid cancer (MEC) av förekomst av mucinproducerande, intermediära och skivepitelstumörceller i ett cystiskt till solitt växtmönster.
Malignitetsgrad avgörs med histologiska parametrar på en tregradig skala och är svår. De två mest använda graderingssystemen i dag är AFIP (Armed Forces Institute of Pathology) och Brandwein Score 291292. Man rekommenderar att gradera enligt båda skalorna och diskutera fallet med patolog, framför allt när tveksamhet råder om malignitetsgraden. Låg och intermediär grad har en generellt god prognos, medan prognosen vid en höggradig tumör är sämre.
Acinic cell-cancer (16 %)
Parotis dominerar (> 90 %) som primär lokal för denna tumörtyp. Acinic cell-cancer (AcCC) malignitetsgraderas inte och kan generellt ses som en låg- till intermediärgradig tumör. En liten andel av dessa tumörer dedifferentierar och har sämre prognos 258.
Adenoidcystisk cancer (15 %)
Adenoidcystisk cancer (AdCC) lokaliseras vanligen (2 av 3) till de större spottkörtlarna och består av epiteliala och myoepiteliala tumörceller som framför allt växer tubulärt, kribriformt och solitt. Perineural växt är mycket vanligt förekommande. Påvisandet av fusionsgenen MYB-NFIB, som hittas i de flesta fall av AdCC, ger också stöd för diagnosen 258293.
Malignitetsgradering av AdCC bör utföras histologiskt på en tregradig skala och baseras i huvudsak på tumörens växtmönster, men även på kärnatypi och mitosfrekvens 258.
Skivepitelcancer (6 %)
Skivepitelcancer förekommer oftast hos äldre som metastas i parotis, vanligen från huden i huvud- och halsområdet. I sällsynta fall kan den förekomma som primär parotistumör. Diagnosen av primärtumör bör därför göras först efter att annat möjligt ursprung har uteslutits 294. Säkra prognostiska markörer saknas på grund av att det finns få beskrivna fallserier i litteraturen 258.
Andra mindre vanliga cancerformer
Karcinom ex pleomorft adenom: är generellt en aggressiv tumör som uppstår i ett preexisterande pleomorft adenom och förekommer vanligen i parotis. Histologin varierar beroende av vilken komponent som malignifierar; de flesta är höggradiga tumörer. 258.
Salivary duct-karcinom: är en höggradig aggressiv malign tumör som mikromorfologiskt liknar duktal bröstcancer (invasiv bröstcancer, NOS) och lokaliseras vanligen till parotis. Prognosen är ofta dålig, och regionala metastaser och fjärrmetastaser är vanligt förekommande. Vid immunhistokemisk färgning är tumören ofta positiv för androgenreceptor (diffust i kärnor), men negativ för ER och PgR. Överuttryck av HER2-proteinet påvisas i en del av fallen, liksom genamplifiering av HER2 258293
Sekretoriskt karcinom (tidigare så kallad MASC): är ett låggradigt spottkörtelkarcinom med morfologiska likheter med sekretoriskt karcinom i bröst och lokaliseras vanligen till parotis och munhåla. Majoriteten av fallen har ett genrearrangemang med translokalisation, vilket resulterar i genfusionen ETV6-NTRK3. Påvisande av detta genrearrangemang ger stöd för diagnosen. Även om tumören anses vara indolent i de flesta fall förekommer regionala metastaser, vilket försämrar prognosen 258290.
Förutom ovan beskrivna tumörer har WHO definierat ytterligare subtyper:
- Polymorft adenokarcinom (PAC eller PLGA) – vanligen låggradig malign tumör.
- Klarcelligt karcinom – vanligen låggradig malign tumör.
- Basalcellsadenokarcinom – vanligen låggradig malign tumör.
- Intraduktalt karcinom – vanligen låggradig malign tumör, men intermediära och höggradiga former förekommer.
- Myoepitelialt karcinom – varierande prognos.
- Epitelialt-myoepitelialt karcinom – vanligen låggradig och indolent.
- Sebaceöst adenocarcinom – varierande prognos.
- Karcinosarkom – aggressiv malignitet med dålig prognos.
- ”Poorly differentiated” karcinom – indelas i odifferentierat karcinom, storcellig neuroendokrint karcinom och småcelligt neuroendokrint karcinom. Dålig prognos.
- Lymfoepitelialt karcinom – varierande prognos.
- Onkocytärt karcinom – ovanlig med osäker prognos.
- Sialoblastom – ovanlig tumör med oklar malignitetspotential.
Tabell 5. Malignitetsgrad och subtyper vid spottkörtelcancer 258295
|
Låggradig cancer |
Intermediär cancer |
Höggradig cancer |
|
Låggradig (högt differentierad) mukoepidermoid cancer Acinic cell-cancer Basalcellsadenocarcinom Polymorft låggradigt adenocarcinom (PLGA) Låggradig kribriform cystadenocarcinom Klarcellscancer Epitelial myoepitelial cancer Sekretoriskt carcinom (MASC) |
Intermediär (medelhögt differentierad) mukoepidermoid cancer Tubulär och kribriform adenoidcystisk cancer Myoepitelial cancer Mucinöst adenokarcinom Karcinoma ex pleomorft adenom |
Höggradig (lågt differentierad) mukoepidermoid cancer Odifferentierad, solid adenoidcystisk cancer Salivary duct-karcinom Adenocarcinom NOS Onkocytär cancer Skivepitelcancer Karcinosarkom Småcellig cancer Storcellig cancer Sebaceöst cancer Lymfoepitelial cancer Odifferentierad acinic cell-cancer |
Symtom
Det vanligaste symtomet är en knuta (resistens). Fixation mot hud eller skelett, kranialnervspåverkan (n facialis, hypoglossus eller lingualis) och värk är prognostiskt ogynnsamma tecken.
Utredning
Klinisk utredning
Utöver sedvanlig ÖNH-undersökning bör resistensen beskrivas vad gäller storlek och rörlighet eller fixation mot hud och underlag. Eventuell kranialnervspåverkan bör anges.
FNAC bör utföras och svaret får bedömas tillsammans med övrig information. Vid oklar cytologi utan malignitetsmisstanke rekommenderas ompunktion vid ett tillfälle 296. Vid stora tumörer eller misstanke om lymfom kan denna punktion göras med mellannål 106.
En resistens i glandula submandibularis och glandula sublingualis med cytologiskt oklar malignitetspotential bör betraktas som malign tills det finns en PAD-analys eftersom risken för malignitet är 50 respektive 90 % 297.
Även vid cytologiskt benign diagnos bör väntetiden till operation vara begränsad eftersom feldiagnostiken är högre jämfört med cytologprov från andra tumörlokaler.
Radiologisk utredning
- UL hals inklusive UL-FNAC.
- DT eller MRT av hals och primärtumörområde samt DT thorax.
- Eventuellt PET-CT helkropp vid avancerade tumörer.
Vid cytologisk eller klinisk misstanke om spottkörtelcancer rekommenderas MR med diffusion och IV-kontrast som kartläggning av primärtumörområdet, eftersom tumören inte sällan är isoattenuerande med normalt spottkörtelparenkym på DT. MRT påvisar också bättre eventuellt engagemang av kärl och nerver och karakteriserar tumören bättre. Vid misstanke om benengagemang bör DT genomföras.
DT hals-thorax för diagnostik av eventuell metastasering.
UL-FNAC ger möjlighet att diagnostisera metastaser i lymfkörtlar på halsen.
Helkropps PET/CT bör övervägas vid avancerade och högmaligna spottkörtelcancrar för detektion av lymfkörtelmetastaser och fjärrspridning. Adenoidcystisk cancer kan ibland uppvisa låg grad av FDG-upptag och benigna tumörer högt FDG-upptag, vilket kan medföra risk för såväl falskt positiva som falskt negativa fynd vid PET-CT 106298.
I de fall malignitetsmisstanken är ringa kan utredningen påbörjas med ultraljud av spottkörtel och hals samt finnålsbiopsi. Om ultraljudsfynd och upprepad cytologi talar för benign genes kan den radiologiska utredningen begränsas till detta.
Behandling
Kirurgi
Den primära behandlingen vid spottkörtelcancer är radikal kirurgi om tumören bedöms resektabel. Vid nervoffrande kirurgi av bekräftad eller misstänkt adenoidcystisk cancer, bör peroperativ fryssnittsanalys av nervänden övervägas 299.
Primärtumör i glandula parotis
Beroende på tumörens utbredning görs en superficiell eller total parotidektomi med så nervsparande kirurgi som möjligt. Om tumören omger facialisnerven eller om det finns nervinväxt reseceras nerven och ersätts med nervgraft, liksom om patienten har preoperativ facialispåverkan eller pares. Om rekonstruktion med nervgraft ej är möjlig bör primär ”passiv upphängning” av ansiktets mjukvävnader och implantation av ett guldlod i övre ögonlocket utföras, för att patienten enklare ska kunna blunda. Vid T3–T4-tumörer kan det bli aktuellt med resektion av närliggande mjukvävnad och ben.
Primärtumör i glandula submandibularis
Tumören utryms med god marginal samtidigt med en supraomohyoidal halslymfkörtelutrymnig.
Vid T3–T4-tumörer kan det bli aktuellt att resekera ytterligare mjukvävnad och mandibel.
Primärtumör i glandula sublingualis
Tumören resekeras med god marginal inklusive halslymfkörtelutrymning när indicerat.
Halsens lymfkörtlar
I en metaanalys som rör spottkörtelcancer återfanns metastaser i 23 % hos patienterna med kliniskt eller radiologiskt N0 hals. Behandling av halsen med kirurgi och/eller strålbehandling ger regionala återfall hos endast 5 % 300.
Överväg att behandla halsen vid cN0 om patienten har någon av följande riskfaktorer för regional spridning 301302.
- höggradig tumör (histopatologi)
- facialispares preoperativt
- lymfovaskulär invasion 303
- extraparenkymatös utbredning
- T3–T4
Vid cN+ bör man överväga neckdissektion regio I–V beroende på primär lokalisation. 298
Efter primär kirurgi och inför ställningstagande till halslymfkörtelutrymning och postoperativ strålbehandling rekommenderas behandlingen i det nedanstående schemat, se tabell 6.
Tabell 6. Schema över rekommenderad behandling efter primär kirurgi.
|
Ingen ytterligare behandling efter primär kirurgi vid |
Halslymfkörtelutrymning, om inte primärt utförd, övervägs vid |
Postoperativ strålbehandling mot tumörområde och hals vid |
|
pT1–T3-tumörer och |
pT3–T4-tumörer och/eller |
pT3 eller pT4, dvs. större tumörer än uppskattat preoperativt |
|
låggradig histologi* |
höggradig histologi |
höggradig histologi |
|
radikalt opererade |
|
snäva eller positiva marginaler |
|
ingen lymfovaskulär invasion eller perineural spridning |
|
pN+ |
|
lymfovaskulär invasion eller perineural spridning |
Vid en histologiskt låggradig tumör, till exempel högt differentierad mukoepidermoid cancer och acinic cell-cancer, anses i allmänhet patienten vara färdigbehandlad efter kirurgi, om tumören är radikalt avlägsnad.
Vid adenoidcystisk cancer rekommenderas alltid postoperativ strålbehandling, oberoende av stadium 106.
Onkologisk behandling
Vid stadium I–II ges postoperativ strålbehandling vid högmalign histologi och liten kirurgisk marginal 304. Tumörens närhet till facialisnerven kan bara bedömas av operatören vid operation och ska vägas in i radikalitetsbedömningen.
Stadium III–IV-tumörer bör alltid strålbehandlas postoperativt.
Postoperativ strålbehandling rekommenderas för alla maligna tumörer i glandula submandibularis, förutom små låggradiga tumörer som exciderats radikalt. Vid adenoidcystisk cancer erbjuds alltid postoperativ strålbehandling oavsett gradering. Behandlinsgvolymen bör omfatta primärtumörområde samt perineural spridningsväg 106.
Strålbehandling
Postoperativ strålbehandling ges mot primärtumörområdet och eventuellt mot ipsilaterala lymfkörtlar på halsen. Strålbehandling till kurativ dos bör övervägas till icke operabla patienter eller icke resektabla tumörer.
Medicinsk tumörbehandling
Cytostatika och annan medicinsk onkologisk behandling används främst i palliativt syfte 305, se avsnitt 11.3.3 Medicinsk tumörbehandling.
Uppföljning
Rekommendation:
Alla patienter med spottkörtelcancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Radiologisk uppföljning kan ingå vid svårbedömt kliniskt status eller specifika frågeställningar.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
För vissa patientgrupper, exempelvis adenoidcystisk cancer kan längre uppföljning vara aktuell.
Prognos
Enligt SweHNCR är den relativa 5-årsöverlevnaden för all spottkörtelcancer i Sverige 75 %. Överlevnaden är något sämre för tumörer i glandula submandibularis, se figur 46. Det finns stora skillnader i överlevnad beroende på stadium vid diagnos, se figur 47, samt mellan olika histopatologiska diagnoser, se figur 48. Hög ålder, avancerat tumörstadium inklusive kranialnervspåverkan, försämrar prognosen 306.
Figur 46. Relativ överlevnad för patienter med spottkörtelcancer.
Figur 47. Relativ överlevnad för patienter med spottkörtelcancer, per stadium (UICC 7th)
Figur 49. Relativ överlevnad för cancer i gl parotis och gl submandibularis
Näs- och bihålecancer
Översikt

|
ICD-10 |
|
|
Näshåla |
C30.0 |
|
Maxillarsinus (käkhåla) |
C31.0 |
|
Etmoidalsinus (silbensceller) |
C31.1 |
|
Näsa-bihåla övergripande växt |
C31.8 |
|
Näsa-bihåla ospecificerad lokalisation |
C31.9 |
|
Frontalsinus (pannbihåla) |
C31.2 * |
|
Sfenoidalsinus (kilbenshåla) |
C31.3 * |
|
Mellanöra |
C30.1 * |
* Cancer i frontalsinus och sfenoidalsinus är ytterst ovanlig med knappt 1 fall per år. Mellanörecancer är också ovanlig, knappt 2 fall per år. ICD-koder finns för dessa men de saknar TNM-klassifikation och diskuteras inte specifikt i detta kapitel.
Anatomi
Området för näs- och bihålecancer definieras av sinonasala benbegränsningar och omfattar även mellanörat. Tumörer utgångna från septum, näsgolvet, lateralväggen och slemhinnan i vestibulum nasi ingår i näshålan.
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning enligt UICC, TNM classification of malignant tumours, 8th edition, 2017 212.
Slemhinnemelanom i näsa och bihålor ska ICD-10-kodas efter lokalisation och registreras i SweHNCR. För dessa finns en speciell TNM-klassifikation som börjar med T3.
Kliniska T-kategorier (cTNM 8)
Maxillarsinus
|
T |
Storlek och utbredning |
|
T1 |
Tumör begränsad till slemhinnan utan benpåverkan |
|
T2 |
Tumör med benerosion eller destruktion inkluderande utbredning till hårda gommen och/eller mellersta näsgången, men ingen utbredning till maxillarsinus bakre vägg eller pterygoidplattorna |
|
T3 |
Tumör som växer in i något av följande: posteriora väggen, subkutan vävnad, orbitagolv eller mediala orbitaväggen, fossa pterygopalatina eller etmoidalsinus |
|
T4a |
Tumör som växer in i något av följande: främre orbita, kindens hud, pterygoidplattor, fossa infratemporalis, kribriformisplatta, sfenoid- eller frontalsinus |
|
T4b |
Tumör som växer in i något av följande: apex orbitalis, dura, hjärna, mellersta skallgropen, andra kranialnerver än trigeminus andra gren, nasofarynx eller clivus |
Kliniska T-kategorier (cTNM 8)
Näshåla och etmoidalsinus
|
T |
Storlek och utbredning |
|
T1 |
Tumör begränsad till en subsite* i näshålan eller etmoidalsinus med eller utan tecken på beninväxt |
|
T2 |
Tumör involverar två subsites* i näshålan eller i etmoidalsinus eller utbreder sig mot och involverar en intilliggande plats inom det nasoetmoidala komplexet, med eller utan beninväxt |
|
T3 |
Tumör som växer in i något av följande: orbitas mediala vägg eller golv, maxillarsinus, gom eller kribriformisplattan |
|
T4a |
Tumör som växer in i något av följande: främre orbita, hud på näsa eller hud på kind, minimal utbredning till främre skallgropen, pterygoidplattor, frontal- eller sfenoidalsinus |
|
T4b |
Tumör som växer in i något av följande: apex i orbita, dura, hjärna, mellersta skallgropen, andra kranialnerver än trigeminus andra gren, nasofarynx eller clivus |
*Subsites näshåla: septum, golv och lateralvägg.
*Subsites etmoidalsinus: höger resp. vänster sida.
Kliniska N-kategorier (cTNM 8)
Näsa och bihålor
|
N |
Storlek, utbredning |
|
N1 |
En ipsilateral körtel ≤ 3 cm utan extranodal utbredning |
|
N2a |
En ipsilateral körtel > 3 cm och ≤ 6 cm utan extranodal utbredning |
|
N2b |
Multipla ipsilaterala körtlar, ingen > 6 cm utan extranodal utbredning |
|
N2c |
Kontralaterala eller bilaterala körtlar, ingen > 6 cm utan extranodal växt |
|
N3a |
Körtel eller körtlar > 6 cm utan extranodal utbredning |
|
N3b |
Körtel eller körtlar med klinisk extranodal utbredning |
Klinisk stadieindelning (cTNM 8)
Näsa och bihålor
|
|
N0 |
N1 |
N2 |
N3 |
|
T1 |
I |
III |
IVA |
IVB |
|
T2 |
II |
III |
IVA |
IVB |
|
T3 |
III |
III |
IVA |
IVB |
|
T4a |
IVA |
IVA |
IVA |
IVB |
|
T4b |
IVB |
IVB |
IVB |
IVB |
M1 är alltid stadium IVC.
Epidemiologi och incidens
Epidemiologi
Under perioden 2008–2021 diagnostiserades cirka 67 nya fall per år av maligna näs- och bihåletumörer (SweHNCR). Incidensen har inte ökat under de senaste 20 åren. Över hälften av tumörerna utgår från näskaviteten, se figur 49.
Könsfördelningen är 58 % män och 42 % kvinnor. Medianåldern vid diagnos är 69 år.
Figur 49. Andel fall per lokalisation för näs- och bihålecancer, 2008–2021.
Etiologi
Var god se enskild histologi nedan.
Patologi
Näs- och bihåletumörer är en komplex grupp av tumörer med ursprung från slemhinna, seromukösa körtlar, mesenkymal vävnad, neural eller neuroektodermal vävnad, hematolymfoida celler och odontogena vävnader 307.
I Sverige är den vanligaste histopatologin skivepitelcancer (cirka 50 %) följt av melanom (15 %) 308.
Keratiniserande sinonasala skivepitelskarcinom (SNSCC) liknar histologiskt övrig keratiniserande SCC inom ÖNH-området och graderas på sedvanligt vis histologiskt. Etiologiska faktorer som ökar risken för SNSCC är rökning, nickel, klorofenoler och textildamm 309310. Patienter med inverterat papillom utvecklar i mindre än 2 % av fallen keratiniserande skivepitelcancer 311. Vanligen lokaliseras denna tumörtyp till näskaviteten och etmoidalsinus. Det är viktig att skilja dessa från SCC med kutant ursprung vid tumör i eller nära vestibulum.
Icke-keratiniserande SNSCC lokaliseras oftast till sinus maxillaris och näskaviteten. De karakteriseras av växtmönster som påminner om urotelcellskarcinom, varför ”transitional cell carcinoma” ibland används som synonym. HPV-association har beskrivits i en del av dessa tumörer men har oklar klinisk relevans.
HPV-relaterat multifenotypiskt sinonasalt karcinom inkluderades i WHO 2022 som en egen entitet. Risken för regionala metastaser är mindre och tumörtypen har en gynnsam prognos trots aggressiv histomorfologi 312. Tumörtypen definieras av p16-överuttryck samt HPV-förekomst, vanligen HPV-33 307.
NUT-karcinom sitter oftast i medellinjen, är ovanligt och definieras av ett lågt differentierat karcinom med ”abrupta foci med keratinisering” och rearrangemang av NUT-genen (Nuclear Protein in Testis), vilket är diagnostiskt. Den histologiska undersökningen måste kompletteras med en immunhistokemisk analys för att påvisa proteinet. Tumörformen förekommer även hos unga patienter. Prognosen är dålig (medianöverlevnad < 1 år) 313.
SMARC B1-deficient karcinoma (SWI/SNF-complexdeficient karcinom) är ett odifferentierat karcinom där diagnosen ställs på basen av histologi och immunhistokemi genom förlust av SMARCB1(INI1) eller SMARCA4 (BRG1). Tumörformen är aggressiv och diagnostiseras ofta med övergripande växt (T4). Trimodal behandling ges om möjligt.
Lymfoepitelialt karcinom är ovanligt, det kan påminna om nasofaryngealt karcinom och kan vara EBV-associerat. Risk för överväxt från äkta nasofarynxcancer bör beaktas 307.
Sinonasalt neuroendokrint carcinom (SNEC) indelas efter differentieringsgrad. Högt till medelhögt differentierade former (carcinoid och atypisk carcinoid) har god prognos. Lågt differentierade tumörer uppdelas efter cellstorlek: småcelliga och storcelliga 314. Småcellig SNEC, som är vanligare utgår från övre eller bakre näskaviteten, ofta T3–T4 vid diagnos. Storcellig SNEC kan vara mycket svår att differentiera från SNUC och har liknande presentation och prognos som småcelliga tumörer. Recidiv och fjärrmetastaser är vanligt vid lågt differentierade tumörer. Paramaligna symtom såsom ektopisk produktion av ACTH, calcitonin och ADH förekommer men är ovanliga 307.
Sinonasalt adenocarcinom (SNAC) 315 delas in intestinal-typ (framför allt etmoidalia) och non-intestinal-typ (framför allt näshåla) som delas upp i låg- och höggradiga typer. Långtidsexponering för trädamm, nickelföreningar, metalliskt nickel, sexvärt krom och polyaromatiska kolväten (PAH) innebär en ökad risk 316. Den intestinala typen liknar normal eller neoplastisk tunn- eller tjocktarm och kan inte differentieras från metastatisk koloncancer med endast histologi 307. SNAC är dock associerat med MET-genamplifiering och kolorektalt karcinom med KRAS- och BRAF-mutationer 317. Det finns också mer ovanliga subtyper av icke-intestinala karcinom som sinonasal renal cell-like adenoma och ETV6-rearranged SNAC 315 Icke-intestinala adenocarcinom har vanligen god prognos men kan recidivera lokalt aggressivt. Höggradiga tumörer har större recidivrisk och kombinationsbehandling bör övervägas.
Sinonasalt odifferentierat karcinom (SNUC) utgörs histologiskt av stora celler med tecken på neuroendokrin differentiering. Tumören är högmalign och vid diagnos förekommer ofta invasion av orbita och skallbas samt i 10–30% metastasering till lokala lymfkörtelstationer 307.
Sinonasalt Adenoidcystiskt carcinom (SNAdCC), se avsnitt 19.13.1.3 spottkörtelcancer, eftersom den beter sig likartat det vill säga risk för perineural infiltration. I motsats till annan sinonasal cancer förekommer den i högre grad hos yngre.
Olfactoriusneuroblastom (ONB), tidigare benämnt estesioneuroblastom, är en malign tumör med neuroektodermalt ursprung. Den utgår från olfactoriskt epitel i övre delen av näshålan och har neuroendokrin differentiering och utgör 3–6 % av sinonasal cancer 318. ONB ingår inte i SweHNCR varför statistik för Sverige saknas.
Stadieindelning enligt Kadish används 319, modifierat A-D 320, där D är det mest avancerade stadiet med fjärrmetastasering. Den histologiska graderingen enligt Hyam I–IV är betydelsefull för risken för regional- och fjärrmetastasering, samt prognos och behandling 321322.
ONB kan ha en neuroendokrin differentiering och kan därmed producera flera typer av peptider och hormoner med paraneoplastiska syndrom som följd. Prognosen beror på Hyam-gradering och stadium 323.
Sinonasalt mukosalt melanom (SNMM) är mer aggressiv än sin kutana motsvarighet. De saknar oftast behandlingsprediktiva mutationer, men trots det bör en melanom-NGS-analys utföras. SNMM är mer aggressiv än de flesta andra sinonasala tumörer. Stadium III är lägsta stadium där T3 indikerar tumör begränsad till endast slemhinna, medan T4a indikerar tumörer som involverar djup mjukvävnad, brosk, ben eller hud 324325. Ca 20 % är multifokala, 6 % har regionala metastaser och 7 % hjärnmetastaser vid diagnos 326. 5-årsöverlevnaden är 25-50 % 326327328. Tumör lokaliserad till näshåla har bättre prognos än de med lokalisation i bihåla 327.
Symtom
Vanliga symtom är nytillkommen och långdragen (månader) ensidig snuva eller nästäppa, återkommande blödning eller blodig sekretion. Återkommande sinuiter som inte läker ut, särskilt hos äldre, bör utredas för att utesluta malignitet. Ensidig ansiktssmärta med svullnad av kinden kan bero på tumörengagemang av främre käkhåleväggen. Dubbelseende och exoftalmus kan orsakas av tumörgenombrott till orbita. Rodnad och svullnad i överkäken är ett observandum. Plötsligt lösa tänder och/eller lokal smärta då man tuggar kan vara tecken på malign sjukdom.
Tumörerna är ofta avancerade vid diagnos och cirka hälften av fallen är i stadium IV, se figur 50.
Figur 50. Fördelning av stadium per tumörlokal för näs- och bihålecancer, 2008–2021 (UICC 7th)
Utredning
Klinisk utredning
Utredningen bör omfatta en anamnes av yrke och eventuell tidigare bihålesjukdom. Rinoskopi med rak eller flexibel optik bör utföras och biopsi tas om möjligt direkt vid mottagningsbesöket. Vid slemhinnetäckt tumör eller lokalisation i bihåla rekommenderas rinosinoskopi med biopsi i narkos. Om tumören påverkar orbita bör en ögonläkare konsulteras.
Radiologisk utredning
- DT av huvud, hals och thorax, gärna med navigationsprotokoll (bihåle-DT med låg stråldos är inte tillräcklig).
- Kompletterande MRT av primärtumörområdet och lokal spridningsväg.
- UL-FNAC av halsens lymfkörtlar om indicerat.
- Helkropps PET-CT vid avancerad tumör eller vid klinisk misstanke om metastasering.
- PET-CT + CT/MRT hjärna bör utföras vid planerad kurativ behandling av SNMM.
Malignitet i näsa eller bihålor destruerar ofta benväggar och växer ut i omgivande vävnader. DT av huvud, hals och thorax med intravenös kontrast är förstahandsmetod och räcker ofta för att kartlägga tumörutbredning och metastaser, som underlag för TNM-klassifikation.
Kompletterande MRT av primärtumörområdet och lokal spridningsväg bör utföras vid utbredda tumörer, särskilt om man misstänker tumörinväxt duralt, intrakraniellt, perineuralt, i kärl, orbita, eller om man inte kan skilja tumörväxt i en utfylld bihåla från avstängd vätska och inflammatoriska förändringar 329.
DT- och MRT-protokollen bör redan från början vara anpassade för peroperativ navigation och detta bör anges i remissen.
UL-FNAC är indicerat vid icke palpabla radiologiskt metastasmisstänkta lymfkörtlar på halsen, eller där initial cytologi varit inkonklusiv.
PET/CT rekommenderas vid primärtumör T3–T4, eller vid klinisk misstanke om metastasering 330. Adenoidcystisk cancer tar inte alltid upp FDG, vilket kan medföra risk för såväl falskt positiva som falskt negativa fynd vid PET-CT 331.
Behandling
Principer för kurativ behandling
Sinonasala tumörer är ofta avancerade vid diagnos. Ca 80 % får kurativ behandling 308.
T1–T2-tumörer: Kirurgi +/- postoperativ strålbehandling
Vid små tumörer (T1) där resektionen är radikal rekommenderas kirurgi som enda behandling.
Vid T2 tumörer rekommenderas i de flesta fall radikal primär kirurgi och postoperativ strålbehandling. Möjliga undantag är låggradiga adenocarcinom, ONB Hyam grad I–II och högt differentierad SNEC.
T3–T4-tumörer: Kombinationsbehandling
Kirurgi rekommenderas som primär behandling vid resektabel tumör. Undantag är till exempel tumörer med särskilt cytostatikakänslig histopatologi (SNUC och lågt differentierad SNEC) 332 eller selekterade fall av avancerad SNSCC där neoadjuvant cytostatika och/eller strålbehandling möjligen skulle kunna optimera förutsättningarna för radikal kirurgi 333334335.
Vid icke resektabel sjukdom rekommenderas fulldos strålbehandling med konkomitant cytostatika. Induktionskemoterapi kan övervägas vid mycket gott allmäntillstånd och cytostatikakänslig histopatologi.
Behandlingsprinciper för särskilda histopatologier
Vid SNUC ges induktionskemoterapi med platinumdubblett, vid god respons följt av definitiv kemoradioterapi. Kirurgi kan övervägas vid bristande respons på induktionsbehandlingen 336.
Vid SNEC rekommenderas primär kirurgi vid högt till medelhögt differentierad tumör. Vid lågt differentierad tumör är både TNM och Ki67 avgörande för val av primär behandling. Enligt metaanalys förordas neoadjuvant behandling följt av kirurgi eller radiokemoterapi 337.
Vid SNMM rekommenderas primär radikal kirurgi (stadium III och IVa) 327328338. Postoperativ RT rekommenderas ofta för bättre lokal kontroll men påverkar sannolikt inte överlevnaden 339340341. Hög risk för hematogen metastasering föreligger både vid diagnos och efter radikal kirurgi, vilket kan tyda på att mikrometastasering förekommer vid diagnos 328342343. Möjligen utgör detta en indikation för neoadjuvant onkologisk behandling innan kurativ kirurgi, antingen med CRT alternativt immunologisk behandling 328344. SNMM bör diskuteras på melanom MDK för ställningstagande till eventuell neoadjuvant eller palliativ onkologisk medicinsk behandling, se nationellt vårdprogram melanom, bilaga 4.
Vid ONB är kirurgi primärbehandling. Postoperativ strålbehandling rekommenderas, särskilt vid avancerat stadium, osäker radikalitet eller Hyam-grad 3–4. Elektiv neckdissektion eller strålbehandling mot halsens lymfkörtlar (nivå Ib–III samt VIIa) kan övervägas 279 då risken minskar för regionalt recidiv även om överlevnaden inte förbättras 345. Alternativt följs patienten noga med beredskap för salvage (regionala recidiv förekommer i 18–41 % och kan komma sent) 345346. Det finns inget stöd för att använda cytostatika konkomitant 347 eller adjuvant 318. Vid icke-resektabel tumör bör strålbehandling, preoperativt eller till fulldos, övervägas 348.
Onkologisk behandling – särskilda överväganden
Induktionskemoterapi inför eventuell kirurgi ges vanligen med 2–3 kurer. Vid SNUC och lågt differentierad SNEC används vanligen platinum i kombination med etoposid, och vid SNSCC främst platinum kombinerat med taxan och/eller 5FU. Rapporterade responssiffror för dessa histologier är mellan 50–70 % och respons är förknippat med bättre prognos [335, 336, 349].
Intensitetsmodulerad strålbehandling (IMRT) har visats ge bättre dostäckning, förbättrad lokal kontroll och mindre toxicitet jämfört äldre behandlingstekniker 350. Särskild toxicitet att beakta inkluderar påverkan på kognitiva funktioner, hypofys samt ögat och synstrukturer 351352. Linjering och hänsyn till aktuella strukturer, inklusive hjärna eller temporallober rekommenderas, i enlighet med internationella konsensusriktlinjer 353. Vid perineural växt bör elektiv dos för relevant nervförlopp till skallbasen övervägas 106. Elektiv behandling av halsens lymfkörtlar vid cT3-4N0 bör övervägas för skivepitelcancer, SNUC och ONB 279354.
Kirurgi
Kirurgi – generella överväganden
Radikal kirurgi har en viktig roll vid kurativ behandling och flera kirurgiska tekniker finns tillgängliga. Valet baseras på flera kriterier som tumörlokalisation, tumörtyp (histopatologi), tumörstadium och prognos. Målet är att uppnå makro- och mikroskopisk radikalitet 355.
Endoskopisk endonasal kirurgi är effektiv vid behandling av utvalda fall av sinonasal cancer. Vid lokalt avancerade tumörer och recidiv diskuteras fortsatt det lämpligaste tillvägagångssättet 355; operation med navigation och endoskopisk teknik, öppen teknik med transfaciell eller sublabial aproach (Rouge Denker eller facial degloving) eller en kombination av dessa tekniker, är möjliga alternativ 355356357.
Tumörer som är begränsade till käkhålans botten och överkäksgingiva kan opereras med en inferior maxillektomi (överkäksresektion). Destruerar tumören övriga väggar utförs en radikal hemimaxillektomi eller medial maxillektomi, inklusive etmoidektomi. Om främre skallgropen är involverad kan man överväga resektion av skallbasen.
Modifierad radikal eller selektiv halslymfkörtelutrymning utförs om det finns regionala metastaser (cN+).
Resektion av mellanansiktets strukturer speciellt i kombination med adjuvant eller neoadjuvant radioterapi medför risk att utveckla funktionella och estetiska defekter 358.
Den kirurgiska rekonstruktionen är utmanande 359. Det krävs ofta fria transplantat med olika vävnadskomponenter för goda funktionella och estetiska resultat 360361. Mycket talar för att man om möjligt bör rekonstruera mellanansiktet primärt med en fri mikrovaskulär lambå med eller utan ben 70360361362363.
Vid större resektioner som involverar främre skallbasen används en lokal periostal eller en fri mikrovaskulär lambå. Titanfixturer bör om möjligt appliceras vid operationen som fästpunkter för en epites. Resektion av ytternäsan medför ofta rekonstruktionsproblem. En pannlambå kan ibland vara lämplig men oftast blir epites bäst. Vid begränsad inferior maxillektomi kan gomdefekten alternativt täckas med en obturatorprotes eller gomplatta 359362.
Uppföljning
Rekommendation:
Alla patienter med näs- bihålecancer ska följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Klinisk och radiologisk uppföljning
Då tumörområdet oftast inte kan inspekteras optimalt rekommenderas bilddiagnostik 3 månader efter primärbehandlingen. MRT är att föredra då det är svårt att skilja postterapeutiska förändringar från återfall. Adenoidcystisk cancer följs med fördel med MRT, med hänsyn till risken för perineural spridning.
Efter strålbehandling bör hypofysfunktionen, visus och synfält beaktas, se nationellt vårdprogram hypofystumörer.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 kontrolleras patienten var 6.e månad.
Vid vissa former av sinonasal cancer, t.ex. olfaktoriusneuroblastom och adenocystisk cancer rekommenderas livslång uppföljning då mkt sena recidiv förekommer i en inte försumbar del av fallen.
Prognos
Den relativa 5-årsöverlevnaden är 54 %. Den histologiska typen har stor betydelse för överlevnaden. Bäst relativ 5-årsöverlevnad har ONB, adenokarcinom samt adenoidcystisk cancer 308364, se figur 53.
Patienter med tumörer som utgår från näshålan har bättre prognos än de med övriga tumörlokaler, se figur 51. Sjukdom i stadium I–II har god prognos, se figur 52. T4b tumörer med inväxt i CNS, orbita (apex), skallbas eller nasofarynx är förenade med dålig prognos, liksom lymfkörtelmetastaser till halsen.
Figur 51. Relativ överlevnad för patienter med näs- och bihålecancer.
Figur 52. Relativ överlevnad för patienter med näs- och bihålecancer, per stadium (UICC 7th).
Figur 53. Relativ överlevnad för patienter med näs-bihålecancer beroende av histopatologisk diagnos.
Lymfkörtelmetastas på halsen med okänd primärtumör, CUP-HH (Cancer of Unknown Primary - Head and Neck)
Översikt
ICD-10
Lymfkörtelmetastas – huvud, hals, supraklavikulärt C 77.0
Många tumörer i huvud- och halsområdet debuterar med en regional lymfkörtelmetastas. CUP-HH är en uteslutningsdiagnos när utredning inte har kunnat påvisa någon primärtumör.
Vid metastaser i nivå II–III är primärtumören ofta belägen i orofarynx. Även p16-positivitet talar starkt för primärtumör i orofarynx. Nasofarynx som primärtumörlokal bör övervägas vid EBV-positivitet, metastas retrofaryngealt alternativt i nivå V. Vid skivepitelcancermetastas längre ned på halsen, i fossa supraclavicularis, är det sannolikt ett annat ursprung än HH-cancer, till exempel esofagus- eller lungcancer. Man bör också beakta möjligheten av metastas från hudcancer, oavsett körtelnivå.
Adenokarcinom i en kranialt belägen lymfkörtel indikerar spottkörtlar som möjlig primärlokal. Vid fynd av adenokarcinom längre ner på halsen och i fossa supraclavicularis bör utredningen riktas mot en primärtumör utanför huvud- och halsområdet, företrädelsevis i bröst, lunga eller esofagus.
I dag anses det mindre sannolikt att skivepitelcancer har sin primära uppkomst i en lateral halscysta 365366.
TNM-klassifikation och stadieindelning
TNM-klassifikation och stadieindelning enligt UICC, TNM classification of malignant tumours, 8th edition, 2017 212.
Eftersom en primärtumör inte har påvisats klassificeras alltid CUP som T0. N-klassificering styrs av EBV-förekomst och p16 uttryck. Vid EBV positiv skivepitelcancer används samma klassificering som nasofarynxcancer. Vid p16 positiv skivepitelcancer används samma klassificering som p16 positiv orofaryngeal cancer. Övriga fall klassificeras som p16 negativ HH-cancer.
Kliniska N-kategorier (cTNM 8)
CUP-HH-, EBV- och HPV/p16-negativa eller ej klassade metastaser
|
N |
Storlek, utbredning |
|
N1 |
En ipsilateral körtel ≤ 3 cm utan extranodal utbredning |
|
N2a |
En ipsilateral körtel, > 3 cm men ≤ 6 cm utan extranodal utbredning |
|
N2b |
Multipla ensidiga körtlar, ingen > 6 cm och utan extranodal utbredning |
|
N2c |
Bilaterala körtlar, ingen > 6 cm och utan extranodal utbredning |
|
N3a |
Körtel > 6 cm utan extranodal utbredning |
|
N3b |
Körtel eller körtlar med extranodal utbredning |
Klinisk stadieindelning (cTNM 8)
CUP-HH-, EBV- eller HPV/p16-negativa metastaser
|
|
N0 |
N1 |
N2 |
N3 |
|
T0 |
- |
III |
IVA |
IVB |
M1 är alltid stadium IVC.
Kliniska N-kategorier (cTNM 8)
CUP-HH, HPV/p16-positiva metastaser
|
|
Storlek, utbredning |
|
N1 |
Ensidiga körtlar ≤ 6 cm |
|
N2 |
Bilaterala körtlar ≤ 6 cm |
|
N3 |
Körtel/körtlar > 6 cm |
Klinisk stadieindelning (cTNM 8)
CUP-HH, HPV/p16-positiva metastaser
|
|
N0 |
N1 |
N2 |
N3 |
|
T0 |
- |
I |
II |
III |
M1 är alltid stadium IV.
Kliniska N-kategorier (cTNM 8)
CUP-HH, EBV-positiva metastaser
|
|
Storlek, utbredning |
|
N1 |
Ensidiga cervikala körtlar och/eller körtlar retrofaryngealt ≤ 6 cm, ovanför nedre kanten av krikoidbrosket |
|
N2 |
Bilaterala cervikala körtlar ≤ 6 cm, ovanför nedre kanten av krikoidbrosket |
|
N3 |
Cervikala körtlar > 6 cm och/eller utbredning nedom nedre kanten av krikoidbrosket. |
Klinisk stadieindelning
CUP-HH, EBV-positiva metastaser
|
|
N0 |
N1 |
N2 |
N3 |
|
T0 |
- |
II |
III |
IVA |
M1 är alltid stadium IVB.
Epidemiologi och incidens
Under åren 2008–2021 registrerades 748 fall av CUP-HH i SweHNCR. En ökande trend noteras 2008–2016 men därefter kan ingen tydlig trend urskiljas. Medianåldern vid diagnos är 65 år för män respektive 68 år för kvinnor. CUP-HH är vanligast hos män (72 % av fallen).
Patologi
Vid utredningen av en malign körtel på halsen ger cytologi och/eller histopatologi vägledning för att bedöma sannolik lokalisation av primärtumören, se avsnitt 19.15.1 Översikt samt 9.1 Patologins roll i den diagnostiska processen. Vid cystiska förändringar kan det krävas flera punktioner för att få ett representativt material för en cytologisk diagnos.
Skivepitelcancer är vanligast och utgör 86 % av fallen, enligt SweHNCR. Cirka 65 % av alla med CUP-HH under perioden 2018–2021 har testats med avseende på p16-uttryck, varav cirka hälften var p16-positiva. Andra diagnoser är adenocarcinom och odifferentierad cancer.
Om den cytologiska diagnosen är malignt melanom, sköldkörtelcancer, lymfom eller annan organspecifik cancer ska de inte inkluderas i CUP-HH, utan hänvisas till därför avsett vårdprogram alternativt CUP, se nationella vårdprogram.
Utredning
Klinisk utredning
CUP utredning inleds vid metastasmisstänkt förändring på halsen med i övrigt invändningsfritt ÖNH-status.
- Utredningen omfattar FNAC, om nödvändigt upprepad. Vid icke konklusiv cytologi görs i första hand mellannålsbiopsi. Om detta inte är möjligt görs öppen biopsi, i första hand rekommenderas att en hel lymfkörtel tas bort.
- p16/HPV-analys och EBV-diagnostik bör genomföras på cytologin eller histologin.
- Panendoskopi görs under narkos med nasofaryngo-, oro-, hypo-, faryngo- och laryngoskopi med riktade biopsier mot misstänkta områden.
- Bilateral tonsillektomi för PAD med nivåsnittning bör göras i frånvaro av misstänkta områden i övrigt.
- Mellannålsbiopsi alternativt mukosektomi av tungbas. Om mellannålsbiopsin är negativ rekommenderas mukosektomi av tungbas genom TORS eller TOUS.
Den radiologiska utredningen bör utföras före panendoskopi med biopsi på grund av risken för felaktig tolkning av såväl MRT som PET-CT.
Radiologisk utredning
- DT av huvud och hals och/eller MRT av huvud och hals samt DT thorax.
- PET-CT med diagnostisk datortomografi hals, thorax och buk.
- Ev. UL-FNAC av halsens lymfkörtlar.
PET med diagnostisk CT är idag den bästa metoden för att detektera primärtumörer, tumörspridning och synkrona tumörer, och den bör utföras som första metod eller när en utredning med DT eller MRT inte identifierat någon primärtumör 367 PET-CT bör inkludera en diagnostisk DT av hals, thorax och buk med kontrastmedel 368. MRT är ett komplement, särskilt om det finns tandartefakter på DT.
PET-MRT kan vara ett alternativ till PET-CT framför allt när kontrastmedel inte kan användas 369.
Andelen upptäckta primärtumörer med PET-CT varierar i litteraturen och är cirka 25–60 %. I de granskade studierna förekommer dock variationer i inklusionskriterier, vilket kan förklara skillnaderna 370.
Lymfoid vävnad i dessa områden har fysiologiskt högt upptag av FDG, vilket bidrar till många falskt positiva och många falskt negativa undersökningar. PET-CT utförd efter skopi med biopsier har fler falskt positiva resultat, varför riktade biopsier bör utföras efter radiologisk utredning 371.
Behandling
Rekommendation:
- extern strålbehandling med eller utan medicinsk tumörbehandling
- halslymfkörtelutrymning med postoperativ strålbehandling.
Behandlingstraditionen vid CUP-HH varierar över landet och det saknas underlag för att fastslå vilken behandling som är bäst. En genomgång av SweHNCR för åren 2017–2021 visar att det finns två behandlingsalternativ enligt ovan.
Ungefär 40 % av patienterna behandlas med primär halslymfkörtelutrymning.
Strålbehandling – val av behandlingsvolym
Den förmodade lokalen för primärtumören, ofta hela eller delar av orofarynx, behandlas med kurativt syftande strålbehandling (66–68 Gy), eller till en lägre, profylaktisk dos (ca 50–60 Gy) då det gäller en subklinisk, mikroskopisk sjukdom. Om utredning talar för annan primärtumörlokal än orofarynx modifieras behandlingen därefter.
Den engagerade körteln/körtlarna behandlas till kurativ dos med profylaktisk dos till nivåer med misstänkt spridning. Alternativt ges postoperativ dos mot halsen efter en halslymfkörtelutrymning. Ofta ges också profylaktisk strålbehandling mot den kontralaterala sidan.
Kirurgi
Vid CUP-HH utförs modifierad radikal halslymfkörtelutrymning som primär kirurgi följd av strålbehandling. Samma behandling ges i de fall då strålbehandling givits som första behandling, om det finns en residualtumör. Möjligheten att överväga enbart en halslymfkörtelutrymning vid solitär metastasering (< 3 cm) har framförts 372.
Uppföljning
Rekommendation:
Alla patienter med CUP-HH-cancer bör följas upp i 5 år och registreras i SweHNCR, oavsett var de behandlats.
Kontrollerna utförs enligt de samarbetsavtal som finns mellan behandlande klinker.
Syftet med kontrollerna efter behandling av CUP-HH är att identifiera behandlingskrävande återfall och metakrona primärtumörer samt att hantera biverkningar av den givna behandlingen. Riktade bilddiagnostiska undersökningar görs vid behov.
År 1–2
Under de 2 första åren kontrolleras patienten var 3:e månad.
År 3–5
År 3–5 görs kontroller var 6:e månad.
Prognos
Den relativa 5-årsöverlevnaden för hela diagnosgruppen är 66 %, och vid kurativt syftande behandling 78 %. Trots skillnader i behandlingstraditioner ses inga nationella skillnader i överlevnad.
Figur 54. Relativ överlevnad för patienter med CUP-HH diagnostiserad 2008–2021, per N-kategori (UICC 7th), utan hänsyn till p16-status.