Bakgrund, orsaker och prevention
Epidemiologi och screening för förstadier
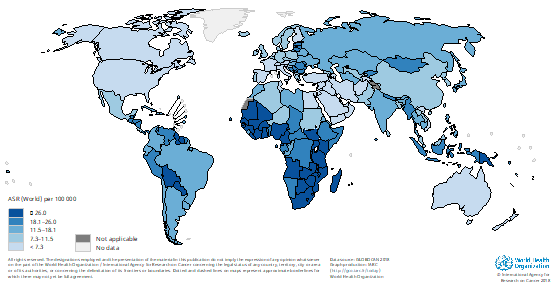
Livmoderhalscancer är den fjärde vanligaste cancersjukdomen bland kvinnor i världen. Cirka 530 000 kvinnor får varje år sjukdomen varav mer än hälften dör, och den utgör därmed den andra vanligaste cancerrelaterade dödsorsaken. Antalet fall varierar stort i olika delar av världen. Mer än 85 % av fallen drabbar kvinnor i låginkomstländer. Flest fall inträffar i Öst- och Västafrika (34/100 000) där sjukdomen också samvarierar med den utbredda hivepidemin. I västra Asien/Mellanöstern är antalet fall få (4,5/100 000) liksom i de länder som sedan decennier haft screeningprogram för att upptäcka och behandla sjukdomens förstadier. Samtidigt finns det verktyg som gör det möjligt att utrota livmoderhalscancer inom en snar framtid. Med screeningprogram baserat på HPV-analys och vaccination av unga flickor och pojkar mot HPV har Australien hösten 2018 annonserat möjligheten att utrota sjukdomen i landet senast år 2035. Andra forskare har kalkylerat möjligheten att göra detsamma i höginkomstländer före år 2060 genom hög täckningsgrad (> 80 %) i HPV-vaccinationsprogrammet för flickor och att erbjuda kvinnor HPV-testning minst 2 ggr/individ 4. I Sverige pågår sedan 2022 en studie med målet att till 2027 ”utrota” livmoderhalscancer, definierat som en incidens av 4,0 fall/100 000 kvinnor (2022 var incidensen ca 10/100 000.) Studien innebär att HPV-vaccination erbjuds till kvinnor födda mellan 1994–1999 i anslutning till första cellprovet och vid uppföljning. Dessutom skickas HPV-självprov till högriskgrupper för cervixcancer t.ex. körtelcellsatypier, långtidsuteblivare, otillräckligt behandlade och uppföljda för fortsatt utredning av vårdgivare av de som är HPV-positiva.
WHO:s generaldirektör Tedros Adhanom Ghebreyesus uppmanade 2019 alla länder att agera kraftfullt för att avsluta allt lidande som orsakas av HPV, genom att implementera vaccination mot HPV, screening och behandling. Se WHO Reproductive Health.
Figur 2. Global incidens av livmoderhalscancer.
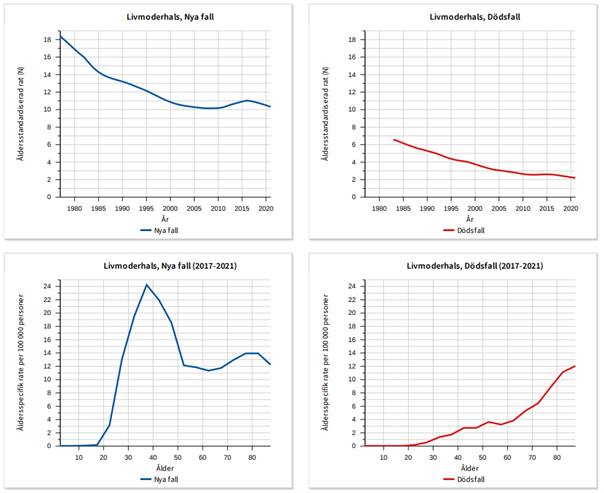
I Sverige började screening med cellprov för cytologi att införas 1966 och sedan 1977 finns en fungerande verksamhet i alla regioner. Incidensen i Sverige sjönk från 25 fall/100 000 (973 fall) 1965 till 8,4/100 000 (484 fall) 2012. Antalet fall av livmoderhalscancer har sedan ökat nationellt med cirka 2,5 % årligen under perioden 2008–2017, motsvarande cirka 100 fall år 2014. Ökningen är kraftigare för adenokarcinom än för skivepitelcancer. De regionala variationerna är stora med spridning från minskad incidens till en ökning på upp till 80 % . Den genomsnittliga incidensen 2015–2017 är 11,4/100 000, se Nationellt Kvalitetsregister för Cervixcancerprevention_Analys. Incidensen lågt stabilt fram till 2018 då man kunde ana en nedåtgående trend. År 2022 var incidensen ca 10/100 000.
Ungefär 75 % av fallen utgörs av skivepitelcancer medan cirka 25 % utgörs av körtelcellscancer (adenokarcinom), men andra histopatologiska diagnoser såsom adenoskvamös cancer, klarcellscancer och neuroendokrina tumörer förekommer. Persisterande infektion med HPV är en nödvändig förutsättning för utveckling av livmoderhalscancer, med undantag av vissa mycket ovanliga typer av adenokarcinom.
Livmoderhalscancer utgör cirka 1,9 % av all cancer för kvinnor i Sverige. Nästan två tredjedelar av cancerfallen inträffar hos kvinnor som inte deltagit i screeningprogrammet alls eller endast lämnat cellprov sporadiskt. Drygt en tredjedel upptäcks hos kvinnor under 40 år och då ofta i tidigt stadium. En fjärdedel av fallen upptäcks efter avslutad screeningålder och då oftast i avancerat stadium.
Vaginalcancer är mycket ovanligt och årligen insjuknar 30–40 kvinnor. Cirka en tredjedel av dessa har tidigare haft cervixdysplasier.
Prognosen är generellt god, med en relativ 5-årsöverlevnad på 81 % rapporterat 2021 . I tidiga stadier är 5-årsöverlevnaden över 90 %, medan den sjunker i högre stadier.
Figur 3. Övre raden: Incidens och dödlighet över tid. Nedre raden: Åldersstandardiserad incidens och dödlighet 2017–2021.
Socialstyrelsens riktlinjer från 1998 har reviderats 2015. 2018 samt 2022 avseende testmetod, åldersgränser och intervall. De nya rekommendationerna är riskbaserade och grundar sig på risk att utveckla livmoderhalscancer utifrån HPV-genotypning i tre olika kategorier (högonkogen-, medelonkogen- respektive lågonkogen HPV-typ) med cytologitriage i alla åldersgrupper
23–70 år. Uppföljningen skiljer sig beroende på genotyp och åldersgrupp 5.
Riktlinjer för gynekologens roll i utredning och behandling av kvinnor med förstadier till livmoderhalscancer har tidigare utarbetats av SFOG:s arbetsgrupp i ämnet (C-ARG), senast 2010 6. I det nationella vårdprogrammets senaste uppdatering från 2022 har gynekologens roll i screeningprogrammet förtydligats. Kvalitetskrav ställs på mottagningens bemanning och utrustning och man har för första gången infört en certifiering i kolposkopi och cervixcancerprevention för specialister i obstetrik och gynekologi. Vårdprogrammet ska underlätta för regionerna att göra screeningen för livmoderhalscancer säkrare, effektivare och mer jämlik i landet.
Cervixscreening med cellprovtagning, gynekologisk cellprovskontroll (GCK), medförde en minskning med 60–70 % av incidensen och en kraftig minskning av dödligheten under de första 50 åren. Om antalet fall år 1965 extrapoleras till dagens befolkning skulle det sannolikt motsvara 1 500–2 000 fall/år. Antalet kvinnor som genom screeningen de senaste 50 åren undvikit att utveckla livmoderhalscancer motsvarar befolkningen i en större svensk stad. Stora ansträngningar görs av den nationella organisationen och kvalitetsregistret för cervixcancerprevention för att analysera de olika delarna av den komplicerade screeningkedjan och vidta åtgärder.
Den organiserade screeningen minskar även risken för adenokarcinom och ovanliga cancertyper 7 och har även medfört en stadieförskjutning mot lägre stadium i de invasiva cancerfallen samt minskad dödlighet. 2021 var dödligheten 2,21/100 000, se NKCx Nationellt kvalitetsregister för Cervixcancerprevention, Årsrapport 2023. Se statistik om dödsorsaker på Socialstyrelsens hemsida 89. Enligt Cancerfondens statistik för livmoderhalscancer dog 151 kvinnor i sjukdomen 2022. De kvinnor som får sin diagnos i screeningprogrammet har bättre prognos än de som upptäcks utanför programmet 9.
Infektion med HPV
I det nya riskbaserade vårdprogrammet från nov 2022 (NVP 4.0) delas de onkogena HPV typerna in i tre kategorier beroende på deras risk att utveckla cancer hos individen. Högonkogena (HPV 16, 18 och 45) är de HPV-typer som har den största risken att utveckla cancer. Drygt 80% av alla livmoderhalscancer beror på dessa. Medelonkogena (HPV 31, 33, 52, 58.) De har lägre risk än de högokogena att utveckla cancer och står vardera för ca 1–2 % av alla livmoderhalscancerfall. Lågonkogena (HPV 35, 39, 51, 56, 59, 66, 68) står vardera för < 0,5 % av alla livmoderhalscancerfall. Persisterande infektion med humant papillomvirus (HPV) är en nödvändig förutsättning för utveckling av livmoderhalscancer 10. Undantagna är vissa adenokarcinom (se bilaga 8 KVAST-dokument, Cervix histopatologi) Nationellt vårdprogram livmoderhalscancerprevention. HrHPV 16, 18 och 45 återfinns i 94 % av alla adenokarcinom 11.
HPV:s karcinogena egenskaper är framför allt relaterade till två virala proteiner, E6 och E7, som genom bindning till p53 och Rb i cellen förhindrar celldöd och leder till oreglerad cellproliferation. För en schematisk bild, se figur 6 i avsnitt 7.1.7.1 Icke-invasiva skivepitelförändringar i cervix.
HPV är världens vanligaste sexuellt överförda infektion. Vertikal transmission (vid graviditet eller förlossning) är däremot mycket ovanlig . Man räknar med att knappt 80 % av alla sexuellt aktiva någon gång kommer att träffa på HPV 13. De allra flesta fall, cirka 90 %, läker spontant inom 1–2 år 141516.
Utveckling till cancer på grund av en persisterande HPV-infektion kan sägas vara en sällsynt komplikation till infektionen. För att en persisterande infektion ska utvecklas och epitelet omvandlas till precancerösa förändringar (HSIL) krävs samverkan med andra s.k. co-faktorer vilka inte är fullständigt kända. Några av dem är rökning, samtidig infektion med annan STI, långvarigt p-pillerbruk (> 5 år), immunosuppression samt ärftliga faktorer (t.ex. Peutz-Jeghers syndrom). Ung ålder vid första samlag, högt antal sexualpartner hos kvinnan och hennes manliga partner samt upprepade förlossningar är associerade med ökad risk för livmoderhalscancer 17181920. HPV-vaccination ger ett gott skydd mot infektion med HPV och cancerutveckling men även kondomanvändning ger ett visst skydd 172122.
Utveckling av förstadier till livmoderhalscancer och invasiv cancer
Utvecklingen från persisterande HPV-infektion till höggradig förändring (HSIL) kan vara så kort som 1–3 år. En vidare utveckling från HSIL/CIN3 till invasiv cancer anses ta längre tid, oftast mer än 10 år 23. LSIL läker ut i de flesta fall 24 och även HSIL/CIN 2 läker ut i nästan hälften av fallen, särskilt i yngre åldrar 2526.
Progressionsrisken för HSIL/CIN 3 till skivepitelcancer varierar mellan 12 och 30 % och ökar med storleken på lesionen och kvinnans ålder 242728. Den är även beroende av immunologiska faktorer med ökad risk för persisterande hrHPV-infektioner t.ex. hos kvinnor med immunsuppressiv behandling, exempelvis transplanterade, eller kvinnor med hivinfektion 2930.
Tidigare behandlad stark cellförändring (HSIL) ökar risken för att utveckla livmoderhalscancer under resten av livet. Risken ökar med stigande ålder. Även risken för vaginalcancer följer samma mönster 31.
För en schematisk bild av dysplasiutveckling och vidare till cancer, se figur 6, avsnitt 7.1.7.1 Icke-invasiva skivepitelförändringar i cervix.
Användning av HPV-testning i screeningprogrammet
Det nationella vårdprogrammet för livmoderhalscancerprevention 4.0 från nov 2022 rekommenderar efter Socialstyrelsen ändrade riktlinjer primär HPV-testning med cytologitriage i alla åldrar i screeningprogrammet. De med HPV pos och neg triage läggs in i sk kontrollfil HPV och återkallas beroende på HPV genotyp med ett visst tidsintervall. I Stockholm remitteras HPV 16 och 18 positiva direkt till kolposkopi utan persistent i kontrollfil sedan feb 2024. Diskussioner pågår f.n. i vårdprogramgruppen för livmoderhalscancerprevention om en nationell rekommendation angående dessa kvinnor. De randomiserade studier som ligger till grund för Socialstyrelsens rekommendation om cervixscreening från 2015 och det Nationella vårdprogrammet för cervixcancerprevention från 2017 baserar sig på primär HPV-testning med cytologisk screening som triage 32. Den svenska Swedescreen-studien har som en av fyra studier bidragit med viktigt underlag 33. Helt nyligen har påvisats att svensk cytologi under senaste åren har uppvisat en försämrad tillförlitlighet i att detektera förstadier till livmoderhalscancer, med en incidensökning som följd. Antalet kvinnor som har haft normalt cytologiskt prov den senaste screeningomgången och ändå utvecklat cancer har ökat med 30 % 1. Cytologisk diagnostik spelar en avgörande roll också efter det nya vårdprogrammets övergång till primär HPV-screening i de åldrar där cancer är vanligast.
Det nationella vårdprogrammet för livmoderhalscancerprevention rekommenderar laboratorierna att använda HPV-analys med så kallad utvidgad genotypning, vilket innebär att analysen bör kunna separera de olika HPV-typerna i minst de 5 olika typerna eller typ-grupperna HPV 16, HPV 18, HPV 45, HPV 31, 33, 52, 58 samt HPV 35, 39, 51, 56, 59, 68.
Vid uppföljning av tidigare behandlade/koniserade kvinnor används HPV-analys i kombination med cytologi som s.k. test of cure. Under pandemin gav SoS särskilda instruktioner om att kunna använda HPV självprovtagning som screeningtest och flera regioner har fortsatt att använda självprovtagning av HPV som primär screeningtest med uppföljande vårdgivartaget prov för cytologitriage hos de som är positiva för HPV 34.
Se kapitel 19 i Nationellt vårdprogram livmoderhalscancerprevention.
Profylaktisk HPV-vaccination och annan primärprevention
HPV-infektioner kan förebyggas med till exempel hälsoupplysning, kondomanvändning eller HPV-vaccination.
De vaccin som använts i Sverige är baserade på s.k. viruslika partiklar (VLP). Dessa innehåller inget av virusets arvsmassa utan utgörs av ett av virusets ytprotein L1, vilket inducerar antikroppsskydd mot den specifika typ de liknar. Det förekommer ett visst s.k. korsskydd mot andra typer än den viruslika partikel som ingår. Alla HPV-vaccin innehåller HPV 16 och 18 VLP (Gardasil®, Gardasil 9®, Cervarix®). De två Gardasil-vaccinen innehåller ytterligare två VLP av HPV-typer som orsakar kondylom och larynxpapillom (HPV 6 och 11). Gardasil 9® innehåller även VLP motsvarande 31, 33, 45, 52 och 58. Effekt är redovisad mot förstadier till livmoderhalscancer, vulva- och vaginalcancer (VIN, VaIN) 3536373839 samt mot livmoderhalscancer 40, liksom hos män mot kondylom och förstadier till analcancer.
Alla tillgängliga HPV-vaccin är profylaktiska och förebygger HPV-infektion och utveckling av förstadier till livmoderhalscancer och har också potentialen att förebygga en stor andel av HPV-relaterad sjukdom i vulva och vagina 41. För bästa effekt bör vaccinet ges innan individen exponerats för HPV. Enligt beräkningar som gjordes inför introduktionen av HPV-vaccinationen framkommer att skyddet i befolkningen mot livmoderhalscancer uppnås fortare om vaccinationen även ges till äldre åldersgrupper än 11–12-åringar. Effekten av den s.k. catch up-vaccinationen sjunker dock gradvis med stigande ålder. T.ex. är effekten av vaccination vid 24 års ålder hälften av den vid 18 års ålder 42. Skyddet mot livmoderhalscancer är också starkare om vaccinet ges före 17 åå jämfört med mellan 17–30 åå 40.
Kostnadseffektiviteten är beroende av vaccinpriset och med det upphandlade vaccinet kan man på goda grunder anta att vaccination i högre åldrar är kostnadseffektiv.
Den icke-organiserade vaccinationen i Sverige 2007–2011 där cirka 25 % av flickorna i relevanta åldrar vaccinerades uppvisade en kraftig social snedfördelning. Det var cirka 15 ggr vanligare att en flicka med universitetsutbildade föräldrar fick vaccin 43.
HPV-vaccination erbjuds sedan 2012 flickor födda 1999 och senare i 11–12 års ålder, med ett catch up-program för flickor/unga kvinnor födda 1993–1998. Möjligheten att vaccineras upp till 18 års ålder kvarstår. Deltagandet i vaccinationsprogrammet för flickor har under åren varit relativt stabilt ca 90 % (i catch up-programmet 55–63 %).
Med dagens vaccin och en god täckningsgrad före sexuell debut räknar man med att kunna förhindra cirka 70–90 % av livmoderhalscancerfallen, 80 % av förstadierna och > 90 % av kondylomfallen (för kondylom gällande Gardasil®, Gardasil 9®). Detta under förutsättning att täckningsgraden för vaccinationen är hög. I en nyligen publicerad populationsbaserad studie från Sverige, undersöktes sambandet mellan HPV vaccinering 2006-2017 och utveckling av livmoderhalscancer. För kvinnor vaccinerade före 17 års ålder noterades en riskminskning på 88 % vilket i stor utsträckning bekräftar vaccinets effekt på cancerutvecklingen 40.
HPV vaccination och screening med HPV-test för att hitta och behandla förstadier till cervixcancer är så effektiva instrument att man runt om i världen med starkt stöd av WHO diskuterar att kunna utrota livmoderhalscancer (definierat som < 4 fall/100 000 kvinnor) inom en överskådlig framtid. I april 2021 tog Sveriges riksdag ett s.k. intentionsbeslut i frågan. Studien för att erbjuda vaccination till de unga kvinnor som kommer på sin första cellprovskontroll pågår sedan 2022 i flera regioner samtidigt som kvinnor med hög risk i screeningprogrammet identifieras och kallas till särskild provtagning. Detta s.k. Utrotningsprojektet drivs av Centrum för cervixcancerprevention på Karolinska Universitetslaboratoriet i samarbete med RCC/NACx, och stöd av Cancerfonden, Nätverket mot gynekologisk cancer och SFOG. Preliminärt räknar man med att uppnå gränsen för utrotning (4 fall/ 100 000) senast 2027.
Flera studier på senare år har visat att män är utsatta för HPV-infektion och dess komplikationer under en stor del av sina liv och förefaller ha svårare än kvinnor att läka ut infektionen på egen hand 444546. Vaccination av pojkar är således av stort värde för att förebygga sjukdom hos män och sexuell spridning av HPV till andra individer. Sedan hösten 2020 ges HPV vaccination i skolhälsovården även till pojkar födda 2009 och senare. Eventuellt catch up program för pojkar. Utreds under våren 2024 av Folkhälsomyndigheten.
Ett antal meta-analyser av tillgängliga studier av det bivalenta och det fyrvalenta vaccinen givna på indikationen att förhindra recidiv efter excisionsbehandling av HSIL har publicerats 474849. I flertalet studier har man funnit en sänkning av risken att utveckla recidiv av HSIL efter kirurgisk excision i gruppen som fick HPV vaccin. Den optimala tidpunkten att ge vaccinet är fortfarande oklar men bäst effekt förefaller uppnås om det ges innan eller i samband med den kirurgiska behandlingen.
Med stöd av data i litteraturen som refereras ovan rekommenderar SFOG genom sin arbetsgrupp C-ARG sedan april 2022 att vaccination i samband med kirurgisk excisionsbehandling bör diskuteras med kvinnan och att vaccination kan rekommenderas. Även det nationella Vårdprogrammet 4.0 ger sedan nov 2022 samma rekommendation.
Prospektiva randomiserade studier pågår för tillfället med användning av det profylaktiska 9 valenta vaccinet (Gardasil 9) på denna indikation, resultaten har fördröjts pga pandemin och väntas tidigast under 2025.
Vartefter individer i de vaccinerade åldersgrupperna diagnostiseras med livmoderhalscancer behövs en systematisk HPV-typning vid livmoderhalscancer, för att kunna bedöma effekten av vaccinerna och eventuella förändringar i förekomsten av olika HPV-stammar. Trots avsaknad av evidens är det i dagsläget rimligt att rekommendera HPV-vaccination till de kvinnor som har genomgått hög excisionsbehandling eller trakelektomi p.g.a. livmoderhlascancer i analogi med rekommendationen för kvinnor som genomgått excisionsbehandling p.g.a. HSIL.
Terapeutiska vacciner
Man har försökt att immunisera mot de onkogena proteinerna E6 och E7 för att därigenom inducera en cellmedierad immunrespons och få lesionerna att gå i regress. En del studier har varit lovande, men fortfarande lär det dröja flera år innan dessa vacciner finns allmänt tillgängliga 50.
