Diffust storcelligt B-cellslymfom
Patologi
Diffust storcelligt B-cellslymfom (DLBCL) utgör en heterogen grupp av höggradiga B-cellslymfom (HGBCL), se avsnitt 8.4.1 Aggressiva B-cellslymfom enligt WHO 2017.
Benämningen DLBCL beskriver den histologiska bilden. Cellerna är stora, växer diffust och uttrycker vanligen B-cellsmarkörer såsom CD20, CD79 och CD19. Tre histologiska varianter kan särskiljas: centroblastisk, immunoblastisk och anaplastisk. Ursprungscellen är en B-cell från germinalcentrum i de sekundära lymffolliklarna eller en cell som passerat germinalcentrum och just påbörjat sin utveckling mot plasmacellsdifferentiering, en s.k. aktiverad B-cell. Genom studier av genuttrycksprofiler från DLBCL har man kunnat urskilja tre huvudgrupper baserat på ”cell-of-origin”, dvs. från vilken normal motsvarighet till ursprungscell som den maligna klonen utvecklats från. Den ena av dessa uppvisar egenskaper som är gemensamma för B-celler från germinalcentrum i de sekundära lymffolliklarna, s.k. GCB‑DLBCL med uttryck av CD10 och BCL6. Den andra huvudgruppen uppvisar egenskaper liknande aktiverade B-celler som passerat germinalcentrum och påbörjat sin utveckling mot plasmacellsdifferentiering, med uttryck av MUM1 och aktivering av NFκB, s.k. ABC‑DLBCL 30. Båda dessa grupper karaktäriseras av olika genetiska aberrationer, där GCB-DLBL ofta uppvisar IGH::BCL2-fusioner och mutationer i EZH2 och GNA13, medan ABC-DLBCL ofta karaktäriseras av mutationer i gener som är involverade i NFκB-signalering såsom MYD88 och CD79B, medan mutationer i KMT2A och TP53 ses vid båda subtyperna. Gemensamt för bägge grupperna är förekomst av somatisk hypermutation, en process som åstadkommer den enorma variabiliteten i IG-generna, men som också slumpmässigt kan ge upphov till mutationer i andra gener. Med genexpression kan man även identifiera en tredje, s.k. oklassificerbar (UC) grupp, medan man med olika immunhistokemiska algoritmer endast kan klassificera lymfom i subtyperna GCB eller icke GCB.
Utöver mutationer karakteriseras DLBCL ofta av andra genetiska aberrationer såsom translokationer och kopietalsvarianter (duplikationer, amplifieringar eller deletioner).
Man har även ytterligare kunnat klassificera DLBCL i flera olika undergrupper som är baserade på genetiska aberrationer och prognos, där Chapuy et al. 47 identifierat fem olika distinkta undergrupper och Schmitz et al. 48 fyra olika undergrupper med delvis överlappande genetik, vilket även beskrivits av Wright et al. med en algoritm för identifiering av sju skilda undergrupper 49.
Subtypning av DLBCL
För subtypning av DLBCL utförs immunhistokemi för exempelvis BCL6, CD10 och MUM1, för klassificering i GCB-DLBCL eller ABC-DLBCL enligt valfri immunhistokemisk algoritm (WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. IARC 2017).
Nya diagnostiska tekniker för karakterisering av DLBCL är under snabb utveckling. En sannolikt mer exakt metod för GCB- eller ABC-klassificering är tekniker för genuttrycksprofilering, vilka kan utföras på formalinfixerat material, 50 liksom för molekylär klassificering 49. Det kliniska värdet av sådan profilering är dock ännu inte klarlagt och tekniken används ännu inte i klinisk rutin. Motivet bakom subtypning är att ett antal nya läkemedel enbart har effekt vid vissa subtyper, t.ex. lenalidomid och ibrutinib vid ABC-DLBCL.
Ytterligare analyser:
- Immunhistokemi för CD30, CD23, ALK, BCL2, MYC, CD5, cyklin D1, p53, TdT (blastisk morfologi) och Ki-67 är av värde för kategorisering.
- För adekvat klassifikation enligt WHO 5 bör utredningen också kompletteras med FISH för påvisande av translokation av MYC och BCL2. Skälet är att dessa patienter i WHO-HAEM5 och även ICC kategoriseras som diffusa storcelliga B-cellslymfom/höggradiga B-cellslymfom med MYC- och BCL2-rearrangemang, och utgör en prognostiskt ogynnsam grupp där man ofta väljer intensifierad behandling. Det finns inga säkerställda sätt att identifiera dessa, men de representeras oftare av GCB-DLBCL. Då den prognostiska betydelsen av MYC- och BCL6-rearrangemang är svag, rekommenderas endast FISH för MYC- och BCL2-rearrangemang.
- Rekommendationen är därför att utföra FISH i samtliga fall hos patienter ≤ 70 år, och hos patienter > 70 år om behandlande kliniker så önskar.
- In situ-hybridisering för EBV-kodande RNA (EBER) kan göras eftersom EBV-positiv DLBCL utgör en distinkt histopatologisk entitet.
MYD88-mutation kan övervägas som tilläggsanalys för att möjliggöra målriktad behandling med BTK-inhibitor (Brutons tyrosinkinas).
En bredare genetisk profilering av tumörcellernas arvsmassa kan i vissa fall vara av värde för patientens fortsatta behandling inklusive medverkande i läkemedelsstudier. Inom Sverige utvecklas för närvarande en bred, nationellt utvecklad lymfatiska genpanel som inkluderar flera kända genetiska avvikelser. Det finns även andra kommersiella alternativ.
Rådgör med de lokala eller regionala genetik- eller patologilaboratorierna för vägledning om vilka genetiska avvikelser som kan vara värdefulla att analysera för fördjupad diagnostik. Om nödvändigt kan det lokala laboratoriet även bistå med att skicka prov för extern analys.
Prognosfaktorer
IPI från 1993 identifierar 5 kliniska variabler vid diagnos som oberoende faktorer för överlevnad hos patienter med aggressiva lymfom som behandlas med doxorubicin-innehållande behandling:
- stadium III/IV
- förhöjt LD-värde
- funktionsstatus (ECOG/WHO) 2–4
- ålder > 60 år
- > 1 extranodalt organ.
Utifrån dessa identifierades fyra riskgrupper med en estimerad 5-årsöverlevnad på mellan 73 % (0–1 faktorer) och 26 % (4–5 faktorer).
För patienter över 60 år utvecklades aaIPI, vilket innehåller tre oberoende faktorer:
- stadium III/IV
- förhöjt LD-värde
- funktionsstatus (ECOG/WHO) 2–4.
Därur identifierades 4 prognostiska grupper med 5-årsöverlevnad på mellan 83 % (0 faktorer) och 32 % (3 faktorer). aaIPI-modellen visade sig även vara applicerbar för patienter yngre än 60 år 23 och är det prognostiska instrument som vi valt att använda för behandlingsrekommendationerna nedan.
Primära extranodala lymfom som stadieindelas enligt Musshoff kan översättas till motsvarande Ann Arbor-stadium vid applicering av aaIPI-modellen och behandlingsrekommendationer (t.ex. räknas Pe1 som Ann Arbor I) om inget annat gäller. I detta sammanhang är det dock viktigt att tänka på att extranodalt engagemang i benmärg, lever, CNS eller pleura, nodalt engagemang i lunga eller disseminerat engagemang i extranodal lokal, alltid ska räknas som Ann Arbor stadium IV 24. Vissa extranodala lokaler är också associerade med en högre risk för CNS-återfall, vilket påverkar behandlingsrekommendationerna. Se avsnitt 11.3.3 aaIPI = 2 (patienter <80 år).
Primär behandling
Primärbehandlingen för DLBCL delas in enligt aaIPI. I texten förekommer också hänvisning till IPI. För beskrivningar av dessa, se avsnitt 9.2 Kliniska prognosfaktorer(IPI). Lymfom med rearrangemang av MYC och BCL2 behandlas enligt höggradiga B-cellslymfom, se Kapitel 12 Höggradigt B-cellslymfom. Inför behandlingsstart bör det alltid övervägas om patienten kan inkluderas i en klinisk studie.
Figur 1. Behandlingsalgoritm för primärbehandling av DLBCL
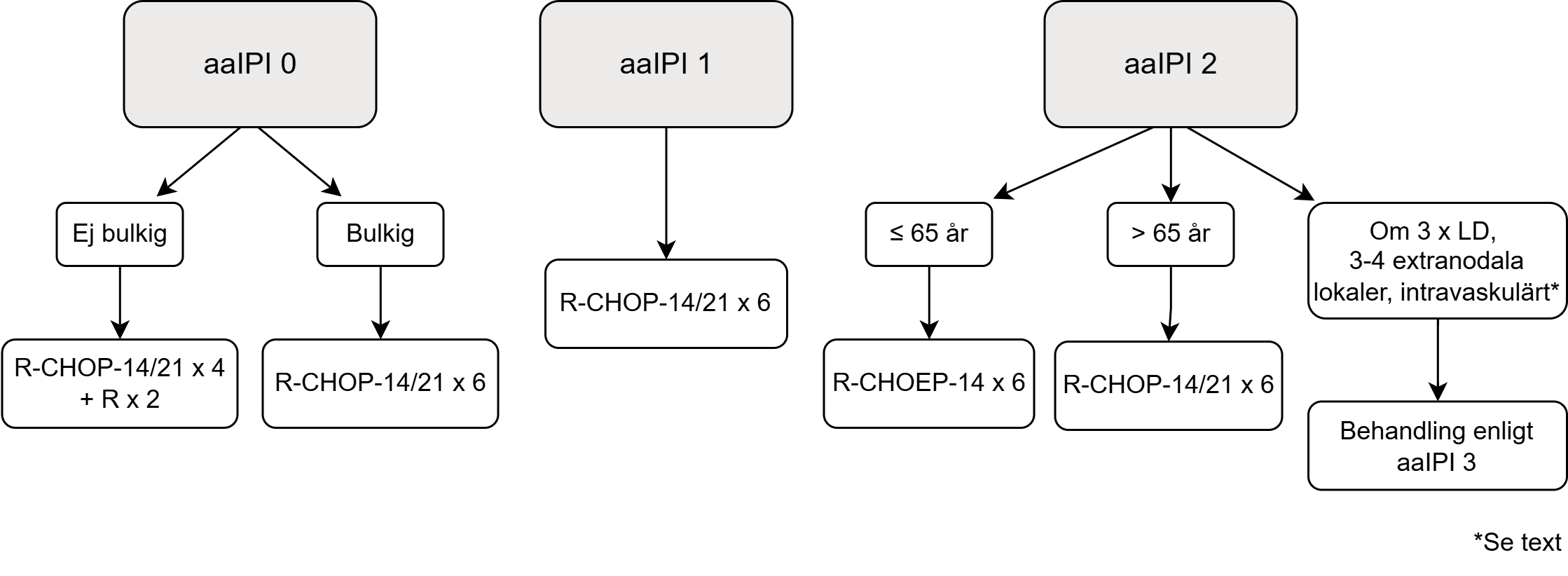
aaIPI = 0 (patienter <80 år)
Rekommenderad behandling
R-CHOP-21 x 4 + 2 x rituximab är enbart studerat för patienter upp till 60 år, men arbetsgruppen anser att det är ett gott alternativ även för äldre patienter 56. Vi anser också att R-CHOP-14 x 4 + 2 x rituximab bör utgöra ett likvärdigt alternativ. R‑CHOP-21 x 6 rekommenderas som förstahandsval för patienter med bulkig sjukdom. Patienter som önskar en kortare behandlingsperiod kan dock erbjudas R-CHOP-14.
aaIPI = 1 (patienter <80 år)
Två randomiserade jämförelser av R-CHOP-14 och R-CHOP-21 har visat jämförbara resultat mellan dessa två regimer (++++) 5758. Kortare behandlingstid kan dock motivera 14‑dagarsregimen. Valet avgörs av lokala traditioner och av vad som bedöms som mest gynnsamt för den enskilda patienten. I de randomiserade studierna har 8 cykler R-CHOP-21 givits. Data från svenska och danska lymfomregistren visar inte någon skillnad mellan 6 och 8 cykler, och 6 cykler dominerar helt i klinisk praxis, även internationellt, varför detta utgör gruppens rekommendation 59. I ovanstående studier gavs 6 cykler R-CHOP-14, men totalt 8 doser rituximab. I klinisk praxis ges dock enbart 6 doser, och detta är därför gruppens rekommendation.
R-ACVBP har i en randomiserad studie för patienter under 60 år uppvisat förbättrad progressionsfri och total överlevnad jämfört med R-CHOP-21. Evidensen är dock otillräcklig för att rekommendera denna regim som standardbehandling 60.
aaIPI = 2 (patienter <80 år)
Rekommenderad behandling
- ≤ 65 år:
- R-CHOEP-14 x 6 (++)
- 65–80 år:
- R-CHOP-14 x 6 eller R-CHOP-21 x 6 (+++)
Patientgruppen med aaIPI = 2 är heterogen, och kräver ofta individualiserad bedömning.
En del patienter över 65 år tolererar också etoposid i reducerad dos. Ett kliniskt dilemma är dock den stora patientgruppen med aaIPI 2–3 över 65 år som inte tolererar intensifierad behandling. För patienter med DLBCL med IPI 2-5, visar fas 3-studien POLARIX att polatuzumab-vedotin + R-CHP kan ge en signifikant förbättrad progressionsfri överlevnad jämfört med R-CHOP 61. Subgruppsanalyser talar för att den förbättrade progressionsfria överlevnaden är särskilt uttalad för patienter över 60 år, för patienter med IPI 3-5 och för patienter med DLBCL med ABC-fenotyp. Liknande resonemang kan föras med utgångspunkt i fas 3-studien REMoDL, där tillägg av bortezomib till R-CHOP signifikant förbättrar total överlevnad hos patienter med ABC-fenotyp 62. Då det för närvarande inte finns implementerade diagnostiska metoder för att analysera ABC-fenotyp (i den immunhistokemiska gruppen ”non-GCB” enligt Hans-algoritmen är upp till cirka 40 % av patienterna inte ABC) är det tyvärr ännu inte möjligt att rekommendera dessa tillägg i dagsläget.
Vissa högriskfaktorer kan motivera behandling enligt aaIPI 3, vilket särskilt bör övervägas för patienter med intravaskulärt lymfom (se avsnitt 17.6 Intravaskulärt storcelligt B-cellslymfom), tredubblat LD (30), eller tre eller flera extranodala lokaler.
Likaså har engagemang av njure/binjure, testis och uterus 6364 visats medföra extra hög risk för återfall i CNS, och kan även det motivera behandling enligt aaIPI 3.
Patienter med CD5+ DLBCL 65, TP53-deletion 66 och DLBCL med IgM M-komponent kan också utgöra separata högriskgrupper, även om data här är än mer begränsade 67.
Figur 2. Behandlingsalgoritm för patientgruppen med aaIPI = 3
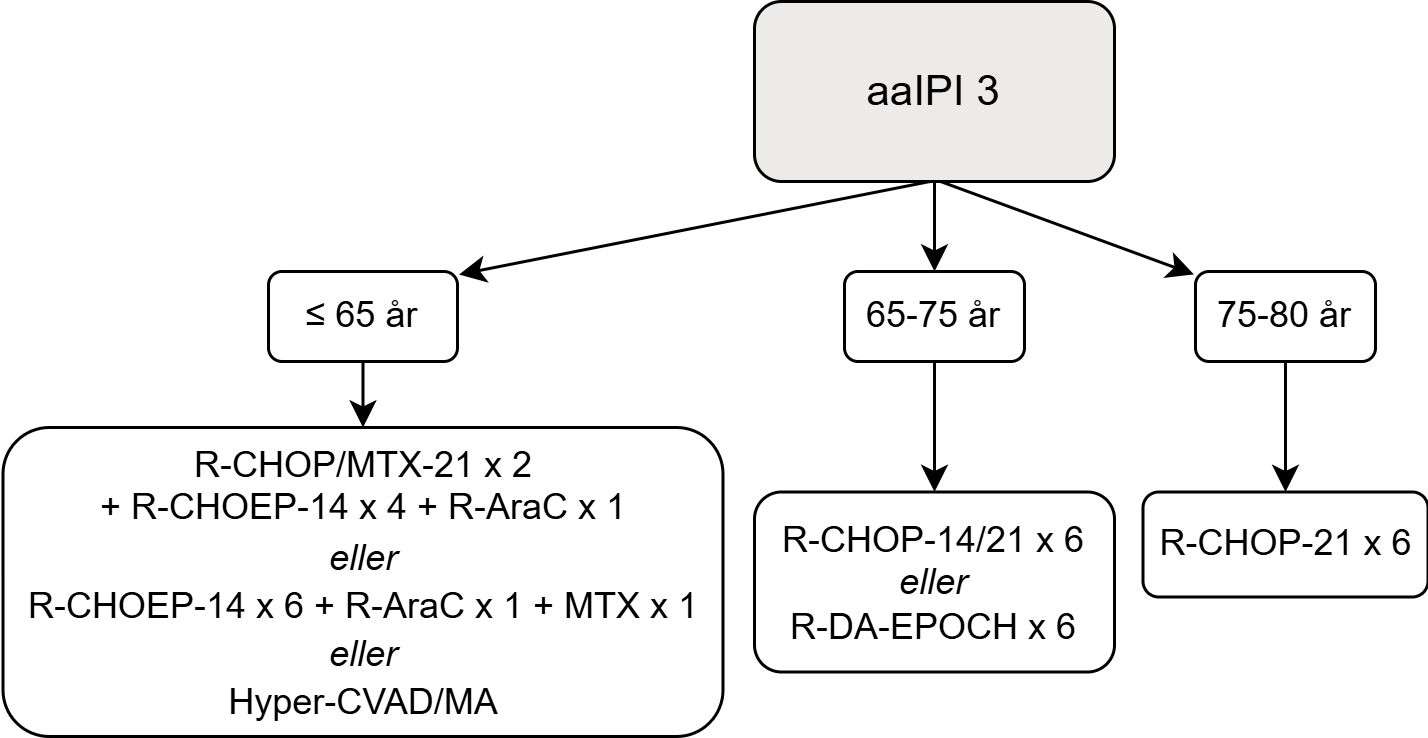
aaIPI = 3 (patienter <80 år)
Rekommenderad behandling
- ≤ 65 år:
- R-CHOP/metotrexat-21 x2 + R-CHOEP-14 x 4 + R-ARAC x 1 (++)
eller R-CHOEP-14 x 6 + R-ARA-C-14 x 1+ metotrexat x 1 (++)
eller R-hyperCVAD-MA (+)
- R-CHOP/metotrexat-21 x2 + R-CHOEP-14 x 4 + R-ARAC x 1 (++)
- 65–75 år:
- R-CHOP-21 x6, R-CHOP-14 x 6 eller R-DA-EPOCH x 6 (+)
- 75–80 år:
- R-CHOP-21 x 6 (+++)
Evidensen för när metotrexat ska ges under behandling är svag. I första hand rekommenderas metotrexat efter avslutad R-CHOP/R-CHOEP, men kan även ges dag 9–15 i kur 1 och 2, enligt CHIC-protokollet 68. Metotrexat kan också ges tillsammans med ARAC enligt R-hyperCVAD/MA.
Dosering av metotrexat och cytarabin i kombination med R-CHOP/R-CHOEP
Metotrexat ges i dosen 3 000 mg/m2 i v, under 3 timmar, med kalciumfolinatrescue, start dag 9–15 i de första 2 behandlingscyklerna, eller som avslutande konsolidering.
Cytarabin (ARAC) ges i dosen 3 000 mg/m2, intravenöst under 1 timme, 2 doser per dygn i 2 dagar, 14 dagar efter avslutad induktionsbehandling. Patienter 60–65 år får 2 000 mg/m2.
Vid beslut om behandling med metotrexat och cytarabin bör toxicitet noggrant vägas mot behandlingsvinst, och dosreduktion får övervägas vid njurpåverkan och hos äldre patienter.
En jämförelse av två nordiska fas 2-studier (CRY 04 och CHIC), indikerar att progressionsfri överlevnad förbättras genom att högdos metotrexat ges tidigt under behandlingen (enligt CHIC) 66. Högdos metotrexat och cytarabin bidrar enligt dessa studier både till ett lägre antal CNS-återfall och till ett lägre antal återfall totalt, även om en formell jämförelse mellan studierna försvåras av att de genomfördes under olika tidsperioder. En brittisk retrospektiv studie visade dock ingen skillnad i CNS-återfall eller överlevnad mellan metotrexat givet tidigt under behandling eller metotrexat givet efter avslutad R-CHOP-baserad behandling 69.
En retrospektiv global studie av 2 300 DLBCL-patienter med CNS-IPI 4–6, visade ingen effekt av högdos metotrexat avseende CNS-återfall 70. Evidensen för att högdos metotrexat förebygger CNS-återfall bedöms därför som svag. I nuläget kan det dock inte uteslutas att intensifierad behandling med metotrexat och cytarabin minskar risken för återfall/CNS-återfall i högriskgrupper, och/eller förlänger progressionsfri överlevnad.
Populationsbaserade studier från såväl Danmark som Sverige indikerar att tillägg av etoposid förbättrar överlevnad, varför R-CHOEP-14 förordas till yngre patienter 717273. En svensk retrospektiv registerstudie visar dessutom ytterligare förbättring av överlevnad genom tillägg av högdos metotrexat och cytarabin 74.
Patienter som inte bedöms kunna tolerera metotrexat i ovanstående dosering, rekommenderas behandling enligt aaIPI = 1. En tendens till förbättrad progressionsfri överlevnad hos subgrupper med IPI 3–5, behandlade med R-DA-EPOCH jämfört med R-CHOP, sågs i Bartlett, JCO 2019 75. R-DA-EPOCH kan därför övervägas som ett alternativ till äldre patienter med aaIPI = 3, enligt ovan.
Särskild behandling för speciella patientgrupper
Rekommenderad behandling
- Nedsatt allmäntillstånd:
- Förbehandling med högdos steroider och allopurinol under 5–7 dygn (+).
- Nedsatt hjärtfunktion:
- Optimering av medicinsk behandling innebär ett skydd (+++).
- Infusionstiden av doxorubicin kan förlängas (+++).
- CEOP kan användas i stället för CHOP men innebär ökad risk för återfall i lymfomsjukdomen (++).
- Ålder > 80 år:
- R-miniCHOP x 6 (++).
- Testisengagemang:
- Metotrexat intratekalt och intravenöst med dos som är anpassad till ålder samt strålbehandling av skrotum och kontralateral testikel som tillägg till standardbehandling (+).
- Primärt CNS-engagemang:
- För yngre (< 65 år) MATRix x 3 + R-IKE x 3 (++).
- Konsolidering med högdosbehandling, karmustin/tiotepa med autologt stamcellsstöd (+).
Konsoliderande strålbehandling
Skelettengagemang
Vid skelettengagemang, i synnerhet vid begränsad sjukdomsutbredning, utgör konsoliderande strålbehandling med 30 Gy, med 2 Gy/fraktion, ett behandlingsalternativ (++). Indikation saknas dock vid komplett remission enligt PET.
Bulkig sjukdom
Vid initialt bulkig sjukdom (> 7,5 cm), utgör konsoliderande strålbehandling till initialt involverad sjukdom med 30–36 Gy, med 2 Gy/fraktion, ett behandlingsalternativ (++). Indikation saknas dock vid komplett remission enligt PET.
Nedsatt allmäntillstånd
Till patienter med nedsatt allmäntillstånd till följd av lymfomsjukdomen, liksom till alla patienter > 65 år, bör förbehandling med högdos steroider (dosering så som i CHOP) och allopurinol, ges i 5–7 dygn. (+) 76.
Nedsatt hjärtfunktion
Om risken för doxorubicinorsakad kardiomyopati ligger till grund för att överväga modifiering av lymfombehandlingen bör patienten genomgå kardiologisk bedömning och medicinsk optimering inför behandling. Skälet är att adekvat behandling med angiotensinkonvertashämmare och betablockad kan ge effektivt skydd.
Till patienter med nedsatt vänsterkammarfunktion kan infusionstiden för doxorubicin förlängas till > 6 timmar (+++) 7778, alternativt kan regimen DA-EPOCH, utan etoposid, användas (+) 75. Vid uttalad risk för allvarlig doxorubicinorsakad kardiomyopati kan R-CHOP ersättas med R-CEOP (++). Risken för kardiomyopati måste då vägas mot en tydligt ökad risk för återfall av lymfomsjukdomen vid användning av CEOP 798081.
Ålder >80 år
För denna patientgrupp måste hänsyn tas till samtidig samsjuklighet vid beslut om behandlingsintention och regim.
Publicerade resultat med dosreducerad R‑CHOP, s.k. R‑miniCHOP x 6, uppvisar god behandlingseffekt och hög tolerabilitet 82. I denna regim ges 50 % dos av vinkristin och doxorubicin, samt cyklofosfamid 400 mg/m2 (++).
Testisengagemang
Patienter med testisengagemang bör genomgå orkektomi. Behandling enligt aaIPI = 3 ges (se avsnitt 11.3.4). För patienter 65–75 år bör 4 doser metotrexat ges intratekalt (i samband med dag 1 R‑CHOP i 4 separata cykler). Vid adekvat njurfunktion även 2 doser metotrexat ges intravenöst, 1,5–3 g/m2, 3 timmars infusionstid och kalciumfolinatrescue, med 14 dagars intervall efter standardbehandlingen 83. Strålbehandling mot skrotum och kvarvarande testikel, 30 Gy på 15 fraktioner, ges efter avslutad cytostatikabehandling (+).
Primärt CNS-engagemang
Dessa patienter behandlas enligt studien MARIETTA 84 med MATRix x 3 följt av R‑IKE x 3 (++). Studieprotokollet medgav behandlingsstart med 1–2 cykler R‑CHOP före start av MATRix om sjukdomen utanför CNS initialt bedömdes vara prioriterad. För patienter i det övre åldersintervallet för MATRix kan regimen dosjusteras genom minskad dos eller uteslutande av cytarabin. I regimen ingår också intrathecal trippel dag 5 i varje behandlingscykel.
Det finns även erfarenhet av att använda regimer som föreslagits under Burkittlymfom (BFM‑2004 eller R‑hyperCVAD‑MA) (+). För äldre patienter (> 65 år) kan behandling ges med R-CHOP-21 med tillägg av metotrexat 3 000 mg/m2 intravenöst, i 3 timmar, dag 9–15, med kalciumfolinatrescue. Detta tillägg ges vid de 4 första behandlingscyklerna (+).
Konsolidering med CNS-penetrerande högdosbehandling, karmustin/tiotepa, med autologt stamcellsstöd, bör ges om utvärdering visar minst partiell remission i CNS (++) 84. I avsaknad av relevant samsjuklighet, eller vid minimal sådan, kan konsolidering med högdosbehandling ofta övervägas om patienten är över 70 år.
Behandling av första återfall
Rekommenderad behandling av första återfall
Kurativ inriktning:
- Tidigt återfall (< 12 månader) eller primärt refraktär sjukdom:
- CAR-T (axikabtagen-ciloleucel eller lisokabtagen-maraleucel) (+++).
- Sent återfall:
- R-GDP, R-DHAP, R-DHAX, R-IKE, och vid respons, konsoliderande högdosbehandling med autologt stamcellsstöd (+++).
- Patienter som inte är aktuella för högdosbehandling:
- R-GEMOX, pola-R-bendamustin, R-IME (++).
Symtomlindrande:
- Lokal strålbehandling.
- Cyklofosfamid, klorambucil.
Figur 3. Behandlingsalgoritm för första återfall av DLBCL
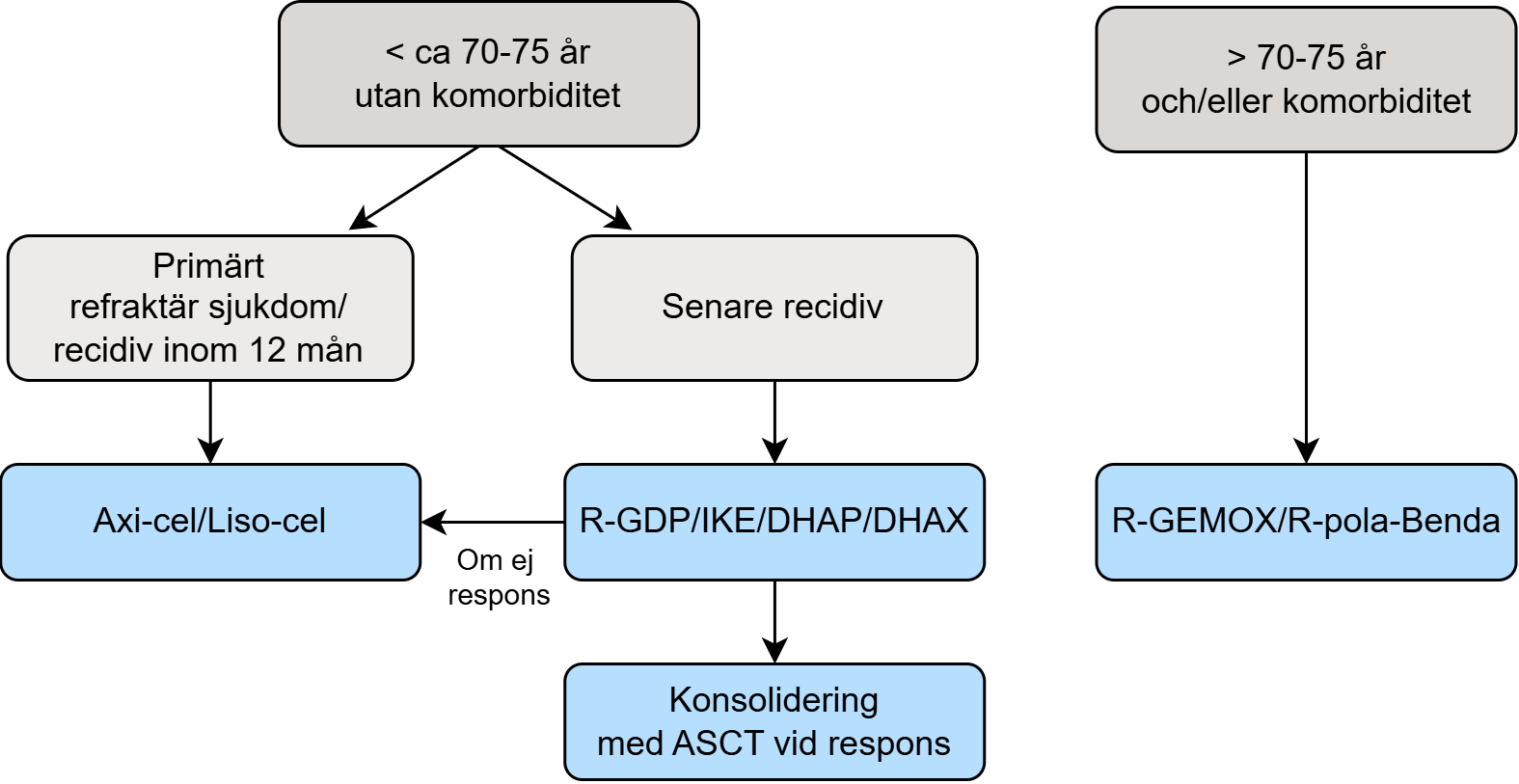
Kurativt syftande behandling
Detta gäller patienter yngre än ca 70 år (högdosbehandling) och ca 75 år (CAR‑T), där hänsyn också tas till funktionsstatus och förekomst av komplicerande sjukdomar:
- Ett återfall bör i denna situation bekräftas morfologiskt, om möjligt med kirurgisk biopsi.
- PET-DT bör användas vid responsbedömning, då en exakt bedömning av respons ofta är avgörande för fortsatt behandlingsval.
Tidigt återfall – CAR-T
Detta gäller patienter med primärt refraktär sjukdom, eller återfall inom 12 månader efter avslutad primärbehandling.
Dessa patienter bör så snart som möjligt tas upp på nationell CAR-T MDK (multidisciplinär konferens) för beslut om leukaferes och bridging inför CAR-T (se Kapitel 18 CAR-T-cellsbehandling vid aggressiva B-cellslymfom).
Sent återfall – behandling med inriktning mot högdosbehandling med autologt stamcellsstöd
Vid kurativ intention bör andra linjens cytostatikabehandling ges, med R-GDP (+++) 85, R‑DHAP (+++), R-DHAX (++) 86, eller R-IKE (+++) 87. Effektmässigt är dessa alternativ likvärdiga. R-GDP är dock associerad med lägre toxicitet. Detta gäller om patienten förväntas tolerera konsolidering med högdosbehandling med stamcellsstöd (++++) 88.
Om patienten fått rituximab < 6 månader före återfall kan detta uteslutas ur regimen (+) 89.
Alla patienter som vid utvärdering efter 2 cykler uppvisar sensitiv sjukdom och är cirka 70 år bör övervägas för högdosbehandling (BEAM). Totalt ges 3–4 cykler före högdosbehandling.
Schema för stamcellsmobilisering
Nedanstående schema utgör ett förslag, men om lokala föreskrifter finns bör dessa gälla i första hand.
|
Mobiliseringsregim |
Startdag (dag 1) |
Beräknad skördedag |
|
CHOP |
Fredag |
Tisdag (dag 12) |
|
Cyklofosfamid |
Lördag |
Tisdag (dag 11) |
|
Cytarabin (2 dagar) |
Torsdag |
Tisdag (dag 13) |
|
IKE |
Onsdag |
Tisdag (dag 14) |
|
IME |
Onsdag |
Tisdag (dag 14) |
|
DHAP |
Torsdag |
Tisdag (dag 13) |
|
CHOEP |
Torsdag |
Tisdag (dag 13) |
|
DA-EPOCH |
Onsdag |
Tisdag (dag 14) |
|
GDP |
Torsdag |
Tisdag (dag 13) |
|
MVP (utan prokarbazin) |
Lördag |
Tisdag (dag 11) |
|
G-CSF enbart |
Fredag |
Tisdag (dag 5) |
Granulocytkolonistimulerande faktor (G-CSF) 10 μg/kg x 1 ges subkutant från dag 5. Vid mobilisering av stamceller efter R-GDP rekommenderas start av G‑CSF dag 9. G‑CSF pågår tills skörden är avslutad. Pegfilgrastim bör inte användas. Vid otillräcklig mobilisering (definierad som CD34+ celler i blod < 10/μl vid LPK > 4,0), överväg tillägg av 1 dos injektion plerixafor 0,24 mg/kg subkutant till natten (ges cirka kl. 23), dvs. 6–11 timmar före planerad aferes. Om effekten inte är tillräcklig kan ytterligare 1 dos plerixafor övervägas inför ytterligare 1 dags skörd.
Patienter som inte är aktuella för kurativt syftande behandling
Detta avser patienter som inte är aktuella för CAR‑T eller högdosbehandling, men som är i gott allmäntillstånd.
Inför behandlingsstart bör det alltid övervägas om patienten kan inkluderas i en klinisk studie.
Följande regimer rekommenderas för denna grupp: R‑GEMOX (++) 909192, polatuzumab vedotin+R-bendamustin (++) 9394 och R‑IME/IMVP‑16 (+) 95. Någon inbördes prioritering mellan dessa regimer kan inte göras, utan de bedöms vara likvärdiga. Vid lokaliserad sjukdom kan konsoliderande strålbehandling ges (+).
Symtomlindrande behandling
Som symtomlindrande behandling rekommenderas lågtoxisk cytostatikabehandling, exempelvis cyklofosfamid, klorambucil, trofosfamid (licenspreparat) och steroider.
Ett annat alternativ är strålbehandling 4 Gy, med 2 Gy per fraktion 96. Vid otillräckligt svar på denna dos ges i stället 30 Gy i 15 fraktioner.
Behandling efter minst två behandlingslinjer
Patienter som erhållit två eller fler behandlingslinjer utgör en heterogen grupp (figur 4). Patienter som genomgått högdos cytostatikabehandling kan, om de är yngre än cirka 75 år, har gott funktionsstatus och inte har komplicerande sjukdomar, vara aktuella för kurativt syftande behandling i form av CAR-T (se Kapitel 18 CAR-T-cellsbehandling vid aggressiva B‑cellslymfom) (+++).
För patienter som genomgått CAR-T, eller icke-kurativt syftande kombinationsbehandling enligt avsnitt 11.5.2, rekommenderas inklusion i klinisk prövning, eller behandling med bispecifik CD3/CD20-antikropp (epkoritamab eller glofitamab) (++) 9798. För bägge preparaten rekommenderas tidsbegränsad behandling om ca 9 månader. Inför dessa behandlingar bör biopsi utföras för att fastställa CD20-uttryck.
I andra hand, eller vid CD20-negativ sjukdom, föreslås platinainnehållande kombinationscytostatikabehandling med inriktning mot ASCT enligt avsnitt 11.5.1.2.
Figur 4. Behandlingsalgoritm för senare återfall
Allogen stamcellstransplantation
Allogen stamcellstransplantation kan övervägas för patienter som är yngre än cirka 65–70 år med återfall efter CAR-T eller högdosbehandling, och med cytostatikakänslig sjukdom, där hänsyn också tas till funktionsstatus och förekomst av komplicerande sjukdomar, (++) 99. Det kan också övervägas när högdosbehandling inte är möjlig pga. utebliven mobilisering/skörd av autologa stamceller. Reducerad konditionering rekommenderas i denna situation. Resultaten är sämre vid primärt refraktär sjukdom. Det är viktigt att ta hänsyn till samsjuklighet, i synnerhet för äldre patienter.
Behandling av återfall i CNS
Återfall begränsat till CNS
Behandling bör ges på samma sätt som vid primärt CNS-lymfom.
Återfall samtidigt i CNS och systemiskt
I denna situation rekommenderas CAR-T-cellsbehandling i första hand, vid tidigt återfall (< 12 mån) eller primär refraktär sjukdom (se Kapitel 18 CAR-T-cellsbehandling vid aggressiva B‑cellslymfom).
För patienter som tidigare erhållit CAR-T föreslås behandling enligt MARIETTA, MATRIX x 3, efterföljt av R-IKE x 3, som induktion inför högdosbehandling 84 (++). För äldre patienter kan en mindre intensiv regim, t.ex. R‑MT eller R‑MPV, ges alternerande med något av alternativen i avsnitt 11.5.2 Patienter som inte är aktuella för kurativt syftande behandling (+).
Konsolidering med högdosbehandling med autologt stamcellsstöd för patienter ≤ 70 år (+) föreslås efter dessa bägge ovanstående situationer. Karmustin- och tiotepabaserad konditionering bör då användas (+) 100.
