Behandling av metastaserad sjukdom
Bakgrund
Cirka 1 500 patienter diagnostiseras med metastaserad bröstcancer (MBC) i år i Sverige. Vid diagnos av MBC betraktas sjukdomen som icke-botbar eller s.k. kronisk. Målet med onkologisk behandling vid MBC är att förlänga överlevnaden och samtidigt ge en god livskvalitet eller till och med att förbättra livskvaliteten om möjligt.
Det finns olika behandlingsmöjligheter som har lett till en förbättrad överlevnad för patienter över tid 1120, vilket man har noterat i Sverige också 1121. Tack vare nya behandlingsmöjligheter estimerar man att det finns cirka 6 000–7 000 patienter med MBC vid liv i Sverige 1122. Det är viktigt att poängtera att inklusion av patienter med metastaserad sjukdom i kliniska studier är avgörande så att patienter kan få nytta av nya behandlingsmöjligheter samtidigt som att man får bättre evidens kring nya behandlingen.
Kapitlet täcker alla behandlingsaspekter som berör behandling av MBC uppdelade i tre subtyper: hormonreceptor-positiv/HER2-negativ (0 eller 1+ enligt IHC eller 2+ samt amplifiering enligt ISH), HER2-positiv (2+ enligt IHC och samtidigt amplifiering enligt ISH eller 3+ enligt IHC) och trippelnegativ bröstcancer. Behandling av patienter med HER2-låg (1+ enligt IHC eller 2+ och samtidigt icke amplifiering enligt ISH) sjukdom diskuteras som en del av hormonreceptor-positiv/HER2-negativ samt trippelnegativ bröstcancer, eftersom HER2-låg sjukdomen inte utgör en klinisk eller biologisk distinkt subtyp utan snarare är en grupp som utmärker sig av en prediktiv biomarkör (HER2-låg) för specifika onkologiska behandlingar 1123. Två speciella kliniska situationer, hjärnmetastaserad bröstcancer samt oligometastatisk sjukdom, diskuteras separat i kapitlet.
Utredning och utvärdering av behandlingseffekt
Anamnes och status
- Anamnes och status tas på samtliga patienter.
Blodprover
- Blodstatus (Hb, leukocyter och trombocyter), serumkemi (Na, K, kreatinin, Ca, albumin) samt levervärden (LD, ALAT, ASAT, ALP och bilirubin) tas på samtliga patienter vid initiala utredningen.
- Tumörmarkör CA 15–3 kan användas som hjälp vid utvärdering av behandlingseffekt vid MBC speciellt om det inte går att utvärdera sjukdomen bildmässigt.
Bilddiagnostik
- I bilddiagnostiken utgör DT torax-buk förstahandsvalet. Skelettskintigrafi med SPECT eller SPECT/DT kan göras som screeningundersökning för att upptäcka skelettmetastaser.
- DT eller MRT av hjärnan utförs vid misstanke om hjärnmetastas, speciellt hög är risken för patienter med TNBC och HER2-positiv sjukdom och nyupptäckt metastasering.
- FDG PET-DT rekommenderas inte rutinmässigt för stadieindelning av bröstcancer utan bör användas när andra bilddiagnostiska metoder ger motsägelsefulla eller tveksamma resultat. Ett undantag är vid inflammatorisk bröstcancer där FDG PET-DT är förstahandsval för staging av patienter men även DT torax-buk-bäcken kan göras om det inte finns tillgång till FDG PET-DT.
Biopsi
- Biopsi bör i princip alltid genomföras vid klinisk eller radiologisk misstanke om återfallssjukdom.
- Biopsi ska genomföras vid ett isolerat återfall eller hos en patient med tidigare malignitet.
- Markörstatus (ER, PR och HER2) bör fastställas i metastasvävnaden eftersom markörer kan visa förändrat uttryck mellan primärtumör och metastas.
- Förnyad metastasbiopsi kan övervägas även vid konstaterad MBC vid atypisk behandlingsrespons på onkologisk behandling (t.ex. vid uttalad progress av en metastaslesion med regress i övriga lokalisationer eller snabb progress av en tidigare stillsam sjukdom).
Utvärdering av behandlingseffekt
- Behandlingseffekten ska regelbundet utvärderas utifrån tre aspekter: klinik (t.ex. smärta, andra symtom), blodprover (t.ex. leverstatus, CA153) samt bilddiagnostik.
Förutom anamnes och klinisk undersökning bör alla patienter med MBC undersökas med blodprover som åtminstone bör omfatta blodstatus (Hb, vita blodkroppar och trombocyter), serumkemi (Na, K, kreatinin, Ca, albumin) samt levervärden (LD, ALAT, ASAT, ALP, gGT och bilirubin).
Tumörmarkören CA 15–3 kan vara av värde för att bättre kunna utvärdera behandlingseffekten speciellt vid bildmässigt icke mätbar sjukdom, till exempel malign pleuraeffusion eller sklerotisk skelettmetastasering. Man bör vara försiktig med tolkning av ett stigande CA15–3 i avsaknad av kliniska eller bilddiagnostiska tecken till progress, och en ändring i behandlingsplan endast på grund av stigande CA15-3 bör undvikas 1124. Det finns inte tillräckligt med evidens som har bevisat klinisk nytta av andra biomarkörer i blodet (cirkulerande tumörceller 1125, ctDNA 1126) som en del av utvärdering vid MBC.
Bilddiagnostiken bör i första hand omfatta DT-buk vilket även ger möjlighet att bedöma centrala delar av skelettet. Skelettskintigrafi har ett värde för att identifiera skelettmetastaser och ska helst utföras med SPECT-teknik som gör att isotopupptaget kan visualiseras i 3D. SPECT- eller SPECT/DT-undersökning med fynd som vid multipel skelettmetastasering anses diagnostiskt, medan enstaka eller oklara upptag som kan orsakas av metastaser bör vidare utredas med MRT. FDG PET-DT eller MRT har visat sig ha högre exakthet för att identifiera skelettmetastaser jämfört med skelettskintigrafi 1127.
DT eller MRT av hjärnan utförs vid klinisk misstanke om hjärnmetastaser. Patienter med trippelnegativ och HER2-positiv bröstcancer har en större risk att utveckla CNS-metastasering tidigt i förloppet av MBC, och man bör vara extra uppmärksam på symtom som skulle tyda på CNS-metastasering hos patienter med dessa subtyper.
FDG PET-DT rekommenderas inte rutinmässigt vid stadieindelning av bröstcancer utan bör användas när andra bilddiagnostiska metoder ger motsägelsefulla eller tveksamma resultat. Ett undantag är hos patienter med inflammatorisk bröstcancer (eventuellt vid lokalt avancerad bröstcancer också) där FDG PET-DT har visat kunna identifiera flera patienter med MBC jämfört med konventionell DT (23 % vs 11 %) i en randomiserad studie som inkluderade 369 patienter med bröstcancer 1128. FDG PET-DT är också motiverat när man önskar säkerställa att det enbart rör sig om ett lokoregionalt återfall eller en isolerad fjärrmetastas inför försök till en lokalt radikal behandling 1124.
Biopsi av metastaser bör utföras rutinmässigt för att verifiera MBC och för att utesluta annan malignitet eller benign sjukdom 1129. Analysen av markörer ska utföras på vävnadsmaterialet eftersom förändrad ER-/PR-status jämfört med primärtumören förekommer i upp till en tredjedel av fallen samt upp till 20 % för HER2, vilket leder till förändrad handläggning av var 6:e till 7:e patient 1130. Det är rimligt att avstå från biopsi för patienter med betydande samsjuklighet där de eventuella vinsterna med vävnadsanalys inte bedöms överstiga riskerna. Biopsi ska dock givetvis i princip alltid genomföras för dem som har ett isolerat återfall eller anamnes på en annan malignitet utöver bröstcancer.
Behandlingsprinciper vid hormonreceptor-positiv/HER2-negativ MBC
Sammanfattning
- Kombinationen icke-steroidal AI och CDK 4/6-hämmare (abemaciklib, palbociklib, ribociklib) ger statistiskt signifikant längre progressionsfri (ribociclib, abemaciklib, palbociclib) och total överlevnad (ribociclib) än AI enbart (++++).
- Kombinationen fulvestrant och CDK 4/6 (abemaciklib, palbociklib, ribociklib) ger statistiskt signifikant längre progressionsfri överlevnad och total överlevnadsvinst (ribociclib, abemaciklib) än fulvestrant (++++).
- Vilken sekvens man ger CDK 4/6-hämmare (första linjen med CDK 4/6-hämmare + AI => fulvestrant vid progress eller första linjen med AI => CDK 4/6-hämmare + fulvestrant) verkar inte påverka progressionsfri överlevnad efter 2 linjer och total överlevnad i en randomiserad studie (+++).
- För premenopausala kvinnor med återfall i hormonreceptorpositiv bröstcancer är AI/TAM + GnRH-analogt förstahandsalternativ (+++). Tillägg av CDK 4/6-hämmare med ribociclib ger en signifikant förbättrad överlevnad i en randomiserad studie dedikerad till premenopausala kvinnor (+++). Premenopausala kvinnor ingick i övriga pivotala studier med CDK 4/6-hämmare med liknande resultat som vid postmenopausala kvinnor (++++).
- CDK 4/6-hämmare plus AI leder till längre progressionsfri överlevnad jämfört med cytostatikabehandling som första linjens behandling hos patienter med stor tumörbörda, visceral sjukdom inklusive patienter med visceral kris (+++).
- För patienter som har nytta av endokrin behandling kan flera linjers behandling prövas med följande alternativ: TAM, AI (anastrozol, letrozol och exemestan), fulvestrant och gestagener (megestrolacetat) (+++ till ++++).
- Hos patienter med avancerad ER-positiv/HER2-negativ bröstcancer, PIK3CA-mutation och progression på tidigare behandling med aromatashämmare, ger tillägget av PI3K-hämmaren alpelisib till fulvestrant en signifikant förlängd progressionsfri överlevnad i jämförelse med enbart fulvestrant (+++).
- Postmenopausala kvinnor som har progredierat efter icke-steroidal AI ger behandling med examestan i kombination med everolimus en signifikant förlängd progressionsfri överlevnad men inte total överlevnad (+++). Även everolimus i kombination med TAM (++) eller fulvestrant (++) har visat sig vara effektiv i mindre randomiserade studier.
- Hos patienter med BRCA-muterad MBC som tidigare har fått minst 1 linje systemisk behandling ger behandling med PARP-hämmare (olaparib, talazoparib) en signifikant längre progressionsfri överlevnad jämfört med standardcytostatikabehandling med lägre risk för biverkningar (ESMO-MCBS: 4; ++++). Endast talazoparib är subventionerad för denna indikation i Sverige.
- Trastuzumab deruxtekan leder till en förbättrad progressionsfri och total överlevnad jämfört med cytostatika (kapecitabine, eribulin, gemcitabin, paklitaxel eller nab-paklitaxel) hos patienter med HER2-låg MBC som har progredierat på minst 1 linje cytostatikabehandling eller inom 6 månader från avslutad adjuvant cytostatika (ESMO-MCBS: 4; +++).
- Sacituzumabgovitekan leder till en förbättrad progressionsfri och total överlevnad jämfört med cytostatikabehandling (eribulin, kapecitabin, vinorelbin eller gemcitabin) hos patienter med hormonreceptor-positiv/HER2-negativ MBC som har fått hormonbaserad behandling och minst två ytterligare systemiska behandlingar för avancerad sjukdom (ESMO-MCBS:4; +++).
- Elacestrant (oral selective estrogen receptor degrader; SERD) leder till en förbättrad progressionsfri överlevnad jämfört med annan endokrin behandling hos postmenopausala kvinnor med hormonreceptor-positiv/HER2-negativ MBC och aktiverad ESR1-mutation som har progredierat efter minst en linje endokrin behandling i kombination med CDK 4/6-hämmare (ESMO-MCBS: 3; +++). Medicinen är godkänd av EMA men tillhandahålls i nuläget inte i Sverige.
- Capivasertib (AKT-hämmare) i kombination med fulvestrant leder till en förbättrad progressionsfri överlevnad jämfört med enbart fulvestrant hos patienter med hormonreceptor-positiv/HER2-negativ MBC och minst en aktiverad mutation i PI3K/AKT-signalväg (PIK3CA, AKT eller PTEN) som har progredierat efter minst en linje endokrin behandling med eller utan CDK 4/6-hämmare. Medicinen är godkänd av EMA men subventioneras inte i Sverige.
- Datopotamab deruxtecan leder till en förbättrad progressionsfri överlevnad jämfört med cytostatikabehandling (eribulin, vinorelbin, kapecitabin, eller gemcitabin) hos patienter med hormonreceptor-positiv/HER2-negativ MBC som har fått hormonbaserad behandling och minst en systemisk behandling med cytostatika för avancerad sjukdom. Medicinen är inte godkänd av EMA än.
Första linjens behandling
- Förstahandsval är CDK 4/6-hämmare (ribociclib (ESMO-MCBS: 4) i första hand, abemaciklib (ESMO-MCBS: 3) eller palbocliclib (ESMO-MCBS: 3) i andra hand, plus aromatashämmare alt fulvestrant (om återfall inom 12 månader från avslutad adjuvant endokrin behandling med aromatashämmare) för patienter som bedöms kunna tåla kombinationen. Hos premenopausala kvinnor ger man samma behandling med tillägg av GnRH-analog (ESMO-MCBS för ribociclib: 5; ESMO-MCBS för abemaciklib: 3; ESMO-MCBS för palbociclib: 3).
- Endast aromatashämmare är ett rimligt alternativ som första linjens behandling i utvalda patientfall, såsom patienter med liten tumörbörda, lång sjukdomfri intervall (> 60 mån) efter tidigare adjuvant hormonbehandling och för patienter som bedöms tveksamma till att tåla CDK 4/6-hämmare. Om återfall inom 12 månader från avslutad adjuvant hormonbehandling med aromatashämmare är även fulvestrant som singelbehandling ett alternativ för patienter som inte är kandidater för CDK 4/6-hämmare.
- CDK4/6-hämmare plus endokrin behandling är förstahandsval jämfört med cytostatika även vid visceral kris om det behandlingsalternativet inte har givits tidigare och sjukdomen inte bedöms som endokrinresistent.
- Vid val av cytostatika som första linjens behandling rekommenderas singelbehandling framför kombinationsbehandling. Den senare kan vara aktuell om man vill öka chans till tumörkrympning, men den påverkar inte överlevnad.
- Hos patienter med hormonreceptorpositiv bröstcancer där man har valt cytostatikabehandling som första linjens behandling och uppnått en bra behandlingseffekt men man kan inte fortsätta med behandlingen på grund av toxicitet bör man överväga underhållsbehandling med endokrin behandling.
Andra linjens behandling
- Patienter som fått AI som första linjens behandling bör få fulvestrant i kombination med CDK 4/6-hämmare (ribociclib (ESMO-MCBS: 4) eller abemaciklib (ESMO-MCBS: 4) eller palbocliclib (ESMO-MCBS: 4)). Fulvestrant i första hand alt. TAM kan också vara ett alternativ om CDK 4/6-hämmare inte anses vara lämplig.
- Hos patienter med PIK3CA-mutation och sjukdomsprogress efter endokrin behandling i singelbehandling bör man överväga fulvestrant i kombination med alpelisib (ESMO-MCBS: 2). Val av behandling mellan CDK 4/6-hämmare och alpelisib för den patientgruppen bör baseras på biverkningsprofil och förväntad tolerabilitet. Alpelisib plus fulvestrant kan övervägas hos patienter med PIK3CA-mutation och sjukdomsprogress efter kombination av CDK 4/6-hämmare och aromatashämmare, men evidens för denna behandlingssekvens är lägre än vid behandling efter endokrin behandling i singelbehandling.
- Cytostatika kan övervägas i den behandlingslinjen om det finns tecken till visceral kris och patienten har fått progress på första linjens behandling med endokrin behandling plus CDK 4/6-hämmare eller vid primär hormonresistens (återfall inom 24 månader efter start av adjuvant endokrin behandling, alt. inom 6 månader under första linjens behandling med CDK 4/6-hämmare innehållande kombination).
Tredje eller senare linjens behandling
- Endokrinbehandling som singelbehandling med ett behandlingsalternativ som inte är givet tidigare (TAM, aromatashämmare, fulvestrant, megestrolacetat) kan vara ett alternativ hos patienter som tidigare har svarat på endokrin behandling eller de som inte anses lämpliga för cytostatikabehandling.
- Om första eller andra linjens behandling innehållit en icke-steroidal AI kan exemestan i kombination med everolimus ses som ytterligare ett alternativ i tredje linjens behandling hos patienter som tidigare har svarat på endokrin behandling eller de som anses inte lämpliga för cytostatikabehandling (ESMO-MCBS: 2). Det finns visst stöd för att kombinera everolimus med TAM eller fulvestrant om någon av dessa hormonella behandlingar inte är givna tidigare.
- Talazoparib (ESMO-MCBS: 4) är förstahandsval före cytostatikabehandling hos patienter med germline BRCA-mutation. Talazoparib kan övervägas som andra linjens behandling också om sjukdomen har progredierat på adekvat första linjens hormonbehandling.
- Cytostatikabehandling är ett rimligt behandlingsalternativ i den tredje behandlingslinjen. Cytostatikabehandling bör ges med längre duration eftersom det ger en längre progressionsfri överlevnad samt total överlevnad än samma cytostatika med kortare duration. En risk-nytta värdering vid varje behandlingsutvärdering bör genomföras på alla patienter under pågående cytostatikabehandling.
- Trastuzumab deruxtecan rekommenderas hos patienter med HER2-låg bröstcancer som tidigare fått kemoterapi för metastaserad sjukdom (ESMO-MCBS: 4). För patienter med sjukdomsrecidiv under eller inom 6 månader efter avslutad adjuvant kemoterapi rekommenderas trastuzumab deruxtecan i stället för cytostatikabehandling när indikation för cytostatika föreligger.
- Sacituzumabgovitekan rekommenderas hos patienter som har fått endokrinbaserad behandling och minst två ytterligare systemiska behandlingar för avancerad sjukdom. För patienter med sjukdomsrecidiv under eller inom 12 månader efter avslutad adjuvant kemoterapi räcker det med progress under en systemisk behandling med kemoterapi vid spridd sjukdom för att kunna erbjuda sacituzumabgovitekan.
- Cytostatika med god dokumentation kring effektivitet vid MBC är antracykliner, taxaner, kapecitabin, eribulin, vinorelbin och i något mindre utsträckning gemcitabin.
- Följande allmänna principer kring val av cytostatikabehandling hos patienter med hormonreceptor-positiv/HER2-negativ bröstcancer gäller:
- Antracykliner (singelbehandling eller EC eller liposomalt doxorubicin) eller taxaner om dessa läkemedel inte har givits tidigare vid neo-/adjuvant situation är förstahandsval. Kapecitabin är ett väl beprövat behandlingsalternativ i tidiga behandlingslinjer.
- Antracykliner, taxaner eller kapecitabin kan användas i senare linjer också om de inte har använts tidigare eller om sjukdomen inte har progredierat på tidigare behandling. Eribulin har visat en förbättrad överlevnad jämfört med andra icke-taxan och icke-antracyklinbaserade cytostatika i senare behandlingslinjer. Andra alternativ är vinorelbin och gemcitabin i kombination.
- Patienter med MBC som svarat på cytostatikabehandling bör erbjudas ytterligare linjers behandling med cytostatika om deras allmäntillstånd tillåter en fortsatt behandling.
- DPD (dihydropyrimidindehydrogenas) test bör utföras på alla patienter innan start av behandling med kapecitabin.
Figur 12. Behandlingsalgoritm vid hormonreceptor-positiv/HER2-negativ metastaserad bröstcancer
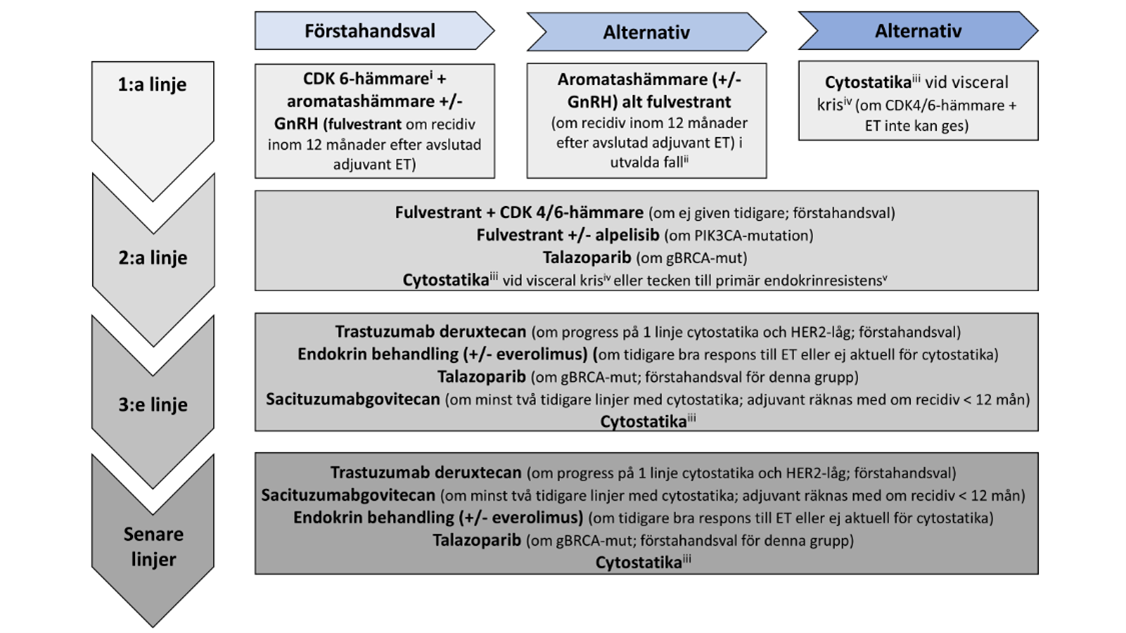
- Ribociclib (ESMO-MCBS: 4–5) i första hand, abemaciklib (ESMO-MCBS: 3) eller palbocliclib (ESMOMCBS: 3) i andra hand. För 2:a linjens behandling: ribociclib (ESMO-MCBS: 4), abemaciclib (ESMOMCBS: 4), eller palbociclib (ESMO-MCBS: 4).
- Utvalda fall: liten tumörbörda, patienter som bedöms tveksamma till att tåla CDK 4/6-hämmare, patienter med långt sjukdomsfritt intervall (> 60 mån) efter tidigare adjuvant ET.
- Singelbehandling i första hand: kombination vid enstaka tillfälle där tumörkrympning anses avgörande, underhållsbehandling med ET som inte har använts tidigare bör alltid övervägas efter respons till cytostatikabehandling.
- CDK 4/6-hämmare plus ET rekommenderas i första hand i stället för cytostatika även vid visceral kris om det behandlingsalternativet inte har givits tidigare och sjukdomen inte bedöms som endokrinresistens.
- primär endokrinresistens (enligt ABC-kriterier dvs. återfall inom 24 månader efter start av adjuvant ET, alt. inom 6 månader under första linjens behandling) på adekvat kombinationsbehandling med CDK 4/6-hämmare.
Notering. Inklusion i kliniska studier bör övervägas vid samtliga linjer.
En sammanfattning av rekommendationer kring behandling vid hormonreceptor-positiv/HER2-negativ MBC i olika behandlingslinjer presenteras i figur 12.
Första linjens behandling
Evidens kring CDK 4/6-hämmare
Endokrinbehandling i kombination med CDK 4/6-hämmare är förstahandsval hos patienter med hormonreceptor-positiv/HER2-negativ bröstcancer som bedöms kunna tåla den kombinationen. Cyklinberoende kinaser har en nyckelroll i att driva cellen vidare till celldelning, och just CDK 4/6 är knutet till övergången mellan G1- och S-fas.
Tre läkemedel, nämligen palbociklib, ribociklib och abemaciklib, är godkända för den indikationen. I PALOMA-2-studien kunde man se en förbättrad progressionsfri överlevnad med palbociklib + letrozol jämfört med enbart letrozol som första linjens behandling (HR 0,56, 95 % KI 0,46–0,69), medan ingen statistiskt signifikant skillnad avseende total överlevnad kunde ses (HR 0,96, 95 % KI 0,78–1,18) 1131 1132. Liknande resultat avseende progressionsfri överlevnad kunde man se i MONALEESA-2-studien där patienter randomiserades till ribocicklib + letrozol vs enbart letrozol som första linjens behandling med HR på 0,57 (95 % KI 0,46–0,70), i MONARCH-3-studien med randomisering mellan abemaciklib + icke-steroidal aromatashämmare vs enbart aromatashämmare (HR 0,53, 95 % KI 0,42–0,67) och i FLIPPER-studien med randomisering mellan palbociklib + fulvestrant vs fulvestrant (HR 0,55, 95 % KI 0,36–0,83) 1133 1134 ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1135 . MONALEESA-2 kunde man också se en statistiskt signifikant förbättrad total överlevnad med kombinationsbehandling 1136 medan en numerisk med formellt inte statistiskt signifikant skillnad kunde ses i den andra interimsanalysen av MONARCH-3-studien 1137. Ribociklib är den enda CDK 4/6-hämmare som har studerats hos premenopausala kvinnor i en dedikerat randomiserad studie som inkluderade 672 patienter. I studien fick alla patienter GnRH-analog med antingen TAM eller icke-steroid aromatashämmare och blev randomiserade mellan ribociklib och placebo. Den progressionsfria överlevnaden förlängdes från 13,0 månader i placeboarmen till 23,8 månader i ribociklibarmen (HR 0,55, 95 % KI 0,44–0,69)1138. I en prespecifierad interimanalys av överlevnadsdata efter 192 händelser kunde man se en signifikant förbättrad total överlevnad med tillägg av ribociklib med en absolut skillnad i 4-årsöverlevnad på 24,2 % (70,2 % vs 46,0 %, HR 0,71, 95 % KI 0,54–0,95) 1139. En ökad risk för förlängning av QTc-intervall kunde ses med kombination av ribociclib plus tamoxifen jämfört med ribociclib plus aromatashämmare.
Kombination av CDK 4/6-hämmare och endokrin behandling har också studerats som andra linjens behandling (efter progress på endast endokrin behandling) i randomiserade studier. CDK 4/6-hämmare + fulvestrant leder till statistiskt signifikant progressionsfri överlevnad med jämförbar relativriskminskning bland olika CDK 4/6-hämmare (HR 0,50, 95 % KI 0,40–0,62 för palbociklib + fulvestrant i PALOMA-3-studien; HR 0,59, 95 % KI 0,49–0,71 för ribociklib + fulvestrant i MONALEESA-3-studien; HR 0,54, 95 % KI 0,45–0,65 för abemaciklib + fulvestrant i MONARCH-2-studien) 1140 1141 1142. Statistiskt signifikant överlevnadsvinst med kombination kunde bekräftas i MONALEESA-3 (HR 0,73, 95 % KI 0,53-1,00 i andra linjen och HR 0,72, 95 % KI 0,57-0,92 i hela studiepopulationen) respektive MONARCH-2 (HR 0,75, 95 % KI 0,60-0,94) studier 1143 1144 medan överlevnadsvinsten i PALOMA-3 var numeriskt men inte formellt statistiskt signifikant 1145.
En meta-analys av randomiserade data från alla tre tillgängliga CDK 4/6-hämmare kunde bekräfta att kombinationsbehandling leder till en statistiskt signifikant och kliniskt meningsfull förbättring på antal objektiva responser, progressionsfri samt total överlevnad. Tilläggseffekten kunde bekräftas för olika subgrupper inklusive premenopausala kvinnor, patienter med viscerala metastaser, patienter med enbart skelettmetastaser, äldre patienter. Som förväntat var risken för biverkningar större med kombinationsbehandling 1146.
Det finns inga direkt jämförande studier bland de olika CDK 4/6-hämmarna. I en network-meta-analys kunde man inte se någon signifikant skillnad avseende progressionsfri överlevnad bland de olika CDK 4/6-hämmarna 1147. En poolad analys med fokus på number-needed-to-treat (NNT) resp. number-needed-to-harm (NNH) bland olika CDK 4/6-hämmare kunde visa en liknande NNT för att förebygga en sjukdomsprogress bland olika CDK 4/6-hämmare (4,4 till 5,0) medan det fanns en skillnad avseende NNT för att förebygga ett dödsfall (cirka 10 för ribociklib och abemaciklib; 21,8 för palbociklib) 1148. De tre CDK 4/6-hämmarna har olika biverkningsprofiler som behöver tas i beaktande vid behandlingsval. Palbociklib och ribociklib är kopplad till en ökad risk för neutropenier medan abemaciklib är kopplad till en ökad risk för diarréer. Ribociklib är också kopplad till en ökad risk för transaminasstegring och abemaciklib till kreatininstegring. Risk för någon sorts grad 3- eller 4-toxicitet såsom risk för dosminskning är liknande bland olika CDK 4/6-hämmare 1148. Med tanke på olika biverkningsprofiler bland olika CDK 4/6-hämmare anses det vara rimlig att byta mellan CDK 4/6-hämmare om toxicitet inte tillåter fortsatt behandling hos patienter som inte har fått sjukdomsprogress. I så fall bör man välja en CDK 4/6-hämmare med annorlunda biverkningsprofil för att undvika samma toxicititet.
I SONIA-studien undersökte man om behandlingssekvens av CDK 4/6-hämmare (som första eller andra linjens behandling) kan påverka prognosen. Studien randomiserade 1 050 pre- eller postmenopausala kvinnor till antingen CDK 4/6-hämmare + icke-steroidal aromatashämmare följt av fulvestrant vid sjukdomsprogress eller icke-steroidal aromatashämmare följd av CDK 4/6-hämmare + fulvestrant vid sjukdomsprogress. Det fanns inte någon statistiskt signifikant skillnad på progressionsfri överlevnad 2 dvs tiden från randomisering till sjukdomsprogress efter två behandlingslinjer eller på total överlevnad medan användning av CDK 4/6-hämmare som andra linjens behandling ledde till färre biverkningar 1149. Även om studien har fått en del kritik (andra linjens behandling efter progress på CDK 4/6-hämmare med enbart fulvestrant kan vara suboptimal för en del patienter, nästan 90 % av patienterna fick palbociklib som inte har visat någon överlevnadsvinst i pivotala randomiserade studier) visar studien att endast hormonbehandling kan vara ett rimligt behandlingsalternativ för vissa patientgrupper. Vårdprogrammet anser att det finns kliniskt definierbara patientgrupper, såsom patienter med liten tumörbörda, patienter som bedöms tveksamma till att tåla CDK 4/6-hämmare samt patienter med långt sjukdomsfritt intervall (> 60 mån) efter tidigare adjuvant endokrin behandling där endokrin behandling som singelbehandling med fördel kan användas medan CDK 4/6-hämmare + fulvestrant kan användas som andra linjens behandling vid sjukdomsprogress.
Det finns än så länge data från 3 randomiserade studier som jämför kombination av CDK 4/6-hämmare med hormonbehandling och cytostatika RIGHT Choice beskrivs i avsnitt 19.3.1.3. I fas 2 av Young-PEARL-studien randomiserade man premenopausala kvinnor med MBC (50 % av patienter var behandlingsnaiva) till antingen exemestan plus GnRH-analog plus palbociclib eller kapecitabin. Efter medianuppföljning på 17 månader kunde man se en signifikant förbättrad progressionsfri överlevnad för palbociclib-armen med 20,1 vs 14,4 månader (HR 0,659, 95 % KI 0,437–0,994) 1150. I fas 3 av PEARL-studien randomiserade man 601 postmenopausala kvinnor med MBC (25 % hade fått minst 2 behandlingslinjer med endokrin behandling; cirka 30 % hade fått cytostatika mot MBC) till antingen exemestan eller fulvestrant plus palbociclib eller till kapecitabin 1151. Man kunde inte se någon signifikant skillnad avseende progressionsfri överlevnad mellan armarna. I finala analysen av PEARL-studien avseende total överlevnad kunde man inte heller se någon skillnad mellan armarna 1152. I en indirekt jämförelse mellan CDK 4/6-hämmare och cytostatika genom en network-metaanalys kunde man inte se att det finns någon cytostatikabehandling som har större chans att leda till bättre progressionfri överlevnad jämfört med CDK 4/6-hämmare 1153.
Om val av endokrin behandling i kombination med CDK 4/6-hämmare vid första linjens behandling påverkar prognosen är testad i två randomiserade studier. I en randomiserad fas II-studie med 486 patienter jämfördes letrozol + palbociklib versus fulvestrant + palbociklib kunde inte visas någon skillnad på varken progressionsfri eller total överlevnad för någon av armarna 1154. PADA-1 testade ett helt annat koncept med implementering av en realtidsmonitorering av ESR1-mutationsutveckling i blodet (ESR1-mutationer är en etablerad resistensmekanism mot aromatashämmare) för att välja ut patienter som skulle ha nytta av att byta backbone-endokrin behandling från aromatashämmare till fulvestrant innan sjukdomsprogress. I studien inkluderades 1 017 patienter som fick första linjens behandling med palbociklib + aromatashämmare varav 172 patienter fick en ökning av ESR1-mutationsstatus i blodet utan sjukdomsprogress och randomiserades till behandlingsbyte till fulvestrant eller fortsättning med samma aromatashämmare. En förbättrad progressionsfri överlevnad till fördel för behandlingsbyte kunde ses (median progressionsfri överlevnad: 11,9 vs 5,7 månader, HR 0,61, 95 % KI 0,43–0,86). Denna behandlingsstrategi kräver implementering av NGS-baserade metoder för blodanalyser i klinisk praxis och man skulle behöva invänta andra aspekter av resultat som total överlevnad, patienternas livskvalitet och metodens kostnadseffektivitet för att kunna få en helhetsbild innan man väljer att implementera en sådan process i klinisk praxis 1155.
Utifrån randomiserad evidens som finns är alla tre CDK 4/6-hämmare godkända av EMA och det finns beslut om generell subvention av TLV i kombination med både aromatashämmare och fulvestrant. Det europeiska godkännandet av dessa läkemedel, både i kombination med aromatashämmare och med fulvestrant, kräver tillägg av GnRH-analog om behandling ges till pre- och perimenopausala kvinnor.
Endokrin behandling som singelbehandling
Det här avsnittet är en sammanfattning av evidens kring endokrin behandling som singelbehandling vid första linjens behandling.
- Endokrin behandling som singelbehandling är minst lika effektiv som cytostatika enligt en metaanalys av 6 randomiserade studier (692 patienter) 1156, samt på så kallad real-world-data 1157 1158 där man inte ser någon skillnad avseende progressionsfri eller total överlevnad mellan cytostatika och endokrin behandling, medan den hormonella behandlingen ger en lägre risk för toxicitet.
- Aromatashämmare är mer effektiva än TAM avseende responser och progressionsfri överlevnad hos postmenopausala kvinnor 1026 och rekommenderas som förstahandsval hos patienter som planeras för första linjens behandling med hormonbehandling i singelbehandling.
- Hos premenopausala kvinnor är GnRH-analog plus TAM mer effektiv än bara TAM, så kombinationsbehandling bör erbjudas i första hand 1159. GnRH-analog plus aromatashämmare är ett rimligt behandlingsalternativ hos premenopausala kvinnor trots att evidens bakom den kombinationen vid MBC baseras på resultat i fas II-studier 1160 1161 1162. Kombination av fulvestrant och GnRH-analog kan också vara ett alternativ 1163.
- Fulvestrant i den rekommenderade dosen på 500 mg (två direkt jämförande randomiserade studier: FIRST and FALCON-studier) är minst lika bra med aromatashämmare som första linjens behandling avseende total överlevnad, men den leder till högre responser 1164 1165.
- Kombination av fulvestrant plus aromatashämmare (två direkt jämförande randomiserade studier: S0226 och FACT-studier) som första linjens behandling leder inte till en förbättrad överlevnad jämfört med aromatashämmare som singelbehandling 1164. Liknande resultat noterades när kombinationen fulvestrant-anastrozol användes som andra linjens behandling jämfört med exemestan hos patienter som fick progress på första linjens behandling med icke-steroidal aromatashämmare 1166.
Behandlingsval vid visceral kris
Visceral kris definieras som kliniska och/eller laboratoriska tecken till begynnande eller konstaterad allvarlig organdysfunktion som en följd av progredierad cancersjukdom 1124. Traditionellt har cytostatika varit förstahandsval hos patienter med metastaserad hormonreceptor-positiv/HER2-negativ bröstcancer med tecken till visceral kris med tanke på snabbare behandlingseffekt och högre responser som förväntas med cytostatika jämfört med hormonbehandling 1124.
I en randomiserad fas II-studie (RIGHT Choice-studien) undersöktes ribociklib plus aromatashämmare (+/- GnRH analog för premenopausala kvinnor) versus kombinationscytostatika som första linjens behandling hos patienter med hormonreceptor-positiv/HER2-negativ bröstcancer och tecken till snabb sjukdomsprogression eller icke-visceral symtomatisk sjukdom eller visceral kris. Bland 222 randomiserade patienter noterades en förbättrad progressionsfri överlevnad (HR 0,54, 95 % KI 0,36–0,79) med ribociklib plus aromatashämmare, jämförbara responser medan risk för toxicitet och behandlingsavbrott var lägre med ribociklib plus aromatashämmare 1167. Utifrån RIGHT Choices studieresultat är CDK 4/6-hämmare plus hormonbehandling förstahandsval jämfört med cytostatika även vid visceral kris om det behandlingsalternativet inte har givits tidigare och sjukdomen inte bedöms som hormonresistent.
Andra linjens behandling
Endokrin behandling i kombination med målsökande behandling
Med tanke på resultat från pivotala studier om CDK 4/6-hämmare plus fulvestrant som andra linjens behandling (PALOMA-3, MONALEESA-3, MONARCH-2) samt resultat från SONIA studie är kombinationen av CDK 4/6-hämmare och fulvestrant förstahandsval hos patienter som inte har fått CDK 4/6-hämmare tidigare och bedöms kunna tåla den kombinationen.
PI3K är enzymer som aktiverar den PI3K/AKT/mTOR-signaleringsväg som är associerad med ökad cellprofileration och cellöverlevnad. Klass I PI3K-enzymer har 4 katalytiska isoformer, nämligen α, β, γ och δ. PIK3CA-genen kodar den katalytiska isoformen α av klass I PI3K-enzymer. Αktiverande somatiska mutationer av PIK3CA-genen inducerar PI3K-enzymer, vilket i sin tur leder till en överaktivering av PI3K/AKT/mTOR-signaleringsvägen. Aktiverande mutationer i PIK3CA-genen förekommer hos cirka 40 % av alla patienter med avancerad hormonreceptorpositiv bröstcancer och är kopplade till sämre prognos 1168 1169.
I SOLAR-1 studien inkluderades 572 patienter med hormonreceptorpositiv, HER2-negativ MBC som hade fått återfall eller progression på tidigare behandling med aromatashämmare 1170. Patienterna stratifierades beroende på PIK3CA-mutationsstatus, och det var 341 patienter med PIK3CA-mutation. Efter stratifiering randomiserade man patienter till antingen fulvestrant plus alpelisib (som hämmar specifikt isoformen α av PI3K-enzymer), eller fulvestrant plus placebo. I PIK3CA-mutationskohorten förlängdes den progressionsfria överlevnaden i alpelisibgruppen med 5,3 månader (11,0 vs 5,7 månader, HR 0,65, 95 % KI 0,50–0,85). Flera patienter i alpelisibgruppen fick grad 3–4-biverkningar inklusive hyperglykemi (36,6 % vs 0,7 %), hudutslag (9,9 % vs 0,3 %) och diarréer (6,7 % vs 0,3 %). Biverkningarna ledde till behandlingsavbrott hos 25 % av patienterna i alpelisibgruppen. I slutliga analysen avseende överlevnad i PIK3CA-muterad kohort kunde man se en numerisk skillnad på OS (39,3 vs 31,4 månader) som inte nådde statistiskt signifikans (HR 0,86, 95 % KI 0,64–1,15) medan mediantid till initiering av cytostatika var längre i alpelisib-armen (23,3 vs 14,8 månader; HR 0,72, 95 % KI 0,54–0,95) 1170.
Dessa resultat ledde till EMA godkännande av alpelisib i kombination med fulvestrant hos patienter med HR-positiv, PIK3CA-muterad bröstcancer efter sjukdomsprogress på endokrin behandling i singelbehandling. Man begränsar, således, användning av alpelisib till patienter som inte har tidigare fått behandling med CDK 4/6-hämmare. Den begränsningen baseras på att det endast fanns 20 patienter i SOLAR-1 studie som hade fått CDK 4/6-hämmare innan inklusion i studie. Det finns data från en fas II studie (BYLieve) där 121 patienter med PIK3CA-mutation och progress under behandling med CDK 4/6-hämmare plus aromatashämmare fick behandling med fulvestrant plus alpelisib och man noterade en median PFS på 7,3 månader och 6-mån PFS rate på 50,4 % 1171. Data från BYLieve är betryggande avseende effektivitet av alpelisib efter sjukdomsprogress på CDK 4/6-hämmare och alpelisib har fått en generell subvention i Sverige som tillåter användning av alpelisib plus fulvestrant efter sjukdomsprogress på CDK 4/6-hämmare och aromatashämmare.
Det finns inga data från någon direkt jämförelse mellan alpelisib och CDK 4/6-hämmare. I en indirekt jämförelse genom en network meta-analys kunde man se att CDK 4/6-hämmare verkar vara mer effektiva än PI3K/AKT/mTOR hämmare generellt som andra linjens behandling 1172.
Capivasertib är en AKT-hämmare som verkar på samma signaleringsväg som PIK3-hämmare (PI3K/AKT/mTOR signalväg). I en randomisera fas 3 studie undersökte man effekten av capivasertib som tillägg till fulvestrant jämfört med fulvestrant plus placebo hos patienter med HR-positiv bröstcancer och progress på aromatashämmare med eller utan CDK 4/6-hämmare. Totalt randomiserades 708 patienter varav 289 hade minst en aktiverad mutation i PI3K/AKT-signalväg (PIK3CA, AKT eller PTEN) och man noterade en statistiskt signifikant förbättrad PFS i capivasertib-armen (7,2 vs 3,6 månader; HR 0,60; 95 % KI 0,51–0,71) i hela kohorten med en numeriskt lägre HR hos patienter med aktiverad mutation på PI3K/AKT-signalväg (7,3 vs 3,1 månader; HR: 0,50; 95% KI: 0,38–0,81) 1173. Resultat från fas 3 studien stödjer tidigare resultat från en randomiserad fas 2 studie där 140 patienter randomiserades till capivasertib plus fulvestrant vs placebo plus fulvestrant och man såg en statistiskt signifikant förbättrad PFS (10,3 vs 4,8 månader; HR 0,56; 95 % KI 0,38–0,81) 1174 .
Endokrin behandling som singelbehandling
Hos patienter utan PIK3CA-mutation eller patienter som inte bedöms kunna tåla fulvestrant plus alpelisib är enbart fulvestrant ett rimligt behandlingsalternativ. Endokrin behandling som singelbehandling med ett behandlingsalternativ annat än fulvestrant som inte är givet tidigare kan också vara aktuell hos patienter som tidigare har svarat på hormonbehandling eller de som inte anses lämpliga för cytostatikabehandling eller kombinationsbehandling.
Elacestrant är en oral SERD som har undersökts som singelbehandling jämfört med annan hormonbehandling inkl. fulvestrant i en randomiserad studie som inkluderade 477 patienter med hormonreceptor-positiv/HER2-negativ bröstcancer som har progredierat på första linjens behandling med CDK 4/6-hämmare plus endokrin behandling 1175. En statistiskt siginifakt förbättrad progressionsfri överlevnad med elacestrant vs annan hormonbehandling observerades i hela kohorten (HR 0,70, 95 % KI 0,55–0,88) men nyttan var mer tydlig hos patienter med ESR1-mutation (HR 0,55, 95 % KI 0,39–0,77). Elacestrant är godkänd av EMA som andra linjens behandling hos patienter med ESR1-mutation men tillhandahålls i nuläget inte i Sverige.
Cytostatikabehandling
Cytostatikabehandling kan var ett behandlingsalternativ som andra linjens behandling vid tecken till visceral kris (om behandling med CDK 4/6-hämmare plus endokrin behandling har givits tidigare) eller om sjukdomen bedöms som primär hormonresistent (definierad som återfall inom 24 månader efter start av postoperativ endokrin behandling, alt. inom 6 månader under första linjens behandling med CDK 4/6-hämmare innehållande kombination 1124. En beskrivning av vilken typ av cytostatika kan väljas utifrån evidens finns i underrubriken om cytostatikabehandling som tredje eller senare linjens behandling.
CDK 4/6-hämmare som andra linje efter progression på CDK 4/6-hämmare i första linjen
Att fortsätta med samma eller annan CDK 4/6-hämmare och annan hormonbehandling som andra linjens behandling efter progress på CDK 4/6-hämmare plus hormonbehandling som första linje har än så länge testats i tre randomiserade fas II studier. I MAINTAIN studie såg man en modest men statistiskt signifikant PFS-vinst på 2,5 månader med ribociklib plus hormonbehandling vs endast hormonbehandling efter progress på CDK 4/6-hämmare (87 % palbociklib; 12 % ribociklib) plus annan hormonbehandling 1176. I PACE studie randomiserades patienter till fulvestrant plus palbociklib (+/- avelumab) vs fulvestrant efter progress på CDK 4/6-hämmare (90 % palbociklib) plus aromatashämmare utan att kunna se en skillnad på progressionsfri överlevnad 1177. I PALMIRA studie randomiserades patienter till palbociklib plus annan hormonbehandling vs hormonbehandling efter progress på palbociklib och hormonbehandling utan några tecken till klinisk nytta 1178.
Det finns således inte någon övertygande evidens om att fortsätta med CDK 4/6-hämmare som andra linje efter progress på CDK 4/6-hämmare som första linje och därför rekommenderas den behandlingsstrategin inte. PostMONARCH studie är en pågående fas III randomiserad studie som undersöker nytta av abemaciklib plus fulvestrant vs enbart fulvestrant efter progress på CDK 4/6-hämmare plus aromatashämmare och kommer att ge svar om den behandlingsstrategin är av värde 1179.
Tredje eller senare linjens behandling
Endokrin behandling i kombination med målsökande behandling
En möjlighet till hormon-baserad behandling som tredje linje är att kombinera endokrin behandling med everolimus som är en mTOR-hämmare. Everolimus är ett peroralt läkemedel som hämmar PI3K/AKT-signalvägen 1180. Randomiserade studier som finns till grund för godkännande av everolimus vid MBC är dock gjorda innan CDK 4/6-hämmare- samt alpelisib-era och hur effektiv den behandlingen är nu kan man inte veta.
Den största studien som undersökte den potentiella nyttan av everolimus inkluderade 724 kvinnor med ER-positiv MBC som hade progredierat på anastrozol eller letrozol 1131. Patienterna randomiserades i förhållandet 2:1 mellan exemestan + everolimus och exemestan + placebo och eman noterade en förbättrad progressionsfri överlevnad med kombinationen (HR 0,43, 95 % KI 0,35–0,54) dock utan någon överlevnadsvinst (HR 0,89, 95 % KI 0,73–1,10). I studien framkom att kombinationsbehandlingen gav mer biverkningar; grad 3–4 av stomatit, anemi, dyspné, hyperglykemi, fatigue och pneumonit var samtliga mer vanliga i samband med everolimusbehandling 1181. Den kombinationen testades också i jämförelse med enbart everolimus eller kapecitabin i en randomiserad studie som inkluderade 309 patienter. Progressionsfri överlevnad var längre för exemestan plus everolimus jämfört med enbart everolimus (8,4 månader vs 6,8 månader, HR 0,74, 95 % KI 0,57–0,97) och det noterades en numerisk men icke-statistiskt signifikant skillnad till fördel för kapecitabin i jämförelse med exemestan + everolimus (9,6 månader vs 8,4 månader, HR 1,16, 95 % KI 0,52–0,84). Det fanns flera grad 3–4-biverkningar med kombinationen än med kapecitabin 1182. Everolimus har även kombinerats med TAM i en randomiserad fas 2-studie med TAM enbart i kontrollarmen 1183. Studien rekryterade 111 kvinnor som alla hade fått tidigare behandling med AI. Den primära effektvariabeln CBR var gränssignifikant med 61 % och 42 % i everolimus + TAM respektive TAM enbart. Både tiden till försämring och den totala överlevnaden var bättre bland dem med tillägg av everolimus, med riskkvoten för tid till progression 0,54 (95% KI 0,36–0,81) samt riskkvoten för total överlevnad 0,45 (95 % KI 0,25–0,81) 1183. Liknande resultat noterade man i en nyligen publicerad randomiserad studie där 131 patienter med aromatashämmare-resistent MBC fick antingen fulvestrant + everolimus eller enbart fulvestrant 1184. Den progressionsfria överlevnaden, som var studiens primära effektmått, förbättrades med kombinationsbehandlingen med 5,3 månader (10,3 månader versus 5,1 månader, HR 0,61, 95 % KI 0,40–0,92). Som förväntat fick patienter med kombinationen flera biverkningar av grad 3–4 i form av mukosit och pneumonit.
Med tanke på avsankad av överlevnadvinst och ökad risk för biverkningar rekommenderas kombinationen av everolimus plus hormonbehandling om patienter har tidigare fått behandlingseffekt på hormonbehandling.
Endokrin behandling som singelbehandling
Endokrin behandling som singelbehandling med ett behandlingsalternativ som inte är givet tidigare kan vara aktuell hos patienter som tidigare har svarat på hormonbehandling eller de som inte anses lämpliga för cytostatikabehandling eller kombinationsbehandling.
PARP-hämmare vid gBRCA-mutation
PARP-hämmare är hämmare av enzymerna ”humant poly (ADP ribos) polymeras” som har som funktion att reparera DNA-enkelsträngsbrott. I normala celler samt cancerceller utan BRCA-mutation kan dessa skador repareras genom ett annat reparationssystem som kallas homolog rekombination, vilket kräver att BRCA1- och 2-generna är funktionella. Vid icke-funktionella BRCA-gener, som vid germline sjukdomsassocierade BRCA1 eller BRCA2-mutationer, kan dock DNA-enkelsträngsbrott inte repareras via homolog rekombination, vilket gör att cancercellerna blir känsliga mot PARP-hämmare 1185.
Två randomiserade studier med liknande design har undersökt eventuell nytta av PARP-hämmare hos patienter med gBRCA-muterad MBC. I första studien randomiserades 302 patienter (50 % hormonreceptor-positiv/HER2-negativ) till antingen olaparib eller standardcytostatika (kapecitabin, vinorelbin, eribulin). Man såg högre responser med olaparib jämfört med standardcytostatika (60 % vs 29 %), längre progressionsfri överlevnad (7,0 vs 4,2 månader, HR 0,58, 95 % KI 0,43–0,80) samt lägre risk för toxicitet (grad ≥ 3 36,6 % med olaparib vs 50,5 % med cytostatika) men ingen signifikant skillnad i totala överlevnaden i intention-to-treat-populationen (19,3 vs 17,1 månader, HR 0,90, 95 % KI 0,66–1,23) 166 ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1186 . Andra randomiserade studien inkluderade 431 patienter med BRCA-mutation (cirka 56 % hormonreceptor-positiv/HER2-negativ) som fick antingen talazoparib eller standardcytostatika (kapecitabin, eribulin, vinorelbin, gemcitabin). Man noterade högre responser med talazoparib jämfört med cytostatika (62,6 % vs 27,2 %), längre progressionsfri överlevnad (8,6 vs 5,6 månader, HR 0,54, 95 % KI 0,41–0,71) men ingen skillnad på totala överlevnaden 1187 1188. Båda studierna visade en förbättrad livskvalitet hos patienter som fick PARP-hämmare jämfört med cytostatikabehandling ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1189 1190 .
PARP-hämmare är förstahandsval jämfört med cytostatika i den här behandlingslinjen med tanke på effektivitet och biverkningsprofil. Man kan överväga PARP-hämmare även som andra linjens behandling hos patienter som har progredierat på adekvat hormonbehandling i första linjen.
Cytostatikabehandling
Det här avsnittet är en sammanfattning av evidens kring cytostatika som behandlingsalternativ hos patienter med hormonreceptor-positiv/HER2-negativ bröstcancer följer. Sammanfattningen gäller cytostatika oavsett behandlingslinje.
- Cytostatika som singelbehandling och sekventiellt anses vara standardbehandling medan kombinationscytostatika används i undantagsfall där tumörkrympning anses vara viktigt. I en meta-analys av randomiserade studier kunde man se högre remissionsfrekvenser och längre progressionsfri överlevnad med kombination utan någon överlevnadsvinst och med ökad risk för toxicitet 1191.
- Längre behandlingsduration av cytostatika leder till en marginell överlevnadsvinst (HR 0,91, 95 % KI 0,84–0,99) och en längre progressionsfri överlevnad (HR 0,64, 95 % KI 0,55–0,99) jämfört med kortare behandlingsduration enligt en meta-analys av 11 randomiserade studier (2 269 patienter). Det är dock oklart hur en längre behandlingsduration påverkar patienternas livskvalitet 1192.
- Vid bra behandlingseffekt av cytostatika och om behandlingen behöver avbrytas på grund av biverkningar, bör man överväga underhållsbehandling med hormonbehandling med ett läkemedel som inte har använts tidigare. Den behandlingsstrategin har inte testats i någon randomiserad studie med modern behandling, men det finns viss evidens från observationella studier där man ser en förbättrad progressionsfri överlevnad i jämförelse med icke-underhållsbehandling 1193. Med tanke på att hormonbehandling oftast är vältolererad, är underhållsbehandling med hormonbehandling efter cytostatika en rekommenderad behandlingsstrategi.
- Taxaner eller antracykliner rekommenderas i första hand som cytostatika hos patienter med bröstcancer som inte har fått tidigare dessa behandlingar som neo-/adjuvant 1194 1195.
- Liposomalt doxorubicin i stället för konventionella antracykliner är minst lika effektiv och med lägre risk för toxicitet 1196.
- Veckovis paklitaxel är mer effektiv än paklitaxel var tredje vecka med en överlevnadsvinst, medan ingen skillnad mellan veckovis paklitaxel och docetaxel var tredje vecka kunde påvisas 1197. Nab-paclitaxel kan vara ett alternativ till paklitaxel eller docetaxel för de individer som inte tolererar premedicinering med steroider eller vid allergiska reaktioner på taxaner, men effektmässigt ser man inte några fördelar 1198.
- Kapecitabin är ett välbeprövat läkemedel som första och senare behandlingslinjer 1199. Läkemedlets bekvämlighet avseende administrering samt effektivitet gör att det ofta används som första cytostatika-alternativ hos patienter med hormonreceptor-positiv/HER2-negativ bröstcancer.
- Eribulin har visat överlevnadsvinst över övriga cytostatika (vinorelbin, gemcitabin eller kapecitabin) och vinorelbin vid senare behandlingslinjer i två randomiserad studier ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1200 1201, men ingen skillnad på effekt vid en direkt jämförelse med kapecitabin . Eribulin är således att föredra jämfört med vinorelbin eller gemcitabin.
- Vinorelbin har visat en viss effektivitet 1203, men i mindre utsträckning än övriga cytostatika. Gemcitabin som singelbehandling har inte visat sig vara effektiv vid MBC 1204, medan gemcitabin i kombination verkar vara mer effektiv än singelbehandling men med större risk för toxicitet 1205.
- För patienter som svarat på tidigare linjers behandling kan man överväga att fortsätta med ytterligare linjers behandling om patientens allmäntillstånd tillåter 1206 1207 1208.
Antikropp-läkemedelskonjugat
Sacituzumabgovitekan är ett s.k. antikropp-läkemedelskonjugat där antikroppen sacituzumab (mot receptorn TROP2) är kopplad via en hydroliserbar linker till 7–8 molekyler SN-38 som är en topoisomeras-I hämmare. Sacituzumabgovitekan binds till TROP2-uttryckande celler (såsom cancerceller) och internaliseras med efterföljande frisättning av SN-38.
I TROPICS02-studien randomiserades patienter med metastaserad hormonreceptor-positiv/HER2-negativ bröstcancer som tidigare hade fått hormonbehandling (inkl. CDK 4/6-hämmare) och minst 2 cytostatikalinjer till sacituzumabgovitekan vs annan cytostatika (eribulin, vinorelbin, kapecitabin eller gemcitabin). Totalt randomiserades 543 patienter och man kunde visa en statistiskt signifikant skillnad på total överlevnad med sacituzumabgovitekan (14,4 månader vs 11,2 %, HR 0,79, 95 % KI 0,65–0,96) men något ökad risk för grad 3–4 toxiciteter fast utan påverkan på risk för behandlingsavbrott eller försämring av livskvalitet 1209. Resultat av TROPICS02-studien bekräftas i en asiatisk population som ingick i EVER-132-002 studien där man såg en statistiskt signifikant skillnad i totalöverlevnad för gruppen med sacituzumabgovitekan jämfört med läkares cytostatikaval (median OS 21.0 månader jämfört med 15.3 månader; HR: 0.64; 95% CI: 0.47–0.88) 1210.
Ytterligare ett antikropp-läkemedelkonjugat mot TROP2, fast med en annan antikropp och cytostatika-molekyl (deruxtekan), med lovande resultat är datopotamab deruxtekan. I TROPION-Breast01-studien randomiserades 732 patienter med metastaserad hormonreceptor-positiv/HER2-negativ bröstcancer som tidigare hade fått hormonbehandling (inkl. CDK 4/6-hämmare) och minst 1 cytostatikalinje till datopotamab deruxtecan vs prövarens val av cytostatika (eribulin, vinorelbin, kapecitabin eller gemcitabin). Man noterade en statistiskt signifikant förbättring på progressionsfri överlevnad med datopotamab deruxtekan jämfört med cytostatika (6,9 månader vs 4,9 månader, HR 0,63, 95 % KI 0,52–0,76) och samtidigt färre grad 3–4 biverkningar och dosreduktioner. Medicinen är inte godkänd av EMA än 1211.
Behandlingsmöjligheter vid hormonreceptor-positiv/HER2-låg MBC
Hos patienter med hormonreceptor-positiv/HER2-låg (1+ enligt IHC eller 2+ enligt IHC utan amplifiering) MBC finns det en ny behandlingsmöjlighet med ett antikropp-läkemedelkonjugat, s.k. trastuzumab-deruxtekan. Medicinen består av anti-HER2 antikroppen trastuzumab som är fäst på 8 molekykler deruxtekan, en topoisomeras I-hämmare, bunden via en klyvbar bindning.
I DESTINYBreast04 studien randomiserades 557 patienter med HER2-låg MBC (88,7 % var hormonreceptor positiva) som hade fått progress på hormonbehandling (cirka 70 % hade fått CDK 4/6-hämmare) och minst 1 linje cytostatika till trastuzumabderuxtekan vs annan cytostatika (eribulin, kapecitabin, nab-paklitaxel, paklitaxel, gemcitabin). Efter en medianuppföljningstid på 18,4 månader sågs en 4,7 månaders vinst på progressionsfri (10,1 månader vs 5,4 månader, HR 0,51, 95 % KI 0,40–0,64) och vid den uppdaterade analysen, efter en medianuppföljningstid på 32 månader, sågs en 6,3 månaders vinst på total överlevnad (23,9 månader vs 17,6 månader, HR 0,69, 95 % KI 0,55–0,87) med trastuzumab deruxtekan. Man kunde också notera färre grad 3–4 biverkningar med trastuzumab deruxtekan, medan frekvensen av pneumonit var 12,1 % (4 patienter avled på grund av pneumonit) 1212 1213.
Resultat av studien visar att HER2-låg är en prediktiv markör för behandling med trastuzumab deruxtekan och därför bör man få information avseende HER2 från immunohistokemiska analyser uppdelad i tre grupper: HER2-positiv (3+ enligt IHC eller 2+ och amplifiering), HER2-låg (1+ enligt IHC eller 2+ enligt IHC utan amplifiering eller HER2-negativ (0 enligt IHC).
Behandlingsprinciper vid HER2-positiv bröstcancer
Sammanfattning
- Pertuzumab i kombination med trastuzumab givet tillsammans med docetaxel ger en tydlig överlevnadsvinst jämfört med trastuzumab + docetaxel (+++). Pertuzumab ökar inte på ett markerat sätt toxiciteten och försämrar inte livskvaliteten (+++).
- Trastuzumab deruxtecan som andra linjens behandling ger en kliniskt och statistiskt signifikant förbättrad progressionsfri överlevnad, total överlevnad och högre objektiva responser än trastuzumab emtansin (+++).
- Trastuzumab emtansin ger ingen statistiskt signifikant förbättring av den progressionsfria överlevnaden men en tydlig trend till förbättrad responsduration och mindre biverkningar, jämfört med trastuzumab + taxan (+++).
- Trastuzumab deruxtecan som tredje eller senare linje (efter progress på trastuzumab emtansin) leder till en förbättrad progressionsfri överlevnad, total överlevnad och hållbara tumörregressioner jämfört med annan behandling som inkluderar HER2-receptorblockad (+++).
- Trastuzumab emtansin som tredje och senare linjers behandling ger en överlevnadsvinst jämfört med annan behandling som inkluderar HER2-receptorblockad (+++).
- Trippelkombination med trastuzumab – kapecitabin – tukatinib som tredje eller senare linje (efter progress på trastuzumab-pertuzumab och trastuzumab emtansin) ger en överlevnadsvinst jämfört med trastuzumab – kapecitabin med en bevisad effekt också vid hjärnmetastaserad sjukdom (+++).
- För ER-positiv och HER2-positiv bröstcancer ger tillägg av HER2-receptorblockad till endokrin behandling förlängd progressionsfri överlevnad, men effekten tycks sämre än vid trastuzumab + cytostatika (+++). Tillägg av pertuzumab i en kombination av trastuzumab och aromatashämmare ger en längre progressionsfri överlevnad men inte längre totalöverlevnad (+++).
- För patienter som sviktat på flera linjers behandling som innehåller trastuzumab ger kombinationen trastuzumab + lapatinib en överlevnadsvinst jämfört med enbart lapatinib (+++).
Rekommendationer för HER2-riktad behandling
- Behandling med trastuzumab ska erbjudas patienter med tumörer som har starkt överuttryck (IHC3+/ISH-positivitet) av HER2 (ESCAT I).
- Patienter med IHC 2+ ska alltid testas med ISH-teknik för att konfirmera HER2-status (ESCAT I). Testningen sker med fördel på någon av metastaserna eftersom dessa kan ha ett annorlunda HER2-status jämfört med primärtumören.
Första linjens behandling
- Patienter bör få trippelkombinationen pertuzumab, trastuzumab och docetaxel/paklitaxel, eftersom det är den effektivaste behandlingen vid första linjens behandling av HER2-positiv MBC (ESMO-MCBS: 4). När cytostatikabehandling avslutas bör man ge underhållsbehandling med endokrin behandling i samband med trastuzumab/pertuzumab för hormonreceptor-positiv/HER2-positiv sjukdom.
- För äldre patienter med samsjuklighet och svårigheter att tolerera ovanstående kombinationsbehandling kan trastuzumab emtansin som första linjens behandling övervägas, men effekten är inte studerad jämfört med nuvarande standardbehandling. Ett alternativ är att kombinera pertuzumab + trastuzumab med vinorelbin som har mer gynnsam biverkningsprofil än taxaner.
- För hormonreceptor-positiv/HER2-positiv MBC kan man också överväga trastuzumab med eller utan pertuzumab kombinerat med endokrin behandling för dem som har svårt att tolerera cytostatikabehandling.
- Pertuzumab – trastuzumab – cytostatika alt. trastuzumab deruxtecan (om recidiv inom 6 månader) kan övervägas som första linjens behandling vid tidigt återfall inom 12 månader från avslutad trastuzumab-behandling i neo-/adjuvant syfte.
- Behandling med pertuzumab + trastuzumab fortsätter till sjukdomsprogression eller oacceptabla biverkningar.
Andra linjens behandling
- Patienter som sviktat på anti-HER2-baserad behandling i första linjen bör erbjudas trastuzumab deruxtecan (ESMO-MCBS: 4). Vid kontraindikation på trastuzumab deruxtekan rekommenderas trastuzumab emtansin som andra linjens behandling.
Tredje och senare linjers behandling
- Trastuzumab deruxtecan bör erbjudas som förstahandsval om det inte har givits tidigare.
- Trastuzumab emtansin (ESMO-MCBS: 4) och tukatinib i kombination med trastuzumab och kapecitabin (ESMO-MCBS 4) bör erbjudas vid tredje eller senare linje.
- Det finns inga direkta jämförelser mellan tukatinib och trastuzumab deruxtecan eller trastuzumab emtansin. Indirekta jämförelser gör att för tredje linjens behandling rekommenderas i första hand trastuzumab deruxtecan över trastuzumab emtansin och tukatinib-trastuzumab-kapecitabin om de inte har använts tidigare. Val mellan trastuzumab emtansin eller tukatinib-trastuzumab-kapecitabin vid tredje eller senare linje får individanpassas, men tukatinib-trastuzumab-kapecitabin är förstahandsval vid hjärnmetastaserad bröstcancer.
- Trastuzumab i kombination med olika cytostatika eller endokrin behandling (vid hormonreceptor-positiv/HER2-positiv sjukdom) som inte är erbjudna tidigare bör övervägas som senare linjer.
- Kombinationen trastuzumab och lapatinib kan övervägas i senare linjers behandling (ESMO-MCBS: 4).
Figur 13. Behandlingsalgoritm vid HER2-positiv metastatisk bröstcancer.

Notering. Inklusion i kliniska studier bör övervägas vid samtliga linjer.
En sammanfattning av rekommendationer kring behandling vid hormonreceptor-positiv/HER2-negativ MBC i olika behandlingslinjer presenteras i figur 13.
Första linjens behandling
Dubbel HER2-blockad i kombination med cytostatika
Dubbel HER2-blockad med trastuzumab och pertuzumab i kombination med taxaner är förstahandsval hos patienter med HER2-positiv MBC tack vare CLEOPATRA-studiens resultat. I studien randomiserades 808 patienter till pertuzumab + trastuzumab + docetaxel vs trastuzumab + docetaxel + placebo och man kunde bevisa en överlevnadsvinst med kombination (57,1 vs 40,8 månader, HR 0,69, 95 % KI 0,58–0,82) utan någon negativ inverkan av pertuzumabtillägget till livskvalitet 1214 1215. I studien fick patienter median 8 kurer med docetaxel. Med tanke på toxicitet relaterad till docetaxel anser man att 6–8 kurer av docetaxel är en rimlig exponering av cytostatika i kombination med dubbel HER2-blockad. Veckovis paklitaxel kan också vara ett behandlingsalternativ i stället för docetaxel med tanke på jämförbar effektivitet men mindre biverkningsrisk 1197. Behandlingen med pertuzumab + trastuzumab fortsätter tills progression eller oacceptabla biverkningar.
I en relativt liten randomiserad fas II-studie med 210 patienter som randomiserades till dubbel HER2-blockad utan eller med cytostatika (paklitaxel eller vinorelbin för minst 4 månader) följt av trastuzumab emtansin vid progress kunde man inte se någon skillnad på 2-års total överlevnad trots att det fanns en tydlig vinst på progressionsfri överlevnad för trippelkombination (23,3 månader Vs 8,4 månader). Studiens korta uppföljningstid försvårar implementering av studieresultatet i klinisk praxis 1216.
Behandlingsalternativ hos skörare patienter
Om dubbel HER2-blockad i kombination med taxaner bedöms vara riskabel t.ex. för äldre patienter med samsjukligheter kan andra behandlingsalternativ övervägas.
Dubbel HER2-blockad i kombination med vinorelbin. Det behandlingsalternativet baseras på extrapolering av data från HERNATA studien där 284 patienter randomiserades mellan trastuzumab + docetaxel vs trastuzumab + vinorelbin som första linjens behandling utan att se någon skillnad på behandlingseffekt men docetaxelkombinationen gav signifikant mer biverkningar i form av neutropeni, neutropen feber, infektioner, neuropati, ödem och nagelpåverkan 1217 och VELVET fas 2 studie där 106 patienter fick första linjens behandling med trastuzumab + pertuzumab + vinorelbin som ett alternativ till taxaner och trippelkombinationen ledde till höga objektiva responser på 74,2 % och en median progressionsfri överlevnad på 14,3 månader 1218.
- Trastuzumab emtansin. I den 3-armade MARIANNE-studien randomiserades 1 095 patienter med avancerad bröstcancer med HER2-positiv sjukdom utan någon tidigare behandling för avancerad sjukdom till behandling med trastuzumab plus en taxan eller trastuzumab emtansin enbart eller trastuzumab emtansin plus pertuzumab. Den progressionsfria överlevnaden var likvärdig för behandlingsarmarna: 13,7 månader för trastuzumab plus en taxan, 14,1 månader för enbart trastuzumab emtansin (HR 0,91, 97,5 % KI 0,73–1,13, P = 0,13) och 15,2 månader för kombinationsarmen (HR 0,87, 97,5 % KI 0,69–1,08, P = 0,14). Totala överlevnaden var också likvärdig bland armar (50,9 månader för trastuzumab + taxaner, 53,7 månader för trastuzumab emtansin, 51,8 månader för trastuzumab emtansin + pertuzumab). Biverkningar av grad 3 eller mer var numeriskt högre i kontrollarmen: 54,1 % versus 45,4 % och 46,2 % 1219 1220. Även om denna studie inte inkluderade dagens förstahandsval som första linjens behandling (trippelkombination) kan man konstatera att trastuzumab emtansin verkar vara effektiv som första linjens behandling och kan övervägas hos skörare patienter där dubbel HER2-blockad med cytostatika bedöms riskabel.
- HER2-blockad i kombination med hormonbehandling hos patienter med hormonreceptor-positiv/HER2-positiv MBC. Endokrin behandling i kombination med trastuzumab är undersökt i en randomiserad studie där 207 postmenopausala kvinnor med ER-positiv och HER2-positiv MBC randomiserades mellan anastrozol med eller utan trastuzumab. Det primära effektmåttet progressionsfri överlevnad var signifikant bättre för kombinationsbehandlingen, 4,8 vs 2,4 månader (HR 0,63, 95 % KI 0,47–0,84) medan medianöverlevnaden inte var signifikant bättre 1221. Trippelkombination med endokrin behandling (letrozol eller anastrozol) + pertuzumab + trastuzumab jämfört med endokrin behandling + trastuzumab som första linjens behandling är också undersökt i en randomiserad studie som inkluderade 258 patienter 1222. I kohorten av patienter som inte hade fått induktionscytostatika (N = 112) var det primära effektmåttet progressionsfri överlevnad längre med trippelkombination (26,6 vs 12,5 månader, HR 0,68, 95 % KI 0,44–1,03) medan man inte kunde påvisa någon statistiskt signifikant skillnad på total överlevnad (64,5 vs 53,7 månader; HR 0,88, 95 % KI 0,50–1,55). Trippelkombinationen var associerad med högre risk för biverkningar (grad ≥ 3-biverkningar 56,7 % vs 41,1 %).
Sammanfattningsvis ser man att HER2-blockad (antingen som singelbehandling eller dubbel) i kombination med endokrin behandling leder till förbättrad progressionsfri överlevnad, men den påverkar inte total överlevnad. Detta stödjer hypotesen att hormonreceptor-positiv/HER2-positiv bröstcancer är generellt mindre känslig för endokrin behandling. Samtidigt är kombinationen mycket bättre jämfört med enbart hormonbehandling och har färre biverkningar jämfört med kombination av HER2-blockad + cytostatika, och anses därför vara ett rimligt behandlingsalternativ om cytostatika bedöms riskabel. Att hormonbehandling är ett rimligt alternativ tillsammans med HER2-blockad stöds också av resultat från en studie från Kina som randomiserade 392 patienter med hormonreceptor-positiv/HER2-positiv MBC till cytostatika plus trastuzumab vs hormonbehandling plus trastuzumab. Median PFS var 19,2 månader för cytostatika plus trastuzumab vs 14,8 månader för hormonbehandling plus trastuzumab (HR 0,88, 95 % KI 0,71–1,09) men den skillnaden var inom gränsen för non-inferiority 1223.
Behandlingsalternativ vid tidigt återfall (inom 12 månader) efter avslutad anti-HER2 behandling
Det finns begränsad evidens kring behandlingsval hos patienter som får ett tidigt återfall efter avslutad anti-HER2-behandling som adjuvant. I CLEOPATRA-studien exkluderades patienter med återfall inom 12 månader efter avslutad adjuvant trastuzumab, medan MARIANNE-studien exkluderade patienter med återfall inom 6 månader efter avslutad adjuvant trastuzumab. DESTINY-Breast03 studien tillät patienter med recidiv inom 6 månader från avslutad adjuvant terapi att ingå. Utifrån data från real-world evidens-studier 1224 samt DESTINY-Breast03 1225 bedöms både dubbel HER2-blockad + cytostatika och trastuzumab deruxtecan (speciellt vid recidiv inom 6 månader) vara rimliga behandlingsalternativ vid återfall inom 12 månader efter avslutad adjuvant trastuzumab.
Om återfall sker under adjuvant trastuzumab eller inom 12 månader efter adjuvant trastuzumab emtansin är det rimligt att påbörja behandling med behandlingsalternativ som finns vid andra linjens behandling.
Andra linjens behandling
Trastuzumab-deruxtekan har jämförts med trastuzumab emtansin som andra linjens behandling i den randomiserade DESTINY-Breast03-studien 1226 1227. Cirka 60 % av patienterna hade fått pertuzumab som första linjens behandling medan alla hade fått trastuzumab. Totalt inkluderades 524 patienter och man såg en klinisk och statistisk signifikant skillnad på progressionsfri överlevnad till fördel för trastuzumab deruxtecan med HR 0,33 (95 % KI 0,26–0,43), median för progessionsfri överlevnad var 6,8 månader trastuzumab emtansin för de patienter som fick trastuzumab emtansin, respektive 28,8 månader för trastuzumab deruxtecan, samt total överlevnad (HR 0,64, 95 % KI 0,47–0,87) Objektiva responser var 79 % för patienter som fick trastuzumab deruxtecan versus 35 % för de som fick trastuzumab emtansin. Incidens av interstitiell pneumonit var 15 % (14 % grad 1–2, ingen grad 4–5) vid behandling med trastuzumab deruxtecan jämfört med 3 % vid trastuzumab emtansin. Med tanke på ovanstående resultat är trastuzumab deruxtekan förstahandsalternativ som andra linjens behandling. Ett observantum avseende trastuzumab-deruxtekan är risken för interstitiell pneumonit som har noterats i alla studier som är gjorda med läkemedel oavsett indikation 1228. Den risken bör alltid tas i beaktande och har lett till utveckling av säkerhetsprotokoll för utredning och uppföljning av misstänkt pneumonit som behöver implementeras 1223 .
Trastuzumab emtansin är ett rimligt behandlingsalternativ som andra linjens behandling om trastuzumab-deruxtekan kontraindiceras. Dess effekt som andra linjens behandling etablerades i EMILIA-studien där 991 patienter med sjukdomsprogress på trastuzumab + cytostatika randomiserades mellan trastuzumab emtansin och dåvarande standard-of-care lapatinib + kapecitabin. Både progressionsfri och total överlevnad var bättre med trastuzumab emtansin jämfört med lapatinib + kapecitabin 1229.
För patienter med progress under pertuzumab + trastuzumab som underhållsbehandling finns begränsad och relativt omodern evidens för att fortsätta med den kombinationen med tillägg av annan cytostatika, utan man rekommenderar byte till andra linjens behandling enligt ovan. I PRECIOUS-studien randomiserades 217 patienter med HER2-positiv MBC och tidigare pertuzumab-innehållande behandling till re-challenge med pertuzumab plus trastuzumab plus cytostatika vs trastuzumab plus cytostatika. Man kunde inte se någon skillnad på PFS medan man noterade en statistisk skillnad på OS till fördel för pertuzumab-innehållande behandling (36,2 vs 26,5 månader, HR 0,73) 1230.
Tredje eller senare linjens behandling
Trastuzumab-deruxtekan är förstahandsval som tredje eller senare behandlingslinje om den inte har använts tidigare. I en fas 2-studie inkluderades 184 patienter som tidigare hade sjukdomsprogress på minst andra linjens behandling (alla hade progress på trastuzumab och T-DM1 och 65,8 % på pertuzumab) och man noterade objektiva responser på 60,9 % med en medianresponsduration på 14,8 månader och PFS på 16,4 månader 1231 . I den randomiserade studien DESTINY-Breast02 inkluderades 608 patienter med HER2-positiv MBC och progress på minst 2 behandlingslinjer (alla patienter hade fått trastuzumab och trastuzumab emtansin, medan 78 % hade fått pertuzumab) och randomiserades till trastuzumab-deruxtekan eller trastuzumab (eller lapatinib) + kapecitabin. Progressionsfri överlevnad var betydligt längre i armen som fick trastuzumab-deruxtekan (17,8 vs 6,9 månader, HR 0,36, 95 % KI 0,28–0,45) liksom total överlevnad (39,2 vs 26,5 månader, HR 0,66, 95 % KI 0,50–0,86) med en något ökad risk för grad 3–4-biverkningar i trastuzumab-deruxtekan-armen (53 % vs 44 %) ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1232 .
Trastuzumab emtansin har visats vara effektiv även vid senare linjer. I den randomiserade studien TH3RESA som inkluderade 602 patienter med minst 2 linjers behandling (inkl. trastuzumab och lapatinib) fick patienterna antingen TDM-1 eller läkares val enligt klinisk praxis (68 % av patienterna fick trastuzumab + cytostatika) ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1233 . Man såg en kliniskt och statistiskt signifikant förlängd överlevnad med TDM-1 jämfört med övrig behandling (22,7 vs 15,8 månader, HR 0,68, 95 % KI 0,54–0,85). Således är trastuzumab emtansin ett behandlingsalternativ vid tredje linjens behandling om den inte har använts tidigare och om trastuzumab-deruxtekan har använts tidigare eller bedöms inte lämplig.
Tukatinib är en tyrosinkinashämmare med selektiv hämning mot HER2 men minimal hämning mot EGFR. Tukatinib testades i en placebo-kontrollerad randomiserad studie (HER2CLIMB-studie) som tillägg till kapecitabin-trastuzumab efter progress på både pertuzumab och trastuzumab emtansin. Studien tillät även patienter med hjärnmetastaserad sjukdom, vilket gör resultaten väldigt intressanta med tanke på hög risk för hjärnmetastasering vid HER2-positiv bröstcancer. Totalt randomiserades 612 patienter i studien varav nästan hälften hade hjärnmetastaser. Tukatinib ledde till en PFS-vinst på 2,7 månader (7,6 vs 4,9 månader, HR 0,57, 95 % KI 0,47–0,70) och en OS-vinst på 5,5 månader (24,7 vs 19,2 månader, HR 0,73, 95 % KI 0,59–0,90) vilket var konsistent i alla subgrupper inklusive patienter med hjärnmetastaser 1234 . Val mellan trastuzumab emtansin eller tukatinib-trastuzumab-kapecitabin vid tredje eller senare linje får individanpassas, men tukatinib-trastuzumab-kapecitabin är förstahandsval vid hjärnmetastaserad bröstcancer med tanke på HER2CLIMB-studiens resultat.
Vid senare behandlingslinjer är behandlingsalternativ från tredje linjen (trastuzumab dexuxtekan, trastuzumab emtansin, tukatinib-trastuzumab-kapecitabin) förstahandsval om de inte är givna tidigare. Utöver dessa tre behandlingsalternativ kan även trastuzumab + andra cytostatika eller hormonbehandling (för hormonreceptor-positiv/HER2-positiv MBC) eller trastuzumab + lapatinib vara rimliga alternativ.
I en randomiserad studie där 156 patienter med progredierande HER2-positiv MBC fick antingen kapecitabin enbart eller kapecitabin tillsammans med fortsatt trastuzumab såg man en förlängd tid till progression för kombinationen: 8,2 månader jämfört med 5,6 månader för kapecitabin enbart (HR 0,69, 95 % KI 0,48–0,97) 1235 . Även remissionsfrekvensen var högre hos dem som fick fortsätta med trastuzumab, 48,1 % versus 27,0 %. Däremot var det inte någon skillnad i total överlevnad mellan grupperna. I en poolad analys av 2 618 patienter som fick trastuzumab i kombination med olika cytostatika efter progression med första linjens behandling med trastuzumabkombination, kunde man visa objektiva responser på 28,7 % och en progressionsfri överlevnad på 7 månader 1236 .
Lapatinib är en liten molekyl som hämmar tyrosinkinasaktiviteten i HER2-receptorn, och den har även effekt på HER1, det vill säga EGFR. Lapatinib i kombination med trastuzumab jämfört med lapatinib enbart testades på 296 kvinnor med HER2-positiv MBC som hade progredierat på tidigare trastuzumabbaserad behandling 1237 . Den progressionsfria överlevnaden var signifikant bättre för trastuzumab i kombination med lapatinib jämfört med lapatinib enbart, motsvarande en riskkvot på 0,73 (95 % KI 0,57–0,93) medan total överlevnad för trastuzumab och lapatinib jämfört med lapatinib enbart gav en riskkvot på 0,74 (95 % KI 0,57–0,97), motsvarande en överlevnad som ökade från 9,5 till 14 månader. I övrigt är värdet av lapatinib vid HER2-positiv MBC begränsad på grund av icke-övertygande evidens (sämre i kombination med taxaner än trastuzumab + taxaner som första linjens behandling 1238 , sämre progressionsfri och total överlevnad med lapatinib + kapecitabin vs trastuzumab + kapecitabin 1239, ingen överlevnadsvinst med lapatinib + kapecitabin vs kapecitabin 1240 , ingen överlevnadsvinst av lapatinib + letrozol vs Letrozol 1241 , ingen överlevnadsvinst med lapatinib + trastuzumab + aromatashämmare vs trastuzumab + aromatashämmare vs lapatinib + aromatashämmare 1242 och toxicitetsprofil där man ser en ökad biverkningsrisk med tillägg av lapatinib i samtliga studier.
Tillägg av pertuzumab till trastuzumab i senare behandlingslinjer rekommenderas inte utifrån resultat från PHEREXA-studien där tillägg av pertuzumab till trastuzumab + kapecitabin inte ledde till statistiskt signifikant skillnad på progressionsfri överlevnad (HR 0,82, 95 % KI 0,65–1,02) medan den numeriska skillnaden på total överlevnad till fördel för pertuzumabtillägget inte var formellt statistiskt signifikant på grund av att analysen på överlevnaden gjordes med så kallat hierarkiskt test 1243.
Trastuzumab som singelbehandling är måttligt effektiv vid HER2-positiv MBC och rekommenderas därför inte om den inte använts som underhållsbehandling 1244.
Behandlingsalgoritmer vid trippelnegativ MBC
Sammanfattning
- Atezolizumab som tillägg till nab-paklitaxel vid första linjen ger en överlevnadsvinst jämfört med nab-paklitaxel hos patienter med metastased trippelnegativ bröstcancer och PD-L1 ≥ 1 % på immunceller (ESMO-MCBS: 3; +++).
- Pembrolizumab som tillägg till cytostatika (nab-paklitaxel, paklitaxel, karboplatin-gemcitabin) vid första linjen ger en överlevnadsvinst jämfört med cytostatika hos patienter med metastaserad trippelnegativ bröstcancer och Combined Positive Score ≥ 10 (ESMO-MCBS: 4; +++).
- Hos patienter med BRCA-muterad MBC som tidigare har fått minst 1 linje systemisk behandling ger behandling med PARP-hämmare (olaparib, talazoparib) en signifikant längre progressionsfri överlevnad jämfört med cytostatikabehandling med lägre risk för biverkningar (ESMO-MCBS: 4; ++++). Endast talazoparib är subventionerad för denna indikation i Sverige.
- Sacituzumabgovitekan ger en överlevnadsvinst jämfört med cytostatika hos patienter som har fått minst 2 behandlingslinjer varav minst 1 för avancerad sjukdom (ESMO-MCBS: 4; +++).
- Trastuzumab deruxtekan leder till en förbättrad progressionsfri och total överlevnad jämfört med cytostatika (kapecitabine, eribulin, gemcitabin, paklitaxel eller nab-paklitaxel) hos patienter med trippel negativ/HER2-låg MBC som har progredierat på minst 1 linje cytostatikabehandling eller inom 6 månader från avslutad adjuvant cytostatika (ESMO-MCBS: 4; +++).
Rekommendation
Första linjens behandling
- Vid trippelnegativ bröstcancer med CPS ≥ 10 och DFI ≥ 12 månader bör man ge första linjens behandling med pembrolizumab plus cytostatika (nab-paklitaxel, paklitaxel, karboplatin-gemcitabin) (ESMO-MCBS: 4).
- Vid trippelnegativ bröstcancer med PD-L1-uttryck ≥ 1 % på immunceller och DFI ≥ 12 månader bör man ge första linjens behandling med atezolizumab plus nab-paklitaxel (ESMO-MCBS: 3).
- Man rekommenderar att man genomför vävnadsanalys för både CPS och PD-L1 på immunceller för varje aktuell patient eftersom positivitet på dessa analyser inte är överlappande. I första hand analyseras metastasbiopsi och i andra hand primära tumören.
- Cytostatikabehandling rekommenderas som första linjens behandling om PD-L1 < 1 % och CPS < 10. Val av cytostatikaregim följer samma principer som vid hormonreceptor-positiv/HER2-negativ MBC men det finns vissa subtyp-specifika indikationer:
- BRCA-muterad trippelnegativ MBC: Behandling med platinum som singelbehandling bör övervägas i stället för antracyklinbaserad behandling eller taxanbehandling.
- Om kombinationsbehandling är aktuell (t.ex. vid hotande viscerala metastaser) bör man överväga i första hand platinumbaserad kombination med taxaner i första hand eller gemcitabin i andra hand.
- Hos patienter med germline BRCA-mutation rekommenderas behandling med PARP-hämmaren talazoparib för patienter som inte är lämpliga för platinumbaserad cytostatikabehandling (ESMO-MCBS: 4). Patienter ska tidigare ha behandlats med antracyklin och/eller taxan (inkl. i neo-/adjuvant situation), förutsatt att patienterna ansetts lämpliga för dessa behandlingar.
Andra linjens behandling
- Sacituzumabgovitekan bör användas vid behandling av patienter med trippelnegativ MBC som tidigare har fått två eller flera systematiska behandlingar, varav en av dem mot avancerad sjukdom (ESMO-MCBS: 4)
- Trastuzumab deruxtecan rekommenderas hos patienter med HER2-låg, trippelnegativ bröstcancer som tidigare fått kemoterapi för metastaserad sjukdom (ESMO-MCBS: 4).
- Det finns inga direkt jämförande studier mellan sacituzumabgovitekan och trastuzumab deruxtecan men evidensen bakom rekommendation för sacituzumabgovitekan (randomiserad studie dedikerad till trippelnegativ bröstcancer) anses vara högre än för trastuzumab deruxtecan (subgruppsanalys av randomiserad studie). Således rekommenderas sacituzumabgovitekan före trastuzumab deruxtecan vid andra linje.
- Hos patienter med germline BRCA-mutation rekommenderas behandling med PARP-hämmaren talazoparib för patienter som tidigare ha behandlats med antracyklin och/eller taxan, (inkl. i neo-/adjuvant situation), förutsatt att patienterna ansetts lämpliga för dessa behandlingar (ESMO-MCBS: 4). Behandling med talazoparib är förstahandsval jämfört med cytostatika i andra eller senare linje för patienter med germline BRCA-mutation. Behandling med talazoparib är aktuell även hos patienter med tidigare platina-baserad cytostatikabehandling.
- Cytostatikabehandling är ett rimligt behandlingsalternativ om förutsättningar för behandling med sacituzumabgovitekan eller talazoparib inte uppfylls. Val av cytostatikaregim följer samma principer som vid första linjens behandling.
Tredje eller senare linjens behandling
- Sacituzumabgovitekan bör användas vid behandling av patienter med trippelnegativ MBC vid tredje eller senare linje om den inte har givits tidigare (ESMO-MCBS: 4).
- Trastuzumab deruxtecan rekommenderas hos patienter med HER2-låg, trippelnegativ bröstcancer som tidigare fått kemoterapi för metastaserad sjukdom (ESMO-MCBS: 4).
- Sacituzumabgovitekan rekommenderas före trastuzumab deruxtecan vid tredje eller senare linje.
- Cytostatikabehandling är ett rimligt behandlingsalternativ om sacituzumabgovitekan inte kan ges. Eribulin kan övervägas tidigare än övriga cytostatika vid tredje eller senare linje.
Figur 14. Behandlingsalgoritm vid trippelnegativ metastaserad bröstcancer.

Notering. Inklusion i kliniska studier bör övervägas vid samtliga linjer.
En sammanfattning av rekommendationer kring behandling vid trippelnegativ MBC i olika behandlingslinjer presenteras i figur 14.
Första linjens behandling
Checkpointhämmare plus cytostatika
Monoklonala antikroppar som slår ut immunreglerande molekyler såsom CTLA4, PD-1 och PD-L1 används sedan några år mot flera olika cancersjukdomar med betydande effekter. Inom bröstcancerområdet är de trippelnegativa tumörerna den subgrupp där behandlingseffekten med checkpointhämmare är etablerad. Data från fas 1–2-studier där man gav singelbehandling med PD-1/PD-L1-hämmare hos tidigare behandlade patienter med metastaserad trippelnegativ bröstcancer visade relativt låga objektiva responser på 5,7–18,5 % 1245 1246 . Liknande resultat avseende singelbehandling med immunterapi kunde man bekräfta i en randomiserad studie (KEYNOTE-119) där man jämförde PD-1-hämmaren pembrolizumab med läkarens val bland fyra olika cytostatika (kapecitabin, gemcitabin, eribulin, vinorelbin) som andra eller senare linje. I den studien såg man jämförbara resultat mellan pembrolizumab och cytostatika beträffande responser och överlevnad 1247 . Däremot noterade man i preliminära studier högre responser (33–38 %) när PD-1/PD-L1-hämmare kombinerades med cytostatika 1248.
Den första randomiserade studien med tillägg av checkpointhämmare, i form av atezolizumab, på cytostatika (nab-paklitaxel) publicerades 2018 1249. I den studien randomiserade man patienter med trippelnegativ MBC till atezolizumab + nab-paklitaxel eller placebo + nab-paklitaxel efter stratifiering för levermetastasering, behandling med taxaner som pre- eller postoperativ behandling och PD-L1-expression på immunceller (Ventana SP142 assay). Det var 41 % av patienterna som hade PD-L1-expression ≥ 1 % och betraktades som PD-L1-positiva. Man såg en signifikant förbättrad progressionsfri överlevnad med 2,5 månader i kombinationsarmen enbart i subgruppen med PD-L1-positiv sjukdom (7,5 vs 5,0 månader, HR 0,62, 95 % KI 0,49–0,78). Den totala överlevnaden var också signifikant längre med 9,5 månader i kombinationsarmen jämfört med enbart cytostatika i subgruppen med PD-L1-positivitet (25,0 vs 15,5 månader, HR 0,62, 95 % KI 0,45–0,86). Tillägget av atezolizumab i den PD-L1-positiva subgruppen gav också högre andel kompletta remissioner med 10,3 % jämfört med 1,1 %. Immunrelaterade biverkningar var inte så vanliga, med 7,5 % av patienter som drabbades av en grad ≥ 3 immunrelaterad biverkning. I den slutliga analysen av studien beträffande total överlevnad konfirmerades en statistiskt signifikant och kliniskt meningsfull överlevnadsvinst med atezolizumabtillägg i den PD-L1-positiva subgruppen (medianöverlevnad 25,4 vs 17,9 månader, HR 0,67, 95 % KI 0,53–0,86) 1250.
Resultaten av IMpassion131-studien där man kombinerade atezolizumab med paklitaxel som första linjens behandling mot trippelnegativ bröstcancer med PD-L1 positivitet var dock negativa. I IMpassion131-studien såg man att atezolizumab kombinerat med paklitaxel jämfört med placebo plus paklitaxel som första linjens behandling mot trippelnegativ PD-L1-positiv MBC varken förbättrade progressionsfri- (median 6,0 mån vs 5,7 mån, HR 0,82, 95 % KI: 0,60–1,12) eller total överlevnad (median 22,1 mån vs 28,3 mån, HR 1,12, 95 % KI 0,76–1,65) 1251.
Det är oklart vad skillnaden i behandlingseffekt mellan nab-paklitaxel och paklitaxel beror på när de ges tillsammans med atezolizumab. Det är mindre sannolikt att skillnaden till någon väsentlig del beror på användningen av kortikosteroider i samband med paklitaxel med tanke på att immunterapi med checkpointhämmare har visat sig vara effektivt i kombination med andra cytostatika som kräver premedicinering med steroider. Det är rimligt att tänka sig en biologisk förklaring till skillnaden i effekt mellan nab-paklitaxel och paklitaxel. I nab-paklitaxel är drogen bunden till albumin vilket möjliggör infusion av paklitaxel utan lösningsmedel. Detta kan ge en helt annan påverkan på tumörens mikromiljö och därigenom påverka effekten av immunterapin.
I KEYNOTE-355-studien undersökte man tilläggseffekt av pembrolizumab till standardcytostatikabehandling (nab-paklitaxel, paklitaxel eller karboplatin-gemcitabin) jämfört med placebo plus cytostatika som första linje hos patienter med trippelnegativ bröstcancer. Studien randomiserade patienter efter stratifiering för vilken cytostatika som användes (taxan vs icke-taxan), PDL1 uttryck på CPS som tar hänsyn till infärgning både på tumörceller och immunceller (≥ 1 vs ≥ 10 och 22C3 PharmDx assay) och behandling med samma typ av cytostatika som pre-eller postoperativ behandling. Ca 38 % av patienterna hade ett PD-L1 uttryck på CPS ≥ 10. Totalt randomiserades 847 patienter och man såg en statistiskt och kliniskt signifikant PFS-vinst endast för subgruppen med CPS ≥ 10 (9,7 vs 5,6 månader, HR 0,65, 95 % KI 0,49–0,86) 1252. Keynote-355 har visat en kliniskt meningsfull och statistisk signifikant längre total överlevnad med 6,9 månader i kombinationsarmen jämfört med cytostatika-subgruppen med ett PD-L1 uttryck på CPS ≥ 10 (23,0 vs 16,1 månader, HR 0,73, 95 % KI 0,55–0,95) 1253.
Både atezolizumab och pembrolizumab som tillägg till cytostatika är godkända som första linjens behandling hos patienter med trippelnegativ MBC med förutsättning för PD-L1-uttryck. Utifrån nuvarande evidens kring PD-L1 som prediktiv biomarkör vid trippelnegativ MBC rekommenderas följande approach: Analysera båda klonerna (SP142 för PD-L1-uttryck på immunceller, 22C3 för CPS) och gör dem i första hand på metastasbiopsi (inte skelettmetastaser) och i andra hand på primära tumören 1254 1255 1256 . Analyserna är läkemedelsspecifika, vilket innebär att man inte får växla om resultaten, utan det krävs ett PD-L1-positivt resultat på immunceller för behandling med atezolizumab och ett positivt på CPS för behandling med pembrolizumab 1257. Om båda analyserna är positiva får man välja checkpointhämmare utifrån andra faktorer som t.ex. vilken cytostatikabehandling man vill använda som backbone och administreringsschema.
En klinisk situation av speciellt intresse är behandlingsval hos patienter som får recidiv inom 12 månader från neo-/adjuvant cytostatika. Ungefär 20 % av patienterna som inkluderades i KEYNOTE-355 studien hade recidiverat inom 6-12 månader från neo-/adjuvant cytostatika, en patientpopulation som inte inkluderades i IMpassion130-studien där inklusionskriteriet var att det måste ha gått minst 12 månader till recidiv. I subgruppsanalys av de patienterna kunde man inte se någon nytta med pembrolizumab-tillägget (HR: 1,44; 95% KI: 0,73-2,82) 1253 . Resultat från IMpassion132 studie randomiserades patienter med recidiv inom 12 månader från avslutad neo-/adjuvant cytostatika till cytostatika (karboplatin-gemcitabin eller kapecitabin) plus atezolizumab eller placebo. Hos patienter med PD-L1 ≥ 1% (SP142; immunceller) kunde man inte se någon skillnad på total överlevnad med tillägg av atezolizumab (HR: 0,93; 95% KI: 0,73-1,20) 1258. För den patientgruppen med snabbt recidiv rekommenderas således inte pembrolizumab eller atezolizumab utan cytostatika som inte ingick i neo-/adjuvant schema är det enda behandlingsalternativet i nuläget.
Behandlingsalternativ om checkpointhämmare inte är en lämplig behandling
Cytostatikabehandling rekommenderas som första linjens behandling om PD-L1 < 1 % och CPS < 10. Det finns ett fåtal randomiserade studier dedikerade till patienter med trippelnegativ MBC som undersöker behandlingseffekt av cytostatika. I TNT-studien randomiserades 376 patienter med trippelnegativ bröstcancer till antingen karboplatin eller docetaxel som första linjens behandling 1259. Det primära effektmåttet var objektiva responser och man såg ingen skillnad i intention-to-treat-populationen. Däremot kunde man påvisa signifikanta högre responser med karboplatin jämfört med docetaxel hos patienter med germline BRCA-mutation (objektiv respons 68 % med karboplatin vs 33 % med docetaxel). Studien kunde således inte bekräfta evidensen som finns från preoperativa studier där man kunde se bättre responser i form av pCR hos patienter som behandlas med platinabaserad behandling jämfört med icke-platinumbaserad behandling 232. Således finns det evidens för att använda platinumsalter vid tidiga linjer vid metastaserad BRCA-muterad trippelnegativ bröstcancer, men man kan inte generellt rekommendera platinumsalter som första linjens behandling vid icke-BRCA-muterad trippelnegativ bröstcancer. Val av cytostatikaregim vid icke-BRCA-muterad trippelnegativ MBC får följa samma principer som vid hormonreceptor-positiv/HER2-negativ MBC. Däremot finns det stöd för att använda platinumbaserad kombinationsbehandling i stället för icke-platinumbaserade kombinationer vid metastaserad trippelnegativ bröstcancer där kombinationen kommer i fråga (t.ex. vid hotande viscerala metastaser) 1260 1261.
Om man väljer kombinationsbehandling finns det stöd att välja platinum plus taxaner i första hand jämfört med platinum plus gemcitabin. I tnAcity-studien randomiserades patienter med trippelnegativ MBC till första linjens behandling med nab-paklitaxel plus karboplatin, gemcitabin plus karboplatin, eller nab-paklitaxel plus gemcitabin och man noterade längre PFS och OS med nab-paklitaxel plus karboplatin (mediantid 8,3 vs 6,0 vs 5,3 månader för PFS, 16,8 vs 12,6 vs 12,1 månader för OS) 1260.
Bevacizumab (monoklonal antikropp mot VEGF, vascular endothelial growth factor) i kombination med pakltiaxel är också godkänd som första linjens behandling mot HER2-negativ MBC. Tillägget leder till en förbättrad PFS men i avsaknad av OS-vinst och med tanke på ökad biverkningsrisk har behandlingen en mycket begränsad användning i klinisk praxis ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1262 .
Patienter med germline BRCA-mutation
Förutom val av platinabaserad behandling som första linjens behandling hos patienter med gBRCA-mutation, PD-L1 < 1 % och CPS < 10 kan vissa patienter vara aktuella för PARP-hämmare i tidiga linjer. Enligt behandlingsindikation för PARP-hämmare ska patienterna tidigare ha behandlats med antracykliner och/eller taxan antingen som neo/adjuvant eller vid metastaserad situation om de är lämpliga för dessa behandlingar. Det kan finnas patienter som tidigare har fått antracykliner och/eller taxaner som en del av kurativ behandling och bedöms inte vara lämpliga för platinabaserad behandling. För dessa patienter är PARP-hämmare ett rimligt behandlingsalternativ.
Att använda PARP-hämmare i tidiga behandlingslinjer stöds av posthoc-analyser från studierna OlympiAD och EMBRACA, där man ser numeriskt en större vinst av PARP-hämmare hos patienter som inte har fått cytostatikabehandling vid metastaserad situation ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1186 1188 .
PARP-hämmare (veliparib) har också testats i kombination med platinabaserad behandling (karboplatin + paklitaxel) och därefter som underhållsbehandling i en randomiserad studie som visade att veliparib-tillägget ledde till en modest men statistiskt signifikant förbättring av progressionsfri överlevnad (medianvinst på 1,9 månader); inga resultat beträffande total överlevnad har presenterats än 168.
Andra linjens behandling
Sacituzumabgovitekan är förstahandsval som andra linjens behandling hos patienter som har fått cytostatikabehandling (+/- checkpointhämmare) som första linje. I ASCENT-studien undersökte man potentiell nytta av sacituzumabgovitekan jämfört med cytostatika (läkares val bland fyra olika cytostatika: eribulin, kapecitabin, vinorelbin, gemcitabin) hos patienter med trippelnegativ MBC och minst två tidigare behandlingslinjer (median 3 linjer). Totalt randomiserades 468 patienter till sacituzumabgovitekan versus cytostatika. Sacituzumabgovitekan ledde till en statistiskt signifikant PFS-vinst på 3,9 månader (5,6 vs 1,7 månader, HR 0,41, 95 % KI 0,32–0,52) och OS-vinst på 5,4 månader (12,1 vs 6,7 månader, HR 0,48, 95 % KI 0,38–0,59). Man noterade samtidigt en större risk för grad ≥ 3 neutropeni (51 % vs 33 %), febril neutropeni (6 % vs 2 %), anemi (8 % vs 5 %) och diarréer (10 % vs < 1 %) med sacituzumabgovitekan jämfört med cytostatika 1263 . I en subanalys av ASCENT-studien med totalt 65 patienter som hade fått en behandlingslinje vid metastaserad situation (sacituzumabgovitekan gavs som andra linjens behandling) kunde man se liknande överlevnadsvinst med sacituzumabgovitekan som i intention-to-treat-analysen 1264 .
Om sacituzumabgovitekan inte är lämplig är trastuzumab deruxtecan (vid HER2-låg sjukdom; var god läs 19.5.3) eller cytostatikabehandling (vid HER2-zero sjukdom) ett rimliga behandlingsalternativ.
Vid gBRCA-mutation är PARP-hämmare också ett behandlingsalternativ om platinabaserad behandling inte anses lämplig. Varken OlympiAD eller EMBRACA jämförde PARP-hämmare med platinum, som har visat sig vara en effektiv behandling vid trippelnegativ BRCA-muterad MBC 1259. Däremot kunde man se i båda studier att behandling med PARP-hämmare var effektiv även för patienter som tidigare hade fått platinum som adjuvant behandling (minst 6 månaders intervall mellan sista platinum-dosen och initiering av PARP-hämmare) eller som en del av behandling vid metastaserad sjukdom (ingen sjukdomsprogress under platinumbehandling var tillåtet). Det finns således ingen randomiserad evidens om behandlingssekvensen mellan platinum och PARP-hämmare vid trippelnegativ BRCA-muterad MBC. Prekliniska data samt data från observationsstudier Med tanke på att det saknas evidens för effekt av behandling med platinabaserad behandling efter progress på PARP-hämmare är det rimligt att överväga platinum som förstahandsalternativ för patienter som är i skick för cytostatikabehandling, medan PARP-hämmare skulle kunna vara ett rimligt alternativ för patienter som inte är aktuella för cytostatikabehandling.
Tredje eller senare linjens behandling
Sacituzumabgovitekan är förstahandsval vid tredje eller senare behandlingslinjer om den inte har använts förut. Cytostatikabehandling är ett rimligt behandlingsalternativ om sacituzumabgovitekan har använts tidigare. Vid val av cytostatikabehandling i senare behandlingslinjer finns randomiserad evidens om att eribulin leder till en överlevnadsvinst jämfört med andra cytostatika inkl. kapecitabin hos patienter med trippelnegativ MBC 1265. PARP-hämmare är också ett rimligt behandlingsalternativ vid gBRCA-mutation om behandlingen inte har givits tidigare.
I DESTINY-Breast04-studien som undersökte trastuzumab deruxtecan vs läkares cytostatikaval hos patienter med HER2-låg MBC inkluderades 58 patienter med trippelnegativ MBC och HER2-låg. I studien kunde man se en förbättrad progressionsfri och total överlevnad när trastuzumab deruxtecan användes i denna subgrupp jämfört med cytostatika.
Behandlingsstrategier vid hjärnmetastaserad bröstcancer
Rekommendationer vid CNS-metastaser – lokal behandling
- Vid singel eller oligometastatisk (2–4 metastaser) hjärnmetastasering bör man överväga kirurgisk exstirpation med eller utan postoperativ stereotaktisk strålbehandling alternativt stereotaktisk strålbehandling beroende på symtom, lokalisation samt storlek på metastaser och resektabilitetsbedömning. Helhjärnsbestrålning bör undvikas i den situationen för att undvika risken för kognitiv påverkan.
- Vid extensiv hjärnmetastasering bör man överväga helhjärnsbestrålning om patientens allmäntillstånd tillåter alternativt enbart best supportive care.
Rekommendationer vid CNS-metastaser – systemisk behandling
- För patienter med progress av extrakraniella metastaser vid diagnos av CNS-metastaser rekommenderas byte av systemisk behandling.
- För patienter med stabila extrakraniella metastaser vid diagnos av CNS-metastaser kan man fortsätta med oförändrad HER2-riktad behandling förutsatt att adekvat lokalbehandling kommer att ges.
- Vid nyupptäckta asymtomatiska hjärnmetastaser eller progress på hjärnmetastaser utan fokala neurologiska bortfall, kan man överväga byte av systemisk HER2-riktade behandling och avvakta med lokal behandling om något av följande alternativ är aktuella: pertuzumab + trastuzumab + cytostatika, trastuzumab-deruxtekan, trastuzumab-tukatinib-kapecitabin, trastuzumab emtansin.
Rekommendationer vid leptomeningeal carcinomatos
- Intratekal behandling ger inte någon säker överlevnadsvinst jämfört med systemisk behandling; systemisk behandling rekommenderas i första hand.
- Strålbehandling bör övervägas vid fokala symtomatiska lesioner.
- Helhjärnsbestrålning kan övervägas vid extensiv, symtomatisk sjukdom eller samtidigt CNS-metastasering.
Allmänt
Cirka 15 % av patienterna med hormonpositiv (HR+)/HER2-negativ metastaserad bröstcancer (MBC) kommer att utveckla BCBrM 1266 . Några studier tyder på att nästan 50 % av patienterna med generaliserad HER2+ 1267 1268 1269 1270 och trippelnegativ bröstcancer utvecklar hjärnmetastaser. Framsteg har gjorts i neoadjuvant/adjuvant behandling av tidig bröstcancer vilket minskat risken för extrakraniella fjärrmetastaser utan att risken för CNS-metastaser påverkats, detta gäller framför allt HER2+-bröstcancer 1271.
Det finns idag inga säkra data som kan avgöra vilka patienter med vare sig tidig eller generaliserad bröstcancer som kommer att utveckla CNS-metastaser, och nuvarande internationella riktlinjer såsom nationella vårdprogrammet avråder från rutinmässig screening vid avsaknad av symtom som skulle tyda på hjärnmetastaser.
Behandling
Eftersom patienter med CNS-metastaser tidigare exkluderats från kliniska studier finns det begränsade data om effekt av olika typer av behandlingar, framför allt gäller detta läkemedel.
Lokalbehandling
Efter diagnos av CNS-metastas(er) rekommenderas ett multidiciplinärt omhändertagande. Lokalbehandling (kirurgi, strålbehandling (RT) eller stereotaktisk RT) har varit förstahandsbehandling och rekommenderas idag patienter med symtom och där läkemedelsbehandling med intrakraniell effekt saknas 1272 . För att hantera större CNS-metastaser eller för att få snabb symtomlindring (och för att få tillgång till vävnad) rekommenderas kirurgi. Vid ett fåtal metastaser rekommenderas kirurgi följt av strålbehandling. Stereotaktisk strålbehandling (RT) ges vid ett begränsat antal metastaser som inte överstiger 4 cm. Det saknas tydliga rekommendationer angående antalet CNS-metastaser lämpliga för stereotaktisk RT men enligt ASCO:s riktlinjer från 2022 finns data av intermediär kvalitet för en svag rekommendation för stereotaktisk RT av 1–4 metastaser och data av låg kvalitet för en moderat rekommendation av stereotaktisk RT av 5 metastaser eller fler 1273 .
Strålbehandling av hela hjärnan (WBRT) försämrar den kognitiva funktionen och patientens livskvalitet och därför rekommenderas att man undviker hippocampusområdet 1273 1274 . WBRT kan rekommenderas patienter med multipla CNS-metastaser eller med leptomeningeal carcinomatos 1273 .
Systemisk behandling
Detta avsnitt är en sammanfattning av evidens kring nytta av systemisk behandling intrakraniellt vid olika bröstcancersubtyper.
Hormonreceptor-positiv/HER2-negativ bröstcancer
- Ingen av de kliniska prövningarna i första eller andra linjens behandling med CDK 4/6-hämmare som syftade till registrering inkluderade patienter med CNS-metastaser.
- abemaciklib eller ribociclib + endokrin behandling är de mest studerade CDK 4/6-hämmarna hos patienter med CNS-metastaser och kan rekommenderas patienter med stabila CNS-metastaser 1275 1276 . Abemaciklib + hormonterapi är den enda studerade CDK 4/6-hämmaren vid aktiva CNS-metastaser och kan användas i denna grupp.
Data på abemaciklib finns från en fas 2-studie. Patienterna delades in i 4 cohorter beroende på subtyp och typ av CNS-metastaser (solida metastaser eller meningeal carcinos). Totalt behandlades 58 patienter med Lum BC och aktiva CNS-metastaser med i median 3 tidigare behandlingslinjer och 47 % hade tidigare fått WBRT. Man fann en intrakraniell objektiv responsfrekvens (definierad som CR eller PR) på 5,2 % (uppnådde inte det primära effektmåttet). Abemaciklib gav dock en intrakraniell klinisk benefit (iCCB) på 24 % och 38 % av patienterna hade en volymsminskning av CNS-metastaserna 1275.
Nyligen publicerades data från en enarmad fas 3b-studie, CompLEEment-1, som undersökte första linjens ribociclib plus letrozol i Lum metastaserad BC. Av 3 246 patienter hade 51 patienter stabila, asymtomatiska CNS-metastaser. TTP skilde sig inte åt mellan patienter med endast extrakraniell sjukdom eller de med CNS-metastaser (ca 27 månader) 1276.
- PIK3CA-mutationer kan vara vanligare i CNS-metastaser av patienter med hormonreceptor-positiv/HER2-negativ bröstcancer (än i primärtumören) men värdet av alpelisib är inte studerat.
- Kliniska studier pågår med syfte att utvärdera trastuzumab deruxtecan hos patienter med HER2-låg MBC. En liten grupp av 10 patienter med CNS-metastaser vid inklusion i DAISY-studien (fas 2) visade en objektiv respons på 30 % 1277 . I DEBBRAH-studien inkluderades 6 patienter med antingen CNS-metastaser som progredierat efter lokalbehandling eller asymtomatiska obehandlade CNS-metastaser med en objektiv responsfrekvens på 50 % 1278.
HER2-positiv bröstcancer
Nya HER2-riktade läkemedel som visat intrakraniell aktivitet har lett till diskussion om möjligheten att skjuta upp lokalbehandling hos asymtomatiska patienter 1279 .
- Första linjens behandling med pertuzumab + trastuzumab + taxaner förlängde tiden till diagnos av CNS-metastaser jämfört med trastuzumab + taxaner (15 jämfört med 12 månader i kontrollgruppen) 1280 . Patienter med CNS-metastaser vid diagnos uteslöts dock från studien.
- Trastuzumab deruxtecan är statistiskt signifikant bättre än trastuzumab emtansin som andra linjens behandling hos patienter med stabila CNS-metastaser 1227 .
- Tucatinib som tillägg till trastuzumab och kapecitabin förbättrar intrakraniell och extrakraniell progressionsfri överlevnad samt total överlevnad i aktiva och stabila hjärnmetastaser jämfört med trastuzumab + kapecitabin 1234 .
- Trastuzumab-deruxtekan har visat statistiskt signifikant förbättrad intrakraniell effekt än jämförelseläkemedel i den sammanslagna analysen av patienter med CNS-metastaser i DESTINY-Breast01 (fas 2), DESTINY-Breast02 (fas 3) och DESTINY-Breast03 (fas 3). Intracranial Objektiv Response Rate (iORR) var 45,2 % i gruppen med behandlade/stabila CNS-metastaser och 45,5 % i gruppen med obehandlade/aktiva CNS-metastaser. Medianvärdet för varaktigheten av intrakraniell respons var 12,3 och 17,5 månader i respektive grupp. I jämförelsegruppen var iORR 27,6 % för patienter med behandlade/stabila CNS-metastaser och 12,0 % för patienter med obehandlade CNS-metastaser. Medianvärdet för varaktigheten av intrakraniell respons var 11,0 månader i gruppen med behandlade/stabila CNS-metastaser. Data angavs inte för patienter med aktiva CNS-metastaser 1281 . Trastuzumab-deruxtekan visade en intrakraniell respons på 73,3 % i en fas 2-studie av 15 patienter med nyupptäckta icke-behandlade eller progredierande hjärnmetastaser 1282.
- Trastuzumab emtansin har visat kunna uppnå en intrakraniell respons på 49,3 % hos patienter med nyupptäckta CNS-metastaser utan lokal behandling, medan totala överlevnaden var i median 18,9 månader i en fas 3b-studie 1283.
Trippelnegativ bröstcancer
Det har varit svårt att specifikt studera effekt av läkemedel intrakraniellt vid TNBC, eftersom snabb progress av extrakraniella metastaser är vanligt 1284 .
- Mycket få patienter med CNS-metastaser inkluderades i studierna av immunterapi för generaliserad TNBC (3,3 %) och effekten i denna patientgrupp rapporterades inte specifikt 1285 .
- Subgruppsanalys från fas-3 i ASCENT-studien visade en förbättrad responsfrekvens och PFS jämfört med cytostatikabehandling för patienter med TNBC och stabila CNS-metastaser vid inklusion, men man fann ingen skillnad i OS 1286 .
Patienter med germline BRCA1/2-mutation och CNS-metastaser från HER2 negativ bröstcancer
Subgruppsanalyser vad gäller effekten av PARP-hämmare på CNS-metastaser finns från de två palliativa studierna OlympiAD (olaparib) och EMBRACA (talazoparib) som båda randomiserade patienter med germline BRCA1/2 mutationer och generaliserad HER2-negative bröstcancer mellan respektive PARP-hämmare och standard-cytostatikabehandling. Resultaten från OlympiaD-studien visade en förbättring av både PFS och ORR oavsett metastaslokal (lung-/pleura-, lever- eller CNS-metastaser). Patienter med CNS- metastaser hade en ORR på 64,7 % med olaparib jämfört med 20,0 % med läkarens val av cytostatikabehandling 1287 . Data från EMBRACA-studien visade en längre PFS för patienter som fick talazoparib jämfört med läkarens val av cytostatikabehandling för hela populationen och för gruppen med CNS-metastaser 1188 .
Leptomeningeal carcinomatos
Incidens av leptomeningeal carcinomatos hos patienter med MBC är cirka 5 % och är ofta en senare komplikation av sjukdomen, även om några fallbeskrivningar med leptomeningeal carcinomatos som första manifestation av trippelnegativ MBC har publicerats 1288. Det finns en tydlig koppling mellan lobulär fenotyp och risk för utveckling av leptomeningeal carcinomatos 1289 samt en överrepresentation av trippelnegativ subtypning bland patienter som drabbas av leptomeningeal carcinomatos 1288 . Median överlevnad är tyvärr begränsad (~ 4 månader, 1-års överlevnad på cirka 20 %) även vid intensiv behandling, även om det finns fallbeskrivningar av patienter med överlevnad > 6 månader 1290.
EANO (European Association of Neuro-Oncology) och ESMO (European Society for Medical Oncology) har nyligen publicerat utförliga riktlinjer kring diagnos, behandling och uppföljning av leptomeningeal carcinomatos vid solida tumörer 1291.
Avseende onkologisk behandling vid leptomeningeal carcinomatos hos patienter med MBC bör följande aspekter tas i beaktande.
- Intratekal behandling har inte kunnat påvisa någon överlevnadsvinst i två små randomiserade studier som inkluderade bröstcancerpatienter 1292 1293. Värdet av intratekal behandling hos patienter med MBC kan ifrågasättas även när man analyserar data från observationsstudier 1294 1295.
- Evidens kring inverkan av systemisk onkologisk behandling på leptomeningeal spridning hos patienter med MBC begränsas till små prospektiva och retrospektiva studier samt fallbeskrivningar 1291.
- Strålbehandling har inte kunnat visa någon överlevnadsvinst utan behandlingen bör betraktas som symtomatisk 1288 1291.
Skelettstärkande (antiresorptiv) behandling
Rekommendationer
- Patienter med skelettmetastaser bör, utöver standardbehandling, få tillägg av antiresorptiv behandling i form av bisfosfonat (intravenöst) eller denosumab (subkutant), eftersom det minskar de skelettrelaterade händelserna vid skelettmetastaserad bröstcancer.
- Vid val av zoledronsyra är intravenös infusion var tredje månad likvärdig med infusion var fjärde vecka.
- Med tanke på risk för osteonekros i käken rekommenderas tandläkarbedömning för undersökning och förebyggande sanering av eventuell patologi i käkarna till alla patienter med MBC innan antiresorptiv behandling inleds.
- Den optimala behandlingslängden av antiresorptiv behandling är inte fastställd. Det finns ingen evidens för fortsatt behandlingseffekt efter 3 års behandling med bisfosfonater. En nytta-riskanalys bör genomföras där man tar hänsyn till risken för skelettrelaterade händelser, biverkningar, patientens allmäntillstånd och förväntad överlevnad.
- En ökad risk för frakturer har observerats efter avslutad denosumabbehandling, vilket motiverar en längre behandling med denosumab eller ställningstagande till bisfosfonatbehandling efter avslutad denosumab för att minska benförlusten.
Två kategorier av antiresorptiva läkemedel är aktuella vid skelettmetastaserad bröstcancer. Bisfosfonater (första generation som klodronat, andra generation som pamidronat, alendronat, tredje generation som ibandronat, zoledronat) anses ha effekt genom att hämma osteoklastaktiviteten. De senare generationernas bisfosfonater har högre potens än första generationens bisfosfonater och det är de som rekommenderas vid skelettmetastaserad malignitet. Denosumab är en human antikropp som binder sig till RANKL, vilket är en faktor som har betydelse för nybildning och funktion av osteoklaster.
Det finns randomiserad evidens av hög kvalitet som påvisar att antiresorptiv behandling minskar risken för s.k. skelettrelaterade händelser (SRE) dvs. patologiska fakturer, strålbehandling mot skelettmetastaser, skelettkirurgi och kompression av ryggmärgen.
I en systematisk översikt har resultatet från 9 studier med 2 891 patienter med skelettmetastaserad bröstcancer ingått i jämförelser av bisfosfonatbehandling med placebo eller ingen bisfosfonat ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1296 . Bisfosfonater minskade risken för SRE men även skelettrelaterade smärtan (i 6 av 11 studier), medan man i 3 av 5 studier kunde se en förbättrad livskvalitet. Man kunde dock inte se någon skillnad avseende total överlevnad.
Tre randomiserade studier har undersökt om deeskalering av bisfosfonatbehandling med längre tid till infusion (12 veckor i stället för 4 veckor) är likvärdig avseende risken för skelettrelaterade händelser. Det finns en del skillnader i studiedesign. Men i alla 3 jämförde man samma antiresorptiva behandling, det vill säga zoledronsyra. Man fann också liknande resultat: att en deeskalering med längre tid till infusion var minst lika effektiv med tätare infusioner 1297 1298 1299.
I tre studier med 2 345 patienter med skelettmetastaserad MBC var denosumab något mer effektivt än zoledronat för att minska risken för SRE, med en 22 % relativ minskning utan någon skillnad beträffande överlevnad ' href='/link/fbd74362e44140c28e730e4c55b5b980.aspx#undefined' class='reference-content'>1296 .
Zoledronsyra ger oftare njurpåverkan medan denosumab oftare ger hypokalcemi. Båda preparaten ger en ökad risk för osteonekros i käken och därför rekommenderar man tandläkarbedömning för undersökning och förebyggande sanering av eventuell patologi i käkarna innan behandlingen inleds. Denosumab har fördelen att ges subkutant. Tillskott av kalcium och vitamin D3 ska ges till patienter som behandlas med denosumab eller zoledronat.
Det finns inga randomiserade studier om behandlingslängd med antiresorptiv behandling. Det finns visst stöd för fortsatt förebyggande effekt mot skelettrelaterade händelser med upp till 3 års behandling 1300 . En nytta-riskanalys bör genomföras där man tar hänsyn till risk för skelettrelaterade händelser, biverkningar, patientens allmäntillstånd och förväntad överlevnad.
Med tanke på risken för en rebound-effekt avseende benmineralhalten som man har noterat efter att man avslutar denosumab-behandling och att den verkar resultera i en ökad frakturfrekvens, rekommenderar man att fortsätta med bisfosfonatbehandling efter avslutad denosumabbehandling för att undvika den potentiella snabba benförlusten 1301.
Behandlingsstrategier vid oligometastatisk sjukdom
Rekommendationer
- Lokalbehandling (kirurgi eller SABR eller radiofrekvensbehandling) rekommenderas generellt inte eftersom evidensläget för lokalbehandling av lokalisationer annan än CNS är lågt. En randomiserad studie som inkluderade olika cancertyper var positiv medan den enda randomiserade studien dedikerad till bröstcancerpatienter var negativ.
Sammanfattning
- Oligometastaserad bröstcancer (OMBC) definieras som 1–5 metastaser i 1–2 organ (++)
- En andel av dessa patienter kan ha mycket lång överlevnad (++).
- Optimal systemisk behandling är grundbehandling (+++)
För metastalokaler utanför CNS finns två randomiserade studier med motstridiga resultat om eventuella nyttan av stereotaktisk ablativ strålbehandling (SABR) varför inklusion i studier är viktigt (++).
Bakgrund
Begreppet oligometastaser ses som ett mellanting mellan lokal botbar sjukdom och en generaliserad cancer med begränsad överlevnad (definieras enligt ABC-konsensusriktlinjerna som 1–5 metastaser med begränsad volym inte nödvändigtvis i ett organ 1124 ). Man skiljer på äkta oligometastatisk bröstcancer (OMBC), inducerad OMBC (generaliserad sjukdom som efter behandling minskar till ett fåtal metastaser) och återkommande OMBC (tidigare OMBC som gått i komplett remission och som återkommer) där den första gruppen har bäst prognos 1302. Det här avsnittet fokuserar på äkta OMBC, dvs. återfall eller de novo-metastatisk bröstcancer med 1–5 metastaser i 1–2 organ.
Initialt var kirurgi den dominerande behandlingen av oligometastaser, men under senare år har nya metoder fått ökad uppmärksamhet, framför allt stereotaktisk ablativ strålbehandling (SABR). Eftersom metoden inte är invasiv är den tillgänglig för en större grupp patienter och den har varit väl tolererad med mycket få allvarliga biverkningar.
Undersökningar som talar för en positiv effekt av lokalbehandling grundar sig på jämförelser mellan hårt selekterade patientpopulationer med gott allmäntillstånd och liten sjukdomsbörda, och patienter med dåligt allmäntillstånd, hög ålder eller mer omfattande sjukdom 1303 1304. Det finns ett flertal fas 2-studier som undersökt kirurgisk intervention vid OM framför allt av lever- men också lungmetastaser. Detta är oftast studier genomförda på en klinik och har ofta mycket kort uppföljningstid . Det vetenskapliga värdet bedöms därför som lågt och ligger inte till grund för behandlingsrekommendationer. På motsvarande sätt finns ett flertal fas 2-studier som undersökt effekten av SABR vid OMBC som också har ett lågt bevisvärde 1304.
Randomiserade studier
En mindre randomiserad fas 2-studie (COMET-studien) med totalt 99 inkluderade patienter, varav endast 18 med bröstcancer, med oligometastas vid återfall har publicerats 1305. Patienterna hade att flertal cancersjukdomar (bröst-, prostata-, kolorektal-, lungcancer, njurcancer) randomiserades till systemisk behandling (standardbehandling) eller systemisk behandling + SABR (experimentell arm). Alla organ utom CNS-metastaser accepterades. Gruppen som fick tillägg med SABR hade en statistiskt signifikant förlängning av progressionsfri överlevnad från 6 till 12 månader (p < 0,001).
5-årsöverlevnaden var 24 % för patienter som endast fick systemisk behandling jämfört med 46 % för de som fick tillägg med SABR. Majoriteten av patienterna hade ≤ 3 metastaser men upp till 5 var godkänt för inklusion i studien. En senare uppföljning rapporterade en 5-årsöverlevnad på 17,7 % och 42,3 % för patienter som fick systemisk behandling eller systemisk behandling + SABR 1306. Man fann inte några nytillkomna allvarliga sena biverkningar med tillägget av SABR och det var ingen skillnad i livskvalitet mellan behandlingsgrupperna.
NRG-BR002-studien presenterades på ASCO 2022. Denna studie inkluderade 125 patienter med OMBC som randomiserades 1:1 till systemisk behandling eller systemisk behandling + lokalbehandling (SABR eller kirurgi). 60 % av patienterna hade 1 metastas och 79,2 % var ER+/HER2-negativa. Resultaten visade ingen förbättring av vare sig PFS eller OS för gruppen som fick lokalbehandling: PFS (experimentell grupp vs kontrollgrupp, HR 0,92, 95 % KI 0,71–1,17) och OS (HR 1,23, 95 % KI 0,63–2,39) 1307. Således finns det motstridiga resultat med den positiva COMET-studien och den negativa NRG-BR002-studien, och större randomiserade fas 3-studier för patienter med OMBC efterfrågas.
Säkerhet vid stereotaktisk ablativ strålbehandling
Den mest omfattande presentationen av SABR-relaterad toxicitet kommer från en prospektiv registerbaserad, enarmad observationsstudie från England. Studien inkluderade 1 422 patienter som fick SABR för extrakraniella OM (1–3 metastaser) från flera typer av cancer, varav 78 bröstcancerpatienter. Mediantiden för uppföljning var 13 månader (IQR 6–23). Total överlevnad var 92,3 % (95 % KI 90,5–93,9) efter 1 år och 79,2 % (76,0–82,1) efter 2 år. Den vanligaste grad 3-biverkningen var trötthet (28 [2,0 %] av 1 422 patienter) och den vanligaste allvarliga (grad 4) händelsen var förhöjda leverenzymer (9 [0,6 %]). Inga behandlingsrelaterade dödsfall rapporterades. Sammanfattningsvis tolkas SABR som en behandling med låg toxicitet 1308.
Sammanfattning
Sammanfattningsvis är systemisk behandling grundbehandlingen vid OMBC medan värdet av tillägg med lokalbehandling (kirurgi, SABR eller strålbehandling) är oklar och rekommenderas därför inte generellt.
