Postoperativ medicinsk behandling
Postoperativ medicinsk behandling
Syftet med detta kapitel är att sammanfatta alla former av medicinsk tilläggsbehandling (s.k. postoperativ eller adjuvant behandling) av bröstcancer, det vill säga behandling efter kirurgi. Målet med denna behandling är att eliminera mikrometastatisk sjukdom. Här tas i princip bara prospektiva och randomiserade studier och evidensgradering upp till diskussion.
Bedömningen av vilka patienter som ska behandlas och med vilken typ av tilläggsbehandling är i dag baserad på riskanalyser på gruppnivå. Om den enskilda individen kommer att ha nytta av tilläggsbehandling kan man dock inte förutsäga. De prediktiva faktorer som har stor betydelse är ER-positivitet som är en förutsättning för effekten av endokrin behandling, och HER2-positivitet som är en förutsättning för effekten av trastuzumab eller annan anti-HER2-riktad behandling. Hög proliferation uppmätt med Ki67 är en oberoende prognosfaktor, men det är oklart om den även kan förutsäga nyttan av cytostatikabehandling.
Det går inte att fastslå en gräns för överdödlighet 692. När cytostatika kan rekommenderas beror på sjukdomens biologi, patientens biologi, patientens inställning och patientens livssituation. Om risken för återfall är stor, som för lymfkörtelnegativa tumörer med riskfaktorer och majoriteten av lymfkörtelpositiva tumörer, är det allmänt accepterat att ge postoperativ behandling. För dessa är risken för återfall 20–30 % eller högre. Vid ER-positiv bröstcancer måste risken för återfall på lång sikt (10–20 år) beaktas när diskussionen om postoperativ behandling förs med patienten 693694.
Tilläggsbehandling med cytostatika för HER2-negativ bröstcancer
Rekommendationer
- Vid ER-positiv, HER2-negativ bröstcancer rekommenderas kombinationscytostatika vid tumörer som är större än 10 mm med riskfaktorer (luminal B) eller ålder < 35 år eller vid körtelpositiv sjukdom (++++).
- Vid osäkerheter kring riskstratifiering (se figur 10) av lymfkörtelnegativ ER-positiv, HER2-negativ bröstcancer avseende riskgrupp hos postmenopausala kvinnor bör man utföra genexpressionsanalys (++++).
- Genexpressionsanalys bör övervägas hos postmenopausala kvinnor med ER-positiv, HER2-negativ bröstcancer med 1–3 positiva lymfkörtlar där det finns osäkerhet kring tumörens riskkategorisering inför beslut om cytostatikaindikation (+++).
- Genexpressionsanalys med Oncotype Dx kan övervägas hos premenopausala kvinnor med ER-positiv, HER2-negativ och lymfkörtelnegativ bröstcancer där det finns osäkerhet kring tumörens riskkategorisering (++).
- Vid trippelnegativ bröstcancer rekommenderas cytostatika hos patienter med tumörstorlek > 5 mm eller lymfkörtelpositiv sjukdom (++++).
- Grundprincipen vid tilläggsbehandling med cytostatika är att en antracyklinkombination (EC) ska ges i sekvens med en taxan (docetaxel eller paklitaxel), till exempel (++++):
– E90 + C600 x 3–4 → docetaxel 100 x 3–4 givet var tredje vecka, eller den omvända sekvensen med docetaxel först.
– E90 + C600 x 3–4 → paklitaxel x 9–12 givet veckovis, eller den omvända sekvensen. - För patienter ≤ 65 års ålder med lymfkörtelpositiv bröstcancer, rekommenderas i första hand dostät antracyklin–taxanbaserad cytostatikabehandling med E90 + C600 x 4 varannan vecka följt av paklitaxel x 12 veckovis eller paklitaxel 175 x 4 varannan vecka eller docetaxel 75 x 4 varannan vecka eller den omvända sekvensen (++++).
- För patienter med trippelnegativ bröstcancer kan kapecitabin-innehållande cytostatikabehandling övervägas som ett alternativt schema för att öka dosintensiteten (+++):
– docetaxel 60 + (kapecitabin 900 x 2 dag 1–14) x 3–4 → E75 + C600 + (kapecitabin 900 x 2 dag 1–14) x 3–4, givet var tredje vecka. - DPD-test (dihydropyrimidindehydrogenas) bör utföras på alla patienter innan start av behandling med kapecitabin (+++).
- För patienter med trippelnegativ bröstcancer som inte har erhållit preoperativ cytostatika kan tillägg av adjuvant karboplatin övervägas (+++).
- För patienter med kontraindikation mot taxan, kan man ge adekvat doserad antracyklinregim såsom E 75–90 + C x 6 givet var tredje vecka (+++).
- För patienter med måttlig återfallsrisk eller där antracykliner bedöms mindre lämpliga, kan man ge D75 + C600 x 6 (+++).
- G-CSF bör i allmänhet ges vid regimer kopplade till risk för neutropen feber > 20 % eftersom det reducerar risken för infektionskomplikationer (++++).
- Väntetiden från kirurgi till initiering av postoperativ cytostatikabehandling bör inte överstiga 4–5 veckor (SVF-dokument), speciellt hos patienter med hög risk för återfall (trippelnegativ bröstcancer, N+) (+++).
Postoperativ cytostatikabehandling med antracyklin och taxan
Sammanfattning
- Antracyklinbaserad cytostatikabehandling ger 21 % relativ minskning motsvarande cirka 6,5 % absolut minskning av bröstcancerdödligheten efter 10 år (++++).
- Högre kumulativa antracyklindoser och längre behandlingslängd ger ytterligare minskning av återfallsrisk på bekostnad av högre risk för akut leukemi och hjärtsvikt (+++).
- Cytostatikabehandling där taxan ingår ger jämfört med behandling utan taxan 12 % relativ minskning samt 3,6 % absolut minskning av bröstcancerdödligheten (++++).
- Parallell behandling med antracyklin och taxan (TAC) ger jämfört med antracyklinfria regimer (TC) 42 % relativ minskning motsvarande 8,7 % absolut minskning av återfallsrisk, och 35 % relativ minskning motsvarande 4,2 % absolut minskning av bröstcancerdödlighet (++++).
- Sekventiell behandling med antracyklin i 3–4 cykler och taxan i 3–4 cykler är likvärdig med TC i 6 cykler (++++).
- Dostäta regimer med behandling varannan vecka reducerar risken för återfall med 4,3 % (17 % relativ riskminskning) och förbättrar bröstcancerdödligheten med 2,8 % i absoluta tal (14 % relativ minskning) jämfört med exakt samma regimer givna var tredje vecka (++++).
- Sekvensbehandling med antracykliner och taxaner ger en 3,2 % absolut minskning av återfall och 2,1 % av bröstdödlighet jämfört med parallell behandling (++++). Dostät sekvensbehandling verkar inte vara statistiskt signifikant bättre än 6 cykler med TAC (+++).
- Docetaxel i 3 veckors regim är mer effektivt än paklitaxel (+++), men effekten beror även på fraktionering där paklitaxel givet veckovis är mer effektivt än paklitaxel givet var tredje vecka (+++). Docetaxel given var tredje vecka och paklitaxel given veckovis är likvärdiga (+++).
- Det finns ingen skillnad mellan upfront taxaner och upfront antracykliner i sekvensbehandling avseende effektivitet (++++).
- G-CSF som tillägg till cytostatika minskar risken för neutropen feber med 73 % (+++) och för tidiga dödsfall med 68 % (++).
Bakgrund
Vår kunskap och aktuella riktlinjer vad det gäller tilläggsbehandling med cytostatika efter operation för bröstcancer baseras på stora metaanalyser av individpatientdata genomförda av Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Data som presenteras nedan härrör från tre EBCTCG-metaanalyser som publicerades 2012 695(n = 100 000, 123 randomiserade studier), 2019 696 (n = 37 298, 26 randomiserade studier) och 2023 697 (n = 100 000, 86 randomiserade studier, delvis en uppdatering av EBCTCG 2012). En viktig slutsats av samtliga EBCTCG-metaanalyser är att ålder, lymfkörtelstatus, tumörstorlek, differentieringsgrad, östrogenreceptorstatus och tamoxifenanvändning inte på något tydligt sätt påverkar den relativa riskminskningen för bröstcancerrelaterad död, oavsett jämförelse (antracyklin vs ingen behandling, tillägg av taxan, dostät cytostatika, etc.). Den relativa riskminskningen med dostät antracyklin och taxan är cirka 40 %, medan den absoluta vinsten beror på den absoluta risken patienten skulle ha utan cytostatikabehandling, vilket hos ER-positiva är den risk som återstår efter lämplig endokrin behandling.
Dostäta regimer som ges varannan vecka, med samma doser som man rutinmässigt ger var tredje vecka, måste ges med G-CSF. Riktlinjer från ASCO 698 och NCCN rekommenderar vidare att primär G-CSF-profylax bör användas om risken för febril neutropeni är över 20 %, till exempel E100C + Docetaxel 100, TC och TAC är regimer där man måste ge G-CSF för att minska risken för febril neutropeni och infektionskomplikationer. En systematisk översikt baserad på totalt 2 156 patienter med bröstcancer från 8 randomiserade studier som undersökte cytostatikabehandling med eller utan G-/GM-CSF, visade att G-CSF (6 studier) gav en minskad risk för febril neutropeni motsvarande en riskkvot på 0,27 (0,10–0,75). Motsvarande resultat för tidig dödlighet var 0,32 (0,13–0,77) 699. Vid anemi sekundärt till cytostatikabehandling så ska erytropoetiner i princip inte användas, eftersom data visar försämrad prognos 700.
Antracyklin
Postoperativ antracyklin (n = 8 575, 82 % var lymfkörtelpositiva) minskar 10 års återfallsrisk (RR 0,73, 95 % CI 0,68–0,79, absolut vinst 8 %), bröstcancerdödlighet (RR 0,79, 95 % CI 0,72–0,85, absolut vinst 6,5 %) och total dödlighet (RR 0,84, 95 % CI 0,78–0,91, absolut vinst 5,0 %) 695. För jämförelser mellan äldre CMF-regimer och ingen behandling eller antracyklin-baserade regimer, hänvisar till tidigare versioner av NVP Bröstcancer.
Studier som ingår i EBCTCG 2012 hade inte rapporterat HER2-status. Två poolade analyser av randomiserade studier (n = 6 564 respektive n = 3 452) har visat statistiskt signifikant interaktion mellan HER2-positivitet och nytta av antracyklinbehandling 701702. Däremot har även patienter med icke-HER2-amplifierade tumörer förbättrad överlevnad med antracyklinbaserade regimer i dessa och andra stora poolade analyser 697702703.
Tillägg av taxan
Vid EBCTCG:s nyligen uppdaterade metaanalys påvisades efter 10 års uppföljning att tillägg av taxan till samma antracyklinregim (n = 52 976, 35 randomiserade studier) förbättrar sjukdomsfriöverlevnad (RR 0,87, 95 % CI 0,82–0,93, absolut vinst 3,3 %) och bröstcancerspecifik överlevnad (RR 0,88, 95 % CI 0,82–0,95, absolut vinst 3,6 %). Däremot såg man ingen vinst i vare sig sjukdomsfriöverlevnad eller bröstcancerspecifik överlevnad när kombinerad antracyklin och taxan jämfördes med regimer som innehöll dubbel antracyklindos 697.
Antracyklinfria regimer
Docetaxel och cyklofosfamid (TC) har jämförts med antracyklininnehållande regimer. Tre studier jämförde parallell TC och antracyklin (TAC 6 cykler) med TC (6 cykler, alltså samma kumulativa docetaxeldos). Sjukdomsfriöverlevnad (RR 0,58, 95 % CI 0,47–0,93, absolut vinst 8,7 %) och bröstcancerspecifik överlevnad (RR 0,65, 95 % CI 0,49–0,87, absolut vinst 4,2 %) var bättre med TAC. Subgruppsanalys kunde inte identifiera någon patientgrupp som inte får nytta av TAC, inklusive patienter med ER-positiv, lymfkörtelnegativ tumör (RR 0,50, 95 % CI 0,20–1,24, p för heterogenitet 0,49) 697.
Sekventiell behandling med antracyklin (3–4 cykler) och taxan (3–4 cykler) är inte bättre än TC (6 cykler, högre kumulativ docetaxeldos) i vare sig sjukdomsfriöverlevnad (RR 0,94, 95 % CI 0,83–1,06) eller bröstcancerspecifik överlevnad (RR 0,92, 95 % CI 0,77–1,09) 697.
Risk för akut leukemi var högre med antracyklinregimer (0,18 % vs 0,03 %, P = 0,013), vilket motsvarar 1 ytterligare fall per 700 behandlade kvinnor 697.
Dostät cytostatika
Dostät cytostatika som ges varannan vecka undersöktes vid EBCTCG:s metaanalys från 2019. Relevanta jämförelser är dostät behandling versus behandling med standardintervall innehållande exakt samma cytostatika och doser samt dostät behandling med TAC.
Jämfört med exakt samma behandling given var tredje vecka såg man att dostät behandling (n = 10 004) förbättrar sjukdomsfriöverlevnad (RR 0,83, 95 % CI 0,76–0,91, absolut vinst 4,3 %) och bröstcancerspecifik överlevnad (RR 0,86, 95 % CI 0,77–0,96, absolut vinst 2,8 %). De flesta patienter som ingick i denna analys var lymfkörtelpositiva och hos lymfkörtelnegativa patienter noterades en mindre relativ riskminskning med dostät behandling (RR 0,93, 95 % CI 0,71–1,24) men ingen heterogenitet beroende på lymfkörtelstatus (p > 0,1) 696. Vinst med dostät cytostatika kvarstår efter långtidsuppföljning (median 15,1 år) enligt GIM2-studien 704. Ett observandum är dock att en annan metaanalys på studienivå har visat att dostät behandling är mer effektiv än standardbehandling endast i studier där standardarmen innehåller paklitaxel var tredje vecka, en regim som visat sig vara svagare än andra taxanbaserade regimer 705.
Avseende frågan om sekvensbehandling eller parallell behandling med antracykliner och taxaner har man (n = 11 028) hittat en absolut 10-årsminskning av återfall med 3,2 % och av bröstcancerdödlighet med 2,1 % till fördel för dostät sekvensbehandling 696. Få studier har dock jämfört 6 cykler av TAC med andra moderna regimer. BCIRG 005 (n = 3 298) visade likvärdig 10 års sjukdomsfriöverlevnad (p = 0,75) och total överlevnad (p = 0,50) mellan TAC x 6 och sekventiell AC x 4 och Docetaxel x 4, båda givna var tredje vecka 706. NSABP B–38 jämförde TAC x 6 med dostät AC x 4 följt av dostät Paklitaxel x 4 och visade en icke-signifikant trend i 5 års sjukdomsfri överlevnad till fördel för dostät behandling (HR 0,87, P = 0,07) men ingen skillnad alls i total överlevnad (HR 1,01, P = 0,96) 707.
Antracyklin jämfört med taxan
Docetaxelinnehållande regimer (TC eller docetaxel plus kapecitabin) har visat sig vara effektivare än antracyklinbaserade regimer (AC eller FAC/FEC) enligt EBCTCG:s metaanalys av fyra studier och 6 019 patienter (RR 0,73, 95 % CI 0,55–0,96). Motsatt effekt observeras i jämförelse mellan antracyklin och veckovis paklitaxel (RR 1,30, 95% CI 1,09–1,56) 697.
Val av taxan
Vid EBCTCG:s metaanalys från 2023 jämfördes docetaxel- och paklitaxel-innehållande regimer (n = 467). Docetaxel var associerad till minskad återfallsrisk (RR 0,74, 95 % CI 0,66–0,84) och bröstcancerdödlighet (RR 0,80, 95 % CI 0,69–0,93). Däremot beror effekten även på fraktionering: paklitaxel veckovis minskar återfallsrisk jämfört med mindre frekvent dosering enligt samma EBCTCG-metaanalys (RR 0,86, 95 % CI 0,78–0,96) 697.
I en stor postoperativ fyrarmad studie (ECOG E1199: AC x 4 → paklitaxel 175 givet var tredje vecka x 4, vs AC x 4 → paklitaxel 80 veckovis x 12, vs AC x 4 → docetaxel 100 var tredje vecka x 4, vs AC x 4 → docetaxel 35 veckovis x 12) visade veckovis paklitaxel signifikant bättre 5-årsöverlevnad än paklitaxel givet var tredje vecka, 89,7 % vs 86,5 %. Resultatet för veckovis paklitaxel var likvärdigt med docetaxel var tredje vecka. Vid subgruppsanalys per subtyp såg man att veckovis paklitaxel var bäst alternativ för trippelnegativ cancer (n = 1 025, sjukdomsfri överlevnad HR 0,69, P = 0,001, totalöverlevnad HR 0,69, P = 0,019) medan docetaxel var tredje vecka var bäst alternativ för hormonreceptor positiv, HER2-negativ cancer (n = 2 879, sjukdomsfriöverlevnad HR 0,76, P = 0,004) 708.
Nab-paklitaxel diskuteras i Kapitel 12 Preoperativ behandling.
Behandlingslängd och dosering
Längre behandlingslängd med antracyklin är associerad till bättre sjukdomsfriöverlevnad (RR 0,87, 95 % CI 0,78–0,96) 697. I denna jämförelse ingick studier som jämförde 4 versus 6 cykler med antracyklin- och taxan-baserad behandling samt GeparTrio som jämförde 6 versus 8 TAC cykler (n = 8 239). Dessutom är högre kumulativa antracyklindoser (skillnad cirka 150 mg epirubicin eller 100 mg doxorubicin) associerade till minskad återfallsrisk (n = 7 988, RR 0,77, 95 % CI 0,63–0,93) 697.
Docetaxel används ibland i en lägre dos, 80 mg/m2, på grund av att den internationellt sett vanligare dosen 100 mg/m2 är mer toxisk. Detta grundar sig på data från Finland från 502 patienter visande en likvärdig behandlingseffekt i en explorativ, icke-randomiserad jämförelse inom en studie som jämförde adjuvant docetaxel med vinorelbine 709. NCCN rekommenderar att docetaxel ges på 100 mg/m2.
Optimal sekvens
EBCTCG:s metaanalys från 2023 undersökte även om det finns någon skillnad i effektivitet av cytostatika eller tolerabilitet om man ger upfront taxaner versus upfront antracykliner i sekvensbehandling. Data från 2 046 patienter analyserades och man kunde inte se någon skillnad i återfallsrisk beroende på sekvens av antracyklin och taxan (RR 1,09, 95 % CI 0,91–1,30) 697.
Tillägg av andra cytostatika
Sammanfattning
- Tillägg av kapecitabin till regimer med antracyklin och taxan har visat en förbättrad sjukdomsfri överlevnad och total överlevnad hos patienter med trippelnegativ bröstcancer, men verkar inte ha någon tilläggseffekt hos patienter med hormonkänslig bröstcancer (++++).
- Tillägg av adjuvant platinabaserad cytostatika såsom karboplatin till taxanbaserade regimer, med eller utan antracyklin, har visat en förbättrad sjukdomsfri överlevnad och total överlevnad hos patienter med trippelnegativ bröstcancer (++++).
Kapecitabin
Kapecitabin är en prodrog till 5-FU som tas peroralt. Den ger en relativt kontinuerlig koncentration av aktiva metaboliter i tumörvävnaden, vilket anses ge en bättre effekt än intravenös bolusinjektion av 5-FU. En metaanalys av individpatientdata från 15 randomiserade post- och preoperativa studier, totalt 15 993 patienter, har undersökt tilläggsvärde av kapecitabin 710. När kapecitabin adderades till standardbehandling såg man en signifikant minskning av återfallsrisk i multivariat analys (HR 0,87, 95 % CI 0,79–0,96) men inte när kapecitabin ersatte annan medicin (HR 1,01, 95 % CI 0,91–1,12). Samma effekt noterades även för total överlevnad (HR 0,84 95 % CI 0,74–0,95). Subgruppsanalys per subtyp visade att signifikant nytta till fördel för kapecitabin fanns hos patienter med trippelnegativ bröstcancer (HR 0,86, 95 % CI 0,74–0,99 för sjukdomsfriöverlevnad och HR 0,77, 95 % CI 0,65–0,92 för total överlevnad) men inte hos patienter med ER-positiv, HER2-negativ bröstcancer, även när man exkluderade CREATE-X. Långtidsuppföljning (medianuppföljningstid på 15 år) av FinXX-studien, där man adderade kapecitabin till standard taxan- och antracyklinbaserad cytostatika ,bekräftade överlevnadsvinst av kapecitabintillägget vid trippelnegativ bröstcancer 711.
Kapecitabin har en väletablerad roll som postoperativ behandling hos patienter med kvarvarande invasiv cancer efter preoperativ cytostatikabehandling på basen av CREATE-X. Denna studie beskrivs i detalj i Kapitel 12 Preoperativ behandling.
Karboplatin
Platinabaserad cytostatikabehandling har visat sig vara effektiv som preoperativ behandling vid trippelnegativ bröstcancer. Den potentiella nyttan av platinabaserad cytostatikabehandling som postoperativ behandling vid trippelnegativ bröstcancer har också studerats. En meta-analys publicerat av Cochrane-gruppen som inkluderade 4 studier och 1 256 patienter visade att tillägg av adjuvant platinabaserad cytostatika såsom karboplatin är associerat till förbättrad sjukdomsfriöverlevnad (HR 0,69, 95 % CI 0,54–0,88) och totalöverlevnad (HR 0,70, 95 % CI 0,50–0,96). Platinatillägg var också associerat till reducerad dosintensitet, uppehåll i behandling och värre myelotoxicitet 712.
Genexpressionsanalys inför beslut om adjuvant cytostatika
Rekommendationer
- Genexpressionsanalys behöver inte utföras när resultatet inte förväntas påverka behandlingsbeslut, till exempel vid medicinsk kontraindikation mot cytostatika, pT1a/bN0-tumör, grad 1-tumör, ≥ 4 positiva lymfkörtlar (+++).
- Genexpressionsanalys bör utföras hos postmenopausala kvinnor med lymfkörtelnegativ, ER-positiv, HER2-negativ bröstcancer där det finns osäkerhet kring tumörens riskkategorisering (se Figur 10) inför val av cytostatikabehandling (++++).
- Genexpressionsanalys bör övervägas hos postmenopausala kvinnor med ER-positiv, HER2-negativ bröstcancer med 1–3 positiva lymfkörtlar där det finns osäkerhet kring tumörens riskkategorisering inför val av cytostatikabehandling (+++).
- Genexpressionsanalys med Oncotype Dx kan övervägas hos premenopausala kvinnor med lymfkörtelnegativ, ER-positiv, HER2-negativ bröstcancer där det finns osäkerhet kring tumörens riskkategorisering inför val av cytostatikabehandling (++).
Sammanfattning
- Det finns två tillgängliga plattformar för genexpressionsanalys i Sverige, Oncotype Dx och Prosigna. Den prognostiska rollen av Oncotype Dx har bevisats i randomiserade studier och av Prosigna i retrospektiva analyser av randomiserade studier. Båda plattformarna bedöms som kostnadseffektiva för svenska förhållanden.
- Vid användning av Oncotype Dx hos postmenopausala kvinnor med lymfkörtelnegativ, ER-positiv, HER2-negativ bröstcancer rekommenderar man inte cytostatikabehandling vid RS < 26 (++++).
- Vid användning av Oncotype Dx hos postmenopausala kvinnor med ER-positiv, HER2-negativ bröstcancer med 1–3 positiva lymfkörtlar som bedöms som intermediär risk, rekommenderar man inte cytostatikabehandling vid RS < 26 (+++).
- Vid användning av Oncotype Dx hos premenopausala kvinnor med lymfkörtelnegativ, ER-positiv, HER2-negativ bröstcancer rekommenderar man inte cytostatikabehandling vid RS 16–20 och låg klinisk risk (definierad som tumörstorlek ≤3 cm och grad 1, eller tumörstorlek ≤2 cm och grad 2, eller tumörstorlek ≤1 cm och grad 3), eller RS < 16 oavsett klinisk risk (++).
- Vid användning av Prosigna hos postmenopausala kvinnor med lymfkörtelnegativ, ER-positiv, HER2-negativ bröstcancer rekommenderar man inte cytostatikabehandling vid ROR ≤ 40 (+++). Vid intermediär ROR (41–60) behöver man ta hänsyn till andra etablerade prognostiska faktorer inför behandlingsval (++).
- Vid användning av Prosigna hos postmenopausala kvinnor med ER-positiv, HER2-negativ bröstcancer med 1–3 positiva lymfkörtlar rekommenderar man inte cytostatikabehandling vid ROR ≤ 15 (+++). Vid intermediär ROR (16–40) behöver man ta hänsyn till andra etablerade prognostiska faktorer inför behandlingsval (++).
- Det finns inte tillräckliga data som stöttar användning av Prosigna hos premenopausala kvinnor.
Olika kommersiella genexpressionsanalyser har utvecklats under de senaste åren i ett försök att kunna kategorisera patienter inom olika molekylärbaserade prognostiska profiler som eventuellt skulle kunna ha betydelse i prediktivt syfte för cytostatikabehandling. ASCO har publicerat rekommendationer om befintliga kommersiella genexpressionsanalyser och deras potentiella kliniska nytta 713. NICE har också publicerat rekommendationer där man dessutom har tagit hänsyn till hälsoekonomiska aspekter 714. Här kommer man att diskutera de genexpressionsanalyser med bäst evidens i nuläget i relation till den kliniska nyttan och som finns som kommersiella produkter i Europa.
Oncotype Dx
Oncotype Dx 21-gens RS baseras på expressionsanalys av 21 gener som ger ett värde (score) på 0–100. Den är den mest validerade metoden för dess prognostiska betydelse och värde för att identifiera patienter med ER-positiv, HER2-negativ bröstcancer som inte får nytta av postoperativ cytostatikabehandling baserad på resultaten av två stora randomiserade studier. Samtidigt har minst två prospektiva-retrospektiva studier visat metodens prediktiva värde 715716.
I TAILORx ingick 10 273 patienter med lymfkörtelnegativ, ER-positiv, HER2-negativ bröstcancer, och de som hade RS 11–25 (6 711 patienter) blev randomiserade till antingen standardpostoperativ behandling med cytostatika och sedan endokrin behandling, eller enbart endokrin behandling 713. Man såg ingen skillnad i sjukdomsfri eller total överlevnad mellan grupperna. Däremot såg man i en sekundär analys av studien att det finns en signifikant interaktion avseende risk för fjärrmetastasering med ålder och RS, där man noterade en signifikant lägre risk för fjärrmetastaser hos kvinnor < 50 år med RS 16–25 när man gav cytostatika. Vid senaste uppdateringen var 11 års fjärrmetastasfri intervall hos patienter med RS 0–10 som inte hade fått cytostatika (n = 1 619) 93,2 %. Kvinnor > 50 år med RS 11–25 och ≤ 50 år med RS 11–15 hade ingen nytta av cytostatika, medan kvinnor ≤ 50 år med RS 16–20 och hög klinisk risk samt RS 21–25 oavsett klinisk risk hade en absolut vinst av cytostatika på 3,1 % respektive 7,8 % i 11 års fjärrmetastasfri intervall 717. Metodens prediktiva värde för lymfkörtelnegativ bröstcancer hade tidigare visats av en retrospektiv analys av NSABP B-20 där signifikant interaktion (p = 0,038) noterades mellan effekt av adjuvant CMF och RS 715.
Den randomiserade studien RxPONDER inkluderade 5 015 patienter med ER-positiv, HER2-negativ bröstcancer, med 1–3 positiva lymfkörtlar och RS < 26 som blev randomiserade till antingen cytostatika och sedan endokrin behandling eller enbart endokrin behandling. Efter medianuppföljning på 5 år kunde man inte se någon statistiskt signifikant skillnad i iDFS hos postmenopausala kvinnor som fick cytostatikabehandling eller inte (5 års iDFS 91,9 % vs 91,6 %), medan det fanns en statistiskt signifikant skillnad i iDFS med tillägg av cytostatikabehandling hos premenopausala kvinnor (5 års iDFS 94,2 % vs 89,0 %). Skillnaderna mellan cytostatikabehandling och inte cytostatikabehandling i fjärrmetastasfri överlevnad var 0,0 % hos postmenopausala kvinnor och 3,3 % hos premenopausala kvinnor 718. I RxPONDER där RS var begränsad från 0 till 25 kunde man inte se någon signifikant interaktion mellan cytostatikaeffekt och RS (p = 0,35), till skillnad från en retrospektiv analys av SWOG-8814 där ingen begränsning i RS fanns (p = 0,029) 716. Osäkerhet på lymfkörtelpositiv bröstcancer är dock större jämfört med randomiserade data för lymfkörtelnegativ bröstcancer med tanke på kortare uppföljningstid av RxPONDER jämfört med TAILORx.
RSClin är ett nytt verktyg som kombinerar klinisk information (grad, storlek, ålder) och RS, som visades vara oberoende prognostiska i TAILORx och NSABP B-14. Verktyget validerades därefter i en separat kohort och kunde prediktera Kaplan-Meier-estimat med hög precision (Lin concordance correlation 0,962) 719. RSClin är inte tillräckligt validerat för klinisk användning och ASCO samt NCCN ger ingen särskild rekommendation.
Användning av Oncotype Dx rekommenderas för lymfkörtelnegativ bröstcancer oavsett ålder eller menopausstatus och för postmenopausala patienter med lymfkörtelpositiv bröstcancer av NCCN (Category of Evidence 1) och ASCO (high/strong) 713. ESMO ger ingen särskild rekommendation för specifika genexpressionssignaturer 720.
Den hälsoekonomiska utvärderingen av Oncotype Dx för svenska förhållanden har visat att analysen är kostnadseffektiv jämfört med enbart klinisk-patologisk bedömning för val av cytostatikabehandling hos patienter som bedöms ha nytta av genexpressionsanalys. Totalt antal vunna kvalitetsjusterade levnadsår (QALY) i grundscenariot är i genomsnitt 0,24 med en kostnadsbesparing på cirka 50 532 kronor i jämförelse mot enbart klinisk-patologisk bedömning. Grundscenariot i den hälsoekonomiska utvärderingen pekar således på att användningen av Oncotype DX ger större nytta till en lägre kostnad 721. Medicintekniska Produktrådet (MTP-rådet) rekommenderar att Oncotype Dx kan användas inför beslut om adjuvant cytostatikabehandling av kvinnor med bröstcancer när osäkerhet om nyttan med behandling föreligger under förutsättning att hantering av personuppgifter kan ske i enlighet med gällande svensk lagstiftning och EU-lagstiftning. För en detaljerad beskrivning av de juridiska frågeställningarna var god se 722.
Mammaprint
Mammaprint (Amsterdam 70-gen signatur) är en metod där man analyserar mRNA-uttryck av 70 gener för att kategorisera ER-positiv, HER2-negativ bröstcancer till låg- eller högriskgrupp. Den metoden har en prognostisk roll som är validerad fast i mindre utsträckning än Oncotype Dx. I en randomiserad studie (MINDACT, n = 6 693) försökte man undersöka Mammaprints prediktiva roll genom att randomisera patienter med diskrepans mellan den kliniska bedömningen och Mammaprintresultatet (hög klinisk risk/låg genomisk risk och låg klinisk risk/hög genomisk risk) till cytostatikabehandling eller inte 723. Man kunde se att för gruppen med hög klinisk risk/låg genomisk risk var prognosen generellt bra men en viss tilläggseffekt av cytostatikabehandling kunde ändå ses. En liknande trend kunde man se vid låg klinisk risk/hög genomisk risk. I en explorativ analys av MINDACT-studien kunde man se att tilläggseffekten av cytostatikabehandling i gruppen med hög klinisk risk/låg genomisk risk var mer påtaglig hos kvinnor yngre än 50 år (5,0 % absolut vinst med cytostatika i fjärrmetastasfri intervall) jämfört med kvinnor äldre än 50 år (0,2 % absolut vinst). Lymfkörtelstatus verkade inte påverka resultatet. Mammaprints prognostiska betydelse på låg klinisk/låg genomisk risk-patienter som inte hade fått cytostatika (n = 2 744) redovisades i MINDACT, för dessa patienter hade efter 8,7 års uppföljning 96,7 % fjärrmetastasfri intervall.
Sammanfattningsvis kunde man inte se i MINDACT-studien att Mammaprint har något prediktivt värde vid val av cytostatikabehandling generellt, men det kan finnas ett visst prediktivt värde för kvinnor > 50 år med hög klinisk risk där en låg genomisk risk enligt Mammaprint kan identifiera en subgrupp med minimal tilläggseffekt av cytostatika. Mammaprint rekommenderas för lymfkörtelpositiva och lymfkörtelnegativa patienter av NCCN (Category of Evidence 1) och ASCO (intermediate/strong, endast postmenopausala patienter) 713. ESMO ger ingen särskild rekommendation för specifika genexpressionssignaturer 720. MTP-rådet rekommenderar att för närvarande avstå användning av Mammaprint på grund av avsaknad av efterfrågat underlag 722.
Prosigna
Prosigna och risk of recurrence score (ROR) använder 50 gener för att göra en molekylär kategorisering av bröstcancer till luminal A eller B, och en algoritm med molekylär subtypning samt tumörstorlek ger ett värde kallat ROR-score. I en poolad analys av 2 postoperativa studier (ABCSG-8 och ATAC) kunde ROR-värdet identifiera subgrupper med N0 eller N+, ER-positiv, HER2-negativ bröstcancer med låg risk för återfall där cytostatikabehandling kanske inte har någon större nytta 724. Liknande resultat kunde man se i en populationsbaserad studie från Danmark som inkluderade 1 163 patienter med N0 och 779 patienter med N1 ER-positiv, HER2-negativ bröstcancer 725. Lågriskpatienter (ROR 0–40) utan cytostatikabehandling hade fjärrmetastasrisk på cirka 3–5 % i ABCSG-8 och DBCG-kohorter. Fjärrmetastasrisk var mindre än 5 % hos lågriskpatienter med 1–2 positiva lymfkörtlar i DBCG (ROR 0–35 respektive 0–25, jämfört med 0–15 i en retrospektiv analys av ABCSG-8 726). Prosigna verkar således ha en prognostisk roll fast utan validering i prospektiva studier. Prosigna ger även möjlighet till att kategorisera tumörer till luminal A eller B utifrån genexpressionsanalys vilket kan ge stöd för behandlingsbeslut. Retrospektiva analyser av två prospektiva studier har visat Prosignas prediktiva värde för CMF- och antracyklinbaserad cytostatikabehandling 727728. Den pågående OPTIMA-studien testar Prosignas prediktiva roll hos ER-positiva, HER2-negativa bröstcancerpatienter med eller utan lymfkörtelmetastaser.
Prosigna rekommenderas för lymfkörtelpositiva och lymfkörtelnegativa patienter av NCCN (Category of Evidence 2A) medan ASCO rekommenderar Prosigna endast för postmenopausala patienter med lymfkörtelnegativ bröstcancer (intermediate/moderate) 713. ESMO ger ingen särskild rekommendation för specifika genexpressionssignaturer 720. Den hälsoekonomiska utvärderingen av Prosigna för svenska förhållanden har visat att analysen är kostnadseffektiv jämfört med enbart klinisk-patologisk bedömning för val av cytostatikabehandling hos patienter som bedöms ha nytta av genexpressionsanalys. Kostnaden per vunnet QALY för Prosigna bedöms vara i genomsnitt 206 846 kronor jämfört med enbart klinisk-patologisk bedömning 729. MTP-rådet rekommenderar att Prosigna kan användas inför beslut om adjuvant cytostatikabehandling av kvinnor med bröstcancer när osäkerhet om nyttan med behandling föreligger 722.
EndoPredict
EndoPredict är en metod där man analyserar mRNA-uttryck av 8 cancergener, 3 referensgener och 1 kontrollgen, vilket leder till en score 0–15 och en gruppindelning till låg- och högriskgrupp. I retrospektiva analyser av prospektiva studier (ABCSG-6, ABCSG-8, ATAC) kunde man se att metoden har prognostisk roll med möjlighet att identifiera patienter med ER-positiv, HER-negativ bröstcancer med väldigt låg risk för återfall inklusive risk för sena återfall 730. EPClin är ett verktyg som kombinerar EndoPredict, tumörstorlek och lymfkörtelstatus och på det sättet ger ytterligare prognostisk information jämfört med EndoPredict och RS 731. I en retrospektiv analys av ABCSG-6/8 (kombinerad kohort) visades att lågriskpatienter enligt EPClin hade 10 års fjärrmetastasrisk mindre än 5 % utan att ha fått postoperativa cytostatika 732. En poolad analys av tre prospektiva studier (n = 3 746) har även visat metodens prediktiva värde med signifikant interaktion (p = 0,022) mellan EPClin och effekt av cytostatikabehandling 733. Ingen prospektiv validering av metoden är publicerad än.
EndoPredict rekommenderas för lymfkörtelpositiva och lymfkörtelnegativa patienter av NCCN (Category of Evidence 2A) och ASCO (intermediate/moderate, postmenopausala patienter oavsett lymfkörtelstatus) 713. ESMO ger ingen särskild rekommendation för specifika genexpressionssignaturer 720. MTP-rådet rekommenderar att för närvarande avstå användning av EndoPredict på grund av avsaknad av efterfrågat underlag 722.
Sammanfattning
Sammanfattningsvis verkar alla kommersiella genexpressionsanalyser ha en prognostisk betydelse för patienter med ER-positiv, HER2-negativ sjukdom. För Oncotype Dx och Mammaprint är den prognostiska betydelsen validerad i prospektiva studier, medan valideringen av Prosigna och EndoPredict baseras på retrospektiva analyser av prospektiva studier. Det finns begränsade jämförelser mellan olika genexpressionsanalyser. I en explorativ analys av ATAC-studien jämförde man det prognostiska värdet av dessa olika genexpressionsmetoder hos 774 postmenopausala kvinnor med ER-positiv, HER2-negativ bröstcancer (591 N0). Man kunde se att alla metoder har prognostiskt värde, men Prosigna, EPClin och Breast Cancer Index (BCI) hade starkast prognostiskt värde för lymfkörtelnegativ bröstcancer, medan EPClin och BCI hade starkast prognostiskt värde för lymfkörtelpositiv sjukdom 734. BCI är inte tillgängligt i Europa. Dess prediktiva värde för förlängd endokrin behandling beskrivs i Kapitel 15 Postoperativ medicinsk behandling.
Ledtider för cytostatikabehandling
Rekommendationer
- Varje 4-veckorsperiod av fördröjning av cytostatikabehandlingsstart ger en relativ riskökning på 5 % för återfall och 8 % för dödlighet. Den negativa effekten är större vid bröstcancer med hög återfallsrisk.
Inom bröstcancersjukvård är den vanligaste definitionen på ledtid för cytostatikabehandling tiden från operation till start av cytostatikabehandlingen. En metaanalys omfattande 8 studier av hög kvalitet visade att varje 4-veckorsperiod gav en relativ riskökning på 5 % för återfall och 8 % för total dödlighet . Den största retrospektiva studien som undersökte start av cytostatikabehandling i relation till prognosen publicerades efter metaanalysen och inkluderade 24 843 patienter som delades in i 4 grupper efter tiden till start av cytostatikabehandlingen: ≤ 30 dagar, 31–60 dagar, 61–90 dagar samt ≥ 91 dagar. Man kunde inte bekräfta resultatet av metaanalysen i hela kohorten, men man såg en tydligt försämrad bröstcancerspecifik och total överlevnad vid start av behandling > 90 dagar från kirurgi och en trend till försämrad överlevnad från > 60 dagar vid HER2-positiv bröstcancer och > 30 dagar vid trippelnegativ bröstcancer 736.
Endokrinbehandling och målriktade läkemedel för hormonreceptorpositiv bröstcancer
Rekommendationer
- Den endokrina behandlingen med TAM eller AI ska startas efter eventuell cytostatikabehandling och kan startas före eller efter eventuell strålbehandling. LHRH-agonist kan startas antingen under eller efter cytostatikabehandling (++++).
- Val av endokrin tilläggsbehandling ska baseras på riskbedömning, menopausalt status, ålder och samsjuklighet. Hög risk definieras generellt som lymfkörtelpositiv bröstcancer eller lymfkörtelnegativ luminal B enligt IHC eller enligt genexpressionsanalys (++++).
- Endokrin behandling bör i princip alltid ges till patienter med ER-positiv bröstcancer. För patienter med mycket låg risk för återfall kan man möjligen avstå från endokrin tilläggsbehandling efter diskussion med patienten om nytta respektive risker (+++).
- För pre- och perimenopausala kvinnor med lägre risk för återfall rekommenderas TAM under år 0–5 (++++).
- Ovariell suppression med tillägg av LHRH-analog till TAM eller AI under år 0–5 rekommenderas till premenopausala kvinnor upp till 45 år med en risknivå som motiverat tilläggsbehandling med cytostatikabehandling (++++).
- För kvinnor med HER2-negativ tumör och hög risk för återfall (till exempel < 40 år, grad 3, T3/4) rekommenderas LHRH-analog plus AI i första hand (++++).
- Vid ovariell suppression med LHRH-analog bör man kontrollera nivåer av östradiol (känslig) (baseline och efter 3, 6 och 12 månader). Vid inadekvat suppression bör man överväga byte till TAM om patienten står på AI (+++).
- Vid ovariell suppression med LHRH-analog är behandling med månadsspruta rekommenderad. Behandling med LHRH-analog var tredje månad kan övervägas i utvalda fall. Det krävs en noggrann uppföljning av ovariell funktion oavsett (+++).
- För postmenopausala kvinnor rekommenderas AI-singelbehandling under år 0–5. Sekventiell behandling, förslagsvis med AI följt av TAM till en total behandlingstid på 5 år, är ett alternativ (++++).
- Det finns för närvarande inte något kliniskt eller genexpressionsbaserat beslutsverktyg som med säkerhet kan prediktera nytta av förlängd endokrin behandling, men CTS5 kan användas som stöd i beslutet (++).
- För pre- och perimenopausala kvinnor med hög risk för återfall som är fria från återfall efter 5 års endokrinbehandling, bör förlängning upp till totalt 10 års endokrin behandling erbjudas (+++). Som hög risk betraktas kvinnor som behandlats med adjuvant cytostatika (++). Förlängd behandling med LHRH-analog rekommenderas inte (++).
- För postmenopausala kvinnor med hög risk för återfall och som behandlats med TAM i 5 år, bör ytterligare 5 års behandling med AI erbjudas (+++).
- För postmenopausala kvinnor med hög risk för återfall och som behandlats med AI i 5 år och är fria från återfall, bör ytterligare behandling med AI erbjudas (+++). Risk kan bedömas med användning av CTS5 (++), där förlängd endokrinbehandling kan övervägas hos intermediär riskpatienter och bör övervägas hos högrisk patienter. Behandlingslängd (2 versus 5 år) baseras på individuellbedömning (++).
- Postoperativ behandling med abemaciklib i 2 år som tillägg till AI-behandling under år 0-5 bör erbjudas till patienter med luminal bröstcancer som bedöms som högrisk för återfall enligt följande kriterier: > 3 positiva lymfkörtlar; eller 1–3 positiva lymfkörtlar och en av följande: grad 3 eller T3–4 (ESMO MCBS: A) (++++). Abemaciklib-behandling bör starta tidigast två veckor efter avslutad cytostatika eller strålbehandling.
Bakgrund
Sammanfattning
- 5 års postoperativ behandling med tamoxifen (TAM) till hormonreceptorpositiva patienter ger cirka 13 % absolut minskning av återfallen samt 9 % absolut minskning av bröstcancerdödligheten vid 15 års uppföljning (++++).
- Den relativa nyttan av postoperativ behandling med tamoxifen är likvärdig oavsett ålder, lymfkörtelstatus, progesteronreceptorinnehåll samt om patienten fått cytostatika eller inte (++++).
- Före AI-behandling ska postmenopausal status vara säkerställd genom: bilateral ooforektomi, eller ålder > 60 år, eller ≤ 60 år och menopaus minst 12 månader innan cancerbehandling och i frånvaro av annan endokrin behandling. Vid tveksamhet ska man kontrollera FSH och östradiol-känslig, helst innan eventuell cytostatikabehandling (++).
- Postmenopausal status kan inte säkert fastställas med FSH och LH hos kvinnor som nyligen behandlats med cytostatika eller TAM, medan en ”känslig bestämningsmetod” för östradiol kan ge vägledning (++).
Effekt av endokrin behandling
Vår kunskap om relativ och absolut nytta av endokrin behandling baseras på en metaanalys från Oxford-gruppen som innehöll 15 års uppföljning av 10 600 kvinnor med ER-positiv tumör som ingått i studier med TAM i 5 år jämfört med ingen endokrin behandling 737. Metaanalysen visade en relativ minskning av risken för återfall med 39 %, vilket motsvarar en absolut minskning på 13,2 % vid 15 år. Motsvarande effekt på bröstcancerdödligheten var en relativ minskning på 30 % och en absolut minskning på 9,2 % vid 15 år. Den relativa effekten är väsentligen likvärdig oavsett lymfkörtelstatus, ålder, progesteronreceptor-innehåll samt om patienten fått cytostatika eller inte. Den absoluta effekten är däremot beroende av vilken risknivå patientgruppen har inför behandlingen, det vill säga en lågriskgrupp har mindre absolut effekt medan en högriskgrupp får en större absolut effekt. TAM i 5 år är fortfarande standardbehandling för premenopausala kvinnor samt för män med ER-positiv bröstcancer. Utöver ovanstående effekter är minskningen av kontralateral bröstcancer hos TAM-behandlade kvinnor av betydelse (38 % relativ riskminskning).
I princip nästan alla patienter med hormonreceptorpositiv bröstcancer bör behandlas med endokrin behandling, även de med små tumörer. I en stor retrospektiv studie (n = 42 708) såg man förbättrad totalöverlevnad på patienter med pT1aN0-tumörer som tog endokrin behandling jämfört med obehandlade patienter när man justerade för ett stort antal faktorer och gjorde olika känslighetsanalyser (HR 0,69–0,80) 738. Liknande resultat påvisades av en sekundär analys av MINDACT: patienter med T1N0 och ”ultralow” risk-tumör enligt MammaPrint som tog hormonellbehandling hade förbättrad fjärrmetastasfri intervall jämfört med obehandlade patienter (absolut skillnad 2,5 %, HR 0,56, 95 % CI 0,30–1,03) men ingen vinst i total överlevnad 739. Däremot måste hänsyn tas till biverkningsprofil och patientens absoluta risk för återfall. Med tanke på den lilla förväntade absoluta vinsten kan man möjligen avstå från endokrin behandling vid utvalda fall enligt mindre retrospektiva studier (n = 5 545) som inte visat någon vinst i fjärrmetastasfriöverlevnad 740.
Inga randomiserade jämförelser mellan moderna strategier (LHRH-analog plus TAM eller AI för premenopausala patienter, AI för postmenopausala patienter, förlängd endokrin behandling) och ingen behandling alls är gjorda, men samtliga strategier har jämförts med tamoxifen som singelbehandling.
Definition av menopaus
Den allmänna definitionen av postmenopaus är när en period av 12 konsekutiva månader gått utan vaginal blödning. Detta i kombination med ett förhöjt follikelstimulerande hormon (FSH) och luteiniserande hormon (LH) ger en relativt säker bedömning av att en kvinna är postmenopausal. Perioden innan postmenopaus inträffar kallas perimenopaus. Denna period kan hos vissa kvinnor pågå i flera år med långa perioder utan vaginala blödningar och efterföljande perioder med blödningar igen. I Sverige är medianåldern för menopaus 51 år.
Kvinnor som menstruerat innan cytostatikabehandlingen påbörjats är mycket svårbedömda vad gäller menopausal status efter genomgången behandling. Olika cytostatikakombinationer har rapporterats ge olika stor frekvens av ovariell svikt, vilken också är beroende av patientens ålder vid behandling. I en sammanställning av befintlig evidens såg man att poolade frekvenser av amenorré var 26 % för kvinnor < 35 år, 39 % för kvinnor 35–40 år och 77 % för kvinnor > 40 år 741.
Kvinnor som haft regelbundna menstruationsblödningar före cytostatikabehandlingen bör betraktas som pre- eller perimenopausala även om blödningarna upphört direkt efter cytostatikabehandlingen. Det finns en risk att AI kan framkalla östrogenproduktion i perimenopausala ovarier, vilket kan leda till att man inte uppnår en adekvat antiöstrogen effekt. TAM kan likväl som AI påverka feedbackmekanismen till hypotalamus och hypofys, vilket leder till ökad insöndring av gonadotropiner, som i sin tur stimulerar till ovulation. Gonadotropinnivåer kan alltså inte användas för att bedöma postmenopausalt status om kvinnan behandlas med TAM, till exempel inför byte till AI. Den perimenopausala kvinnan bör alltid erbjudas adekvat preventivmedelsrådgivning.
De kvinnor man avser behandla med AI måste ha en säkerställd postmenopausal status innan man påbörjar behandlingen: bilateral ooforektomi eller > 60 år eller ≤ 60 år med spontan amenorré i minst 12 månader utan tidigare cytostatikabehandling, endokrin behandling, bröstcancerbehandling eller några hormonella preventivmetoder såsom p-spruta, hormonspiral, p-stav eller p-piller.
Endokrinbehandling för premenopausala patienter: år 0–5
Sammanfattning
- Kombinationen TAM + LHRH ger efter 15 år en absolut 4,5 % minskning av återfall enligt en metaanalys (++++) och efter 12 år en absolut 2,2 % minskning av total dödlighet jämfört med TAM i en randomiserad studie (+++) på bekostnad av mer biverkningar (++++) och sämre livskvalitet (++).
- Bland yngre premenopausala kvinnor med ER-positiv tumör, < 45 år som fått cytostatika finns stöd för en större absolut riskminskning när LHRH-agonist adderas till TAM (+++).
- AI + LHRH-agonist har, jämfört med TAM + LHRH, visat bättre sjukdomsfri och fjärrmetastasfri överlevnad (+++) i en poolad analys av två RCT med en absolut vinst på 4,6 % avseende sjukdomsfri och 1,8 % avseende fjärrmetastasfri överlevnad (++++). Dessa resultat bekräftas i en individuell patientmetaanalys som inkluderar alla RCT (++++).
- Kvinnor med HER2-negativa cancrar får en större relativ och absolut riskminskning med AI + LHRH-agonist jämfört med TAM + LHRH-agonist samt även förbättrad total överlevnad (++++).
- Patientrapporterad hälsorelaterad livskvalitet skiljer sig inte signifikant mellan AI +LHRH och TAM + LHRH (++).
- LHRH-agonist kan hos en viss andel av patienterna ge otillräcklig hämning av äggstockarnas östradiolproduktion, något som i kombination med AI kan ge helt utebliven behandlingseffekt (++).
Tillägg av LHRH-analog till Tamoxifen
Två stora randomiserade studier med poolade resultat har undersökt konceptet med ovariell suppression hos premenopausala kvinnor. I SOFT-studien randomiserades 3 066 patienter till TAM vs ovariell suppression + TAM vs ovariell suppression + exemestan, medan i TEXT-studien randomiserades 2 672 patienter till antingen ovariell suppression + TAM eller suppression + exemestan 742. Avseende TAM med eller utan ovariell suppression kunde man notera, efter 12 års medianuppföljning, att tillägget av suppression ledde till en 4,2 % absolut riskminskning av återfall (HR 0,82, 95 % CI 0,69–0,98) och 2,2 % av total dödlighet (HR 0,78, 95 % KI 0,60–1,01) 743. Dock var risken för biverkningar större vid tillägg av ovariell suppression och den hälsorelaterade livskvaliteten var sämre under behandlingstiden, men den effekten försvann efter avslutad behandling. Subgruppsanalyser tyder på en större behandlingseffekt hos yngre patienter (< 35 år) och patienter yngre än 40 med ogynnsamma prognostiska faktorer som ledde till valet av cytostatikabehandling. Den individuella patientmetaanalysen (n = 4 851) av tillägg av ovariell suppression eller ablation till tamoxifen som presenterades på ASCO 2023 visade en signifikant relativ riskminskning på 20 % och en absolut riskminskning på 4,5 % för återfall 15 år efter primärbehandling (p = 0,002). När ovariell suppression eller ablation inte kombinerades med tamoxifen såg man en större relativ (med 39 %) och absolut (med 17,5 %) riskminskning i återfallsrisk. Ovariell suppression eller ablation på kvinnor som inte hade fått cytostatika eller på kvinnor som förblev premenopausala trots cytostatika var associerat till minskad återfallsrisk oavsett lymfkörtelstatus och ålder samt till minskad total dödlighet (absolut vinst på 11,6 % efter 20 år) 744.
Sammantaget antyder nuvarande evidens att kombinationen av TAM och ovariell suppression ger en förbättrad effekt, men samtidigt en ökad risk för biverkningar. Effekten förefaller större och mer kliniskt signifikant i subgrupper med högre risk för återfall som yngre patienter med ogynnsamma prognostiska faktorer. Å andra sidan hade lägre risk-patienter som enbart behandlades med TAM totalöverlevnad på 96 % efter 12 års uppföljning i SOFT 743.
Den optimala behandlingslängden för LHRH-analoger är okänd, men i en översiktsartikel hade 2 års behandling tillämpats i 12 av 16 studier 745. Den av tillverkaren rekommenderade behandlingstiden på 3 år baseras på en enstaka klinisk studie som omfattar 1 034 receptorpositiva premenopausala kvinnor där man jämförde goserelin + TAM med enbart CMF. I SOFT- och TEXT-studierna gav man totalt 5 års behandling med ovariell suppression medan man i ASTRRA-studien gav 2 år.
LHRH-analog kombinerad med AI
En annan viktig fråga är om AI + LHRH-analog är effektivare än TAM + LHRH-analog vid behandling av premenopausala kvinnor. I en individuell patientmetaanalys som inkluderade fyra RCT inklusive SOFT och TEXT 746, kunde man visa en absolut vinst på 2,8 % avseende bröstcanceråterfall och 1,9 % avseende fjärrmetastasering med tillägg av AI till LHRH-analog jämfört med TAM + LHRH-analog. Det fanns ingen skillnad i effekt beroende på ålder, lymfkörtelstatus, PGR och tumörstorlek. Däremot såg man en signifikant interaktion mellan HER2-status och behandling, där AI + LHRH var effektivare för HER2-negativ bröstcancer. Denna interaktion har noterats i vissa individuella studier såsom SOFT och HOBOE, men inte i TEXT och ABCSG-12. Man kunde inte se någon skillnad i metaanalysen mellan AI + LHRH-analog och TAM + LHRH-analog beträffande bröstcancerspecifik eller total dödlighet, vilket delvis kan bero på en relativt kort uppföljningstid på 8 år. Med längre uppföljning i SOFT/TEXT (median 13 år) ses även förbättrad totalöverlevnad med AI + LHRH på patienter med HER2-negativ tumör som dessutom hade högre risk för återfall, till exempel hade fått cytostatika (absolut vinst 3,3 %), eller var < 35 år (absolut vinst 4,0 %), eller var 35–39 år (absolut vinst 3,5 %), eller med tumörstorlek > 2 cm (absolut vinst 4,5 %), eller med grad 3-tumör (absolut vinst 5,5 %) 747.
Sammantaget finns det stöd för att AI är fördelaktigare än TAM som tillägg till ovariell suppression avseende total överlevnad, speciellt för patienter med HER2-negativ tumör och hög risk för återfall.
Hormonell uppföljning
I de flesta randomiserade studierna som undersöker tillägg av LHRH-analog har man givit behandling med månadssprutor, därför rekommenderar man i första hand månadssprutor som standardbehandling. Det finns två randomiserade studier som undersökte non-inferiority avseende östradiolsuppression av LHRH-analog som månadssprutor versus sprutor var tredje månad hos bröstcancerpatienter där man kunde bevisa non-inferiority 748749. I en av dessa studier som inkluderade patienter med spridd bröstcancer kunde man inte se någon skillnad mellan de två grupperna avseende ORR eller PFS 749. Man kan således överväga behandling med LHRH-analog var tredje månad i utvalda fall (patientens önskemål, svårigheter med administrering av månadssprutor), men det krävs en noggrann uppföljning avseende tecken till ovariell funktion.
SOFT-EST var en substudie inom SOFT där man monitorerade östradiol före behandlingsstart och efter 3, 6, 12, 18, 24, 36 och 48 månader. Minst 17 % av triptorelin-behandlade patienter hade mätbar östradiol vid någon tidpunkt under det första året 750. I en annan studie inkluderades patienter som behandlades med AI och man såg kraftigt ökad återfallsrisk (HR 9,3, 95 %, CI 3,3–48,0) till följd av reaktivering av ovarialfunktion 751. I ljuset av dessa studier rekommenderas monitorering av patienter insatta på LHRH-analog och AI enligt SOFT-EST schema i minst 1 år efter behandlingsstart.
Endokrinbehandling för postmenopausala patienter: år 0–5
Sammanfattning
- Tilläggsbehandling med AI som singelbehandling i 5 år ger en absolut minskad risk för återfall med 3,6 % jämfört med TAM, och efter 10 år minskar bröstcancerdödligheten med AI med 2,1 % och den totala dödligheten med 2,7 % (++++).
- 2–3 år av TAM följt av 2–3 år med AI ger en reducerad bröstcancerdödlighet med 1,3 % och en reducerad total dödlighet med 3 % efter 10 år jämfört med 5 år TAM (++++). 5 år med AI jämfört med 2–3 år TAM följt av 2–3 år AI ger någon procent i reducerad bröstcancerdödlighet respektive total dödlighet (++++).
- 5 år med AI jämfört med 5 års sekvensbehandling med AI först och TAM sedan har jämförbar sjukdomsfri samt total överlevnad (+++).
- Det finns ingen skillnad i behandlingseffekt mellan olika AI (++++).
Aromatashämmare i 5 år
Två randomiserade studier (ATAC, BIG1-98) har jämfört AI i 5 år med TAM i 5 år. En metaanalys av dessa resultat från EBCTCG (n = 9 885) visade minskad risk för återfall (RR 0,80, 95 %CI 0,73–0,80, absolut vinst 3,6 %), minskad bröstcancerdödlighet (RR 0,85, 95 % CI 0,75–0,96, absolut vinst 2,1 %) och minskad total dödlighet (RR 0,89, 95 % CI 0,80–0,97, absolut vinst 2,7 %). Man kunde inte se några skillnader i effekt beroende på ålder, BMI, tumörstadium, tumörgrad, PGR eller HER2-status. Alla tre tillgängliga AI (anastrozole, letrozole, exemestane) var lika effektiva, RR 0,67–0,73 i jämförelse med TAM 752. Detta har också bekräftats av individuella studier som direkt jämförde olika AI med varandra (FATA-GIM3, MA.27, FACE) 753754755.
En tidigare analys av BIG 1-98 hade visat att AI är betydligt effektivare än TAM för patienter med lobulär bröstcancer 756. Däremot kunde man inte påvisa någon signifikant interaktion mellan histologisk subtyp och effekt av AI vs TAM i en metaanalys av tre studier, oavsett definition för lobulär bröstcancer (central histopatologisk bedömning, n = 9 328, pinteraktion = 0,99 och E-cadherin, n = 7 654, pinteraktion = 0,9) 757.
Sekvensbehandling med AI och TAM
Tamoxifen i 2–3 år och därefter byte till AI i 2–3 år (s.k. ”short switch” eller sekvensbehandling) har undersökts i flera studier. Sekvensbehandling visade sig vara effektivare än TAM enligt EBCTCG-metaanalys (sex studier, n = 11 798) när det gäller återfallsrisk (RR 0,82, 95 % CI 0,75–0,91, absolut vinst 2 %), bröstcancerdödlighet (RR 0,84, 95 % CI 0,72–0,96, absolut vinst 1,5 %) och total dödlighet (RR 0,82, 95 % CI 0,73–0,91, absolut vinst 2,9 %) 758. Jämfört med AI i 5 år (tre studier, N = 12 779) såg man en gränssignifikant skillnad för AI singelbehandling i återfallsrisk (absolut vinst 0,7 %) men ingen skillnad i bröstcancerdödlighet (P = 0,11) 758. Ett annat alternativ är AI i 2–3 år följt av TAM i 2–3 år: i BIG1-98 var 10 års kumulativ incidens av bröstcanceråterfall väldig lik mellan denna strategi och AI i 5 år (26,0 % vs 26,8 %) 759. Under sekvensbehandling skiljer sig effekten och biverkningsprofilen signifikant åt under de perioder då behandlingen skiljer sig mellan grupperna.
Förlängd endokrin behandling
Sammanfattning
- Förlängd behandling med tamoxifen till totalt 10 år kan ge ytterligare drygt 3 % minskning av återfallen samt drygt 2 % förbättrad bröstcanceröverlevnad (++++).
- Förlängd behandling med AI i 5 år av patienter som är postmenopausala efter 5 års behandling med TAM ger en absolut riskminskning för återfall på cirka 5 % jämfört med ingen endokrin behandling (+++).
- Förlängd behandling med AI hos postmenopausala patienter efter 5 års behandling med AI har i vissa studier visat en förlängd tid till bröstcanceråterfall (+++) men ingen överlevnadsvinst (++++).
- Efter 5 års behandling med AI-innehållande behandling ger en 5 års förlängd behandling med AI inte någon överlevnadsvinst jämfört med 2–3 års förlängd behandling med AI enligt två randomiserade studier (+++), däremot har en meta-analys på studienivå visat att 5 års förlängd behandling är kopplad till förbättrad sjukdomsfri överlevnad hos lymfkörtelpositiva patienter (+++).
Bakgrund
En analys av nästan 63 000 randomiserade patienter har visat att 20-årsrisken för återfall för patienter som fått 5 års postoperativ endokrin behandling är påtaglig. För en patient med en T1-cancer utan lymfkörtelmetastaser, högt differentierad, har man 10 % risk för fjärråterfall. För större cancrar med flera lymfkörtelmetastaser är fjärråterfallsrisken kring 50 % 693. Liknande resultat har beskrivits i en populationsbaserad studie från Danmark: bland 20 000 patienter utan återfall 10 år efter primärbehandling observerades sent återfall hos 8,5 % 15 år efter primärdiagnos, 12,5 % 20 år efter primärdiagnos och 15,2 % 25 år efter primärdiagnos 694. Detta är alltså viktig information; diskutera med patienterna om nytta och risker med förlängd endokrin behandling till totalt 10 års behandling i ljuset av risken för fjärråterfall trots 5 års endokrin behandling.
Studiedata
Resultat av studier som har undersökt förlängd endokrin behandling presenteras i figur 11. Förlängd endokrinbehandling efter 5 års tamoxifenbehandling förbättrar sjukdomsfri överlevnad. Evidens för förlängd behandling med AI efter 5 års AI-innehållande behandling (singelbehandling eller sekvensbehandling) är svårtolkad. Publicerade studier om förlängd behandling har begränsningar som behöver beaktas vid tolkningen av resultat inklusive relativ kort uppföljningstid, begränsad statistisk styrka speciellt i subgruppsanalyser samt heterogenitet avseende typ av postoperativ endokrin behandling innan randomisering till förlängd AI. Dessutom verkar kortare varianter av förlängd behandling (2–3 år) inte vara sämre än längre varianter (5 år) enligt ABCSG-16 och IDEAL. Däremot har en metaanalys av dessa studier visat att längre förlängd AI-behandling ledde till förbättrad sjukdomsfri överlevnad jämfört med kortare förlängd AI-behandling hos lymfkörtelpositiva patienter (HR=0.85, 95% CI 0.74–0.97, pinteraktion = 0.048) 760. Med tanke på risken för biverkningar vid förlängd behandling, den blygsamma effekten och avsaknaden av överlevnadsvinst, bör man göra en individuell bedömning om eventuell nytta av förlängd behandling i relation till risker.
Beslutsverktyg för att stödja beslutet om förlängd endokrin behandling
Även om det finns en tydlig koppling mellan traditionella tumörkarakteristiska och risk för sena återfall, ser man samtidigt en ökad risk för sena återfall även vid lågrisktumörer enligt traditionella markörer. Förlängd endokrin behandling har visats kunna minska risken för sena återfall, men det finns samtidigt risk för biverkningar. Det finns således ett stort behov av utveckling av beslutsverktyg som kan prediktera vilka patienter som skulle ha nytta av förlängd endokrin behandling.
CTS5 (clinical treatment score after 5 years) är en algoritm baserad på tumörkarakteristiska (tumörstorlek, lymfkörtelspridning, gradering) och ålder som ger en prognos för risken för sena återfall mellan år 5 och 10 hos patienter med ER-positiv bröstcancer som är sjukdomsfria efter 5 år. Algoritmen utvecklades med hjälp av data från ATAC-studien och validerades i en oberoende kohort av BIG 1-98-studien 761. CTS5 har validerats i några oberoende kohorter där man bekräftar den prognostiska rollen av algoritmen avseende risken för sena återfall hos postmenopausala kvinnor 762, medan algoritmens prognostiska roll hos premenopausala kvinnor är mer tveksam. Man har däremot inte kunnat visa någon prediktiv roll av CTS5-algoritmen avseende förlängd endokrin behandling 763. CTS5 rekommenderas av ASCO som ett verktyg som stöd i beslutet om förlängd endokrin behandling 713. En rimlig strategi är att erbjuda förlängd behandling till hög risk patienter enligt CTS5 och diskutera potentiell nytta och risker med intermediär risk patienter, baserat på en poolad analys av ABCSG-6 och ABCSG-6a studier som visade trender för mindre fjäråterfallsrisk till fördel för förlängd endokrinbehandling (-4.0% resp -6.1%, jämfört med -0.9% hos låg risk patienter) 764.
Alla de fyra kommersiella genexpressionsanalyserna för bröstcancer som är tillgängliga i Europa (Oncotype Dx, Mammaprint, EndoPredict, Prosigna) har visat sig ha ett visst prognostiskt värde avseende risken för sena återfall. Det finns däremot begränsad evidens för det potentiella prediktiva värdet avseende nyttan med förlängd endokrin behandling. I en retrospektiv analys av den prospektiva NSABP B-42-studien kunde man se en signifikant interaktion mellan Mammaprint och behandlingseffekt: patienter med låg risk enligt Mammaprint hade större nytta av tillägg av AI än patienter med hög risk 765. Detta fynd bekräftades i en retrospektiv analys av IDEAL, där patienter med lågrisk-tumör hade större nytta av förlängd endokrin behandling 766. För närvarande rekommenderar ASCO inte någon av dessa fyra genexpressionsanalyser som beslutsstöd för beslut om förlängd endokrin behandling 713.
Figur 11. Randomiserade studier som har undersökt förlängd hormonbehandling.
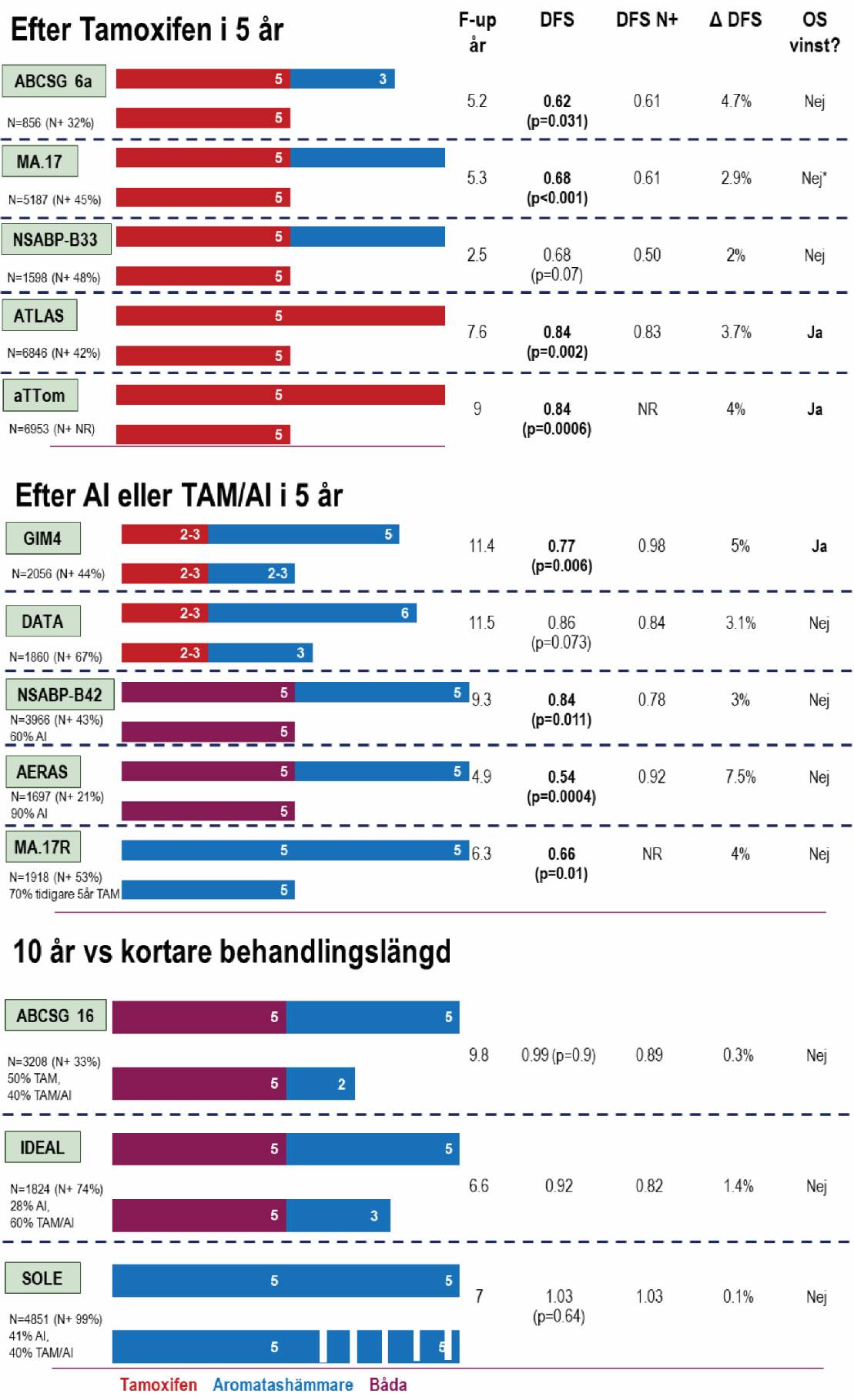
Breast Cancer Index är en RT-PCR-baserad analys som kombinerar två biomarkörer (HOXB13:IL17BR (H/I) kvot samt en 5-gen molecular grade index (MGI)) och ger prognostisk information om risken för sena återfall för ER-positiv bröstcancer. Breast Cancer Index har också visat prediktivt värde i tre retrospektiva analyser av tre randomiserade studier varav två med förlängd AI och en med förlängd TAM. I alla dessa tre studier kunde man se att (H/I)-high-tumörer var mer känsliga för endokrin behandling och hade större nytta av förlängd endokrin behandling än (H/I)-low-tumörer (signifikant interaktion mellan BCI och förlängd behandling) 767768769. Resultat från NSABP B-42-studien har dock inte visat en signifikant interaktion mellan (H/I) och behandlingseffekt, trots att man såg större nytta av förlängd behandling hos patienter med (H/I)-high-tumörer än (H/I)-low-tumörer 770. Dessutom har (H/I) visat sig vara prediktiv för nytta av GnRH agonist + AI jämfört med Tamoxifen (pinteraktion < 0.01) i en analys från SOFT, där endast patienter med (H/I)-low-tumörer hade nytta av GnrH agonist + AI 771. Breast Cancer Index är den enda genexpressionsanalys som rekommenderas av NCCN och ASCO som ett verktyg som stöd i beslutet om förlängd endokrin behandling 713. Än så länge är Breast Cancer Index inte tillgängligt i Europa.
Biverkningsprofil
Tamoxifen
Kunskapen om biverkningar av postoperativ TAM i 5 år baseras till stor del på EBCTCG:s metaanalys från 2005 som omfattar 7 512 behandlade och 7 005 obehandlade kvinnor 201. TAM ökar risken för endometriecancer med en faktor 3 (1,9 mot 0,6/1 000 kvinnor) jämfört med ingen endokrin behandling. Venös tromboembolism är också vanligare hos de tamoxifenbehandlade, men man har inte kunnat påvisa någon statistiskt signifikant ökad dödlighet i vare sig endometriecancer eller venös tromboembolism. Den vaskulära dödligheten i tamoxifen- respektive kontrollgruppen visade ingen signifikant skillnad men man fann numeriskt fler dödsfall i tamoxifengruppen, 189 mot 169, vilket motsvarar 0,27 % i absoluta tal. Detta kan förklaras av att den sammanlagda observationstiden är längre i tamoxifengruppen på grund av minskad bröstcancerdödlighet.
Aromatashämmare
Biverkningsprofilen skiljde sig åt i EBCTCG:s metaanalys från 2015, med ökad risk för endometriecancer för TAM jämfört med AI 758: 1,2 % jämfört med 0,4 % efter 10 år, vilket var statistiskt signifikant. Risken för frakturer var signifikant högre i AI-gruppen jämfört med TAM, med 5 års risk (8,2 % jämfört med 5,5 %). Vidare är TAM förknippad med en fördubblad risk för djup ventrombos/lungemboli jämfört med AI, medan det har funnits farhågor att AI skulle vara förknippad med fler kardiovaskulära händelser än TAM 772. Bland övriga biverkningar kan nämnas mer svettningar, vallningar och vaginala flytningar med TAM, medan AI oftare ger vaginal torrhet samt led- och muskelsmärtor. Flera av de stora randomiserade studierna som jämför AI med TAM har haft tilläggsprotokoll för att undersöka effekterna på den hälsorelaterade livskvaliteten. Några signifikanta skillnader mellan de olika typerna av hormonella läkemedel har dock inte framkommit 773774.
Dessa skillnader i biverkningsprofil är ibland styrande för vilket läkemedel man rekommenderar, i ljuset av data att bristande följsamhet till endokrin behandling, oftast på grund av biverkningar, är associerad till ökad dödlighet 775, medan återstart av behandling förbättrar sjukdomsfriöverlevnad 775. Bröstcancerbehandlande kliniker har således ett stort ansvar att ordna uppföljning på ett sådant sätt att patienterna kan få råd och stöd som underlättar följsamhet till den endokrina behandlingen.
Förlängd endokrin behandling
I ATLAS-studien som undersökte adjuvant TAM i 10 år såg man ingen skillnad i dödsfall av annan orsak än bröstcancer jämfört med TAM i 5 år (p = 0,84). Däremot sågs en ökad incidens av endometriecancer medan antalet dödsfall av endometriecancer inte skilde sig signifikant (17 versus 11 fall). Antalet lungembolier var lågt men signifikant fler i gruppen med förlängd behandling, 41 versus 21 (p = 0,01). Även ischemisk hjärtsjukdom var vanligare med förlängd behandling, 127 fall jämfört med 63 (p = 0,01). Man kunde dock se att incidensen av ischemisk hjärtsjukdom var lägre med förlängd behandling (2,7 % vs 3,4 %, P = 0,01) 776.
En metaanalys av 7 studier (n = 16 349) har undersökt biverkningsprofilen av förlängd AI-behandling. Med förlängd behandling såg man en signifikant ökning av cerebrovaskulära händelser med 0,82 % (p = 0,05) och av frakturer med 1,39 % (p < 0,001), medan ingen skillnad noterades i varken antal dödsfall utan återfall (p = 0,34), eller antal cancerfall förutom bröstcancer (p = 0.56) 777.
Osteoporos
Rekommendationer
- Alla patienter ska få allmänna råd om fysisk aktivitet och rökstopp.
- Postmenopausala kvinnor som planeras få AI i 5 år utan planerad postoperativ behandling med bisfosfonater ska remitteras för bentäthetsmätning (DEXA).
- Pre- eller perimenopausala kvinnor som planeras för ovariell suppression ska remitteras för DEXA efter cirka 1–2 års behandling.
- Initiering av antiresorptiv behandling rekommenderas vid T-score < −2 eller minst 2 av följande riskfaktorer: hög ålder (> 65 år), tidigare fraktur efter lågenergitrauma, höftfraktur hos förälder, kortisonbehandling > 3 månader (motsvarande 5 mg prednisolon eller högre; kortisonbehandling vid cytostatika räknas inte med), rökning, BMI < 20 och T-score mellan −1,5 och −2.
- Om patienten sätts på perorala bisfosfonater utförs bentäthetsmätning vartannat år, medan vid behandling med intravenös zoladronsyra (eller denosumab vid njursvikt) utförs bentäthetsmätning 1 år efter tredje dosen.
- Om patienten inte sätts på antiresorptiv behandling utförs ny bentäthetsmätning efter 1–2 år, beroende på riskfaktorer.
Vid behandling med AI måste man beakta den högre risken för osteoporos. Enligt en översiktsartikel om frakturincidens i 7 stora postoperativa studier med AI jämfört med TAM var den absoluta riskökningen för frakturer 2,2 % och den totala frakturrisken var 7,7 % 778. Notera att TAM motverkar osteoporos, vilket har betydelse när man ger sekventiell behandling med AI följt av TAM. Ovariell suppression hos premenopausala kvinnor påverkar också benmassan negativt, med en snabbare benförlust oavsett om suppressionen kombineras med TAM eller AI 779. Man kan förebygga benförlusten i den populationen med antiresorptiv behandling. Samma rekommendationer som vid postmenopausala kvinnor avseende initiering av antiresorptiv behandling gäller även för premenopausala med ovariell suppression.
Det förefaller därför rimligt att patienter som planeras för 5 års behandling med AI utan planerad postoperativ behandling med bisfosfonater bör skickas för DEXA, och att eventuell antiresorptiv behandling ges i enlighet med internationella riktlinjer om behandling av AI-inducerad benförlust 779780. Frakturriskbedömning kan göras med hjälp av FRAX-verktyget. Dock är denna algoritm inte designad för patienter med bröstcancer, och det finns risk att underskatta risken för fraktur hos bröstcancerpatienter under AI-behandling. En konsensus av 7 internationella föreningar rekommenderar att man väljer ”reumatoid artrit” för att beräkna frakturrisk hos AI-behandlade bröstcancerpatienter 779. Vid användning av FRAX inför beslut om initiering av behandling rekommenderas de allmänna, ej bröstcancerspecifika cut-offs för risk för fraktur (minst 20 %) eller höftfraktur (minst 3 %).
Val av antiresorptiv behandling sker i enlighet med rekommendationer från respektive osteoporosmottagning och bör ta hänsyn till patientens önskemål och individuella förutsättningar.
Postoperativ målriktad läkemedelsbehandling med CDK 4/6-hämmare
Sammanfattning
- Hos patienter med högrisk (definierad som > 3 positiva lymfkörtlar eller 1–3 lymfkörtlar plus en av följande: Ki67 20 % eller grad 3 eller T3–4) HR-positiv, HER2-negativ bröstcancer, leder postoperativ abemaciklib i 2 år till en förbättring av 5 års invasiv sjukdomsfri överlevnad med 7,6 % och fjärrmetastasfriöverlevnad med 6,8 %.
- Hos patienter med HR-positiv, HER2-negativ, stadium II/III-bröstcancer, förbättrar postoperativ ribociklib 400 mg/d i 3 år som tillägg till endokrin behandling 3 års sjukdomsfri överlevnad med 3,1 % och fjärrmetastasfri överlevnad med 2,7 %.
- Hos patienter med HR-positiv, HER2-negativ, stadium II/III-bröstcancer, förbättrar postoperativ palbociklib i 2 år som tillägg till endokrin behandling inte invasiv sjukdomsfri överlevnad.
- Hos patienter med HR-positiv, HER2-negativ bröstcancer med kvarvarande viabel sjukdom efter preoperativ behandling, förbättrar postneoadjuvant palbociklib i 1 år som tillägg till endokrin behandling inte invasiv sjukdomsfri överlevnad.
Rekommendation
- Postoperativ behandling med abemaciklib i 2 år som tillägg till endokrin behandling (aromatashämmare eller tamoxifen +/- GnRH-analog) bör övervägas hos patienter med luminal bröstcancer som bedöms som högrisk för återfall enligt följande kriterier:
- > 3 positiva lymfkörtlar
- 1–3 positiva lymfkörtlar och en av följande: grad 3 eller tumör ≥ 5 cm. (+++) (ESMO MCBS: A)
- Postoperativ behandling med ribociklib i 3 år som tillägg till endokrin behandling (aromatashämmare +/- GnRH-analog) bör övervägas hos patienter med luminal bröstcancer av anatomiskt stadium II eller III som bedöms som högrisk för återfall enligt NATALEE-studien (+++) (ESMO MCBS: A). Patienter med anatomiskt stadium IIA har på gruppnivå en bättre prognos och där överväger nyttan med ribociklib inte säkert riskerna med behandlingen. Ribociklib kan övervägas i selekterade fall av stadium IIA med grad 3 tumörer eller högrisk enligt genexpressionsanalys (+++). Man bör även överväga att avstå från ribociklib vid stadium IIB och grad 1 tumörer av samma skäl som stadium IIA ovan.
- Hos patienter som är kandidater både för abemaciklib och ribociklib rekommenderas i första hand abemaciklib, med hänsyn till längre uppföljning och större absolut vinst i monarchE samt kortare behandlingstid (2 kontra 3 år). Ribociklib kan ges till patienter som inte tolererar abemaciklib. Rekommendation om val av preparat kan komma att modifieras när längre uppföljning finns i studierna eller vid nya hälsoekonomiska data om dessa behandlingar.
Tabell 4. Rekommendation för adjuvant behandling med CDK4/6-hämmare.
|
Anatomisk stadieindelning |
TNM |
Ribociklib rekommenderas |
Abemaciklib rekommenderas |
|
I |
T1N0 |
Nej |
Nej |
| IIA |
T0N1 |
Om grad 3 eller högrisk på GES* |
Nej |
|
T1N1 |
Om grad 3 eller högrisk på GES* |
Om grad 3 (1:a handsval) |
|
|
T2N0 |
Om grad 3 eller högrisk på GES |
Nej |
|
| IIB |
T2N1 |
Ja |
Om grad 3 (1:a handsval) |
|
T3N0 |
Ja |
Nej |
|
|
IIIA |
T0N2 |
Ja |
Ja (1:a handsval) |
|
T1N2 |
Ja |
Ja (1:a handsval) |
|
|
T2N2 |
Ja |
Ja (1:a handsval) |
|
|
T3N1 |
Ja |
Ja (1:a handsval) |
|
|
T3N2 |
Ja |
Ja (1:a handsval) |
|
|
IIIB |
T4N0 |
Ja |
Nej |
|
T4N1 |
Ja |
Om grad 3 eller tumör ≥ 5 cm (1:a handsval) |
|
|
T4N2 |
Ja |
Ja (1:a handsval) |
|
|
IIIC |
AnyTN3 |
Ja |
Ja (1:a handsval) |
* ingen behandlingsindikation vid N1m (mikrometastas). GES = genexpression.
CDK 4/6-hämmare har en etablerad roll vid behandling av patienter med metastaserad HR-positiv, HER2-negativ bröstcancer. Konceptet med tillägg av CDK 4/6-hämmare till endokrin behandling har också testats i postoperativ situation med motstridiga resultat.
I PALLAS-studien randomiserade man 5 760 patienter med HR-positiv, HER2-negativ, stadium II/III bröstcancer till palbociklib i 2 år eller placebo tillsammans med endokrin behandling. Studien stoppades efter den andra interimsanalysen eftersom man inte skulle kunna bevisa någon förbättring av prognosen med palbociklib. Vid senaste uppdateringen såg man ingen skillnad i 4 års sjukdomsfriöverlevnad (84,2 % vs 84,5 %, HR 0,96, 95 % CI 0,81–1,14, P = 0,65). Tidigt avbrott av palbociklib och dosintensitet var inte förknippat med behandlingseffekt 781.
Palbociklib har också testats som postneoadjuvant behandling i PENELOPE-B-studien med negativa resultat som i PALLAS. I PENELOPE-B-studien randomiserades 1 250 patienter som inte fick pCR efter preoperativ behandling till palbociklib i 1 år eller placebo som tillägg till endokrin behandling. För att inkluderas i studien krävde man också att patienterna hade en högrisksjukdom med antingen en clinical pathological staging-estrogen receptor grading score ≥ 3 eller 2 och ypN+. Efter medianuppföljning på 42,8 månader kunde man inte se någon statistiskt signifikant skillnad i invasiv sjukdomsfri överlevnad (HR 0,93, 95 % CI 0,74–1,17) och inte heller i total överlevnad (HR 0,87, 95 % CI 0,61–1,23) 263.
Till skillnad från resultaten från studierna PALLAS och PENELOPE-B som var negativa, är resultaten av monarchE- och NATALEE-studierna positiva. I monarchE-studien randomiserades patienter med HR-positiv, HER2-negativ bröstcancer till 2 års postoperativ behandling med abemaciklib eller placebo som tillägg till endokrin behandling. ITT-populationen bestod av patienter med hög risk för återfall definierad som > 3 positiva lymfkörtlar eller 1–3 lymfkörtlar plus en av följande: Ki67 20 % enligt central granskning (Kohort 2) eller grad 3 eller T3–4 (Kohort 1). Totalt 5 637 patienter inkluderades i studien och vid senaste uppdateringen sågs att abemaciklibtillägget ledde till en förbättrad 5 års invasiv sjukdomsfri överlevnad (83,6 % vs 76,0 %, HR 0,68, 95 % CI 0,59–0,77) och fjärrmetastasfri överlevnad (86,0 % vs 79,2 %, HR 0,67, 95 % CI 0,58–0,77). Det är värt att påpeka att vid längre uppföljning ser man större relativ nytta med abemaciklibbehandling (år 0–1 HR 0,78; år 1–2 HR 0,67; år 2–3 HR 0,62; år 3+ HR 0,60 261. Baserat på positiva resultat från MonarchE-studien har EMA godkänt abemaciklib som postoperativ behandling vid högrisk luminal bröstcancer. TLV:s beslut om generell subvention gäller enligt omprövning i december 2022 även den postoperativa indikationen.
I NATALEE-studien inkluderas patienter med stadium II/III-bröstcancer, dvs. alla patienter med icke-metastaserande HR-positiv, HER2-negativ tumör utom stadium T1N0 och T0-1N1mi, medan endast högrisk T2N0 kunde inkluderas (grad 3 eller grad 2 och Ki67 ≥ 20 %, eller högrisk enligt genexpressionsanalys såsom Oncotype, Prosigna, MammaPrint eller EndoPredict). Patienterna randomiserades till ribociklib 400 mg/dag (alltså lägre dos än den palliativa indikationen) i 3 år eller placebo. Vid senaste uppdateringen efter medianuppföljning på 44,2 månader sågs en förbättrad invasiv sjukdomsfri överlevnad (88,5 % vs 83,6 %, HR 0,71, 95 % CI 0,61–0,84) och fjärrmetastasfri överlevnad (HR 0,71, 95 % CI 0,60–0,85). Effekt var likvärdig oavsett stadium (II vs III), lymfkörtelstatus (N0 vs N1–3) eller grad 782. Jämfört med den vanliga doseringen (600 mg/dag) noterades lägre incidens av QTc-förlängning (4,2 % vs 6,5 %) och grad ≥ 3 neutropeni (44 % vs 60 %) 783784. På basen av dessa resultat godkändes ribociklib av EMA som postoperativ behandling vid högrisk luminal bröstcancer.
Endokrin behandling vid duktal cancer in situ
Rekommendation
- Endokrin behandling rekommenderas inte generellt, men kan övervägas vid ER-positiv duktal cancer in situ när nyttan för den enskilda patienten bedöms överstiga nackdelarna.
En Cochraneanalys från 2012 baserad på 2 randomiserade studier som inkluderat drygt 3 000 kvinnor, visade att TAM efter bröstbevarande kirurgi för DCIS reducerar antalet nya bröstcancerhändelser 785. TAM reducerade både ipsilaterala DCIS (HR 0,75, 95 % CI 0,61–0,92) och kontralaterala DCIS (HR 0,50, 95 % CI 0,28–0,87). Kontralateral invasiv cancer minskade också (HR 0,57, 95 % CI 0,39–0,83), och det fanns en trend till reduktion av ipsilateral invasiv cancer (HR 0,79, 95 % CI 0,62–1,01). Ingen effekt på total överlevnad sågs (RR 1,11, 95 % CI 0,89–1,39). Nyttan av TAM gäller endast dem med hormonreceptorpositiv DCIS enligt en analys av NSABP B-24-studien (HR 0,49 för bröstcancerhändelse efter 10 år, P = 0,001) 786. Endast en av studierna rapporterade biverkningar (toxicitet, humörförändringar, djup ventrombos, lungemboli och endometriecancer) och man såg ingen signifikant skillnad mellan TAM och placebo. En icke-signifikant trend för ökad risk för endometriecancer visades för tamoxifengruppen 787.
Vid dålig tolerans kan enligt UpToDate övervägas lägre dosering av TAM, dvs. en halv tablett varannan dag vilket motsvarar 5 mg/dag 788. Denna låga dos undersöktes i en studie av 501 patienter som hade blivit opererade för DCIS (70 %), LCIS eller atypisk duktal hyperplasi. Patienter som behandlades med TAM 5 mg/dag i 3 år hade en mindre risk för återfall eller invasiv bröstcancer (HR 0,48, 95 % CI 0,25–0,89, absolut vinst 6,2 %) 61, en relativ riskminskning motsvarande den beskrivna i NSABP B-24. Riskminskningen kvarstod efter längre uppföljning (median 9,7 år, HR 0,58, 95 % CI 0,35–0,95), även i DCIS-gruppen (HR 0,50, 95 % CI 0,28–0,91) 789.
I IBIS-II DCIS och NSABP B-35 jämförde man AI och TAM för postmenopausala kvinnor efter bröstbevarande operation med och utan strålbehandling för DCIS. I NSABP B-35 fanns en liten men signifikant skillnad i bröstcancerfritt intervall (BCFI) vid 10 år, 89,2 % för TAM och 93,5 % för anastrozol (HR 0,73, P = 0,03). Skillnaden märktes sent under uppföljningen och gällde kvinnor under 60 år vid diagnos 790. I IBIS-II DCIS inkluderades 2 980 patienter; efter median uppföljning av 11,6 år var det ingen skillnad i återfallsfrekvens (HR 0,87, 95 % CI 0,67–1,14) eller dödlighet (HR 0,94, 95 % CI 0,67–1,33) 791.
Efter bröstbevarande kirurgi för DCIS kan 5 års endokrin behandling övervägas. ER-status ska då utföras. Endokrin behandling rekommenderas inte generellt, men kan övervägas vid ER-positiv DCIS när nyttan för den enskilda patienten bedöms överstiga nackdelarna. Utbredning och nukleär grad har en viss korrelation till återfallsrisk. Någon överlevnadsvinst finns sannolikt inte och risken för biverkningar måste beaktas.
Systemisk tilläggsbehandling vid HER2-positiv bröstcancer
Rekommendationer
- Patienter som primärt opereras för HER2-positiv bröstcancer bör erbjudas 1 års postoperativ behandling med trastuzumab (++++).
- För vissa patienter med i övrigt mycket gynnsam prognos, såsom ≤ 5 mm ER-positiv och grad 1–2, är det efter avvägning mot risken för biverkningar och samsjuklighet rimligt att avstå från trastuzumab (++).
- Om man ska erbjuda tilläggsbehandling med trastuzumab ska patienten i princip få tilläggsbehandling med cytostatika. Trastuzumab ges i första hand samtidigt med taxan (++++).
- Vid lågriskpatienter (pT1N0) eller äldre patienter bör man överväga behandling med paklitaxel 80 mg/m2 x 12 tillsammans med trastuzumab var tredje vecka x 17 (+++).
- Sekventiell behandling med antracyklin och taxan med tillägg av trastuzumab samtidigt med taxan är standardbehandling för primärt opererade högriskpatienter (++++).
- Om patienten bedöms ha förhöjd risk för hjärtsjukdom kan docetaxel + karboplatin x 6 kombineras med trastuzumab (+++).
- Tillägg av pertuzumab till adjuvant trastuzumab rekommenderas inte i avsaknad av överlevnadsvinst och i enlighet med NT-rådets rekommendation (+++).
- Förlängd anti-HER2-behandling med neratinib i 1 år rekommenderas inte i avsaknad av överlevnadsvinst (ESMO MCBS: No evidence of benefit).
Sammanfattning
- Tillägg av trastuzumab till standard-cytostatikabehandling med antracyklin och taxan ger en absolut minskning av 10 års återfallsrisk på 9 % och dödlighet på 6,5 % (++++).
- Ett års behandling med trastuzumab ger en relativ minskning av risken för återfall med 19 % och risken för total dödlighet med 22 % jämfört med kortare behandling (9 veckor eller 6 månader) (++++).
- Paklitaxel veckovis x 12 tillsammans med trastuzumab i 1 år till patienter med < 2 cm HER2-positiv bröstcancer leder till en väldigt låg risk för 10 års bröstcancerdöd på 1,2 % (+++).
- Docetaxel + karboplatin i kombination med trastuzumab är ett alternativ för patienter med förhöjd risk för hjärtsjukdom, men denna kombination ger numeriskt fler bröstcanceråterfall jämfört med motsvarande antracyklinkombination (+++).
- Tillägg av postoperativ pertuzumab till ovanstående standardbehandlingar ger en statistiskt signifikant men modest förbättring av den 8 års invasiva sjukdomsfria överlevnaden med 4,9 % i N+. Man ser ingen skillnad i totalöverlevnaden (+++) (ESMO MCBS: A).
- Tillägg av postoperativ neratinib i 1 år efter avslutad postoperativ trastuzumab ger en förbättrad 5 års invasiv sjukdomsfriöverlevnad på 2,5 %. Man ser ingen skillnad i totalöverlevnaden (+++) (ESMO MCBS: No evidence of benefit).
Adjuvant trastuzumab
HER2/neu- (c-erbB-2) är en onkogen som överuttrycks i primär bröstcancer i frekvensen 10–30 % beroende på vilken bröstcancerpopulation som studerats och med vilken metod genen analyserats. De tumörer som överuttrycker HER2 har en sämre prognos än HER2-negativa 792.
Effekt
EBCTCG har publicerat en individuell patient-metaanalys av 7 randomiserade studier med trastuzumab vid tidig bröstcancer 793, och man såg att trastuzumabtillägget ledde till en absolut minskning av 10 års återfallsrisk med 9 %, en minskning på 6,4 % av bröstcancerdödlighet och 6,5 % av total dödlighet. Den relativa nyttan var opåverkad av kliniska och patologiska faktorer och var högst under år 0–1 (RR 0,53, 99 % CI 0,46–0,61) jämfört med år 2–4 (RR 0,73, 99 % CI 0,62–0,85) och 5–9 (RR 0,80, 99 % CI 0,64–1,01). Den absoluta nyttan berodde på den absoluta risken för återfall: patienter med lymfkörtelnegativ bröstcancer hade en absolut minskning av 5 års återfallsrisk med 5,7 %, medan patienter med fyra eller fler angripna lymfkörtlar hade en absolut minskning på 10,7 %. Patienter med ER-positiva och ER-negativa tumörer hade liknande absolut minskning av 10 års bröstcancerdödlighet, 5,1 % respektive 6,9 %.
Behandlingslängd
Med dagens kunskapsläge rekommenderas 1 års tilläggsbehandling med trastuzumab. HERA-studien är en trearmad studie där patienter med HER2-positiv bröstcancer randomiserades till cytostatika följt av trastuzumab i 1 år, cytostatika följt av trastuzumab i 2 år samt en kontrollarm med enbart cytostatika. Vid 11-årsuppföljning sågs inget tilläggsvärde av 2 års postoperativ trastuzumabbehandling 794. I den ovannämnda metaanalysen av EBCTCG ledde 1 års behandling till signifikant minskad återfallsrisk jämfört med 6 månaders behandling (RR 0,86, 95 % CI 0,76–0,99). Inga subgruppsanalyser har presenterats och denna jämförelse baserades inte på individpatientdata. Två studier har jämfört ännu kortare behandlingslängd, 9 veckor, med standardduration: Short-HER (n = 1 254) och SOLD (n = 2 174) 795796. Ingen studie kunde påvisa non-inferiority av 9 veckors behandling. I Short-HER sågs en interaktion mellan antal angripna lymfkörtlar och nytta av 1 års behandling, vilket inte bekräftades i SOLD. En till metaanalys av 5 studier (11 381 patienter) har jämfört standardbehandling med kortare durationer där man noterade en signifikant förbättrad sjukdomsfri överlevnad och total överlevnad med 1-årsbehandlingen 797.
Hjärtbiverkningar
En analys av 7 studier med sammanlagt 7 939 patienter visade att trastuzumab ökar risken för klinisk hjärtsvikt med RR 5,1 (95 % CI 3–8,7), vilket innebär en ökning på 2–3 % i absoluta tal jämfört med cytostatika enbart 798. På grund av detta rekommenderas undersökning av hjärtats vänsterkammarfunktion (LVEF) inför och under behandling med trastuzumab. Ämnet diskuteras i detalj i Kapitel 21 Kardioonkologi.
Postoperativ tilläggsbehandling för patienter i låg risk för återfall
Patienter med små HER2-positiva tumörer har en betydande återfallsrisk jämfört med HER2-negativa tumörer 799. Olika strategier har undersökts prospektivt i studier för att på ett optimalt sätt behandla patienter i relativt låg risk för återfall.
I APT-studien som var en fas 2-studie utan kontrollarm undersökte man om det var möjligt att deeskalera onkologisk behandling hos patienter med lågrisk HER2-positiv bröstcancer (tumörstorlek < 3 cm) genom att ge paklitaxel veckovis x 12 och trastuzumab i 1 år. 91 % av inkluderade patienter hade tumör < 2 cm och cirka hälften < 1 cm. 10 års invasiv bröstcancerfri överlevnad var 91,3 % och 10 års bröstcancerspecifik överlevnad var 98,8 %, vilket innebär en utmärkt prognos för de patienterna trots deeskalerad behandling 800.
I ATEMPT-studien jämförde man postoperativ behandling med 1 års trastuzumab emtansin kontra veckovis paklitaxel i kombination med trastuzumab. I en studiekohort på 497 patienter kunde man inte bekräfta att postoperativ trastuzumab emtansin var mindre toxisk än veckovis paklitaxel-trastuzumab, men 3 års invasiv sjukdomsfriöverlevnad för trastuzumab emtansin-armen var utmärkt (97,8 %) 801. Trastuzumab emtansin är inte godkänt som postoperativ behandling för primärt opererade patienter med HER2-positiv bröstcancer.
Trastuzumab som singelbehandling utan tillägg av cytostatika har studerats i ett annat sammanhang, dvs. äldre kvinnor i risk för cytostatika-orsakade biverkningar. En studie randomiserade 275 patienter till trastuzumab med eller utan cytostatika (35 % paklitaxel, 23 % antracyklin, 14 % docetaxel, 20 % CMF) 802. Man noterade en icke-signifikant trend till bättre 3 års sjukdomsfri överlevnad (HR 1,36, 95 % CI 0,72–2,58) med kombinerad behandling, en riskminskning på 4,3 % i absoluta tal. Denna riskminskning motsvarade dock endast 0,4 månader i RMST (restricted mean survival time).
Postoperativ tilläggsbehandling för patienter i hög risk för återfall
Patienter med HER2-positiv bröstcancer som har en hög återfallsrisk bör i princip alltid behandlas preoperativt, men av olika skäl såsom patentens val, preoperativ diagnos av HER2-negativ bröstcancer osv. kan det vara aktuellt med primäroperation.
Antracykliner och antracyklinfria regimer
Två poolade analyser av randomiserade studier (n = 6 564 respektive n = 3 452) har visat statistiskt signifikant interaktion mellan HER2-positivitet och nytta av antracyklinbehandling 701702, där patienter med HER2-amplifierad sjukdom verkar ha större nytta av antracykliner. Om ingen kontraindikation föreligger bör dostät antracyklin innehållande regimer användas i ljuset av begränsade befintliga data 803. Cytostatika och trastuzumab kan ges antingen parallell eller sekventiellt enligt EBCTCG-metaanalysen (RR för återfallsrisk 0,61 respektive 0,69). Konkomitant administrering med antracykliner bör dock undvikas på grund av förhöjd risk för hjärtsvikt i vissa 804 men inte alla studier 242.
BCIRG 006-studien är av särskilt intresse eftersom det är den enda studien som innehåller en antracyklinfri cytostatikaregim given tillsammans med trastuzumab: docetaxel + karboplatin x 6 givet samtidigt med trastuzumab som pågick i 1 år, vilket jämfördes med kontrollarmen AC x 4 följt av docetaxel x 4, och slutligen en tredje arm med AC x 4 → docetaxel x 4 med trastuzumab i 1 år som startades samtidigt med docetaxel. Det fanns ingen skillnad i effekt mellan de 2 trastuzumab armarna men incidensen av klinisk hjärtsvikt var 2 % för antracyklin + trastuzumabarmen och 0,4 % för den antracyklinfria armen.
Pertuzumab
Pertuzumab är en anti-HER-monoklonal antikropp som förhindrar dimeriseringen av HER2-receptorn med de andra medlemmarna i HER-familjen, alltså en komplementär funktion till trastuzumab. I APHINITY-studien randomiserades 4 805 patienter mellan standardbehandling med postoperativ cytostatikabehandling och trastuzumab med eller utan pertuzumab; 63 % hade lymfkörtelpositiv sjukdom. Vid senaste uppdateringen efter median uppföljningstid på 8,4 år sågs en statistiskt signifikant förbättring av invasiv sjukdomsfriöverlevnad hos de individer som fick pertuzumab (HR 0,77, 95 % CI 0,66–0,91) som var begränsad till lymfkörtelpositiva patienter (absolut vinst 4,9 %), medan lymfkörtelnegativa patienter inte hade någon nytta alls av pertuzumab (HR 1,01, 95 % CI 0,72–1,42). Det sågs ingen vinst i total överlevnad, med icke statistiskt signifikant skillnad hos lymfkörtelpositiva patienter på 1,9 % 805. Postoperativ behandling med pertuzumab är godkänd av EMA som postoperativ behandling hos patienter med hög risk för återfall men rekommenderas inte av NT-rådet med tanke på kostnader i relation till nytta. Det kan däremot finnas undantagsfall där postoperativ pertuzumab kan övervägas, till exempel patienter med 4 eller fler positiva lymfkörtlar som visats ha avsevärt sämre prognos trots 1 års behandling med trastuzumab (10 års sjukdomsfriöverlevnad på 54,5 % i HERA.
Neratinib
Neratinib är en peroral irreversibel pan-HER-tyrosinkinashämmare. I ExteNET-studien randomiserades 2 840 patienter som var färdiga med postoperativ trastuzumab till antingen neratinib 240 mg per dag i 12 månader eller placebo. Efter 5,2 års medianuppföljningstid kunde man se en signifikant förbättrad sjukdomsfriöverlevnad i neratinibarmen med 3,5 % (HR 0,73, 95 % CI 0,57–0,92). I en subgruppsanalys kunde man se att neratinib ledde till en HR på 0,60 avseende sjukdomsfriöverlevnad vid hormonreceptorpositiv sjukdom 806. I den finala överlevnadsanalysen kunde man dock inte se någon nytta i total överlevnad i vare sig den totala populationen eller någon subgrupp av intresse (enligt ER-status, genomgången neoadjuvant behandling, lymfkörtelstatus, osv.) 807. Neratinibbehandling var kopplad till en betydligt ökad risk för grad 3-diarréer (40 % vs 2 %), vilket ledde till dosminskningar hos 26 % av patienterna 806. I ljuset av dessa data och data från CONTROL-studien rekommenderas profylaktisk loperamid vid användning av neratinib 808.
Neratinib är godkänt av EMA med indikation att övervägas som utvidgad postoperativ behandling hos patienter med HER2-positiv och hormonreceptorpositiv bröstcancer inom 1 år efter att de är färdiga med postoperativ trastuzumabbehandling och subventioneras i Sverige. I avsaknad av total överlevnadsvinst, biverkningsprofil och oklar effekt efter pertuzumabbehandling (ingen patient i ExteNET hade fått pertuzumab, vilket nu betraktas som preoperativ standardbehandling) eller trastuzumab emtansin (som är standardbehandling vid kvarvarande invasiv cancer efter preoperativ behandling), bör neratinib användas endast vid mycket utvalda fall.
Postoperativ tilläggsbehandling med övriga mediciner
Postoperativ behandling med bisfosfonater och denosumab
Nedan beskrivs all relevant evidens beträffande användning av bisfosfonater eller denosumab postoperativt i syfte att minska risk för bröstcanceråterfall.
Sammanfattning
- Postoperativ bisfosfonatbehandling hos postmenopausala patienter ger en statistiskt signifikant minskning av antalet skelettmetastaser (absolut minskning på 2,2 %), samt förbättrar bröstcanceröverlevnaden med absolut förbättring på 3,3 % och totalöverlevnaden med absolut förbättring på 2,3 % (++++).
- Postoperativ bisfosfonatbehandling hos premenopausala patienter påverkar inte statistiskt signifikant vare sig risken för skelettåterfall eller bröstcancerdödlighet (++++). Endast två studier har undersökt postoperativ bisfosfonatbehandling hos premenopausala patienter som står på LHRH-analog med motstridiga resultat (++).
Rekommendationer
- Postoperativ bisfosfonatbehandling rekommenderas till postmenopausala patienter med primär lymfkörtelmetastaserande sjukdom oavsett ER-status. Behandlingslängden rekommenderas till 3 år (++++).
- Postoperativ bisfosfonatbehandling till pre- och perimenopausala patienter med lymfkörtelmetastaserande sjukdom som står på LHRH-analog kan övervägas. Behandlingslängden rekommenderas till 3 år och behandlingen bör avbrytas ifall LHRH-analog seponeras (++). Bisfosfonatbehandling ska inte ges vid kvarstående barnönskan.
- Postoperativ behandling med denosumab rekommenderas inte i nuläget.
Effekt
EBCTCG har genomfört en metaanalys på individpatientdata av 18 766 patienter som hade deltagit i 32 randomiserade studier som undersökt värde av tilläggsbehandling med bisfosfonater 809. I den totala populationen såg man ingen statistiskt signifikant minskning av återfallsrisk (RR 0,94, 95 % CI 0,87–1,01). Däremot noterades en minskning av 10 års fjärrmetastasrisk (RR 0,92, 95 % CI 0,85–0,99, P för interaktion 0,01) som mest handlade om en minskning av skelettåterfall (RR 0,83, 95 % CI 0,73–0,94, absolut vinst 1,2 %). Både bröstcancerdödlighet (RR 0,91, 95 % CI 0,83–0,99, absolut vinst 1,8 %) och total dödlighet (RR 0,92, 95 % CI 0,85–1,00, absolut vinst 1,5 %) var bättre med bisfosfonatbehandling.
Indikation
I metaanalysen sågs en interaktion mellan effekt och ålder (p = 0,03) samt menopausstatus (p = 0,06) där endast postmenopausala patienter hade nytta av bisfosfonatbehandling i skelettåterfallsrisk (RR 0,72, 95 % CI 0,60–0,86) men inte premenopausala (RR 0,92, 95 % CI 0,75–1,12). Ytterligare interaktion mellan andra kliniska och patologiska faktorer och effekt kunde man inte se. Kvinnor som hade behandlats med cytostatika hade liknande relativ riskminskning som kvinnor som inte hade behandlats med cytostatika (RR 0,84 respektive 0,74). Detsamma noterades när det gäller hormonreceptorstatus (ER-negativ tumör RR 0,76, ER-positiv tumör RR 0,85). Patienter med lymfkörtelnegativa tumörer hade ingen minskning av skelettåterfallsrisk (RR 1,02), jämfört med patienter med 1–3 (RR 0,79) eller fler angripna lymfkörtlar (RR 0,83), men interaktion mellan lymfkörtelstatus och effekt var inte statistiskt signifikant (p = 0,5).
Det är oklart varför man ser så stora skillnader i effekt i den pre- respektive postmenopausala gruppen. Det är också oklart om premenopausala patienter som erhåller LHRH-analog också bör behandlas med postoperativa bisfosfonater. Två studier har undersökt denna specifika frågeställning. I ABCSG-12 randomiserades 1 803 premenopausala kvinnor till tamoxifen + zoledronsyra, tamoxifen, anastrozole eller anastrozole + zoledronsyra. Alla behandlades med goserelin. Tillägg av zoledronsyra förbättrade sjukdomsfriöverlevnad (HR 0,68, 95 % CI 0,51–0,91, absolut vinst 4 %) med minskning av både lokal- och fjärråterfall, oavsett lymfkörtelstatus, men endast på kvinnor > 40 år (HR 0,58, jämfört med HR 0,94 < 40 år). Total överlevnad var inte statistiskt signifikant bättre i zoledronsyraarmarna (HR 0,67, 95 % CI 0,41–1,07, P = 0,09) 810. I HOBOE randomiserades 1 065 premenopausala kvinnor till adjuvant tamoxifen eller letrozole eller letrozole + zoledronsyra. Alla behandlades med triptorelin. Letrozole + zoledronsyra ledde jämfört med letrozole till en icke statistiskt signifikant minskning av 5 års återfallsrisk (HR 0,70, 95 % CI 0,44–1,12, P = 0,22 811). Metaanalys av dessa två studier har däremot visat en signifikant förbättring av sjukdomsfri överlevnad (HR 0,75, 95 % CI 0,60–0,94) se Supplementary Figure A6) i följande referens 811.
ASCO 812, ESMO 176780, NCCN och UpToDate rekommenderar tilläggsbehandling med bisfosfonater för alla postmenopausala kvinnor oavsett orsak till menopaus, även unga kvinnor som erhåller LHRH-analog, som har tillräckligt hög risk för återfall. ASCO rekommenderar att man använder NHS PREDICT som stöd för beslut om adjuvanta bisfosfonater, medan ESMO rekommenderar bisfosfonater för patienter som behandlas med cytostatika och/eller har en 10 års risk för bröstcancerdöd > 12 %. Samtidigt måste man ta hänsyn till att bisfosfonater klassas i kategorin B:3 avseende graviditetsklass vilket innebär en potentiell skadlig effekt på reproduktionsprocessen, vilket är ett observandum eftersom bisfosfonater har förmåga att ackumuleras i skelettet och kvarstannar i några år efter utsättningen, även om risk för skador verkar vara mycket låg 814.
Val av bisfosfonat och regim
Vilken typ av bisfosfonat man väljer verkar inte spela någon roll för behandlingseffekt och inte heller behandlingslängd enligt EBCTCG-metaanalysen. Dock är de flesta studierna gjorda med zoledronsyra intravenöst 4 mg var 6:e månad i 5 år. I SWOG S0307 som publicerades efter EBCTCG:s metaanalys randomiserades 6 097 patienter i tre armar: zoledronsyra, klodronat och ibandronat. 5 års sjukdomsfri överlevnad och total överlevnad var likvärdig i alla grupper (87 % respektive 92 %). Grad 3/4 toxicitet noterades vid 10,5 % av patienter som fick ibandronat jämfört med 8,8 % för zoledronsyra och 8,3 % för klodronat. Risk för käkbensnekros var lägst med klodronat (0,36 %) jämfört med ibandronat (0,77 %) och zoledronsyra (1,26 %) 815. En studie som undersökte ibandronat på postmenopausala patienter och som också publicerades efter EBCTCG:s metaanalys visade ingen signifikant förbättring av sjukdomsfri överlevnad jämfört med placebo 816, därför kan zoledronsyra och klodronat betraktas som förstahandsalternativ.
SUCCESS A undersökte om behandlingslängd har betydelse för effekten. Totalt randomiserades 2 987 patienter efter 2 års zoledronsyra 4 mg var tredje månad (8 infusioner) till antingen ingen mer behandling eller ytterligare 3 års behandling med 4 mg var 6:e månad upp till 5 år (6 ytterligare infusioner). Man kunde inte se någon skillnad i sjukdomsfri eller total överlevnad med 2 års behandling jämfört med 5 års behandling. Däremot var risken för biverkningar lägre vid kortare arm. Ett observandum är att 2-årsarmen innebar totalt 32 mg zoledronsyra, vilket motsvarar 4 års behandling med zoledronsyra 4 mg var 6:e månad 817. Konfirmerande resultat från ABCSG-12 har visat att sjukdomsfri- och total överlevnad var likvärdiga för patienter som hade erhållit ≤ 6 och ≥ 7 infusioner med zoledronsyra 818.
ASCO rekommenderar zoledronsyra 4 mg var 6:e månad i 3 år, eller klodronat per os 1 600 mg/dag i 2–3 år eller ibandronat per os 50 mg/dag i 3 år 812. ESMO rekommenderar zoledronsyra parallellt med cytostatika och därefter antingen zoledronsyra 4 mg var 6:e månad i 3 år eller peroral behandling med ibandronat/klodronat i 3 år 780. Innan man inleder bisfosfonatbehandling ska man skaffa sig en uppfattning om patientens tand- och munhålestatus, eftersom bisfosfonater ökar risken för komplikationen käkbensnekros. Vid behov rekommenderas patienten tandläkarkontakt. Risken med den föreslagna regimen, zoledronat intravenöst 4 mg var 6:e månad i 3–5 år, måste dock bedömas som låg. Man bör kontrollera kreatinin, albumin och kalcium vid varje kur. När bisfosfonater används ska man också i princip ge kalcium och vitamin D3.
Denosumab
Denosumab är en humaniserad monoklonal antikropp som binder sig till RANK ligand, en faktor som kontrollerar osteoklastaktiviteten och som därigenom hämmar benresorption. Denosumab har studerats vid dels osteoporos, dels metastatisk sjukdom. Doseringsstrategierna är olika för respektive indikationer.
I ABCSG-18 randomiserades 3 420 patienter till denosumab 60 mg eller placebo, subkutan injektion var 6:e månad. 9 års sjukdomsfri överlevnad var 79,4 % i denosumabarmen och 75,9 % i placeboarmen (HR 0,83, 95 % CI 0,71–0,97). Risk för skelettåterfall minskade med 2,5 % (HR 0,81, 95 % CI 0,65–1,00) och total dödlighet med 1,0 % (HR 0,80, 95 % CI 0,64–1,01). Man såg dock att effekt i sjukdomsfri överlevnad berodde mest på en minskning av antal icke-bröstcancerfall (101 versus 127), medan ingen skillnad i bröstcancerfri intervall noterades (HR 0,95, 95 % CI 0,76–1,19).
I D-CARE-studien randomiserade man 4 509 patienter till denosumab 120 mg varje månad i 6 månader och sedan var tredje månad upp till 5 år eller placebo. Efter medianuppföljning på 67 månader såg man ingen skillnad i skelettmetastasfri överlevnad, sjukdomsfri överlevnad eller total överlevnad. Betydligt fler fall av käkbensnekros sågs i denosumabarmen (5,4 % versus 0,2 %).
Rekommendation är att tills vidare avvakta med postoperativ denosumabbehandling. Varken ASCO eller ESMO rekommenderar denosumab i adjuvant syfte 780812.
Postoperativ behandling med PARP-hämmare
Rekommendation
Olaparib som monoterapi rekommenderas för adjuvant behandling av vuxna patienter med germline BRCA1- eller BRCA2 mutation som fått neoadjuvant kemoterapi för trippelnegativ bröstcancer och inte uppnått pCR och där behandling med kapecitabin inte är lämplig (betingad nedsatt förmåga att omsätta läkemedlet eller andra specifika biverkningar av kapecitabin) samt som monoterapi för patienter med BRCA1/2-muterad stadium I/II trippelnegativ bröstcancer som fått adjuvant kemoterapi (+++).
Sammanfattning
Hos bröstcancerpatienter med stadium II/III bröstcancer och germline BRCA1- eller BRCA2-mutation som fått postoperativ cytostatikabehandling eller preoperativ cytostatikabehandling utan pCR, leder postoperativ olaparib i ett år till en kliniskt och statistiskt signifikant förbättrad 4 års total överlevnad med en absolut vinst på 3,4 % (89,8 % vs 86,4 %) (+++) (ESMO MCBS A).
PARP-hämmare är en effektiv behandling hos patienter med metastaserad bröstcancer som har germline BRCA1- eller BRCA2-mutation. I OlympiA undersökte man om PARP-hämmaren olaparib har någon roll som postoperativ behandling hos bröstcancerpatienter med HER2-negativ bröstcancer germline BRCA1- eller BRCA2-mutation. I studien ingick två kohorter: preoperativ kohort med patienter utan pCR efter preoperativ behandling (alla trippelnegativa och högrisk hormonreceptorpositiva patienter, dvs. med CPS + EG score ≥ 3); postoperativ kohort med patienter med stadium II/III trippelnegativ bröstcancer eller HR-positiv, HER2-negativ med ≥ 4 positiva lymfkörtlar. Totalt blev 1 836 patienter randomiserade till olaparib 300 mg x 2 dagligen i ett år eller placebo. Behandlingen initierades efter avslutad strålbehandling (minst 2 veckor och max 12 veckor efter strålbehandling) och kunde ges tillsammans med endokrin behandling för HR-positiv bröstcancer. Postneoadjuvant kapecitabin var inte tillåtet, eftersom det vid initiation av studien inte var standardbehandling.
Vid senaste uppdateringen efter 3,5 års medianuppföljning ledde olaparibbehandling till kliniskt och statistiskt signifikant förbättrad 4 års sjukdomsfri överlevnad med en absolut vinst på 7,3 % (82,7 % vs 75,4 %, HR 0,63, 95 % CI 0,50–0,78), fjärrmetastasfri överlevnad med en absolut vinst på 7,4 % (86,5 % vs 79,1 %, HR 0,61, 95 % CI 0,48–0,77) och total överlevnad med en absolut vinst på 3,4 % (89,8 % vs 86,4 %, HR 0,68, 98,5 % CI 0,47–0,97). Subgruppsanalys visade att alla subgrupper beroende på hormonreceptorstatus, neo- vs adjuvant behandling, platinumbehandling och muterad BRCA-gen hade nytta av olaparibbehandling. Två patienter som hade behandlats med olaparib och tre med placebo diagnostiserades med akut leukemi/myelodysplastiskt syndrom 169.
Resultaten av OlympiA-studien är övertygande avseende vinsten med tillägg av olaparib som (postneo)adjuvant behandling hos patienter med BRCA-mutation. EMA har godkänt postoperativ olaparib som tilläggsbehandling för högriskpatienter med germline BRCA-mutation. TLV har beslutat att olaparib subventioneras som ensam behandling efter operation hos vuxna patienter med nedärvd BRCA1/2-muterad trippelnegativ bröstcancer som fått cytostatikabehandling inför operation och inte uppnått fullständigt behandlingssvar, och där behandling med kapecitabin inte är lämplig samt som ensam behandling för patienter med BRCA1/2-muterad trippelnegativ bröstcancer som fått cytostatikabehandling efter operation.
