Bilaga 1. Kvalitetsbilaga för bröstpatologi (KVAST-bilaga)
2020-05-06 Version 1.
2020-06-01 Version 2.
2021-10-27 Version 3.
2022-02-17 Version 4.
2023-06-18 Version 5.
2024-06-24 Version 6.
2025-06-17 Version 7.
Förord
Detta är en uppdaterad version av KVAST-dokumentet från år 2025 och är en bilaga till nationella vårdprogrammet för bröstcancer. Sedan senaste version år 2024 finns uppdaterad beskrivning av biomarköranalyser, utvärdering av neoadjuvant behandlingssvar, remissens svarsdel och koder samt beteckningar. Därutöver korrektion av stavfel och referenser samt förtydligande för genexpressionsanalyser och bildanalys. Även informationen i svarsdelen för lymfkörtlar efter neoadjuvant behandling har uppdaterats.
Utskärningsanvisningar
Preparat med cancer (invasiv och/eller in situ)
Mastektomi och bröstbevarande kirurgi (partiell mastektomi, ”sektor”)
Preparatets mått i tre dimensioner noteras. Vikt kan anges enligt lokala rutiner. Eventuell hud och suturmarkeringar anges. Utskärning kan ske på färskt eller formalinfixerat preparat. Preparatröntgen bör utföras på alla partiella mastektomipreparat och kan med fördel utföras även på mastektomipreparat med multipla tumörer, mikrokalk eller icke-palpabla förändringar. Preparatet bör färskhanteras. Ange om dorsal fascia är fri och rörlig, bedömningen görs säkrast på färskt preparat.
Om inte resektionskanter är tuschade av kirurgerna, tuschas alla ytor med separata färger efter ett angivet schema. Sidokanterna (circumferent yta) kan benämnas laterala, mediala, kraniala och kaudala, eller orienteras efter klockslag. Övriga ytor benämns ventral och dorsal (alternativ ”hudnära” och ”fascial”).
Det är av central betydelse att den kliniska tumörbeskrivningen (tumörstorlek, antal, lokalisering) och eventuell tumörmarkering, kan korreleras och spåras genom den makroskopiska beskrivningen, och därmed till den mikroskopiska diagnosen.
Val av tumörmarkeringsmetod kan göras lokalt i samråd mellan kirurgi, radiologi, onkologi och patologi. Kolindikering är enkel och billig att utföra. Den vägleder kirurg men har nackdelen att den inte syns radiologiskt och kan vara svår att återfinna histopatologiskt. Metallclips har fördelen att synas radiologiskt och makroskopiskt. Ett annat alternativ är radioaktiva korn.
Vid neoadjuvant behandling ska tumören alltid markeras preoperativt (innan start av neoadjuvant behandling) för att kunna identifiera tumörområdet i operationspreparatet. Detta kan göras med clips inlagda vid biopsitagning, och/eller kolmarkering av tumören i bröstet. Innan omhändertagning av preparatet måste patologen ha exakt information om tumörlokalisation och antal tumörer.
Största möjliga uppmätta tumörstorlek noteras (av 3 dimensioner) och avstånd till dorsal resektionsyta, ventral och sidoresektionsyta antecknas.
När tumör ses makroskopiskt tydlig och välavgränsad kan hela tumörområdet bäddas i standardklossar. Standardklossar har fördelen att vara lättillgängliga för kompletterande immunhistokemisk undersökning. Vid stora, diffust utbredda, eller svåravgränsade tumörer, är storsnitt till god hjälp. Storsnitt täcker stora ytor med bibehållna relationer mellan olika strukturer och resektionsytor. Storsnitt är till hjälp vid oklart tumörfynd efter neoadjuvant behandling, utbredd DCIS eller utbredd diffust växande lobulär cancer.
I princip skall det bäddas tillräckligt med vävnad – inte för lite och inte för mycket. Hur mycket beror på tumören, preparattypen och tumörutbredningen. Bitar skall tas för fastställande av tumörstorlek, tumörutbredning och radikalitet. Vid unifokal tumör räcker ett mindre antal bitar. Vid mikrokalk utan makroskopiskt synlig tumör är det nödvändigt att bädda mer vävnad, ibland hela preparatet. Från preparatet tas bitar till dokumentation av mikroskopisk tumörstorlek. I de flesta fall med invasiv cancer <20 mm kan en bit bäddas i en kassett. Vid större tumörer kan antingen storsnitt användas eller så kan tumörområdet kartläggas genom att delas upp i flera små kassetter med motsvarande kanter märkta för orientering. Vid stora tumörer med största tumörmått vinkelrätt mot snittplanet tas snitt med ungefär 1 cm mellanrum och storleken beräknas med hjälp av skivtjocklek, antal tumörengagerade skivor och jämförs eventuellt med radiologiska mått.
Vid flera invasiva tumörer dokumenteras varje tumör som ovan. Avstånden mellan tumörerna mäts makroskopiskt. Alternativt kan de avbildas i storsnitt.
Ett snitt vinkelrätt mot dorsal resektionsyta närmast tumören tas om inte denna är med i tumörsnittet. Preliminär radikalitetsbedömning kan göras på preparatröntgen och makroskopiskt, men vid definitiv radikalitetsbedömning är de histologiska marginalerna avgörande.
Färsk tumörvävnad till tumörbiobank tillvaratas enligt lokala anvisningar. Tumörvävnad med kontrollerad fixeringstid för biomarkörbestämning kan med fördel tillvaratas färsk och fixeras i separat kassett. Notera tidpunkten då tumörbiten läggs i och tas ur formalinet. Om inte tumörbit tillvaratas färsk skall preparatet skivas enligt beskrivning nedan för att säkerställa god fixering. Vid mikrokalk och multipla tumörer kan skivorna preparatröntgas.
Sentinel node
Försiktig dissektion måste användas för att säkra att körtlarna är hela och att antalet är rätt. Syftet med undersökningen är att hitta alla metastaser >2 mm varför SN makroskopisk skivas i maximalt 2 mm tjocka skivor. .
Fryssnitt av SN görs inte rutinmässigt men vid fryssnitt av färska SN undersöks bitarna med ett eller flera ytliga seriesnitt på samma nivå. Nivåsnittning bör undvikas vid fryssnittning då det finns risk att metastaser snittas bort. Vid makroskopisk metastas i en SN räcker det med fryssnitt från denna SN. Fryssnittning är resurs- och tidskrävande och undersökningens omfattning bör beslutas i överenskommelse med det lokala multidisciplinära teamet.
Immunhistokemi på fryssnitt kan användas efter lokala rutiner. Handläggning av efterföljande formalinfixerat och paraffininbäddat material beror på fynden vid fryssnittningen:
- Vid negativt fryssnitt och vid fynd av metastas ≤2 mm snittas paraffinsnitt i 3 nivåer med 200 µm emellan.
- Vid fryssnittfynd av metastas >2 mm är ett paraffinsnitt tillräckligt.
Immunhistokemisk undersökning med cytokeratin bör utföras på negativa sentinel nodes vid diffus (lobulär) tumörväxt och efter neoadjuvant behandling, i överenskommelse med det lokala multidisciplinära teamet.
TAD
Vid utskärning av TAD preparat måste man verifiera vilken lymfkörtel/lymfkörtlar som innehåller preoperativ inlagt markering. Om markering inte hittas, så måste hela preparatet bäddas.
Axillpreparat
Ange vikt av preparatet. Stora lymfkörtlar delas i längdaxeln och båda halvorna bäddas med en lymfkörtel per kassett. Större lymfkörtlar fördelas i flera kassetter. Lymfkörtlar <4 mm kan bäddas odelade och flera tillsammans i en kassett. Varje paraffinblock undersöks med ett hematoxylin-eosin färgat (HE) snitt. Från stora lymfkörtlar med makroskopiskt synlig metastas kan det räcka med en bäddad bit, men lymfkörteln skall undersökas i sin helhet om metastasen inte bekräftas mikroskopiskt. Vid misstanke på kvarvarande metastas (t ex fibros) efter neoadjuvant behandling bör immunhistokemisk undersökning med pan-cytokeratiner utföras.
Preparat utan påvisad cancer
Riskreducerande/profylaktisk mastektomi: Noggrann makroskopisk undersökning. Om makroskopisk undersökning bedöms normal undersöks 1 vävnadsbit per kvadrant och mamillbas mikroskopiskt eller enligt lokala rutiner. Korrelation med preoperativ bilddiagnostik bör ske vid den patologiska bedömningen.
Reduktionsplastik: Noggrann makroskopisk undersökning. Om inget avvikande ses undersöks 1 vävnadsbit per bröst.
Diagnostiska excisioner: Omhändertas som partiell mastektomi. Representativa snitt tas från förändringen och från resektionskanter.
Mikroskopisk undersökning och bedömning
Bröstcancer typas morfologiskt på HE färgade histopatologiska snitt från bröstcancer i enlighet med internationell referenslitteratur WHO-klassificering 5:e upplagan(1). Immunhistokemisk undersökning används som komplement till den morfologiska undersökningen, exempelvis för att bedöma tumörprimaritet, tumörtyp och invasivitet. Indelning enligt en molekylär subklassifikation baseras på en kombination av biomarköruttryck och NHG grad, denna indelning finns beskrivet i NVP kapitel 10. Patologiska variabler ger information om cancerns stadium, prognos och prediktion till behandlingseffekter. Ett patologisvar ska således innehålla lättöverskådlig, dylik information där varje informationsdel kan kallas för ett dataelement. Dataelement, vilka är anpassade till svenskt språk att användas i patologirapporteringssystem för bröstcancer är under framtagande på nationell nivå i samarbete mellan svensk förening patologi och NAG gruppen för strukturerad vårdinformation och förväntas vara färdigt under 2025. Internationellt finns publicerade dataset, där KVAST gruppen främst vill lyfta fram international collaboration on cancer reporting, ICCR, vilka har dataelement som bygger på konsensus med inlagda evidensnivåer. Dataelementen är framtagna av en grupp internationella experter inom bröstområdet från olika dicipliner, (https://www.iccr-cancer.org/datasets/published-datasets/breast/), i dessa dataset finns även beskrivningar till varje variabel/dataelement. ICCRs dataset har starkt koppling till WHOs klassificering enligt den 5:e upplagan inom brösttumörer (1).
Gradering av in situ cancer och subtypning
Gradering görs främst utifrån kärnstorlek och pleomorfism som sammanfattas i tabellen nedan (2) med tillägg om förekomst av nekros. Nekros definieras som pyknotiska celler i lumen, nekros associeras framförallt med kärngrad 3 och ses inte vid kärngrad 1.
|
|
Grad 1 |
Grad 2 |
Grad 3 |
|
Storlek |
1,5-2 ggr jmf en röd blodkropp eller normalt bröstepitel |
Mellangrad om varken grad 1 eller 3 uppnås |
>2,5 ggr jmf en röd blodkropp eller normalt bröstepitel |
|
Pleomorfism |
Monomorf cellbild |
Mellangrad om varken grad 1 eller 3 uppnås
|
Kraftig pleomorfism |
|
Kromatin |
Diffust och fintfördelat |
Mellangrad om varken grad 1 eller 3 uppnås
|
Vesikulärt med orgelbunden fördelning |
|
Nukleol |
Enstaka |
Mellangrad om varken grad 1 eller 3 uppnås
|
Påtagliga och rikliga |
|
Mitoser |
Enstaka |
Mellangrad om varken grad 1 eller 3 uppnås
|
Rikliga |
|
Orientering |
Polariserade kring lumen |
Mellangrad om varken grad 1 eller 3 uppnås
|
Ingen polarisering |
Gradering av invasiv bröstcancer
Alla typer av primär invasiv bröstcancer som mäter mer än 1 mm bör graderas. Gradering utförs även på preoperativa biopsier för ställningstagande till preoperativ (neoadjuvant) behandling. Graderingen av preoperativa biopsier är preliminär och kan komma att ändras vid bedömning av operationspreparatet. Neoadjuvant behandlad bröstcancer ska även graderas om kvarvarande tumör tillåter detta. Vid sparsam förekomst av cancer bör reservation kring graderingen läggas in som en kommentar.
Morfologisk gradering av tumörgrad ger en kraftfull prognostisk information och utförs i enlighet med Nottingham Histologic Grade (NHG), även kallad Elston-Ellis modifiering av Scarff-Bloom-Richardsons gradering (3) Graderingen görs på HE färgade tumörsnitt och utgörs av tre olika bedömningselement; körtelformationer/tubuli, kärngrad och mitoser. Varje element har tre kategorier, se nedan för mer specifik beskrivning. Reproducerbarheten av låg (NHG1) versus hög (NHG3) tumörgrad är förhållandevis god under förutsättning att graderingen utförs noggrant och i enlighet med de riktlinjer som publicerats (4, 5).
För ytterligare information om gradering var god se note 8 relaterat till Histologisk tumörgradering i ICCRs dataset för invasiv bröstcancer (6).
Gradering kan utföras i mikroskop eller digitalt, där samma kriterier för detektion av tubuli, kärnatypi eller mitos tillämpas, oavsett vilken miljö diagnostiken sker i. Valideringsstudier av digital patologi (med jämförelse av patologers utfall vid digital granskning jämfört med granskning i mikroskop) har visat likvärdiga resultat oberoende av i vilken miljö diagnostiken utförs i (för bröstcancer diagnostik inkluderande gradering visades 96% överenstämmelse mellan utfall från respektive miljö och 99,89% överenstämmelse mellan digital diagnostik och referensvärdet, en så kallad ground truth) (7)
CE-IVD märkta AI baserade bildanalysmodeller för gradering eller stöd för ex mitosräkning finns tillgängliga på marknaden men utvärdering av nyttoläget är ännu ej utfört.
Separata tumörhärdar med olika morfologi graderas separat, detsamma gäller när två morfologiskt helt skilda tumörtyper förekommer inom samma tumör (invasivt blandat carcinom). En god fixering är en förutsättning för korrekt gradering. Dålig fixering omöjliggör säker bedömning av samtliga tre ingående parametrar i NHG: cellkärnorna blir svullna och vakuoliserade (kärnatypin kan ej värderas), gångepitelet lossnar och dissocierar (andelen öppna tubuli kan ej värderas) och mitoserna blir svåra att skilja från pyknotiska cellkärnor, apoptotiska celler samt autolyserat material. Dessutom minskar antalet mitoser med ökad tid till fixering (8). Det är därför viktigt att ha en klar gräns för när man avstår från gradering. Bra kvalitet på rutinfärgning med HE är en förutsättning för diagnostik och histologisk gradering inom bröstpatologi, varför det rekommenderas att avdelningar deltar i externa kvalitetssäkringsprogram.
Körtelgrad
Granska samtliga tumörglas i låg förstoring för att bedöma andelen öppna, tubulära invasiva strukturer med polariserade epitelceller, i procent av hela den invasiva cancerns epitelkomponent. In situ-komponenter skall således exkluderas. Kribriforma invasiva strukturer jämställs med tubulära komponenter. Detsamma gäller invasiva papillära formationer, men dessa är extremt ovanliga.
Poäng tilldelas enligt följande:
|
Poäng |
Andel körtelstrukturer |
|
1 |
> 75% |
|
2 |
10–75% |
|
3 |
< 10% |
Kärngrad
Kärnatypigraden är den svårast reproducerbara parametern i NHG och kräver att man regelbundet kalibrerar sin uppfattning om kärnatypigrad mot bildmaterial. I det aktuella preparatet utgör normalt gångepitel den interna referensen. Kärnatypin består av 4 komponenter (kärnstorlek, storleksvariabilitet, kromatinmönster samt nukleoler) som skall värderas inom hela tumörcellspopulationen och alltid jämföras med det normala gångepitelet. Det skall dock poängteras att det är kärnstorleken som är det primära kriteriet. Var god se Bilaga avseende referensbilder.
Nedan följer ett försök till verbal beskrivning av kärnatypi:
|
Poäng |
Beskrivning av kärnatypi |
|
1 |
Små, regelbundna cellkärnor. Låg intercellulär variabilitet. Regelbundet kromatin, små eller inga synliga nukleoler. Lindrig avvikelse från det normala gångepitelet (<1,5 ggr storleken av cellkärnor i det normala gångepitelet). |
|
2 |
Måttligt förstorade cellkärnor. Måttlig intercellulär variabilitet. Ofta vesikulära cellkärnor med synlig, solitär nukleol. Måttlig avvikelse från det normala gångepitelet (1,5-2 ggr storleken av cellkärnor i det normala gångepitelet). |
|
3 |
Stora oregelbundna kärnor med hög intercellulär variabilitet. Bisarra kärnor kan förekomma. Vesikulära cellkärnor med en eller flera framträdande nukleoler. Uttalad avvikelse från det normala gångepitelet (>2 ggr storleken av cellkärnor i det normala gångepitelet). |
Mitosgrad
Mitosbedömning har många utmaningar i både metodologi och utförande, vilket har gett variationer i reproducerbarhet. Var god se Bilaga avseende referensbilder. Genom att systematiskt använda sig av likartat arbetssätt och framförallt genom att tillämpa kriterier för mitosdetektion kan man öka på den manuella metodens reproducerbarhet, men även lägga grund för tillämpning av digital bildanalys (9).
Identifiera och räkna mitoser inom en yta motsvarande 40x objektiv (s.k. ”high power fields”) inom det mest proliferativa området, så kallad “hot spot”. De mest proliferativa områdena är oftast belägna i cancerns periferi. Vid lobulär cancer är dock mitoserna i regel lika frekventa centralt som perifert.
När gradering sker digitalt ska mitosdetektionen istället relateras till area, det finns idag ingen internationell praxis om vilket areamått som ska tillämpas (9) KVAST gruppen föreslår en tillämpning av 2mm2, vilket enkelt kan harmoniseras till “mitoser per 10 HPF” genom att synfältsdiametern cirka 0,5mm motsvarar 0,2mm2 och därmed ger 10 HPF 2mm2, vilket innebär att upp till 7 mitoser tilldelas 1p, 8-14 mitoser tilldelas 2p och om det finns 15 eller fler mitoser tilldelas 3p. Tillämpning om 2mm2 beskrivs närmare i denna artikel (10). Räkna antalet entydiga mitoser i totalt 10 synfält där summan blir underlag för poängtilldelningen efter att synfältsdiametern fastställts och korrigering av brytpunkterna för mitosräkningen gjorts enligt tabell i ICCRs dataset för invasiv bröstcancer, note 8, Histological tumour grade (6).
Om mitos-summan hamnar nära någon brytpunkt – framför allt när den totala graden kan ändras – kontrollräkna i ytterligare några “hot spots”.
Rapportering av graderingen
De tre parametrarna summeras och resulterar i en malignitetsgrad, som benämns Nottingham Histologic Grade (NHG). I svaret bör en specifik grad anges (NHG1, NHG2 eller NHG3), intervall (t ex NHG1-2) ska undvikas. Varje bedömningsklass kan även anges tillsammans med graden där man kan skriva dem i ordning om tubuli+kärnatypi+mitoser (tex NHG1(2+2+1). I svårbedömda fall, vid mycket små tumörer och vid biopsier kan prefixet ”närmast” anges före graden (t.ex närmast NHG1).
Totalpoäng = körtelpoäng + kärnpoäng + mitospoäng.
|
Totalpoäng |
NHG |
|
3–5 |
1 |
|
6–7 |
2 |
|
8–9 |
3 |
Invasiv lobulär cancer kan anta vilken som helst av de tre malignitetsgraderna, men har oftast grad 2. Invasiv lobulär cancer med kärngrad 3 kallas pleomorf lobulär cancer.
Stadieindelning
Tumörstadieindelning baseras på pTNM-klassificering (11, 12).
Stadieindelande tumörstorlek är en tumörs största mått i mm avrundat till närmaste tröskelvärde i pTNM, var god se nedan).
Om den invasiva tumörutbredningen mäter under eller lika med (≤) 1 mm, kategoriseras tumören som mikroinvasiv och ska rapporteras i enlighet med detta. Obs, begreppet gäller bara operationsmaterial och INTE biopsier.
Vid multipla tumörer gäller måttet för största enskilda tumörhärd. Entydig definition av multifokalitet försvåras av att bröstcancer inte sällan utbreder sig diskontinuerligt i varierande små och/eller stora förband. Begreppet multifokalitet diskuteras i AJCC, 8:e utgåvan, och där föreslås att multipla tumörer föreligger om dessa är makroskopiskt urskiljbara med kliniska och patologiska metoder (12). Däremot om tumörerna är “mycket nära varandra” vilket föreslås kunna motsvara ett avstånd på <5 mm, speciellt om tumörerna är histologiskt lika, så utgör de sannolikt en tumör med komplex form.
I gränsfall föreslås tumörutbredningen beskrivas och bedömningen motiveras i utlåtandet. En viktig konsekvens av uppdelning av tumörer i flera är att måttet på den stadieindelande största härden då minskar.
Metastasers storlek mäts som största storlek av härd med tumörceller i kontakt med varandra. Skilda härdar får inte adderas. Om metastasen har inducerat en desmoplastisk stromareaktion inkluderas det fibrotiska området i metastasmåttet.
Cancerhärdar som ligger fritt i den axillära fettvävnaden utan histologisk påvisbar rest av lymfkörtel klassas som regional lymfkörtelmetastas (≥ N1) när det finns en påvisad invasiv cancer i bröstet.
För att patienten ska kategoriseras som makrometastas-positiv ska åtminstone en lymfkörtel innehålla en tumörhärd som är > 2,0 mm (makrometastas). För att medräknas i körtelstatus måste ytterligare lymfkörtlar innehålla tumörhärdar som är > 0,2 mm (d.v.s åtminstone mikrometastas).
Mikrometastas definieras som en tumörhärd större än 0,2 mm men inte större än 2,0 mm i största mått. En tredimensionell tumörhärd mätande 0,2 mm innehåller i genomsnitt cirka 1 000 tumörceller. Om man påträffar mer än 200 tumörceller i ett enda snitt av en lymfkörtel är därmed sannolikheten stor att hela lymfkörteln innehåller mer än 1 000 tumörceller och därför motsvarar en mikrometastas.
Isolerade tumörceller (ITC) definieras som lymfkörtel innehållande fynd av kontinuerlig tumörhärd mätande mindre än 0,2 mm. Dock kan sådan tumörförekomst uppvärderas som mikrometastas om man i ett enda snitt sammanlagt kan påvisa mer än totalt 200 tumörceller. Tumörcellerna skall räknas i ett enda snitt och fynd i flera snitt skall inte adderas (12).
Lymfkörtlar som endast innehåller tumörhärdar ≤ 0,2 mm (isolerade tumörceller, ITC) räknas inte som positiva lymfkörtlar i N-klassifikationen, men ska registreras som innehållande ITC. Gränsvärdet 200 celler är endast en riktlinje och patologen kan göra en egen bedömning av om en tumörcellansamling mest sannolikt utgör mikrometastas eller isolerade tumörceller.
Bedömning av metastasstorlek görs oberoende av om tumörhärden är lokaliserad inom en lymfkörtel, i anslutning till kapseln eller ligger helt fritt i fettväv.
Intramammara lymfkörtlar ligger i bröstvävnad och kodas som axillära lymfkörtlar när fallet stadieindelas. För detaljerad beskrivning se AJCC, 8:e utgåvan (12).
Axillära lymfkörtelmetastaser
|
ITC: |
≤ 0,2 mm och < 200 celler |
|
Mikrometastas: |
> 0,2 mm eller > 200 celler |
|
Makrometastas: |
> 2,0 mm |
För riktlinjer efter neoadjuvant behandling var god se utvärdering av neoadjuvant behandlingssvar på sidan 21 och även Bilaga avseende storlek och fokalitet efter neoadjuvant behandling.
TNM systemet
pTX Primär tumör kan inte bestämmas
pT0 Inget belägg för primär tumör
pTis Cancer in situ
pTis (DCIS) Duktal cancer in situ
pTis (LCIS) Lobulär cancer in situ
pTis (Paget) Morbus Paget i mamillen utan invasiv eller in situ cancer i bröstet
pT1 ≤ 20 mm
pT1mi ≤ 1 mm
pT1a > 1 mm och ≤ 5 mm
pT1b > 5 mm och ≤ 10 mm
pT1c > 10 mm och ≤ 20 mm
pT2 > 20 mm och ≤ 50 mm
pT3 > 50 mm
pT4 Tumör oberoende av storlek, som växer direkt över på bröstkorgsväggen och/eller på huden (som hudulceration eller hudnoduli). Invasion av enbart dermis räcker ej för T4)
pT4a Överväxt på bröstkorgsväggen (växt i pectoralismuskeln räcker ej)
pT4b Ulceration och/eller ipsilateral hud satellit nodule och/eller hud ödem (inkluderande peau d’orange)
pT4c Både T4a och T4b ovan
T4d Inflammatorisk bröstcancer (klinisk diagnos, som kan korrelera med histopatologiskt fynd av lymfovaskulär invasion).
Biomarköranalyser – grundpanel för alla invasiva tumörer
Sammanfattning
Biomarkörer analyseras på tumörvävnad med kontrollerad och om möjligt dokumenterad fixeringstid på 24–72 timmar. Kall ischemitid (tid från operation till formalin) dokumenteras om möjligt, och bör understiga en timme för att få optimala biomarköranalyser (13). Samtliga biomarkörer kan uppvisa intratumoral heterogenitet, men den är mest påtaglig för Ki67 och PR (4). Detta innebär att ju mindre ytenhet av tumören som analyseras, desto större risk för att det sanna biomarköruttrycket ej uppmärksammas.
Utifrån ovanstående bör därmed primär bröstcancer analyseras avseende östrogen (ER)- och progesteronreceptorer (PR), proliferationsmarkör Ki67 och HER2-status. Analysen görs alltid på preoperativa biopsier och upprepas på operationspreparatet enligt lokala rutiner (14). Eftersom uttrycket av biomarkörer kan ändras i lokal- eller fjärr-recidiv bör alltid biomarkörerna analyseras på nytt (15). I första hand sker biomarköranalys på operations- eller biopsimaterial, i andra hand på cytologiskt material.
Vävnad där analys av kontroller inte utfaller korrekt, trots upprepning, kan inte användas till receptorbestämning. Tekniska orsaker till problem kan vara fixering i alkohol eller andra fixativ än 10% neutral buffrad formalin, fixering <6 timmar eller >72 timmar, kall ischemitid överstigande en timme eller urkalkning i stark syra (exempelvis saltsyra).
Analyserna ska vara kvalitetssäkrade (intern kvalitetssäkring, extern kvalitetssäkring exempelvis NordiQC eller UK NEQAS och populationsnivå genom Equalis). Analysmetod (inkluderande instrument, antikroppar, mm) ska dokumenteras vid laboratoriet, för att kunna utlämnas vid förfrågan. Kontroller, såväl negativa som olika positiva, ska finnas med på glaset. Separat ackreditering av bröstdiagnostiken (Swedac) är att rekommendera.
Om analysmetoden (instrument, protokoll, reagenser) eller preparathantering (fixering, dehydrering, bäddning) ändras, ska validering utföras.
Enligt nationella vårdprogrammet för bröstcancer har subtypsindelningen av bröstcancer ändrats för att efterlikna genexpressionsbaserad (PAM50) subtypsindelning. Denna indelning har stort prognostiskt värde men utesluter på intet sätt vanlig morfologisk klassificering. Det ska också poängteras att denna indelning är ett surrogat för äkta genexpressionsbaserad indelning (15). Indelning sker alltså med hjälp av en kombination av morfologisk klassificering och immunhistokemi. I denna indelning tas hänsyn till ER, PR, Ki67 och NHG där den senare spelar en avgörande roll. För detaljerad beskrivning hänvisas till Nationella vårdprogrammet bröstcancer, kap 10; “kategorisering av tumören” (16).
Östrogen- och progesteronreceptorstatus – immunhistokemisk metod
Målet för östrogenreceptorbestämning (ER) är att förutsäga kliniskt svar på endokrin terapi (17) och målet för progesteronreceptoranalys (PR) är prognostisk (17). Bägge har dock betydelse för subtypsindelning enligt ovan (16).
Om normal bröstvävnad finns med i snittet så fungerar denna som intern kontroll för immunhistokemin. Normala körtelceller uppvisar varierande (ingen till stark) kärninfärgning utmed gångens cirkumferens.
Extern kontroll ska användas i form av extra snitt på glaset av till exempel normal vävnad eller cellinjer (eller vävnad) med varierande receptoruttryck.
Endast invasiva tumörstrukturer avläses och ska vid tveksamhet avseende invasiv eller in situ-komponent i rutinfärgning kompletteras med immunhistokemisk färgning för myoepitel. All invasiv tumör på glaset ska granskas eftersom uttryck kan vara heterogent, i synnerhet avseende PR.
Analys av ER utförs på DCIS-lesioner vid kliniskt önskemål på grovnålbiopsi eller operationsprep (18).
Brunfärgade cellkärnor bedöms som positiva oavsett färgintensitet.
Rapportering
Resultatet anges som helt negativt eller med uppskattad andel positiva tumörceller i den invasiva komponenten i hela snittet (kontinuerligt medelvärde 0–100 %). Detta är också det format som används i nationella kvalitetsregistret för bröstcancer. I samråd med SweBCG och nationella vårdprogramgruppen ska positivitet anges enligt följande:
Positiv ER-status ≥ 10 %
Positiv PR-status ≥ 10 %
Proliferationsmarkör Ki67 – immunhistokemisk metod
Andel Ki67-positiva invasiva tumörceller (Ki67-index) korrelerar till prognos och har ett visst behandlingsprediktivt värde för ER-positiv bröstcancer (19-22). Bedömningen, vilken rapporteras som procentandel positiva tumörceller, utförs på invasiva cancerceller över hela tumörytan. Tidigare KVAST-riktlinjer har förordat räkning inom hot spot. I enlighet med internationella riktlinjer rekommenderar nu KVAST-gruppen att övergå till räkning av andel Ki67-positiva cellkärnor i hela infärgade tumörytan (s.k. weighted global score) (23). Den huvudsakliga anledningen är ett stort behov av att förbättra reproducerbarheten och minska variabiliteten av Ki67.
Räkning kan ske manuellt med ”visual scoring method” enligt publicerade riktlinjer (var god se Bilaga avseende Ki67, samt Bilaga med exempel på Ki67 räkning till KVAST-dokument). Samtliga invasiva cancrar indelas enligt denna metod i fyra olika områden baserat på ytandel respektive nivå av Ki67-uttrycksnivå; områden med negativ, låg, intermediär och hög nivå av Ki67, liksom deras procentuella andel av tumörytan. En nedladdningsbar app (se appendix) är användbar för att på ett enkelt sätt beräkna weighted global score. Bildanalytiska metoder förbättrar Ki67 analysen och en validerad och i första hand CE-godkänd digital bildanalys är att föredra. Ett antal kommersiella system finns tillgängliga.
Exempel på Ki67-positiva celler beskrivs närmare i appendix. Resultatet anges som ett medelvärde av Ki67 (kontinuerligt värde 0–100%). Det formatet kommer att användas i nationella kvalitetsregistret för bröstcancer. I enlighet med nya riktlinjer från ”International Ki67 working group” bör patologer använda två fasta brytpunkter renderande följande tre grupper: Ki67-låg <6%, Ki67-intermediär 6–29% och Ki67-hög >29%. Gruppindelningen baseras utifrån den av International Ki67 in breast cancer working group utförda studien, vilken påvisade bristande tillförlitlighet i Ki67-analysen inom området 6–29% mellan olika bedömare. I området ≤5% och området ≥30% var däremot samstämmigheten mellan olika bedömare närmast total.
HER2 status – analysmetoder
Kontroller och validering
HER2 är en prognostisk och prediktiv biomarkör som identifierar patienter som har nytta av HER2-riktad behandling (24-27). Rutinmässigt analyseras HER2 med immunhistokemi och kompletteras med in situ hybridisering (ISH) vid tvetydiga utfall (HER2 2+). Studier visar att även sekvenseringsbaserad analys (DNA- och RNA-sekvensering) och kvantitativ PCR kan ge tillförlitliga resultat (28-30).
Vid immunhistokemisk färgning används extern kontroll. Här används bröstcancervävnad alternativt cellinjer med varierande uttryck av HER2-protein (0 till 3+). Normal bröstvävnad i snittet fungerar som intern kontroll. I normal bröstvävnad skall ses en svag, inkomplett infärgning i utförsgångar. För ISH utgör normal bröstvävnad eller exempelvis stroma i provet en intern kontroll. Som extern kontroll kan vävnad med olika antal HER2-kopior användas (icke amplifierad, tvetydig, amplifierad).
Om resultatet i kontrollerna inte utfaller som väntat måste analysen göras om. Om cytoplasmatisk färgning döljer membranfärgningen måste testet göras om och/eller ISH utföras.
Avläsning
Immunhistokemiskt uttryck för HER2 ska avläsas i cellmembranet på den invasiva komponenten, gärna tillsammans med tillhörande rutinfärgat glas.
IHC-avläsning
HER2 IHC avläses med 10x objektivet.
All tumörvävnad i snittet granskas och andel tumör med signifikant membraninfärgning (styrka och utbredning), uppskattas enligt nedan.
0: Ingen infärgning
0+: Inkomplett membranfärgning som är svag/knappt synlig i ≤10%.
1+: Inkomplett membranfärgning som är svag/knappt synlig i >10%
2+: Komplett svag/måttlig membranfärgning i >10%. U-format basolateral kraftigt positiv membranfärgning där den luminala delen av membranen är negativ (mindre vanligt, kan ses vid mikropapillär differentiering) (31) och skall betraktas som 2+). Komplett kraftig membranfärgning i ≤10%.
IHC 2+ fall verifieras med ISH
3+: Komplett, kraftig membranfärgning i >10%. Dessa fall kan konfirmeras med ISH om lokala rutiner kräver detta, men är ej nödvändigt enligt senaste internationella guidelines som betraktar dessa fall som HER2-positiva (32).
ISH-avläsning
Analys av ISH sker enligt algoritm som finns beskriven i detalj i internationella guidelines samt enligt tillverkarens rekommendationer (4, 33). Om tumören är heterogen ska signalerna räknas i den del av tumören som har det högsta proteinuttrycket enligt immunhistokemisk infärgning. Som intern kontroll används stromala celler. Om inte majoriteten av dessa uppvisar 1-2 signaler i tumörcellskärnorna av vardera kromosom 17 (CEP17) och HER2 bör man göra om analysen. Analysen bör också göras om när rikligt med cytoplasmatiska eller extracellulära signaler ses. Minst 20 icke överlappande cellkärnor ska räknas inom ett eller max två olika synfält. I de fall där resultatet hamnar nära gränsvärden eller tumören uppvisar stor heterogenitet räknas minst ytterligare ett område om 20 cellkärnor. Både medelantalet HER2-kopior per cellkärna samt kvoten mellan antalet HER2-kopior och CEP17 ska räknas. HER2- eller CEP17-signaler som ligger närmare varandra än sin diameter räknas som enbart en signal (”dubblettsignal”).
Det är de celler som är representativa för cellpopulationen med högst medelantal HER2-signaler som ska räknas. Dessa celler behöver alltså inte ligga intill varandra och celler med bara enstaka signaler bör inte tas med i räkningen om det i samma område finns celler med många signaler. Målet är att identifiera om det föreligger en HER2-amplifierad population som utgör minst 10% av tumören och innebär inte att man ska leta igenom tumörmaterialet för att lokalisera enstaka celler med ökat kopieantal. Vanligen räcker det med ca 2–3 synfält (40x) för att hitta tillräckligt många celler som är både bedömbara och representativa. Om heterogenitet föreligger gäller som för IHC3+ att om den amplifierade klonen utgör ≥10% av hela snittet bedöms tumören som positiv. Vid heterogenitet bör uppskattad %-andel amplifierade tumörceller anges i svaret.
Om resultatet ligger nära gränsvärdet eller om det är svårt att hitta bedömbara celler kan dock flera områden behöva undersökas och dessa fall bör bedömas av ytterligare en patolog eller skickas för extern konsultation.
Rapportering HER2-status
HER2-status talande för amplifiering:
- IHC-färgning 3+
- IHC 2+ med ISH kvot ≥2 och samtidigt kopior ≥4
- IHC 2+ med ISH kvot <2 men HER2 kopior ≥6
HER2-status utan påvisad amplifiering:
Samtliga fall som inte uppfyller kriterier ovan.
I svaret rapporteras IHC-utfall (0, 0+, 1+, 2+, 3+) och om ISH utförts rapporteras även HER2-kvot och antal HER2-kopior per cell. Ange IHC-score och eventuellt ISH-utfall som HER2-amplifierad eller ej (enligt ISH-analys). Det rekommenderas INTE att svara ut HER2-analyser som positiva eller negativa då detta kan leda till språkliga missförstånd. Vi rekommenderar inte heller användandet av termerna Her2-low respektive Her2-ultralow i svaret.
(Till kategorin HER2-low hör de patienter som utfaller med infärgningsscore 1+ immunhistokemiskt eller med score 2+ och icke-amplifierad i in-situ hybridisering. Till kategorin HER2-ultralow sorteras de patienter som utfaller med infärgningsscore 0+ immunhistokemiskt, var god se beskrivningen ovan).
Vävnad där interna kontroller inte utfaller korrekt, trots att testet har upprepats och undersökts med både IHC och ISH, kan inte bedömas och besvaras som ”icke bedömbart resultat”.
Ytterligare studier pågår angående värdet av HER2-riktad behandling mot tumörer med ännu svagare/mindre utbredd immunhistokemisk-färgning. Terminologin kan därför komma att ändras under de närmaste åren – vilket understryker vikten av att inte svara ut tumörer som positiva/negativa.
Övriga analyser
Analys utförs i första hand på biopsi från metastas eller recidiv.
Tumörinfiltrerande lymfocyter (sTIL)
Utvärdering av stromala tumörinfiltrerande lymfocyter (sTIL) har prognostisk betydelse framförallt för bröstcancerpatienter med trippelnegativa tumörer (4, 34)[1, 24] men även HER2-positiv cancer. Hög andel sTILs är kopplat till ett bättre kliniskt utfall och ett bättre svar på neoadjuvant behandling i trippelnegativa bröstcancrar men även i HER2-positiva bröstcancrar. Kvantifiering av sTILs utförs på HE-snitt enligt internationella riktlinjer (35). sTILs utvärderas i stromat av hela tumörområdet med en visuell uppskattning. Resultatet presenteras som en procentuell andel, och avrundas till närmaste hela 10-tal (TILs referensbilder länk och video länk). Analysen utförs manuellt, men mycket snart förväntas digital bildanalys finnas tillgänglig. KVAST rekommenderar att utvärdering av sTILs utförs på samtliga trippelnegativa bröstcancrar innan behandling enligt lokala rutiner och i samråd med kliniker. Det gäller preoperativa biopsier såväl som exciderade tumörer. Framöver kan analysen även komma att utföras vid HER2-positiv cancer.
Utvärdering av neoadjuvant behandlingssvar
Det prognostiska värdet av en tumörregress efter neoadjuvant terapi har bevisats i flera studier (36-38). KVAST-gruppen rekommenderar att bedömningen av tumörrespons efter neoadjuvant behandling görs både enligt AJCC (som komplett respons/partiell respons/ingen respons) och som RCB (RCB 0 – III samt poäng). Dessa två metoder skiljer sig delvis åt och vissa diskrepanser kan därför uppstå vid rapporteringen (var god se Bilaga avseende storlek och fokalitet efter neoadjuvant behandling).
Checklista
Ingen kvarvarande tumör (invasiv och DCIS) - pCR (ypT0 ypN0/cN0)
Kvarvarande DCIS utan invasiv cancer - pCR (ypTis ypN0/cN0)
Kvarvarande invasiv cancer – Ej pCR
Kvarvarande lymfovaskulär invasion - Ej pCR(39)
Kvarvarande ITCs (ypN0(i+)) – Ej pCR
Bedömning enligt AJCC (American Joint Committee on Cancer Staging Manual, Eight Edition, 2017, (12)) baseras på graden av svar på neoadjuvant kemoterapi som patologisk komplett respons (pCR), patologisk partiell respons (pPR) eller ingen respons (pNR). pCR innebär frånvaro av invasivt carcinom i bröstet och lymfkörtlarna (in situ komponent får dock finnas kvar i bröstet). Vid pPR finns det bevis på respons i form av behandlingsrelaterade förändringar (fibros, hyalinisering, lymfohistiocytisk infiltration, hemosiderinladdade makrofager, jättecellbildning och vaskulär proliferation) men även invasiva tumörceller. Vid pNR påvisas opåverkat, viabelt carcinom och behandlingsassocierade förändringar saknas.
Vid bedömning av tumörrespons enligt AJCC(12) kan man välja att lägga till bedömning enligt pTNM med ett tillägg av prefixet y (vilket markerar att det utgör status efter neoadjuvant terapi). För ypT-stadiet mäter man det största kontinuerliga fokuset av kvarvarande invasiv cancer. Terapiinducerad fibros inom eller omkring tumören räknas ej enligt AJCC (till skillnad från vid bedömning enligt RCB-metoden). Om ingen kvarvarande tumör finns benämns detta ypT0. Finns det resttumör anges ypT1-T4 beroende på storlek. För ypN-stadiet mäts det största kontinuerliga tumörfokuset i lymfkörteln. Om det inte finns kvarvarande metastas benämns detta ypN0. Finns resttumör i lymfkörteln anges ypN kategorier beroende på metastasens storlek som vid pN. För mätning av metastasstorlek vg se bild nedan.
Eventuellt kan ypM stadiet anges om det finns vävnad från fjärrmetastaser tillgänglig för histopatologisk undersökning.
Bedömning enligt Residual Cancer Burden (RCB) baseras på största storleken på hela tumörbädden, ytandel av kvarvarande invasiv cancer och/eller DCIS, antal positiva lymfkörtlar och storlek på den största lymfkörtelmetastasen (40, 41). Tumörbädden avser enligt RCB det område i bröstet inom vilket det finns kvarvarande cancer (in situ eller invasiv) och anges med största mått i två dimensioner (För ytterligare detaljer var god se KVAST Bilaga avseende RCB).
Om äkta multifokalitet bedöms föreligga används mått för tumörbädden för det största tumörfocuset vid inmatning enligt RCB.
I lymfkörteln mäter man vid RCB-bedömningen den totala utbredningen av den största metastasen inklusive fibros i en dimension, vg se bild nedan.
Alla fynd av kvarvarande metastas räknas in, oberoende av storlek, vid bedömning av RCB, således inräknas även fynd av ITC som positiv lymfkörtel.
Samtliga ovan angivna variabler matas in i kalkylatorn på MD Anderson Cancer Center hemsida och omvandlas till en av fyra riskgrupper: RCB-0 till RCB-III utifrån RCB-poäng. För mer detaljerad beskrivning av analysen och inrapportering i analysverktyget hänvisas till hemsidan vid MD Anderson Cancer Center (42).
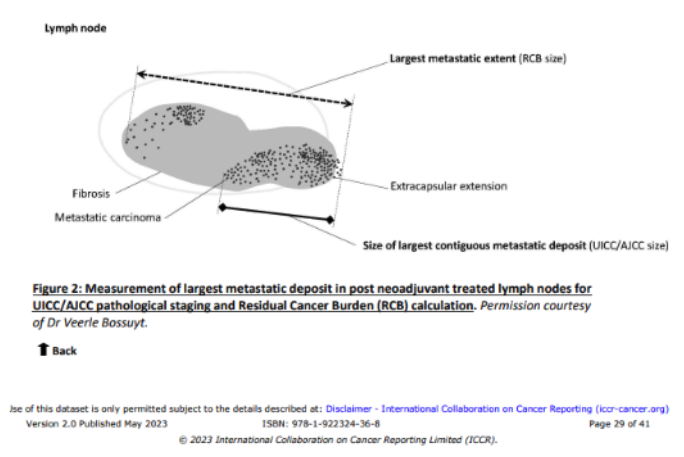
Mätning av kvarvarande tumör i lymfkörtel enligt AJCC versus RCB.
Förekomst av (lymf)kärlinväxt efter neoadjuvant behandling är en oberoende prediktor för överlevnad och bör anges i utlåtandet (43).
När det endast ses intravaskulär eller intralymfatisk tumör utan någon kvarvarande invasiv cancer anger man ypT0 enligt AJCC, men detta betraktas enligt AJCC inte som patologisk komplett respons. Det finns inga tydliga direktiv om (lymf)kärlinväxt bör ingå i bedömning enligt RCB eller ej.
Lymfkörtelmetastaser skall rapporteras på likartat vis oberoende om tumören har neoadjuvant behandlats eller ej, det vill säga enligt kriterierna för makrometastas, mikrometastas respektive ITC.
Notera att enligt AJCC betraktas förekomst av ITC efter neoadjuvant behandling inte som en patologisk komplett respons, och att lymfkörtlar med ITC ingår i RCB-algoritmen (vilket även beskrivits ovan).
Biomarkörbestämning rekommenderas upprepas på eventuell kvarvarande tumör i bröstet.
PD-L1-analys
Immunhistokemisk färgning och analys av PD-L1 rekommenderas i vissa fall för ställningstagande till behandling med anti-PD-L1, s.k. checkpoint-hämmare vid trippelnegativ bröstcancer (44). Det är viktigt att poängtera att olika checkpoint-hämmare har egna, specifika validerade analyspaneler vilka inkluderar antikropp, reagens, plattform och avläsningsalgoritm. Beställning, utförande och besvarande av analyser måste därför vara tydligt inriktade och beskrivna för varje frågeställning. I nuläget finns två godkända analysmetoder för bröstcancer: PD-L1 SP-142 assay vilken är behandlingsprediktiv för atezolizumab samt 22C3 assay vilken är behandlingsprediktiv för pembrolizumab. För bedömning krävs utbildning. Se detaljerad beskrivning av respektive analys på tillverkarens hemsida. Analysen utförs på begäran från kliniker.
Prognostiska analyser: Genexpressionsprofiler och AI-baserad bildanalys
Genexpressionsprofilering (GEP) utförs på excisionspreparatet av ER+ HER2- postmenopausal bröstcancer där det föreligger svårigheter att bedöma patientens risk för recidiv med rutinmetoder (huvudsakligen kategorin NHG2 och Ki67-intermediär) (45). Det finns ett flertal kommersiella metoder som ger prognostisk, och i vissa fall behandlingsprediktiv information (46-49). I enlighet med Vårdprogrammets rekommendationer bör Prosigna eller OncotypeDx användas som GEP för klinisk rutindiagnostik. Vid Prosigna-analys ska mikrometastaser räknas som N1 för att inte underskatta patientens risk vid bedömningen. GEP utförs efter beställning från kliniker eller enligt lokala rutiner.
Det nationella kvalitetsregistret för bröstcancer, NKBC visar en viss variabilitet i biomarkörer och gradering inom och mellan olika patologkliniker (50).
Biomarkörer (ER, HER2, Ki67) och NHG-grad är behandlingsstyrande och därför är det viktigt att minimera variabilitet och öka precision (51). Bildanalytiska system för biomarköranalys, cancerdetektion och gradering har potential att minska variabiliteten och öka den diagnostiska träffsäkerheten (52, 53). Med AI-baserad bildanalys finns också möjlighet att utföra riskprofilering direkt på mikroskopibilder som ett kostnadseffektivt och snabbt alternativ till genexpressionsanalys (54). I nuläget finns flera regulatoriskt godkända AI-baserad bildanalyser tillgänliga på marknaden. Bildanalys kan ingå som en del i det digitala arbetsflödet för bröstdiagnostik, men systemen för dessa bildanalyser klassas som medicinteknisk produkt varför de ska vara CE-IVD märkta, eller ha motsvarande dokumentation. Svenska läkemedelsverket har publicerat en vägledning för tillämpning av AI baserade analyser och NAG digital patologi har även berört detta i sin vägledning. Införande av bildanalytiska system och genexpressionsanalyser bör ske i samråd med behandlande kliniker.
En metodologisk svårighet är faktumet att över 50% av samtliga invasiva tumörer hamnar inom intermediärgruppen NHG2, vilken i sig inte utgör en tumörbiologisk entitet, samtidigt som gruppen saknar kliniskt värde (50, 55, 56). NHG2-tumörer kan, med hjälp av genexpressionsanalys eller AI-baserad bildanalys, delas in i antingen en hög- eller lågriskgrupp avseende på risk för recidiv (54, 57). För att förbättra riskstratifieringen ytterligare bör genexpressionsanalys användas i samråd med behandlande kliniker, se NVP bröstcancer kapitel 10 och 15.
Genomisk profilering – DNA-analys
Genomisk profilering av tumören med DNA-sekvensering utförs rutinmässigt för t.ex. lungcancer (58) men det finns ett ökande behov av sekvensering även av bröstcancer. Mutationer i HER2, BRCA, ESR1, PIK3CA och eventuellt NTRK har ett prognostiskt och/eller behandlingsprediktivt värde (59-61) vid avancerad sjukdom. Genomisk profilering kommer bli ett viktigt komplement till morfologisk diagnostik och kan identifiera behandlingsgrundande DNA-förändringar (62). Dessa förändringar kan inte hittas med klassiska histopatologiska tekniker såsom immunhistokemi eller in situ-hybridisering. På flertalet svenska molekylärpatologiska enheter finns idag möjlighet att analysera mindre genpaneler. Genomic Medicine Sweden är en landsomfattande infrastruktursatsning som syftar till att integrera breda och validerade genpaneler i rutinsjukvården framöver (63). Men redan idag finns kommersiella CE-godkända metoder tillgängliga för bred genomisk profilering (64). Den generella rekommendationen är att analys bör ske av biopsimaterial från cancerrecidiv eller fjärrmetastas. Genomisk profilering kan även utföras genom så kallad liquid biopsy direkt från ett blodprov (65) som del i forskningsprojekt. Samtliga metoder ska utföras i samråd med behandlande kliniker.
Information i remissens svarsdel
Standardsvar bör användas. Standardiserade patologisvar är viktiga för att standardisera och kategorisera fynd såväl vid preoperativ som postoperativa undersökningar av bröstvävnad. Standardiserade nationella synoptiska svarsmallar som kan integreras i det lokala systemet (LISet eller IMS) där informationen regelbundet uppdateras av KVAST-gruppen är under upparbetning i samverkan med NAG SVI. Nedanstående rekommenderade svarsmallar överensstämmer i innehåll och benämningar med dessa synoptiska mallar som är under framtagande.
Parametrar markerade med asterisk (*) är variabler som rapporteras in till det nationella kvalitetsregistret för bröstcancer (NKBC). För patienter som opereras är det endast resultatet från operationspreparat som rapporteras, för dem som inte opereras är det biopsin. Det nationella kvalitetsregistret för mammografiscreening (NKM) omfattar målpopulationen för mammografiscreening och innehåller bröstradiologiska data för hela processen: inbjudan, deltagande, datum, ledtider, screeningresultat och diagnostisk utredning. Data överförs automatiskt till NKBC exempelvis undersökningskoder, vilket omfattar koderna till biopiser och cytologier. NKM och NKBC samkör data och med bakgrund av dessa kvalitetsregister och internationella riktlinjer har KVAST bröstgruppen beslutat att definiera undersökningskoder även i detta dokument (66-68). Undersökningskoder förvaltas av Nationella arbetsgruppen för mammografi, NAM och fyndkoder rekommenderas av vårdprogramsgruppen. Beslut att ansluta sig till kvalitetsregistert tas på regional nivå och för närvarande finns ingen nationell täckning av NKM. Parametrar markerade med fet stil bör ingå i svaret.
Parametrar med normal stil kan ingå i svaret.
Preoperativa prover
Cytologimaterial
Förutom uppgift om material och en beskrivande diagnos kan dessa fyndkoder anges i svar och registreras som kod.
C1: Otillräcklig bröstcytologi
C2: Benign bröstcytologi
C3: Oklart atypisk bröstcytologi
C4: Malignitetsmisstänkt bröstcytologi
C5: Malign bröstcytologi
I fyndkoden C1 kan otillräckligt material även ingå
Biopsier (mellannål, grovnål eller VAB)
Förutom uppgift om material och en beskrivande diagnos kan ett dessa fyndkoder anges i svar och registreras som kod..
B1: Normal bröstvävnad
B2: Benign bröstvävnad
B3: Oklart atypisk bröstvävnad . Lesion med oklar malignitetspotential (inkluderar ADH, FEA, ALH, klassisk LCIS, phyllodestumör (ej malign enl riktlinjerna), papillom utan atypi, papillom med ADH, stråligt ärr, MLL och ytterligare några ovanliga lesioner).
B4: Malignitetsmisstänkt bröstvävnad
B5: Malign bröstvävnad
B5a: in situ (DCIS, pLCIS och fLCIS) inklusive papillom med otvetydig in situ-proliferation.
B5b: invasiv bröstcancer, malign phyllodes, metastaser, lymfom, sarkom
B5c: bröstcancer där det inte går att avgöra om det är in situ eller invasiv
I fyndkoden B1 kan otillräckligt material även ingå.
För biopsier med CIS bör/kan följande parametrar ingå i svaret:
Typ av in situ*: a
Kärngrad*: b
ER (%):
Mikroinvasion: Ja/Nej
Nekros: Ja/Nej c
a DCIS / klassisk LCIS / pleomorf LCIS / florid LCIS/ solid papillär cancer in situ/ inkapslad papillär cancer.
Vad gäller inkapslad papillär cancer ska den i nuläget enligt WHO klassas som ”in situ” förutsatt att ingen av följande riskfaktorer föreligger: uttalad kärnpleomorfism (motsvarande kärngrad 3), hög mitosfrekvens, trippelnegativ eller HER2-amplifierad fenotyp. I dessa fall ska den graderas och stadieindelas som en invasiv cancer.
b anges för DCIS, solid papillär cancer in situ och inkapslad papillär cancer utan riskfaktorer enligt fotnot a.
c För nekros krävs flera pyknotiska kärnor i samma gång. Enbart granulärt, stagnerat sekret är inte nekros.
För biopsier med invasiv bröstcancer bör/kan följande parametrar ingå i svaret:
Typ av cancer*:
Histologisk grad enligt Nottingham*:
Östrogenreceptor* (%):
Progesteronreceptor* (%):
HER2 immunhistokemi *. Anges med 0, 0+, 1+, 2+, eller 3+
ISH HER2*a:
Ki67-index* (%) b:
Genexpressionsanalys*: (Utförd ja/nej, riskgrupp om utförd)
Bildanalys:
sTILs (%)c:
a Ingår om analysen bedöms relevant efter genomförd HER2 immunhistokemi. Ange antal HER2-kopior, antal CEP17-kopior och kvot samt om resultatet är amplifierat/icke-amplifierat
b Anges som global score, medelvärde Ki67. I svaret anges även cut-off värden och grupp. Se ”Bilaga avseende Ki67” samt ”Bilaga med exempel på Ki67-räkning” på Svensk Förenings för Patologi hemsida.
c Stromala tumörinfiltrerande lymfocyter. Vid trippelnegativ cancer eller inremitterandes begäran. För detaljerade instruktioner se kapitlet ”Biomarköranalyser – tilläggsanalyser” och hemsidan för International Immuno-Oncology Biomarker Group on Breast Cancer.
Operationspreparat
Sentinel node / axillarutrymning (utan neoadjuvant behandling)
Makroskopisk beskrivning
Typ av preparat samt sida.
Antal lymfkörtlar dokumenteras. Största mått på varje lymfkörtel kan anges vid behov.
Mikroskopisk beskrivning
Totalt antal lymfkörtlar* a:
Antal lymfkörtlar med metastas (≥0,2 mm eller fler än 200 tumörceller)*:
Varav körtlar med
Mikrometastas b:
Makrometastas c:
Antal lymfkörtlar med isolerade tumörceller (ITC)d:
Största metastasstorlek e:
Extranodal växt:
Övrigt:
a Fria tumörhärdar i fett likställs med lymfkörtlar med metastas för TNM.
b Mikrometastas = metastas ≥0,2 mm eller fler än 200 tumörceller, men inte större än 2,0 mm
c Makrometastas = metastas ≥2,0 mm
d Förekomst av ITC påverkar ej pN-stadium. Eventuellt användande av immunhistokemi för att identifiera ITC i lymfkörtlar som är negativa i rutinfärgning kan göras enligt lokala rutiner.
e Metastasers storlek mäts som största storlek av härd med tumörceller i kontakt med varandra. Skilda härdar får inte adderas – men om metastasen har inducerat desmoplastisk stromareaktion så inkluderas det fibrotiska området i metastasmåttet
Sentinel node / TAD / axillarutrymning (efter neoadjuvant behandling)
Makroskopisk beskrivning
Typ av preparat samt sida.
Antal lymfkörtlar dokumenteras. Största mått på varje lymfkörtel kan anges vid behov.
Mikroskopisk beskrivning
Totalt antal lymfkörtlar* a:
Antal lymfkörtlar med metastas (≥0,2 mm eller fler än 200 tumörceller)*:
Varav körtlar med
Mikrometastas b:
Makrometastas c:
Antal lymfkörtlar med isolerade tumörceller (ITC)d:
Största metastasstorlek (TNM) e:
Största metastasstorlek (RCB) e:
Extranodal växt:
Tecken till tumörregress: (ja/nej)
Övrigt:
a Fria tumörhärdar i fett likställs med lymfkörtlar med metastas för TNM.
b Mikrometastas = metastas ≥0,2 mm eller fler än 200 tumörceller, men inte större än 2,0 mm
c Makrometastas = metastas ≥2,0 mm
d Förekomst av ITC påverkar ej pN-stadium. Eventuellt användande av immunhistokemi för att identifiera ITC i lymfkörtlar som är negativa i rutinfärgning kan göras enligt lokala rutiner. ITC påverkar RCB-beräkningen, där de räknas som lymfkörtel med metastas.
e Metastasstorleken för TNM-stadieindelning beräknas på likartat sätt för neodajuvant och icke neoadjuvant behandlade patienter, dvs tumörceller i kontinuerligt förband. För metastasstorlek till RCB-kalkyl räknas dock hela metastasområdet med (spridda) cancerceller och mellanliggande fibros. Detta sätt att räkna är alltså likartat hur beräkningen av tumörbäddens storlek i bröstet görs vid RCB-gradering. Se Bilaga avseende storlek och fokalitet efter neoadjuvant behandling för illustration av de båda mätmetoderna.
Operationspreparat med enbart in situ-cancer
Makroskopisk beskrivning
Ska innehålla uppgifter om orientering (suturer, clips, preparatröntgen, tuschning) så att radiologisk-histologisk korrelation är möjlig. Makrofoto bör användas.
Typ av preparata:
Mått:
Vikt:
Sida:
Tumörlokalisation:
Bitförteckning/fraktionering:
Mikroskopisk beskrivning
Histologisk typb:
Sammanlagd utbredning*c (mm):
Kärngrad*d:
Nekrose:
Östrogenreceptor (%):
Förekomst av mikroinvasion: (ja/nej)
Minsta avstånd från in situ-cancer till sidoresektionsyta (mm)f:
Radikal operation (Ja / Nej)g:
Övriga kommentarer:
a Lokal excision / sektor / enkel mastektomi / modifierad radikal mastektomi / utvidgad excision efter tidigare ingrepp / reduktionskirurgiskt preparat
b DCIS / klassisk LCIS / pleomorf LCIS / florid LCIS/ solid papillär cancer in situ / inkapslad papillär cancer. Vad gäller inkapslad papillär cancer ska den i nuläget enligt WHO klassas som ”in situ” förutsatt att ingen av följande riskfaktorer föreligger: uttalad kärnpleomorfism (motsvarande kärngrad 3), hög mitosfrekvens, trippelnegativ eller HER2-amplifierad fenotyp. I dessa fall ska den graderas och stadieindelas som en invasiv cancer.
c det största måttet i tre dimensioner
d anges för DCIS, solid papillär cancer in situ och inkapslad papillär cancer utan riskfaktorer enligt fotnot b.
e För nekros krävs flera pyknotiska kärnor i samma gång. Enbart granulärt, stagnerat sekret är inte nekros.
f marginaler anges inte för klassisk LCIS. Om preparatet enbart innehåller klassisk LCIS lämnas denna rad tom och marginalen kan kommenteras under ”Övriga kommentarer”
g enligt gällande vårdprogram 2024 krävs ≥2 mm marginal för att betrakta operationen som radikal i fall med enbart CIS och man kan överväga att avstå strålbehandling i vissa fall (grad 1-2, ingen nekros etc), med marginal ≥ 3 mm.
Operationspreparat med invasiv cancer utan neoadjuvant behandling
Makroskopisk beskrivning
Ska innehålla uppgifter om orientering (suturer, clips, preparatröntgen, tuschning) så att radiologisk-histologisk korrelation är möjlig. Makrofoto bör användas.
Typ av preparata:
Mått:
Vikt:
Sida:
Tumörlokalisationb:
Bitförteckning/fraktionering:
Mikroskopisk beskrivning
Morfologisk subtyp (enligt WHO)*:
Multifokal invasiv tumör c: (ja/nej)
Antal invasiva tumörer*:
Storlek på största invasiva tumören (mm)d*:
Sammanlagd cancerutbredning (mm)e*:
Histologisk grad (NHG)*:
Tubuli:
Kärnpleomorfism:
Mitoser:
Summa:
Östrogenreceptor (%)*:
Progesteronreceptor (%)*:
HER2-immunhistokemi*. Anges med 0, 0+, 1+, 2+, eller 3+
HER2 ISH*f:
Ki67-index* (%) g:
Genexpressionsanalys*: (Utförd ja/nej, riskgrupp om utförd)
sTILs (%)h:
Kärlinväxt:
In situ komponent
Histologisk typk:
Kärngradl:
Nekrosm:
Minsta avstånd från invasiv tumör till resektionsyta (mm):
Minsta avstånd från in situ-cancer till sidoresektionsyta (mm)n:
Radikal operation (ja/nej):
Övriga kommentarer:
a Lokal excision / sektor / enkel mastektomi / modifierad radikal mastektomi / utvidgad excision efter tidigare ingrepp / reduktionskirurgiskt preparat
b Vid mastektomi kan klockslag med klockslag 1–12, och avstånd till mamill anges. Retromamillärt anges med kl. 0. Vid sektor/lokal excision är relation till mamill ofta inte bevarad och lokalisation kan istället anges utifrån radiologens benämning av tumören/tumörerna.
c Anges med ja, nej eller diffus växt. Med diffus växt avses finfördelad eller diskontinuerlig tumörväxt utan välavgränsad tumörkropp.
d endast ett mått, det största av tre dimensioner behöver anges.
e endast ett mått, det största av tre dimensioner behöver anges. Innefattar området som engageras av invasiv tumör och in situ. OBS in situ omfattar här inte klassisk LCIS.
f Ska ingå om analysen bedöms relevant efter genomförd HER2 immunhistokemi. Ange antal HER2-kopior, antal CEP17-kopior och kvot samt om resultatet är amplifierat/icke-amplifierat.
g Anges som global score, medelvärde Ki67. I svaret anges även cut-off värden och grupp. Se ”Bilaga avseende Ki67” samt ”Bilaga med exempel på Ki67-räkning” på Svensk Förenings för Patologi hemsida.
h Stromala tumörinfiltrerande lymfocyter. Vid trippelnegativ cancer. För detaljerade instruktioner se kapitlet ”Biomarköranalyser – tilläggsanalyser” och hemsidan för International Immuno-Oncology Biomarker Group on Breast Cancer.
k DCIS / klassisk LCIS / pleomorf LCIS / florid LCIS/ solid papillär cancer in situ/ inkapslad papillär cancer. Vad gäller inkapslad papillär cancer ska den i nuläget enligt WHO klassas som ”in situ” förutsatt att ingen av följande riskfaktorer föreligger: uttalad kärnpleomorfism (motsvarande kärngrad 3), hög mitosfrekvens, trippelnegativ eller HER2-amplifierad fenotyp. I dessa fall ska den graderas och stadieindelas som en invasiv cancer.
l anges för DCIS, solid papillär cancer in situ och inkapslad papillär cancer utan riskfaktorer enligt fotnot k.
m För nekros krävs flera pyknotiska kärnor i samma gång. Enbart granulärt, stagnerat sekret är inte nekros.
n Kan anges i de fall där detta påverkar radikalitetsbedömningen som helhet (i vårdprogrammet 2024 finns tre relevanta brytpunkter: mindre än 3 mm, mindre än 2 mm och 0 mm.) Marginaler anges inte för klassisk LCIS.
Operationspreparat med invasiv cancer efter neoadjuvant behandling
Makroskopisk beskrivning
Ska innehålla uppgifter om orientering (suturer, clips, preparatröntgen, tuschning) så att radiologisk-histologisk korrelation är möjlig. Makrofoto bör användas.
Typ av preparata:
Mått:
Vikt:
Sida:
Tumörlokalisationb:
Bitförteckning/fraktionering:
Mikroskopisk beskrivning
Morfologisk subtyp (enligt WHO):
Multifokal invasiv tumör c:
Antal invasiva tumörer*:
Storlek på största invasiva tumören (mm x mm)d*:
Sammanlagd cancerutbredning (mm)e*:
Histologisk grad (NHG)*:
Tubuli:
Kärnpleomorfism:
Mitoser:
Summa:
Östrogenreceptor (%)*:
Progesteronreceptor (%)*:
HER2-protein*. Anges med 0, 0+, 1+, 2+, eller 3+
ISH HER2*f:
Ki67-index* (%) g:
Genexpressionsanalys*: (Utförd ja/nej, riskgrupp om utförd)
Kärlinväxt:
sTILS:
In situ komponent
Histologisk typh:
Kärngradk:
Nekrosl:
Minsta avstånd från invasiv tumör till resektionsyta (mm):
Minsta avstånd från in situ-cancer till sidoresektionsyta (mm)m:
Radikal operation (ja/nej):
Residual Cancer Burden (RCB) scoren:
RCB klass*:
a Lokal excision / sektor / enkel mastektomi / modifierad radikal mastektomi / utvidgad excision efter tidigare ingrepp
b Vid mastektomi kan klockslag med klockslag 1–12, och avstånd till mamill anges. Retromamillärt anges med kl. 0. Vid partiell mastektomi är relation till mamill ofta inte bevarad och lokalisation kan istället anges utifrån radiologens benämning av tumören/tumörerna.
c Anges med ja, nej eller diffus växt. Med diffus växt avses finfördelad eller diskontinuerlig tumörväxt utan välavgränsad tumörkropp. Efter neoadjuvant behandling ses ofta fläckvisa kvarvarande tumörhärdar inom det tidigare tumörområdet. Detta innebär inte att tumören är multifokal; det är en unifokal tumör med varierande grader av regression. Korrelation bör ske med makroskopi och radiologiska undersökningar innan behandlingsstart innan tumören anges som multifokal.
d endast ett mått, det största av tre dimensioner behöver anges.
e motsvarar sk ”Residual tumour bed”. Två mått, de största av tre dimensioner behöver anges. Innefattar området som engageras av invasiv tumör och in situ. OBS in situ omfattar inte klassisk LCIS.
f Ska ingå om analysen bedöms relevant efter genomförd HER2 immunhistokemi. Ange antal HER2-kopior, antal CEP17-kopior och kvot samt om resultatet är amplifierat/icke-amplifierat.
g Anges som global score, medelvärde Ki67. I svaret anges även cut-off värden och grupp. Se ”Bilaga avseende Ki67” samt ”Bilaga med exempel på Ki67-räkning” på Svensk Förenings för Patologi hemsida.
h DCIS / klassisk LCIS / pleomorf LCIS / florid LCIS/ solid papillär cancer in situ. Vad gäller inkapslad papillär cancer ska den i nuläget enligt WHO klassas som ”in situ” förutsatt att ingen av följande riskfaktorer föreligger: uttalad kärnpleomorfism (motsvarande kärngrad 3), hög mitosfrekvens, trippelnegativ eller HER2-amplifierad fenotyp. I dessa fall ska den graderas och stadieindelas som en invasiv cancer.
k anges för DCIS, solid papillär cancer in situ och inkapslad papillär cancer utan riskfaktorer enligt fotnot h.
l För nekros krävs flera pyknotiska kärnor i samma gång. Enbart granulärt, stagnerat sekret är inte nekros.
m Kan anges om i de fall där detta påverkar radikalitetsbedömningen som helhet. (i vårdprogrammet 2024 finns tre relevanta brytpunkter: mindre än 3 mm, mindre än 2 mm och 0 mm.) Marginaler anges inte för klassisk LCIS
n Beräknas på https://www3.mdanderson.org/app/medcalc/index.cfm?pagename=jsconvert3 med hjälp av parametrarna ”Sammanlagd cancerutbredning” (förvirrande nog benämnt ”primary tumour bed area” i räkneverktyget), sammanlagd tumörcellshalt inom detta utbredningsområde, och andel av dessa tumörceller som är in situ. I beräkningen ingår även antal positiva lymfkörtlar (såväl körtlar med ITC som mikro- eller makrometastas) samt storleken på den största metastasen. För metastasstorlek till RCB-kalkyl räknas hela metastasområdet med (spridda) cancerceller och mellanliggande fibros (Se Bilaga avseende RCB). Detta sätt att räkna är alltså likartat hur beräkningen av tumörbäddens storlek i bröstet görs vid RCB-gradering men skiljer sig i vissa fall från hur metastasstorleken räknas för TNM-indelning. Se Bilaga avseende storlek och fokalitet efter neoadjuvant behandling för illustration.
Koder och beteckningar
SNOMED-kodning
För närvarande (2024) används SNOMED-II för kodning av topografi och diagnos. SNOMED-II underhålls inte längre vilket innebär att nya entiteter som förut inte har funnits behov av att särskilja (exempelvis FEA) inte kan få egna koder. Därför är övergång till SNOMED-CT en nödvändighet inom en snar framtid. Ett samordnat införande, där respektive region i sitt LIS använder sig av det konfigurationsunderlag för synoptiska svarsmallar som KVAST-gruppen tagit fram, krävs för att koderna ska vara enhetliga och möjliggöra t ex direkt överföring till cancerregistren.
Nedan ses de SNOMED-II koder som rekommenderas fram till dess att SNOMED-CT är i bruk.
Topografikoderna används med tillägget 1 = höger, 2 = vänster, 4=bilateralt, 9 = sida okänd.
T04000 Bröst UNS
T04010 Kvinnligt bröst
T04040 Manligt bröst
Alternativt kan man använda (och isåfall behöver inget tillägg av kod för sida göras):
T04020 Kvinnligt bröst, höger
T04030 Kvinnligt bröst, vänster
T04050 Manligt bröst, höger
T04060 Manligt bröst, vänster
T04800 Bröst hö + vä
T04100 Mamill
Epiteliala tumörer
|
Diagnos |
SNOMED II |
SNOMED CT |
|
Invasiv duktal cancer (NST) |
85003 |
82711006 |
|
Invasiv lobulär cancer |
85203 |
89740008 |
|
Invasiv tubulär cancer |
82113 |
4631006 |
|
Invasiv kribriform cancer |
82013 |
30156004 |
|
Invasiv mucinös cancer |
84803 |
72495009 |
|
Invasivt mucinöst cystadenocarcinom |
84703 |
79143006 |
|
Invasiv cancer med apokrin differentiering |
84013 |
57141000 |
|
Invasiv mikropapillär cancer |
85073 |
703578005 |
|
Invasiv metaplastisk cancer |
85753 |
128705006 |
|
Invasiv sekretorisk cancer |
85023 |
41919003 |
|
Invasiv acinärcellscancer |
85503 |
45410002 |
|
Invasiv mucoepidermoid cancer |
84303 |
4079000 |
|
Invasiv polymorf cancer |
85253 |
128702009 |
|
Invasiv adenoidcystisk cancer |
82003 |
11671000 |
|
Inkapslad papillär cancer (grad 3 eller riskfaktorer, se svarsmall)a |
85043 |
703547006 |
|
Invasiv solid papillär cancera |
85093* |
703594003 |
|
Kolumnärcellscarcinom med reverserad polaritet |
85093* |
Utveckling av nytt begrepp i Snomed CT pågår |
|
Duktululobulär cancer |
85003+85203 |
444057000 |
|
Invasiv bröstcancer (UNS) |
81403 |
1187332001 |
* Samma kod för flera tumörer pga att systemet inte underhålls.
a Observera att om det rör sig om EPC eller SPC med övergång i invasiv duktal/mucinös/etc cancer så kodas detta istället med 85042/85092 med tillägg av kod för den invasiva tumörtypen.
Epiteliala-myoepiteliala tumörer
|
Diagnos |
SNOMED II |
SNOMED CT |
|
Pleomorft adenom |
89400 |
8360001 |
|
Adenomyoepiteliom |
89830 |
128765009 |
|
Malignt adenomyoepiteliom |
89833 |
703644009 |
|
Epitelial-myoepitelial cancer |
85623 |
9618003 |
In situ
|
Diagnos |
SNOMED II |
SNOMED CT |
|
Duktal cancer in situ |
85002 |
1162814007 |
|
Lobulär cancer in situ |
85202 a |
444739008 |
|
Florid lobulär cancer in situ |
85202 a |
1290750006 |
|
Pleomorf lobulär cancer in istu |
85202 a |
444591006 |
|
Inkapslad papillär cancer (grad 1-2) |
85042 |
703545003 |
|
Solid papillär cancer in situ |
85092 |
703546002 |
|
Mb Paget |
85403 |
2985005 |
|
Mb Paget med underliggande DCIS |
85433 |
Utveckling pågår |
|
Mb Paget med underliggande duktal cancer |
85413 |
Utveckling pågår |
a Koder saknas för att kunna särskilja de klassiska, florida och pleomorfa formerna av LCIS i SNOMED-II.
Fibroepitaliala tumörer
|
Diagnos |
SNOMED II |
SNOMED CT |
|
Fibroadenom |
90100 |
1156873009 |
|
Phyllodestumör, benign |
90200 |
16566002 |
|
Phyllodestumör, malign |
90203 |
87913009 |
|
Phyllodestumör, borderline |
90201 |
71232009 |
|
Hamartom |
75500 |
51398009 |
Benigna epiteliala proliferationer
|
Diagnos |
SNOMED II |
SNOMED CT |
|
Intraduktalt papillom |
85030 |
5244003 |
|
Komplex skleroserande lesion (stråligt ärr) |
74220 |
133855003 |
|
Intraduktal epitelial hyperplasi (UDH) |
76080 |
472906008 |
|
Kolumnärcellshyperplasi / kolumnärcellsmetaplasi |
73000 (eg. metaplasi UNS) |
Utveckling av nytt begrepp i Snomed CT pågår |
|
Intraduktal epitelial hyperplasi med atypi (ADH) |
76085 |
6660000 |
|
Flack epitelatypi |
69720 (eg. körtelcellsatypi) |
55465005 |
|
Fibroadenos / Adenos (skleroserande / apokrin / mikroglandulär) |
74200 |
367647000 |
|
Adenom (tubulärt/lakterande/apokrint/duktalt) |
81400 |
Delas upp |
Övriga maligna tumörer
|
Diagnos |
SNOMED II |
SNOMED CT |
|
Neuroendokrin tumör (NET) |
82403 |
1286769009 1286770005 1286772002 |
|
Diffust storcelligt B-cellslymfom |
96873 |
1172695008 |
|
Neuroendokrin cancer, storcellig |
80133 |
128628002 |
|
Neuroendokrin cancer, småcellig |
80413 |
74364000 |
Mesenkymala tumörer
|
Diagnos |
SNOMED II |
SNOMED CT |
|
Angiolipom |
88610 |
73219006 |
|
Angiosarkom |
91203 |
863926008 |
|
Desmoid-typ fibromatos |
88211 |
47284001 |
|
Granularcellstumör |
95800 |
12169001 |
|
Hemangiom |
91200 |
699948001 |
|
Inflammatorisk myofibroblastisk tumör |
88251 |
1290860006 |
|
Leiomyom |
88900 |
1162890002 |
|
Lipom |
88500 |
134328007 |
|
Myofibroblastom |
88250 |
128738002 |
|
Neurofibrom |
95400 |
1156930004 |
|
Nodulär fasciit |
88280 |
703616008 |
|
Pseudoangiomatös stromal hyperplasi (PASH) |
72430 |
674441000119105 |
|
Schwannom |
95600 |
985004 |
|
Liposarkom |
88503 |
1162815008 |
|
Rabdomyosarkom |
89003 |
30924005 |
|
Osteosarkom |
91803 |
1163405004 |
|
Leiomyosarkom |
88903 |
1163022006 |
Övriga koder
|
Diagnos |
SNOMED II |
SNOMED CT |
|
Fettvävsnekros |
54110 |
79682009 |
|
Laktation, graviditet |
79000 |
71377008 |
|
Protes, implantat |
15800 |
2282003 |
|
Förkalkning |
55400 |
18115005 |
|
Gynekomasti |
71000 |
56246009 |
|
Gångectasi |
32100 |
25322007 |
|
Strålförändring |
11600 |
53222009 |
|
Mamilladenom (Nipple adenoma) |
85060 |
65787003 |
|
Syringomatös tumör |
84070 |
71244007 |
Tilläggsregistreringar
I det nationellt kvalitetsregister för bröstcancer registreras den första bröstcancern (invasiv eller in situ) i höger respektive vänster bröst. Kvalitetsregistret för bröstcancer (NKBC) innehåller patologidata och för närvarande fyller patologer, kirurger, sjuksköterskor eller sekreterare manuellt i ett formulär med data som senare överförs i ett online-register. På vissa håll i landet fyller man i data direkt i registret. Arbete pågår för att skapa en gemensam databas för patologisvar och registrering i kvalitetsregistret i laboratorieinformationssystemet. Patologivariabler (enligt standardsvar) ska matas in i databasen genom ett separat fönster i datasystemet. En kopia förs in i patologisvaret och data skickas automatisk till kvalitetsregistret. Detta kräver att variabler i den lokala laboratoriedatabasen, i databasen på regionalt cancercentrum och i det nationella kvalitetsregistret är helt kongruenta. För komplett lista på parametrar som ska rapporteras hänvisas till NKBC, RCC.
Kvalitetsindikatorer
Följande kvalitetsindikatorer rekommenderas för både biopsier och operationspreparat vid invasiv cancer (18):
- Morfologisk gradering enligt NHG (NHG1 / NHG2 / NHG3)
- ER-status (positiv / negativ)
- HER2-status (amplifierad / icke-amplifierad)
- Ki67-grupp (låg / intermediär / hög)
- Histopatologisk respons efter neoadjuvant behandling enligt AJCC/TNM (komplett respons/ partiell respons / ingen respons)
Följande kvalitetsindikatorer rekommenderas för operationspreparat vid enbart DCIS (18):
- Gradering enligt WHO(Kärngrad 1 / 2 / 3)
- Morfologisk subtyp samt närvaro av nekros och kalk,
- Marginaler
- Storlek
Författare (KVAST-gruppen för bröstpatologi)
Sammankallande: Balazs Acs, Karolinska Universitetslaboratoriet, Stockholm
Anna Ehinger, Skånes Universitetssjukhus, Lund
Anikó Kovács, Sahlgrenska Universitetssjukhuset, Göteborg
Eugenia Colon-Cervantes, Unilabs S:t Göran, Stockholm
Åsa Rundgren, Karolinska Universitetslaboratoriet, Stockholm
Johannes van Brakel, Skånes Universitetssjukhus, Malmö
Anna Boden, Linköpings Universitetssjukhus, Linköping
Annette Bauer, Region Dalarna, Falun
Gunilla Rask, Norrlands universitetssjukhus, Umeå
Referenser
- Rakha E, Sasano H, Wu Y. WHO classifcation of tumours editorial board: Breast tumours. WHO classifcation of tumours series. 2019.
- Consensus Conference on the classification of ductal carcinoma in situ. The Consensus Conference Committee. Cancer. 1997;80(9):1798-802.
- Elston CW, Ellis IO. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology. 1991;19(5):403-10.
- Lakhani S. Breast tumours. Who classification of breast tumours. 2nd ed. ed. Lyon: International Agency for Research on Cancer; 2019.
- Elston CW, Ellis IO. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology. 2002;41(3A):154-61.
- Ellis I, Allison K, Dang C, Gobbi H, Kulka J, Lakhani S, et al. Invasive carcinoma of the breast histopathology reporting guide. International Collaboration on Cancer Reporting: Sydney. 2022.
- Azam AS, Tsang YW, Thirlwall J, Kimani PK, Sah S, Gopalakrishnan K, et al. Digital pathology for reporting histopathology samples, including cancer screening samples–definitive evidence from a multisite study. Histopathology. 2024;84(5):847-62.
- Start RD, Flynn MS, Cross SS, Rogers K, Smith JH. Is the grading of breast carcinomas affected by a delay in fixation? Virchows Arch A Pathol Anat Histopathol. 1991;419(6):475-7.
- Ibrahim A, Lashen A, Toss M, Mihai R, Rakha E. Assessment of mitotic activity in breast cancer: revisited in the digital pathology era. J Clin Pathol. 2022;75(6):365-72.
- Al-Janabi S, van Slooten HJ, Visser M, van der Ploeg T, van Diest PJ, Jiwa M. Evaluation of mitotic activity index in breast cancer using whole slide digital images. PLoS One. 2013;8(12):e82576.
- Brierley J, Gospodarowicz MK, Wittekind C. TNM classification of malignant tumours. Chichester, West Sussex, UK ;: John Wiley & Sons, Inc.; 2017.
- Amin MB, Greene FL, Edge SB, Compton CC, Gershenwald JE, Brookland RK, et al. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging. CA: a cancer journal for clinicians. 2017;67(2):93-9.
- Khoury T, Sait S, Hwang H, Chandrasekhar R, Wilding G, Tan D, et al. Delay to formalin fixation effect on breast biomarkers. Modern pathology : an official journal of the United States and Canadian Academy of Pathology, Inc. 2009;22(11):1457-67.
- Robertson S, Rönnlund C, de Boniface J, Hartman J. Re-testing of predictive biomarkers on surgical breast cancer specimens is clinically relevant. Breast cancer research and treatment. 2019;174(3):795-805.
- Lindstrom LS, Karlsson E, Wilking UM, Johansson U, Hartman J, Lidbrink EK, et al. Clinically used breast cancer markers such as estrogen receptor, progesterone receptor, and human epidermal growth factor receptor 2 are unstable throughout tumor progression. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2012;30(21):2601-8.
- Regionala Cancercentrum i Samverkan. Nationellt vårdprogram Bröstcancer [2024-01-23]. Available from: https://kunskapsbanken.cancercentrum.se/diagnoser/brostcancer/.
- EBCTCG. Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Early Breast Cancer Trialists' Collaborative Group. Lancet. 2005;365(9472):1687-717.
- Rubio IT, Marotti L, Biganzoli L, Aristei C, Athanasiou A, Campbell C, et al. EUSOMA quality indicators for non-metastatic breast cancer: An update. European Journal of Cancer. 2024;198.
- Denkert C, Budczies J, von Minckwitz G, Wienert S, Loibl S, Klauschen F. Strategies for developing Ki67 as a useful biomarker in breast cancer. Breast. 2015;24 Suppl 2:S67-72.
- Denkert C, Loibl S, Muller BM, Eidtmann H, Schmitt WD, Eiermann W, et al. Ki67 levels as predictive and prognostic parameters in pretherapeutic breast cancer core biopsies: a translational investigation in the neoadjuvant GeparTrio trial. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2013;24(11):2786-93.
- Ellis MJ, Suman VJ, Hoog J, Goncalves R, Sanati S, Creighton CJ, et al. Ki67 Proliferation Index as a Tool for Chemotherapy Decisions During and After Neoadjuvant Aromatase Inhibitor Treatment of Breast Cancer: Results From the American College of Surgeons Oncology Group Z1031 Trial (Alliance). Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2017;35(10):1061-9.
- Dowsett M, Nielsen TO, A'Hern R, Bartlett J, Coombes RC, Cuzick J, et al. Assessment of Ki67 in breast cancer: recommendations from the International Ki67 in Breast Cancer working group. Journal of the National Cancer Institute. 2011;103(22):1656-64.
- Leung SCY, Nielsen TO, Zabaglo LA, Arun I, Badve SS, Bane AL, et al. Analytical validation of a standardised scoring protocol for Ki67 immunohistochemistry on breast cancer excision whole sections: an international multicentre collaboration. Histopathology. 2019;75(2):225-35.
- Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science (New York, NY). 1989;244(4905):707-12.
- Gianni L, Dafni U, Gelber RD, Azambuja E, Muehlbauer S, Goldhirsch A, et al. Treatment with trastuzumab for 1 year after adjuvant chemotherapy in patients with HER2-positive early breast cancer: a 4-year follow-up of a randomised controlled trial. The Lancet Oncology. 2011;12(3):236-44.
- Ross JS, Fletcher JA. The HER-2/neu oncogene: prognostic factor, predictive factor and target for therapy. Seminars in cancer biology. 1999;9(2):125-38.
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, Goldhirsch A, Untch M, Smith I, et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. The New England journal of medicine. 2005;353(16):1659-72.
- Rantalainen M, Klevebring D, Lindberg J, Ivansson E, Rosin G, Kis L, et al. Sequencing-based breast cancer diagnostics as an alternative to routine biomarkers. Sci Rep. 2016;6:38037.
- Ross DS, Zehir A, Cheng DT, Benayed R, Nafa K, Hechtman JF, et al. Next-Generation Assessment of Human Epidermal Growth Factor Receptor 2 (ERBB2) Amplification Status: Clinical Validation in the Context of a Hybrid Capture-Based, Comprehensive Solid Tumor Genomic Profiling Assay. J Mol Diagn. 2017;19(2):244-54.
- Ross JS, Gay LM, Wang K, Ali SM, Chumsri S, Elvin JA, et al. Nonamplification ERBB2 genomic alterations in 5605 cases of recurrent and metastatic breast cancer: An emerging opportunity for anti-HER2 targeted therapies. Cancer. 2016;122(17):2654-62.
- Rakha EA, Starczynski J, Lee AH, Ellis IO. The updated ASCO/CAP guideline recommendations for HER2 testing in the management of invasive breast cancer: a critical review of their implications for routine practice. Histopathology. 2014;64(5):609-15.
- Lin L, Sirohi D, Coleman JF, Gulbahce HE. American Society of Clinical Oncology/College of American Pathologists 2018 Focused Update of Breast Cancer HER2 FISH Testing GuidelinesResults From a National Reference Laboratory. Am J Clin Pathol. 2019;152(4):479-85.
- Wolff AC, Hammond MEH, Allison KH, Harvey BE, Mangu PB, Bartlett JMS, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2018;36(20):2105-22.
- International Immuno-olcology. Group ITV: Biomarker Working Group on Breast cancer; [Cited 2024-01-23]. Available from: https://www.tilsinbreastcancer.org/.
- Hendry S, Salgado R, Gevaert T, Russell PA, John T, Thapa B, et al. Assessing Tumor-infiltrating Lymphocytes in Solid Tumors: A Practical Review for Pathologists and Proposal for a Standardized Method From the International Immunooncology Biomarkers Working Group: Part 1: Assessing the Host Immune Response, TILs in Invasive Breast Carcinoma and Ductal Carcinoma In Situ, Metastatic Tumor Deposits and Areas for Further Research. Adv Anat Pathol. 2017;24(5):235-51.
- Cortazar P, Zhang L, Untch M, Mehta K, Costantino JP, Wolmark N, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-72.
- Esserman LJ, Berry DA, DeMichele A, Carey L, Davis SE, Buxton M, et al. Pathologic complete response predicts recurrence-free survival more effectively by cancer subset: results from the I-SPY 1 TRIAL--CALGB 150007/150012, ACRIN 6657. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2012;30(26):3242-9.
- von Minckwitz G, Untch M, Blohmer JU, Costa SD, Eidtmann H, Fasching PA, et al. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2012;30(15):1796-804.
- Kovács A, Rundgren-Sellei Å, Rask G, Bauer A, Bodén A, van Brakel J, et al. Navigating discrepancies: The assessment of residual lymphovascular invasion in breast carcinoma after neoadjuvant treatment. Breast. 2025;82:104519.
- Symmans WF, Peintinger F, Hatzis C, Rajan R, Kuerer H, Valero V, et al. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2007;25(28):4414-22.
- Bossuyt V, Provenzano E, Symmans WF, Boughey JC, Coles C, Curigliano G, et al. Recommendations for standardized pathological characterization of residual disease for neoadjuvant clinical trials of breast cancer by the BIG-NABCG collaboration. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2015;26(7):1280-91.
- MD Anderson Cancer Center. Residual Cancer Burden Calculator: The University of Texas; [Cited 2021-10-26]. Available from: http://www3.mdanderson.org/app/medcalc/index.cfm?pagename=jsconvert3.
- Liu YL, Saraf A, Lee SM, Zhong X, Hibshoosh H, Kalinsky K, et al. Lymphovascular invasion is an independent predictor of survival in breast cancer after neoadjuvant chemotherapy. Breast Cancer Res Treat. 2016;157(3):555-64.
- Schmid P, Adams S, Rugo HS, Schneeweiss A, Barrios CH, Iwata H, et al. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. The New England journal of medicine. 2018;379(22):2108-21.
- Prat A, Ellis MJ, Perou CM. Practical implications of gene-expression-based assays for breast oncologists. Nature reviews Clinical oncology. 2012;9(1):48-57.
- Cardoso F, van't Veer LJ, Bogaerts J, Slaets L, Viale G, Delaloge S, et al. 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. The New England journal of medicine. 2016;375(8):717-29.
- Paik S, Shak S, Tang G, Kim C, Baker J, Cronin M, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. The New England journal of medicine. 2004;351(27):2817-26.
- Parker JS, Mullins M, Cheang MC, Leung S, Voduc D, Vickery T, et al. Supervised risk predictor of breast cancer based on intrinsic subtypes. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2009;27(8):1160-7.
- Saal LH, Vallon-Christersson J, Hakkinen J, Hegardt C, Grabau D, Winter C, et al. The Sweden Cancerome Analysis Network - Breast (SCAN-B) Initiative: a large-scale multicenter infrastructure towards implementation of breast cancer genomic analyses in the clinical routine. Genome medicine. 2015;7(1):20.
- Acs B, Fredriksson I, Rönnlund C, Hagerling C, Ehinger A, Kovács A, et al. Variability in Breast Cancer Biomarker Assessment and the Effect on Oncological Treatment Decisions: A Nationwide 5-Year Population-Based Study. Cancers. 2021;13(5).
- Rask G, Olofsson H, Bauer A, Bodén A, van Brakel J, Colón-Cervantes E, et al. A bottom-up initiated digital external quality assessment scheme for the state-of-the-art pathology in Sweden: reduced variability between pathology departments. Virchows Arch. 2025.
- Shmatko A, Ghaffari Laleh N, Gerstung M, Kather JN. Artificial intelligence in histopathology: enhancing cancer research and clinical oncology. Nature cancer. 2022;3(9):1026-38.
- Stalhammar G, Fuentes Martinez N, Lippert M, Tobin NP, Molholm I, Kis L, et al. Digital image analysis outperforms manual biomarker assessment in breast cancer. Modern pathology : an official journal of the United States and Canadian Academy of Pathology, Inc. 2016;29(4):318-29.
- Wang Y, Acs B, Robertson S, Liu B, Solorzano L, Wählby C, et al. Improved breast cancer histological grading using deep learning. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2022;33(1):89-98.
- Ivshina AV, George J, Senko O, Mow B, Putti TC, Smeds J, et al. Genetic reclassification of histologic grade delineates new clinical subtypes of breast cancer. Cancer research. 2006;66(21):10292-301.
- Sotiriou C, Wirapati P, Loi S, Harris A, Fox S, Smeds J, et al. Gene expression profiling in breast cancer: understanding the molecular basis of histologic grade to improve prognosis. Journal of the National Cancer Institute. 2006;98(4):262-72.
- Liedtke C, Hatzis C, Symmans WF, Desmedt C, Haibe-Kains B, Valero V, et al. Genomic grade index is associated with response to chemotherapy in patients with breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2009;27(19):3185-91.
- Shames DS, Wistuba, II. The evolving genomic classification of lung cancer. The Journal of pathology. 2014;232(2):121-33.
- Bose R, Kavuri SM, Searleman AC, Shen W, Shen D, Koboldt DC, et al. Activating HER2 mutations in HER2 gene amplification negative breast cancer. Cancer discovery. 2013;3(2):224-37.
- Robinson DR, Wu YM, Vats P, Su F, Lonigro RJ, Cao X, et al. Activating ESR1 mutations in hormone-resistant metastatic breast cancer. Nature genetics. 2013;45(12):1446-51.
- Juric D, Rodon J, Tabernero J, Janku F, Burris HA, Schellens JHM, et al. Phosphatidylinositol 3-Kinase alpha-Selective Inhibition With Alpelisib (BYL719) in PIK3CA-Altered Solid Tumors: Results From the First-in-Human Study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2018;36(13):1291-9.
- Zehir A, Benayed R, Shah RH, Syed A, Middha S, Kim HR, et al. Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000 patients. Nature medicine. 2017;23(6):703-13.
- Genomic Medicine Sweden. [Online] Kristianstad: Genomic Medicine Sweden (GMS); [Cited 2024-01-23]. Available from: https://genomicmedicine.se/.
- Frampton GM, Fichtenholtz A, Otto GA, Wang K, Downing SR, He J, et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nat Biotechnol. 2013;31(11):1023-31.
- Marcinak CT, Murtaza M, Wilke LG. Genomic Profiling and Liquid Biopsies for Breast Cancer. The Surgical clinics of North America. 2023;103(1):49-61.
- Lee A, Deb PCDR, Ellis IO, Howe M, Jenkins MJA, Pinder SE. Guidelines for Non-Operative Diagnostic Procedures and Reporting in Breast Cancer Screening. August 2021. 2021.
- Biganzoli L, Cardoso F, Beishon M, Cameron D, Cataliotti L, Coles CE, et al. The requirements of a specialist breast centre. The Breast. 2020;51:65-84.
- Perry N, Broeders M, de Wolf C, Törnberg S, Holland R, von Karsa L. European guidelines for quality assurance in breast cancer screening and diagnosis. -summary document. Oncology in Clinical Practice. 2008;4(2):74-86.
