Bilaga 12. Anvisningar för cytologi och histologi
Cancer i urinvägarna
Svensk förening för patologi - Svensk förening för klinisk cytologi
Dokumentnamn: Cancer i urinvägarna. Dok.nr: 2
Framtaget av: URO-KVAST. Utgåva: Version 2.1. Fastställt: 2023.
Riktlinjer för omhändertagande och besvarande av cancer i urinvägarna utformade av KVAST (Kvalitets- och standardiseringsgruppen inom Svensk Förening för Patologi).
I. Innehållsförteckning
- Innehållsförteckning
- Klinisk bakgrundsinformation
- Anvisningar för provtagarens hantering av prover
- Anamnestisk remissinformation
- Hantering av prover på patologlaboratoriet/Utskärningsanvisningar
- Analyser
- Rekommenderade klassifikationssystem
- Information i remissens svarsdel
- Administrativt
- Övrigt
- Referenser
Appendix 1. Immunhistokemiska färgningar
Appendix 2. Förslag på svarsmallar för cystektomi
II. Klinisk bakgrundsinformation
I Sverige diagnosticeras ca 3600 fall med cancer i urinvägarna per år, varav ca 3200 i urinblåsan. Symptomen på urotelial cancer är vanligen makroskopisk hematuri. Detta ger anledning till utredning av urinvägarna med cystoskopi. I den kliniska rutinen ingår blåssköljvätskor/kastad urin, sköljvätska från uretra, biopsitagning med kall klocktång och TUR-B. Biopsitagning från olika lokaler i blåsan (mapping) förekommer också.
Den vanligaste typen av cancer i urinblåsan är urotelial cancer som utgör mer än 90 procent. Skivepitelcancer utgör 5 procent och adenocarcinom 0.5–2 procent.
Enbart 5–10 procent av urotelial cancer uppstår i njurbäcken och/eller i uretärer.
Urotelial carcinoma in situ (Tis) ter sig ibland kliniskt som en rodnad i urinblåsan, men det är ovanligt som enskilt patologiskt fynd (1–3%). Icke-BCG-responsiv eller BCG-refraktär Tis är en indikation för primär cystektomi, då naturalförloppet leder till invasiv tumör i 50 procent av fallen inom 5 år. Därför är det mycket viktigt att man är säker på diagnostiken av CIS. Behandling med BCG eller mitomycin av icke-muskelinvasiva tumörer inklusive Tis är rutin i kliniken.
Tis förekommer oftare synkront med eller efter höggradig papillär eller invasiv urotelial cancer. Frekvensen av samtidig Tis hos patienter med T1 eller blåscancer av högre stadie är 50–60 procent.
Uroteliala tumörer är oftast papillära även om de är invasiva. I urinblåsan utgörs nyupptäckt urotelialcancer i 70–85 procent av fallen av icke muskelinvasiva stadier (pTis, pTa och pT1). Icke muskelinvasiv blåscancer har ofta multipla recidiv och i 10–20 procent av fallen ses progression till muskelinvasiv cancer.
Det är vanligt att tumörer har en blandning av konventionell urotelial cancer, histologiska subtyper och/eller divergerande differentiering. I dessa fall är det viktigt att ange de olika komponenterna, eftersom det har betydelse för prognos och val av behandling, och det rekommenderas också att försöka kvantifiera dem. Vissa histologiska subtyper av urotelial cancer har sämre prognos än ren urotelial cancer justerat för tumörstadium och anses vara högrisk tumörer.
Vid invasiv tumörväxt ska invasionsdjupet bedömas enligt TNM. Engagemang av detrusormuskulatur leder oftast till cystektomi.
Detta dokument omhandlar hantering och diagnostik av biopsier/TUR-B, cystektomipreparat och biopsier/resektat från övre urinvägarna.
III. Anvisningar för provtagarens hantering av provet
Som fixativ rekommenderas buffrad formalin 10 procent (formaldehyd 4%). Använd en volym motsvarande minst 10 gånger preparatvikten.
- Biopsier: Antalet biopsier anges för varje fraktion. Numreras enligt remissuppgifter.
- TUR-B-material: För säkrare bedömning av invasion är fraktionering av resektionsmaterialet i huvudprov och tumörbas önskvärt.
- Cystektomipreparat: Inskickas färskt eller formalinfyllt. Preparatet kan lämnas till patologavdelningen färskt och ouppklippt med kateter i uretra, alternativt fylls blåsan maximalt via kateter med formalin (buffrad formalin 10%). Kateter och uretra knyts om, uretärer utmärkes på valfritt sätt. Om detta förfarande inte är genomförbart fixeras blåsan uppklippt i framvägg så att formalin kommer in i blåsan utan fördröjning.
- Nefrektomi/uretärektomipreparat: Inskickas färskt eller formalinfixerat. Fixeringssnitt av njuren kan läggas från lateralt.
IV. Anamnestisk remissinformation
Av remissen ska följande framgå:
Patientens namn och personnummer.
Remitterande enhet och läkare.
Känd smittfara (HIV, HBV, HCV).
Datum och tidpunkt när preparatet lagts i formalin om det inte skickas färskt.
Adekvata uppgifter om sjukhistoria och undersökningsfynd samt eventuell tidigare BCG-/mitomycinbehandling/gemcitabin/docetaxel/epirubicin, eventuell tidigare radioterapi och tidigare lokalisation av behandlad tumör.
Uppgifter om vad biopsi/operationsmaterialet i sin helhet omfattar.
Antalet burkar skall anges på remiss. Numrering eller annan märkning på preparatburk ska överensstämma med remissuppgifter. (OBS! Ej märkning på locket).
V. Hantering av prover på patologlaboratoriet/Utskärningsanvisningar
Utskärningsanvisningar
1. Biopsier – mapping
Varje fraktion bäddas i separata kassetter. Materialet snittas i 2–3 nivåer.
2. TUR-B material
Preparatmängd uppskattas (ml eller gram) och noteras. Separata fraktioner undersökes var för sig. Allt material (upp 10 ml eller 10g) undersökes. Vid mer material bäddas initialt 6–8 kassetter. Mängden kvarvarande material noteras. Materialet snittas i en eller flera nivåer.
Rekommendation: om det i den initiala bäddningen påvisas invasion i lamina propria (pT1), bädda mer eller resten av materialet. Detta för att utesluta invasion i detrusormuskeln. Muskelinvasion (pT2) har sämre prognos och behandlingen är mer aggressiv.
3. Kirurgiska blåsresektat (ej TUR-B)
Hanteras beroende på frågeställning.
4. Cystektomipreparat
Preparatet mottages färskt eller formalinfyllt.
Ouppklippt, ofixerad blåsa fylls maximalt med formalin via kateter, varefter en sutur eller snöre knyts om uretra och katetern.
Alternativt fixeras blåsan uppklippt och uppnålad på platta.
Lägg preparatet i formalin för fixering cirka 2 dygn.
Beskriv typ av operationspreparat.
Mät urinblåsan och eventuellt medföljande organ. Inspektera utsidan, tuscha eventuellt resektionsytor, speciellt om misstanke på tumörgenombrott.
Om det finns en vidhängande prostata kan man börja med utskärning av denna som bör handläggas enligt liknande protokoll som prostatektomipreparat (KVAST prostata), dock med horisontella snitt av prostatabasen vid övergången till urinblåsa. I cirka 30 procent av cystoprostatektomierna vid blåscancer hittas även prostatacancer som bör rapporteras.
Om vidhängande uterus/vagina finns undersöks om tumöröverväxt föreligger.
Om det finns makroskopisk synlig tumör i urinblåsan beskriv växtsättet (uni/multifokal), lokalisation, tumörmått i mm och tumörens djupaste invasion, ffa om växt i perivesikal fettväv eller ut i resektionsyta.
Om ingen makroskopisk synlig tumör ses, beskriv slemhinnan noggrant ex rodnad, hemorrhagisk, indragen eller slät, ärr efter tidigare TUR, divertiklar.
Perivesikal fettväv undersöks med avseende på lymfkörtelförekomst.
Separata lymfkörtelfraktioner undersöks var för sig.
Bitar till mikroskopisk undersökning
Tumör undersöks med en bit/cm av tumörens största diameter alternativt med storsnitt. Bitarna skall även omfatta djupaste tumörväxt samt resektionsrand i anslutning till tumören. Det är ofta lämpligt att dessutom undersöka ett urval av vävnadsbitar från urinblåsan (blåsbotten, framvägg, bakvägg, höger och vänster sidovägg, blåstak) samt från uretärostier.
Om det inte finns någon tumör rekommenderas att hela ärrområdet/områdena bäddas.
Båda uretärernas resektionsränder bäddas, om inte separata preparat av dessa har skickats med. Uretras resektionsrand bäddas.
Prostata bäddas enligt ovan.
Vid makroskopisk misstanke om överväxt på uterus eller andra medföljande organ skall bitar tas för dokumentation av överväxt samt säkerställande av radikalitet.
Varje lymfkörtelfraktion undersöks separat. Bäst resultat erhålls om samtliga körtlar bäddas var för sig. Mindre lymfkörtlar (<4 mm i största diameter) som inte delas kan dock läggas samman i en kassett. Resterande fettvävnad kan bäddas men det är inte obligatoriskt. I detta material ses ofta små lymfkörtlar vid mikroskopering.
5. Nefrektomi/uretärektomier med njurbäcken eller uretärtumör
Njurbäckentumör
Mät hela preparatet, njuren och uretärens längd.
Inspektera utsidan, tuscha eventuellt resektionsytor, speciellt om misstanke på tumörgenombrott. Klipp upp uretären och skär vidare genom njurhilus så att njuren delas i 2 delar.
Beskriv tumören/tumörernas lokalisation, storlek och utseende samt eventuell makroskopisk invasion i njurparenkym och peripelvin/perinefrisk fettväv.
Ta bit från uretärens resektionsrand.
Ta bit från resektionsranden av njurven/artär.
Tumör undersöks med en bit/cm av tumörens största diameter alternativt med storsnitt. Bitarna skall även omfatta relation till njurparenkym och peripelvin/perinefrisk fettväv.
För att utreda förekomst av multifokal (mikroskopisk) tumör rekommenderas även bitar från uretär (tvärsnitt med 2 cm intervall).
Uretärtumör
Vid uretärtumör mät tumörutbredning (längd, diameter) samt avstånd till longitudinell och cirkumferentiell resektionsrand. Representativa bitar tas från tumören samt från andra delar av uretären (efter uppklippning och inspektion av slemhinnan, alternativt tvärsnitt med 2 cm intervall av hela uretären). Longitudinella och cirkumferenta resektionsytor bäddas
VI. Analyser
Som rutinfärgning används HE men tillägg med Van Gieson (VG) eller annan färgning, t ex trikrom är till hjälp för att bedöma invasionsdjup och relation till muscularis propria.
Immunhistokemi är inte rutin men kan vara användbar vid svårtolkad bild. Exempelvis kan reaktiva urotelförändringar vara svåra att skilja från Tis.
| Tis: |
CK20 är vanligen positiv i hela urotelets tjocklek. CK20 är positiv vid CIS där urotelet är delvis avlossat/denuderat och i individuella celler i pagetoid variant av Tis. Ki67 visar ökat proliferationsindex och i flera nivåer. P53 uppvisar vanligen diffus stark nukleär infärgning genom hela urotelets tjocklek eller är helt negativ/null. CD44 är vanligen negativ eller basalt positivt. |
| Normalt/Reaktivt: |
CK20 positiv i paraplyceller. Ki67 positiv basalt men kan visa mer uttalad positivitet vid reaktiva förändringar. CD44 positiv basalt i normalt urotel och vid reaktivt ökad positivitet upp genom urotelet. Urotelialt papillom har samma infärgningsmönster som normalt flackt urotel. |
Vid blåstumörer som är svårtolkade med ex differentialdiagnostik mot metastas av skivepitelcancer eller prostatacancer kan följande antikroppar användas:
| CK7 |
positiv i nästan alla uroteliala carcinom (90%) och i 15 procent av prostatacancer. |
| CK20 |
positiv i de flesta uroteliala carcinom (60%) och adenocarcinom, negativ i skivepitelcancer och prostatacancer. |
| GATA3 |
positiv i de flesta uroteliala carcinom (75%), negativ i prostatacancer. |
| p63 |
positiv i de flesta uroteliala carcinom (80%), negativ i prostatacancer. |
| Uroplakin 2 |
positiv i uroteliala carcinom (ca 63–73%), mycket specifik för urotel. |
| CDX2 |
positiv i körteldifferentiering och adenocarcinom, både i primära adenocarcinom i urinblåsa och vid överväxt/metastas från colorektalt adenocarcinom, negativ i prostatacancer. |
Var god se Appendix 2 för ytterligare immunhistokemi.
MMR-testning av övre urinvägstumörer
Bedömning av MMR-proteiner bör utföras på samtliga resektat av uroteliala tumörer från övre urinvägarna, då Lynchs syndrom ligger bakom 5–10 procent av dessa fall (resten är sporadiska) och MMR-defekt ses i 3–30 procent av samtliga fall.
MMR-defekt innebär för Lynch-patienter längre uppföljning och predikterar respons på immun-checkpoint hämmarbehandling. I första hand görs immunhistokemiska färgningar för MLH1, PMS2, MSH2 och MSH6. Bevarat uttryck, dvs positiv kärninfärgning, rapporteras som bevarat uttryck, pMMR (proficient MMR), medan avsaknad av kärninfärgning innebär förlust av MMR (dMMR, deficient MMR, likvärdig med MSI). Svaga och heterogena infärgningar (även cytoplasmatiska) kan vara tecken till bakomliggande defekt men också en effekt av icke optimal färgning. Överensstämmelsen mellan immunhistokemi och molekyärpatologiska metoder är hög men immunhistokemi kan inte skilja mellan MSI-low och mikrosatellitstabilitet (MSS).
PD-L1 immunhistokemi för responsprediktion av systemisk behandling med checkpoint-hämmare
Användande av PD-L1 immunhistokemi utförs för responsprediktion vid behandling av urotelial cancer med immuncheckpoint-hämmare.
Det finns i dagsläget tre immunterapeutiska läkemedel som är godkända av NT-rådet för adjuvant behandling av urotelial cancer, där hänsyn måste tas till PD-L1-uttryck, se NT-rådets rekommendation för PD-(L)1-hämmare.
Varje läkemedel är knutet till en specifik diagnostisk antikropp och IHC-plattform, där celltyper och definitioner av tröskelvärden för vad som räknas som högt respektive lågt uttryck är olika för de olika terapeutiska antikropparna (v g se tabell 1 nedan). Därtill har varje terapeutisk antikropp specifika bedömningskriterier för fastställande av högt respektive lågt uttryck. Detta innebär att beställare/remittenter måste ange vilket läkemedel som ska användas i det speciella patientärendet.
Tabell 1.PD-L1 immunhistokemi för urotelial cancer
|
|
Atezolizumab (Tecentriq) |
Pembrolizumab (Keytruda) |
Nivolumab (Opdivo) |
|
Antikropp klon |
SP142 |
22C3 |
28–8 |
|
IHC-plattform |
Ventana |
Dako |
Dako |
|
Celltyper i score |
IC |
IC och TC |
TC |
|
Tröskelvärde (pos) |
>5% av tumörens yta |
CPS >10 |
TC ≥1% |
IC: tumör-associerade inflammatoriska celler (olika celltyper ingår beroende på antikropp), TC: tumörceller, CPS: combined positivity score.
VII. Rekommenderade klassifikationssystem
För histologisk indelning av blåstumörer ska senaste WHO-klassifikation användas: WHO Classification of Tumors of the Urinary System and Male Genital Organs 2022.
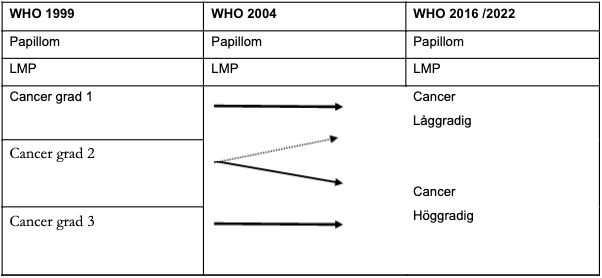
Klassifikation och gradering av papillära tumörer
Enligt internationella rekommendationer klassificeras papillära uroteliala neoplasier enligt WHO2004 (ISUP 1998) och 2016/2022: papillom, PUNLMP, låggradig cancer och höggradig cancer. För att erhålla maximal prognostisk information, möjliggöra historiska jämförelser och tillgodose det kliniska behovet att följa gällande vårdprogram, bör man dessutom dela upp höggradig urotelial cancer enligt WHO 2004 i grad 2 och 3 enligt WHO 1999 (se Tabell 2 och 3). Således bör följande kategorier användas: papillom, PUNLMP, låggradig cancer (grad 1 WHO 1999 och del av grad 2), höggradig cancer (grad 2 eller grad 3 WHO 1999).
Papillär urotelial cancer bör graderas som höggradig om den höggradiga komponenten utgör ≥5 procent av tumören. Cancer med <5 procent höggradig komponent bör graderas som ”låggradig med <5 procent höggradig komponent”. Mer än 95 procent av invasiva uroteliala carcinom är höggradiga och bara ett fåtal är histologiskt låggradiga, t ex nested subtyp, vilken trots histologin är en mycket aggressiv cancer.
Tabell 2. Histologiska kriterier för gradering av papillära tumörer
|
Typ/grad |
Papillom |
LMP |
Grad 1 |
Grad 2 |
Grad 3 |
|
Uroteltjocklek |
Normal (≤ 7 lager) |
Förtjockad |
Variabel |
Variabel |
Variabel |
|
Polarisering/ utmognad |
Normal |
Normal |
Mest ordning |
Mest oordning |
Upphävd |
|
Kärnstorlek |
Normal |
Uniformt lätt förstorade |
Förstorade, liten variation |
Förstorade, måttlig variation |
Förstorade, stor variation |
|
Kärnform |
Normal |
Normal |
Lätt variation |
Måttlig pleomorfism |
Grav pleomorfism |
|
Kromatin |
Fintecknat |
Fintecknat |
Lätt variation |
Måttlig variation |
Stor variation |
|
Nukleol |
Normal (liten) |
Normal (liten) |
Vanligen liten |
Prominent |
Förstorad, multipla |
|
Mitoser |
Saknas |
Få, basala |
Spridda, olika nivåer |
Vanliga, alla nivåer |
Vanliga, alla nivåer |
Tabell 3 Historisk gradering av urotelial cancer
Det finns normerande utbildningsmaterial, var god se webbadresser i referensavsnittet.
I WHO 2016 beskrevs en entitet som kallades ”urothelial proliferation of uncertain malignant potential”. I WHO 2022 har denna entitet tagits bort och dessa lesioner (korta, icke förgrenade papillära formationer med urotel med lätt atypi) klassificeras nu som tidig låggradig icke invasiv papillär cancer eller som förlängningen av en sådan tumör.
Papillär urotelial hyperplasi är borttaget sedan tidigare.
Urotelial dysplasi är en flack lesion som morfologiskt inte når upp till kriterierna för Tis. Det är debatterat om dysplasi i urotel alltid är en intraepitelial neoplasi men den antas omfatta förändringar som är pre-neoplastiska.
Urotelial cancer med divergerande differentiering och subtyper av urotelial cancer
Urotelial cancer med skivepitel differentiering är den vanligaste typen av divergerande differentiering och utgör 30–40 procent av fallen. Glandulär differentiering är den näst vanligaste och ska skiljas från körtelliknande pseudolumina i en annars konventionell urotelial cancer. Andra divergerande differentieringar är trophoblastisk och Müllersk.
Det finns flera olika subtyper av urotelial cancer som betraktas som höggradiga, vanligtvis blandade/mixed med konventionell urotelial cancer.
Mikropapillär urotelial cancer är en aggressiv subtyp och cystektomi kan övervägas även hos patienter med icke muskelinvasiv cancer. Kärlinväxt är vanligt och Tis ses i mer än hälften av fallen.
Nested urotelial cancer är viktig att känna igen då den ofta är mer aggressiv än vad den morfologiskt ser ut att vara. Large cell nested är en ovanlig subtyp där patienterna ofta diagnosticeras med pT2 tumörer och många har extravesikal spridning.
Tubulär och mikrocystisk urotelial cancer är likt nested mer aggressiv än vad de morfologiskt ser ut att vara.
Plasmacytoid urotelial cancer är en aggressiv subtyp.
Sarkomatoid urotelial cancer karakteriseras av att det finns områden med tumör som ej kan skiljas mot sarkom. Den är ofta blandad/mixed med konventionell urotelial, skivepitel, glandulär eller småcellig neuroendokrin cancer.
Lipid-rich urotelial cancer är ofta blandad/mixed med konventionell urotelial cancer och andra subtyper.
Andra sällsynta subtyper är lymfoepiteliomlik-, klarcellig (glykogen-rik)-, jättecells- samt odifferentierad urotelial cancer.
Icke uroteliala tumörer
Skivepitelcancer utgörs av tumör med ren skivepiteldifferentiering som bör graderas som högt, medelhögt eller lågt differentierad. Det ses ofta prekursorförändringar som kan utgöras av skivepitelcancer in situ eller keratiniserande skivepitelmetaplasi med/utan dysplasi.
Adenocarcinom utgörs av tumör med ren körteldifferentiering som bör graderas som högt, medelhögt eller lågt differentierad. Adenocarcinom lokaliserade på platsen för urachus, s.k. urachuscancer har dålig prognos p.g.a. avancerat stadium vid diagnos. Det kan även ses samtidig adenocarcinom in situ eller villöst adenom.
Neuroendokrina neoplasmer
Småcellig neuroendokrin cancer (SCNEC) är vanligare än storcellig neuroendokrin cancer. Neuroendokrin tumör (tidigare kallad carcinoid) är mest sällsynt. Neuroendokrin cancer kan antingen vara ”ren” eller utgöra en komponent i blandad/mixed neuroendokrin/icke-neuroendokrin cancer. Procentandelen av den neuroendokrina cancern kan anges.
SCNEC utgör mindre än 1 procent av blåstumörer och har dålig prognos.
De är ofta stora tumörer med infiltration i muskelväggen eller perivesikal fettvävnad. De kan förekomma i alla vägglagren i blåsan och ses ofta som ulceration men de kan även vara nodulära eller polypoida. Nekros är vanlig. Blandad tumörer/mixed förekommer i två tredjedelar av fallen och är antingen blandade med urotelial cancer eller med adenocarcinom, mikropapillär, skivepitel eller sarkomatoid cancer. SCNEC i urinblåsa och i prostata är morfologiskt likadana. TMRSS2:ERG fusion i prostata SCNEC och TERT promoter mutation i urinblåsa SNEC kan användas för att skilja dem åt, om det kliniskt är viktigt.
Storcellig neuroendokrin cancer i urinblåsan är sällsynt.
Tumörstadium
Tabell 4.Cancer i urinblåsa, enligt TNM Classification of Malignant Tumours (UICC) 2025, 9:e upplagan
|
pT0 |
Ingen tumör |
|
pTis |
Cancer in situ |
|
pTa |
Papillär cancer utan invasiv växt |
|
pT1 |
Tumörinfiltration i lamina propria* |
|
pT2 pT2a pT2b |
Tumörinfiltration i detrusormuskulatur inre halvan yttre halvan |
|
pT3 pT3a pT3b |
Tumörväxt i perivesikal fettväv Mikroskopisk tumörväxt i perivesikal fettväv Makroskopisk tumörväxt i perivesikal fettväv |
|
pT4 pT4a pT4b |
Tumör invaderar prostatastroma, vesicula seminalis, uterus, vagina, bäckenvägg, bukvägg Tumör invaderar prostatastroma**, vesicula seminalis, uterus, vagina Tumöröverväxt på bäckenvägg eller bukvägg |
|
N0 |
Ingen lymfkörtelmetastas |
|
N1 |
Metastas i en lymfkörtel i bäckenet |
|
N2 |
Metastas i multipla lymfkörtlar i bäckenet |
|
N3 |
Metastas i lymfkörtlar längs iliaca communis |
|
M0 |
Ingen fjärrmetastas |
|
M1 M1a M1b |
Fjärrmetastas Icke-regional lymfkörtelmetastas Övriga fjärrmetastaser |
* T1 tumörer skall bedömas som ytlig eller utbredd invasiv tumörväxt. I TNM8 finns inte subklassificering men sedan WHO 2016 finns önskemål om T1m (minimal/ytlig) vid enstaka focus mindre än 0,5 mm i diameter och T1e (extensiv/utbredd) vid multipla minimala foci eller utbredd mer än 0,5 mm i diameter.
** enligt AJCC Cancer Staging Manual 8th ed (2018) gäller detta endast för transmural/extravesikal spridning av primär urinblåsecancer, medan invasion av prostatastroma via uretra och prostatagångar inte är T4a utom stadieindelas enligt uretracancer pTNM. Om uroteliala cancerceller sprids intraepitelialt i prostatiska uretra och/eller intraduktalt i prostatagångar är det pTis, om de infiltrerar i subepitelial vävnad i uretra är det pT1, och om de infiltrerar i prostatastroma är det pT2. För primär uretracancer som växer ut genom prostata i periprostatisk vävnad är det pT3.
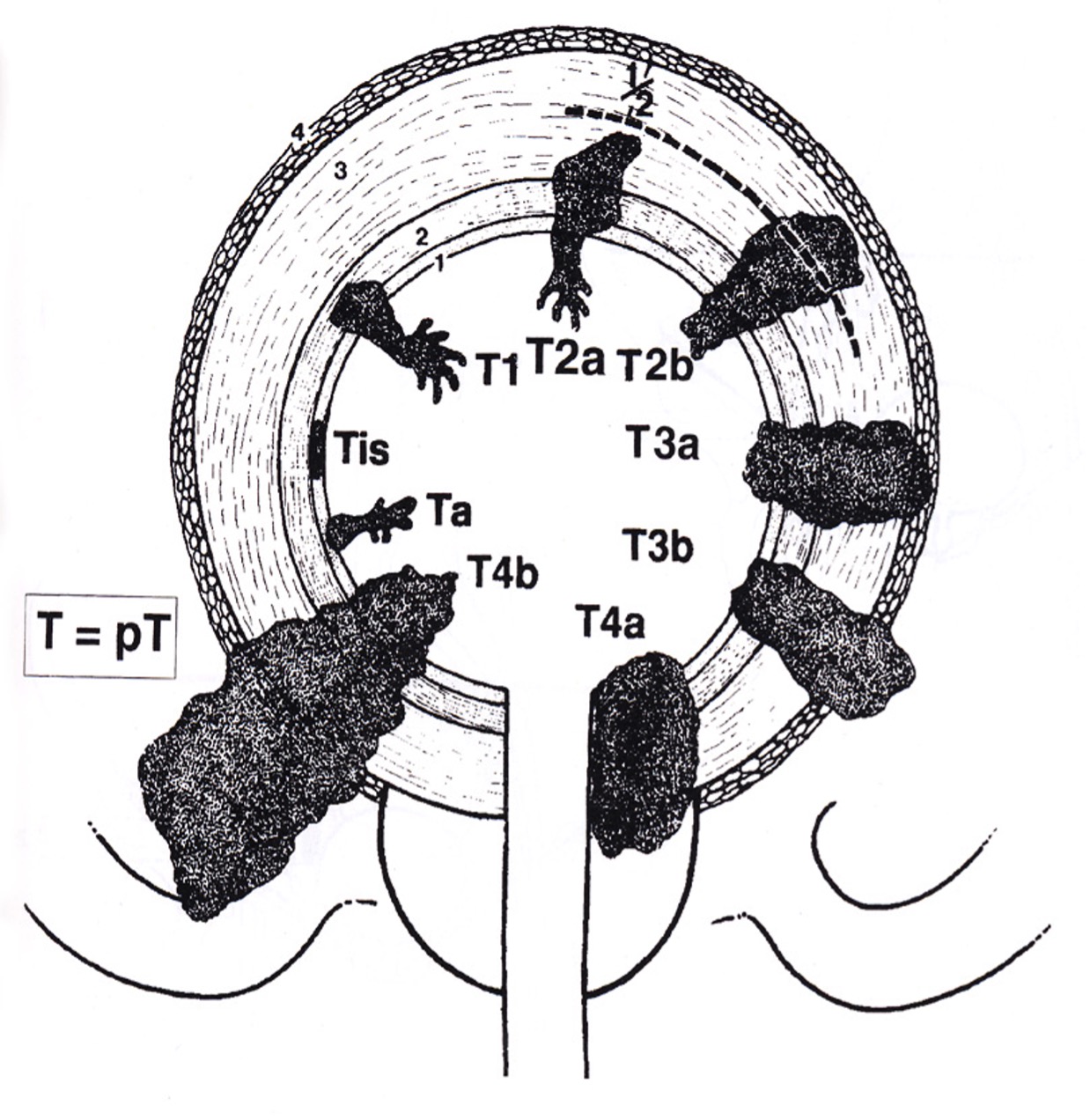
Bedömning av pT stadium vid cancer i divertiklar
Divertiklar har inte någon detrusor muskel, men de har ofta hypertrofi av muscularis mucosa.
P g a att de saknar detrusor muskel kan de inte ha ett pT2 stadium.
Tabell 5 Cancer i övre urinvägarna, enligt TNM Classification of Malignant Tumours (UICC) 2017, 8:e upplagan
|
pT0 |
Ingen tumör |
|
pTis |
Cancer in situ |
|
pTa |
Papillär cancer utan invasiv växt |
|
pT1 |
Tumörinfiltration i lamina propria |
|
pT2 |
Tumörinfiltration i muskularis |
|
pT3 |
Njurbäcken: tumörväxt i peripelvin fettväv eller njurparenkym Uretär: tumörväxt i periuretärisk fettväv |
|
pT4 |
Tumör invaderar närliggande organ eller genom njurparenkymet i perinefrisk fettväv. |
|
N0 |
Ingen lymfkörtelmetastas |
|
N1 |
Metastas i en lymfkörtel <2 cm i största diameter |
|
N2 |
Metastas i en lymfkörtel >2cm eller i multipla lymfkörtlar |
|
M0 |
Ingen fjärrmetastas |
|
M1 |
Fjärrmetastas |
VIII. Information i remissens svarsdel
1 Biopsier/TUR-B material
Varje fraktion besvaras separat. Förekomst av CIS rapporteras. Svaret ska innehålla uppgift om förekomst av detrusormuskulatur. Vid tumör rapporteras histologisk typ, ev. subtyp/ divergerande differentiering, grad enligt WHO 1999 och 2016/2022 och i den sammanfattande diagnosen dessutom patologiskt tumörstadium pT enligt TNM 2017.
Ex. Fragmenterad blåsvävnad ca 5 ml.
Mikroskopiskt ses blåsslemhinna med växt av en papillär urotelial cancer grad 2/höggradig. Inga tecken på invasiv tumörväxt och ingen tumör i medföljande detrusormuskulatur.
PAD: Papillär urotelial cancer grad 2 (höggradig), pTa.
2 Cystektomipreparat/ Nefrouretärektomipreparat
Makroskopisk beskrivning: måttangivelser och beskrivning av förändringar enl makroskopisk bedömning vid utskärningen.
Mikroskopiskt utlåtande: tumörtyp anges med histologisk typ, ev subtyp/divergerande differentiering, grad enligt WHO 1999 och 2016/2022 och patologiskt tumörstadium pT enligt TNM 2017. Förekomst av CIS rapporteras. Iakttagen lymfovaskulär invasion rapporteras.
Radikalitetsbedömning.
Varje lymfkörtelfraktion besvaras separat. Förslag på svarsmall vg se appendix 2.
IX. Administrativt
Tabell 6
a. SNOMED-koder
|
Papillom |
81200 |
|
Inverterat papillom |
81210 |
|
Papillär urotelial neoplasi av låg malignitetspotential, PUNLMP |
81301 |
|
Cacinoma in situ |
81202 |
|
Icke invasiv papillär urotelial cancer |
81302* |
|
Invasiv urotelial cancer grad (konventionell, med divergent differentiering, samt subtyperna nested, large nested, tubulär, mikrocystisk, sarkomatoid, lipid-rik och klarcellig/glykogen-rik cancer) |
81203* |
|
Invasiv urotelial micropapillär |
81313 |
|
Invasiv urotelial lymfoepitelioma-liknande |
80823 |
|
Invasiv urotelial plasmacytoid |
81223 |
|
Invasiv urotelial jättecellscancer |
80313 |
|
Invasiv odifferentierad urotelial cancer |
80203 |
|
Ingen resttumör |
M09451 |
* En sjätte siffra kan anges för att indicera malignitetsgrad enl. WHO 1999 och underlätta uttag av kvalitetsindikatorer (ex M813021 för en icke invasiv papillär cancer grad 1, osv).
b. Kvalitetsindikatorer:
- På biopsier och TUR-B: fördelning av papillom (M81200), PUNLMP (M81301), urotelial cancer in situ (M81202) utan samtidig papillär urotelial cancer eller invasiv cancer, icke invasiv papillär urotelial cancer grad 1 (M813021) /grad 2 (M813022) /grad 3 (M813023), samt invasiv urotelial cancer.
- För cystektomier urotelial cancer indelad efter tumörstadium pTis, pTa, pT1, pT2a, pT2b, pT3a, pT3b, pT4a och pT4b, samt cystektomier utan någon kvarvarande rest av tidigare diagnosticerad cancer (M09451 ingen resttumör)
- Som kvalitetsindikator för kirurgerna är det viktigt att förekomst/frånvaro av detrusor anges i svaret vid biopsier/TUR-B.
X. Övrigt
a. KVAST-gruppens medlemmar
Adresslista till deltagarna i KVAST-gruppen för uropatologi
Viktoria Gaspar (sammankallande)
Medicinsk Service, Labmedicin, Klinisk Patologi,
251 87 Helsingborg
Tel: 042 – 406 33 39
E-mail: Viktoria.Gaspar@skane.se
Christina Kåbjörn Gustafsson
Tel: 0701 45 19 53
E-mail: christina.kabjorngustafsson@gmail.com
Mehriban Yumer
Klinisk patologi, Universitetssjukhuset,
581 85 Linköping
Tel: 01010 33698
E-mail: Mehriban.Yumer@regionostergotland.se
Anca Dragomir
Klinisk Patologi, Akademiska sjukhuset,
751 85, Uppsala
Tel: 018 611 3836
Email: anca.dragomir@akademiska.se
Rita Pedersen
Klinisk patologi och cytologi, Hallands sjukhus Halmstad,
301 85 Halmstad
Tel: 035 131840
E-mail: rita.pedersen@regionhalland.se
Lorand Kis
Unilabs, Capio S:t Göran, klinisk patologi och cytologi,
Vårdvägen 6, 112 91 Stockholm
Tel: 0730410790
E-mail: lorand.kis@unilabs.com
b. Klinisk organisation som granskat och godkänt dokumentet
KVAST-dokumentet är förankrat i den Nationella vårdprogramsgruppen för urinblåsecancer med representation från Svensk Urologisk Förening, Svensk Förening för Urologisk Onkologi samt Svensk Förening för Patologi.
c. Länk till nationellt vårdprogram (NVP)
https://kunskapsbanken.cancercentrum.se/diagnoser/urinblase-och-urinvagscancer/vardprogram
XI. Referenser
Artiklar
Amin MB, Epstein J, Ulbright T et al. Best practices recommendations in the application of immunohistochemistry in the bladder lesions: report from the International Society of Urologic Pathology consensus conference. Am J Surg Pathol. 2014;38: e20-34
Berndl F, Hassler MR. Molecular intricacies of upper tract urothelial carcinoma and their relevance for therapy considerations. Curr Opin Urol. 2022;32: 48-53
Gayhart MG, Johnson N, Paul A et al. Universal mismatch repair protein screening in upper tract urothelial carcinoma. Am J Clin Pathol. 2020;154: 792-801
Grignon D, Brimo F, Comperat E et al. (2018). Carcinoma of the bladder, Histopathology Reporting Guide, 1st edition. International Collaboration on Cancer Reporting; Sydney, Australia. ISBN: 978-1-925687-13-2
Hassler MR, Bray F, Catto J et al. Molecular characterization of upper tract urothelial carcinoma in the era of next-generation sequencing: A systematic review of the current literature. 2020;78: 209-220
Humphrey PA, Moch H, Cubilla AL et al. The 2016 WHO classification of tumours of the urinary system and male genital organs-part B: Prostate and bladder tumours. Eur Urol. 2016;70: 106-119
Magers MJ, Lopez-Beltran A, Montironi R et al. Staging of bladder cancer. Histopathology. 2019;74: 112-134
Rouprêt M, Seisen T, Birtle A et al. European Association of Urology Guidelines on upper urinary tract urothelial carcinoma: 2023 update. Eur Urol. 2023;84: 49-64
Smith SC, Mohanty S, Kunju L et al. Uroplakin II outperforms uroplakin III in diagnostically challenging settings. Histopathology. 2014;65: 132-8
Handböcker
AJCC Cancer Staging Manual 8:e upplaga (2017). Amin MB et al, Springer New York, ISBN 978-3319406176
Biopsy interpretation of the bladder, 3:e upplaga (2017) Epstein et al. Wolters Kluwer ISBN 978-1496315045
Diagnostic Pathology: Genitourinary 2:e upplaga (2016). Amin, & Ticko. Elsevier ISBN 978-0323377140
NT-rådets rekommendation för PD-(L)1-hämmare
https://janusinfo.se/nationelltinforandeavlakemedel/uppfoljning/ntradetsgenerellarekommendationforpdl1hammare.4.64f7f0551764bcaa0af7560.html läst apr 2023
PD-L1 IHC 22C3 pharmDx Interpretation Manual – Urothelial Carcinoma. Agilent Dako.
https://www.agilent.com/cs/library/usermanuals/public/29276_22C3_pharmdx_uc_interpretation_manual_us.pdf läst apr 2023.
PD-L1 IHC 28-8 pharmDx Interpretation Manual - Urothelial Carcinoma. Agilent Dako.
https://www.agilent.com/cs/library/usermanuals/public/29491en-eu-d70793-pd-l1-ihc-28-8-uc-interpretation-manual.pdf läst apr 2023.
TNM Classification of Malignant Tumours. 8:e upplaga (2017), UICC. Wiley-Blackwell Oxford, ISBN 978-1119263579.
Urologic Surgical Pathology 4:e upplaga (2019). Cheng, Maclennan, & Bostwick, Elsevier, ISBN 978-0-323-54941-7.
Urological Pathology (2013). Amin et al, LWW, ISBN 9780781782814
VENTANA PD-L1 (SP142) Assay Interpretation Guide for Urothelial Carcinoma. Roche. https://diagnostics.roche.com/content/dam/diagnostics/us/en/products/v/ventana-pd-l1-sp142-assay/VENTANA-PD-L1-SP142-IG-UC.pdf läst apr 2023" https://diagnostics.roche.com/content/dam/diagnostics/us/en/products/v/ventana-pd-l1-sp142-assay/VENTANA-PD-L1-SP142-IG-UC.pdf läst apr 2023.
WHO Classification of Tumours Editorial Board, Urinary and Male Genital Tumors, 5:e upplaga (2022), IARC Press, Lyon. ISBN 978-9283245124
WHO Classification of Tumours of the Urinary System and Male Genital Organs 4:e upplaga (2016). IARC Press, Lyon. ISBN 978-9283224372
Webbadresser
Ett par normerande bilddatabaser har upprättats med hjälp av internationella experter:
https://isupweb.org/pib-bladder-papillary-lesions/category/public-cases
https://isupweb.org/pib-bladder-flat-lesions/category/public-cases
Appendix 1. Immunhistokemiska färgningar
Det finns ingen ideal markör eller etablerad panel för att bekräfta urotelial differentiering.
Positivitet för GATA3, CK7, CK20, p63 och HMWCK eller CK5/6 samt Uroplakin är till hjälp för att bevisa urotelialt ursprung om tumörens morfologi och klinik passar. Urotelial cancer är en av de få tumörer som ofta visar coexpression av CK7 och CK20 (50–62%).
Upp till 14 procent av urotelial cancer uttrycker dock varken CK7 eller CK20.
GATA3 kärnfärgning och positiv i de flesta uroteliala carcinom (75%)
CK7 cytoplasmatisk infärgning och positiv i nästan alla uroteliala carcinom (90%)
CK20 cytoplasmatisk infärgning och positiv i uroteliala carcinom (60%)
P63 kärnfärgning och positiv i de flesta uroteliala carcinom (80%)
HMWCK cytoplasmatisk infärgning och positiv i uroteliala carcinom (34βE12) (69%)
CK5/6 cytoplasmatisk infärgning och positiv i uroteliala carcinom (50%)
Uroplakin Uroplakin 2 är positiv i uroteliala carcinom (63–73%).
Uroplakin 3 rekommenderas ej.
Vid behov kan desmin ev som dubbelfärgning med CK AE1/AE3 vara av hjälp för att skilja muskulatur från desmoplastiskt stroma. Desmin skiljer inte muscularis mucosae från muscularis propria men infärgningen tydliggör muskulaturens tjocklek och lokalisation och kan vara av hjälp.
Differentialdiagnoser
Urotelial cancer versus skivepitelcancer
Urotelial cancer uppvisar till stora delar liknande immunprofil som skivepitelcancer (CK5/6, p63, CK7, GATA3). Morfologin är avgörande. CK14 (cytoplasmatisk infärgning) är dock mer selektivt uttryckt vid skivepitelcancer jämfört med urotelial cancer.
Urotelial cancer versus prostatacancer
GATA3 och p63 är positiva i urotelial cancer och negativa i prostatacancer. Prostein och NKX3.1 är positiva i prostatacancer och negativa i urotelial cancer. PSA är oftast negativ i urotelial cancer, men kan även vara negativ i höggradig prostatacancer. CK7/20 är positiva vid urotelial cancer, men kan även vara positiva vid höggradig prostatacancer och rekommenderas inte för differentialdiagnostik mellan dessa diagnoser då överlappningen av färgningsutfallet är alltför stor.
Urotelial cancer med glandulär differentiering versus primärt adenocarcinom.
Urotelial cancer med glandular differentiering måste skiljas från urotelial cancer med pseudoglandulär arkitektur. Urotelial cancer med glandulär differentiering och primärt adenocarcinom i urinblåsa visar varierande positivitet för CK20 och CK7. CDX2 är positiv i adenocarcinom och negativ i urotelial cancer.
Primärt adenocarcinom versus colorectalt adenocarcinom.
På grund av överlappande immunprofil är immunhistokemi inte av stor hjälp och kliniken är helt avgörande. Colorectalt adenocarcinom och primärt adenocarcinom är i de flesta fall positiva för CK20 och CDX2 samt negativa för CK7. β-catenin kan användas för att skilja dessa åt, då colorectalt adenocarcinom visar, utöver membranös infärgning, även stark kärninfärgning (70%). Primärt adenocarcinom i urinblåsa och urotelial cancer med glandulär differentiering visar stark β-catenin membranös och möjligen cytoplasmatisk infärgning, men ingen kärninfärgning.
Urotelial cancer versus cervixcancer
Immunhistokemi har begränsat värde i detta sammanhang. Klinik och radiologiska fynd är avgörande. p16 uttrycks ofta både i primär skivepitelcancer och skivepitelcancer i cervix. Om HPV associerad cervikal skivepitelcancer övervägs kan HVP analys (in situ hybridisering eller PCR) vara till hjälp.
Appendix 2. Förslag på svarsmall för cystektomi
MAKROSKOPISK BEDÖMNING
Typ av preparat: Cystektomi/ Cystoprostatektomi
Ev andra organ:
Resektatets storlek (cm): Alla organ.
Tumörbeskrivning: antal tumörer, lokalisation, tumörstorlek (den största tumören), ev infiltration, ärrområde.
Makroskopiskt överväxt till annat organ: ja/nej
Färgmarkeringar av patolog:
Ev andra fraktioner: t ex lgl
Övriga fynd:
Fotodokumenterat: ja/nej
MIKROSKOPISK BEDÖMNING
Tumör histologisk typ och ev. subtyp/divergerande differentiering (WHO 2022)
Tumör grad:
Tumörbeskrivning:
Invasion: (ange om invasiv i lamina propria, detrusor, perivesikalt, andra organ)
Resektionsränder: pos/neg (uretär, uretra, cirkumferentiell)
Kärlinväxt: påvisad/ej påvisad
Övriga relevanta histologiska fynd: (Tis, tecken på tidigare behandling)
Andra organ:
Ev andra fraktioner t ex lgl: antal undersökta och antal med metastas, storlek på den största metastasen, förekomst av extrakapsulär växt.
pTNM:
Exempel på diagnostext:
Urinblåsa med detrusorinvasiv papillär urotelial cancer grad 3 (höggradig), (y)pT2a. Radikal excision.
Urinvägscytologi
Svensk förening för klinisk cytologi - Svensk förening för klinisk patologi
Dokumentnamn: Urinvägscytologi. Dok.nr: v3
Framtaget av: KVAST-Exfoliativ Cytologi. Utgåva: Version 2024. Fastställt: 2024-03-06
Riktlinjer för omhändertagande och besvarande av urinvägscytologi utformade av KVAST (Kvalitets- och standardiseringsgruppen inom Svensk Förening för Klinisk Cytologi)
I. Innehållsförteckning
- Innehållsförteckning
- Klinisk bakgrundsinformation
- Anvisningar för provtagarens hantering av prover
- Anamnestisk remissinformation
- Hantering av prover på patologlaboratoriet/Utskärningsanvisningar
- Analyser
- Rekommenderade klassifikationssystem
- Information i remissens svarsdel
- Administrativt
- SNOMED-koder
- Equalis
- Kvalitetsindikatorer
- Övrigt
- KVAST-gruppens medlemmar
- Klinisk organisation som granskat och godkänt dokumentet
- Referenser, Artiklar & Handböcker
II. Klinisk bakgrundinformation
Det upptäcks ca 3600 nya fall av urinvägscancer i Sverige varje år. Symptomen är vanligen makroskopisk hematuri. Detta ger anledning till utredning av urinvägarna med cystoskopi. I den kliniska rutinen ingår provtagning från kastad urin, blåssköljvätskor, biopsitagning och TUR-B. Det är vanligt att man följer patienter med tidigare blåscancer med regelbundna blåssköljvätskor eller kastad urin.
Carcinoma in situ (Tis) ter sig ofta kliniskt som en rodnad i urinblåsan. Icke-BCG-responsiv och BCG-refraktär Tis leder oftast till cystektomi, då naturalförloppet leder till invasiv tumör i ca 50 % av fallen inom 5 år. Det är då av yttersta vikt att man är så säker man kan på diagnostiken men också försiktig i sin tolkning. Behandling med BCG eller Mitomycin av ytliga tumörer och Tis är rutin i kliniken. Det kan ibland ge cytologiska reaktiva ”atypier”.
Uroteliala tumörer är oftast papillärt strukturerade. De kan graderas enligt en 3gradig skala eller i en 2-gradig skala i samråd med kirurgen på tillhörande klinik, se tabell längre ner. Uroteliala tumörer kan ha väldigt olika utseende och i cirka 30–40 procent av fallen finns inslag av skivepiteldifferentiering.
Vid gradering av urotelial cancer används WHO 99/2004 men ett standardiserings-system kallat Paris-systemet används alltmer internationellt och rekommenderas nu även i Sverige. Detta avhandlas lägre ner under VII.
III. Anvisningar för provtagarens hantering av provet
Provet kan tas från sköljvätska eller kastad urin. Om kastad urin används bör den första portionen inte användas och provet bör inte tas omedelbart efter cystoskopin eller annan instrumentering. Redan vid provtagningstillfället ska man ha vetskap om vilken analysmetod som används på tillhörande patologi/cytologilaboratorium. Här kan det variera med mängden vätska och fixeringsmetod. Prov kan inkomma ofixerade för att sedan fixeras på lab eller redan fixerade med exempelvis 50 procent etanol 1:1, metanol/ättiksyra 1:1 eller CytoRichRed beroende av prepareringsmetod. Fixering är viktigt om man senare vill göra kompletterande utredningar ex FISH-analys
IV. Anamnestisk remissinformation
Typ av prov
Indikation för provtagning
Tidigare tumörer
Klinisk information om cystoskopisk bild, rodnad, tumör
Tidigare behandlingar med BCG/Mitomycin eller tidigare genomgången strålbehandling
Tidigare kirurgiskt ingrepp
V. Hantering av prover på laboratoriet/anvisningar
- Registrering och färgning
Kontrollera vid uppackning att namn och 10-siffrigt personnummer överensstämmer mellan burk och remiss, sortera enligt gängse rutiner. Färga enligt Papanicolaou (se metodbeskrivning på EQUALIS hemsida) Kontrollera vid etikettering att namn, personnummer och registreringsnummer på remiss överensstämmer med glas och etikett. Fel och brister i remiss- och glasmärkning dokumenteras. Kontrollera prepareringen varje färgningsdag. Preparering och analysmetod kan variera på laboratorierna, vilket speglas av den mängd vätska och fixeringsmetod som används. Syftet med alla prepareringsvarianter från vätskeprover är att anrika celler för mikroskopisk diagnostik. KVAST-gruppen rekommenderar i nuläget ingen teknik framför en annan även om vätskebaserad teknik ger möjlighet till ancillära tekniker såsom FISH. - Utstryk
Centrifugering av prov och där pektin tillsätts supernatanten. Utstryk på glas. - Vätskebaserad teknik
En större mängd sköljvätska som kan vara ofixerad eller fixerad med specifik fixeringsvätska inkommer till lab. Denna vätska koncentreras sedan till ca 20 mL som används för analys. Alternativt kan provet centrifugeras och pelleten slammas upp i Preserve Cyt (20 mL) eller CytoRrich Red (50 mL), varefter glas prepareras. - Millipore filterteknik
Montering av filter på glas som fortfarande används på en del laboratorier och som har en del fördelar ffa vad gäller cellgrupper som lägger sig i filterdjupet. - Filterimprint
Vätskan körs genom ett filter därefter avtryck på glas - Megafunnel
Prov appliceras i tratt som vid cytospin hamnar på glas. - Cellblock
Fragment i vätskan bäddas i paraffin.
VI. Analyser
Rutiner för diagnostik
Kontrollera att numret på glasetiketten överensstämmer med remissen (i tillämpliga fall med streckkodsläsare). Kontrollera att antalet glas och deras märkning överensstämmer med noteringen på remissen.
Granskning
CD förgranskar preparatet. På särskild delegation kan CD besvara vissa prover men annars lämnas fallet med diagnosförslag till läkare. Även i benigna prover kan information om blod 4 och inflammation vara viktig. Översiktsbedömning: Översiktsbedömning av materialet med objektiv x4 eller x10 beträffande allmän bedömbarhet, inflammation och blod. Granskning av Cytodiagnostiker, CD: Granska med objektiv x10 glaset överlappande från glasets ena kant till den motsatta. Överlappa med c a 20 procent. Markeringar: Markera atypiska celler med stämpel eller tusch. Markeringarna skall vara representativa för diagnosförslaget. Undvik alltför många markeringar och utmärk de mest uttalade förändringarna med ”vinge” eller svans.
Bedömbarhet
Det cytologiska provsvaret ska i förekommande fall innehålla uppgifter om varför ett prov är ”obedömbart”. Urinvätska är i princip alltid bedömbar.
Bedöm graden av inflammation.
Bedöm förekomst av erytrocyter.
Bedöm förekomsten av urotelceller.
Bedöm förekomsten av atypiska celler.
Diagnostiska kriterier
Papillom/LMP/ Urotelial tumör grad 1 – kan vanligen inte bedömas då de cellulära atypierna är ringa. Ibland förekommer fragment av papillära strukturer med fibrovaskulärt stroma (ssk viktigt vid kastad urin) som kan ge ledtråd till denna diagnos.
Urotelial tumör grad 2 – Måttliga atypier i uroteliala celler. Kärnhyperkromasi. Kärnfåror.
Urotelial tumör grad 3/CIS – grava atypier i uroteliala celler som ofta ligger dissocierade. Starkt förhöjd kärn/cytoplasmakvot, hyperkromasi, kärnstorleksvariation, kärnfåror.
Skivepitelcancer – starkt avvikande skivepiteldifferentierade celler, dyskeratotiska celler, tadpole-fenomen.
Adenocarcinom – körteldifferentierade celler, pleomorfa cellkärnor med distinkta nukleoler och cytoplasma ofta med vakuoler.
VII. Rekommenderade klassifikationssystem
För histologisk indelning av blåstumörer ska senaste WHO-klassifikation användas: WHO Classification of Tumors of the Urinary System and Male Genital Organs 2022.
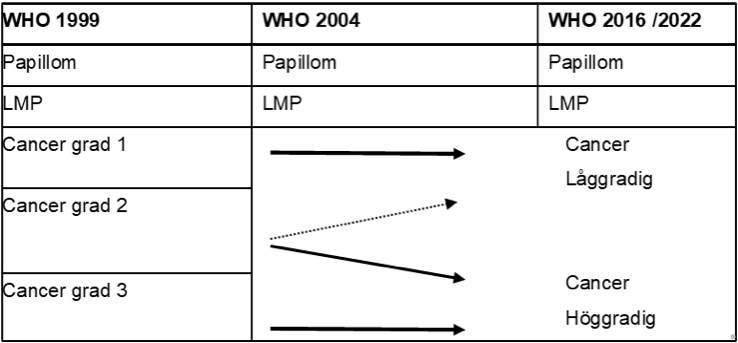
Enligt internationella rekommendationer graderas urotelial cancer enligt WHO 2004 (ISUP 1998) och 2022: PUNLMP, låggradig och höggradig cancer. För att möjliggöra historiska jämförelser och tillgodose det kliniska behovet att följa nu gällande vårdprogram bör man dessutom dela upp höggradig urotelial cancer enligt WHO 2004 i grad 2 och 3 enligt WHO 1999.
Se nedanstående tabell
WHO-gradering
Paris klassificeringssystem – Svensk version för kategorisering av cytologiska preparat från urinvägarna.
Diagnostiken är oförändrad men Paris innebär kategorisering numer i 6 kategorier.
Diagnosrad: beskrivande text, Paris 1–6.
Exempel:
Blåssköljvätska utan atypi, Paris 2.
Kastad urin utan belägg för maligna uroteliala celler, Paris 2.
Betydelse av Paris i respektive kategori
Paris 1 - otillräckligt material eller otillfredsställande
Paris 2 - inga hållpunkter för höggradiga maligna uroteliala celler
Paris 3 – urotelial cellatypi
Paris 4 – misstanke på höggradiga maligna uroteliala celler
Paris 5 – höggradiga maligna uroteliala celler
Paris 6 – maligna celler av annan typ av malignitet, specificera om möjligt.
Allt som bedöms som reaktivt pga inflammation, svamp eller behandling besvaras som Paris 2.
Skivepitelatypier, körtelcellsatypier och oklara atypier (skall undvikas) faller inom Paris 6.
Prov som saknar cellinnehåll, labbtekniska problem faller inom ramen för Paris 1.
VIII. Information i remissens svarsdel
Läs informationen på remissen. Vid hematuri besvara om möjligt förekomst av erytrocyter och grad av inflammation, vilket kan vara en hjälp till att förklara den kliniska bilden. Gradering i WHO 2 eller 3 vid cytologi är inte fokus i den nya klassificeringen enligt Paris då både grad 2 och 3 hamnar i Paris 5.
Ex:
Kastad urin otillräcklig för diagnos, Paris 1.
Blåssköljvätska utan atypi, Paris 2.
Kastad urin med urotelial cellatypi, Paris 3.
Blåssköljvätska med maligna uroteliala celler, Paris 5.
Kastad urin med höggradiga maligna uroteliala celler, Paris 5.
IX. Administrativt
a. SNOMED-kodning
Datarutiner måste anpassas så att risken för felrapportering minimeras och adekvata svar skall genereras i klartext, inte som kod eller siffra.
SNOMED-kodning enligt nationellt överenskommen nomenklatur
T74 urinblåsa
T73 uretär
T72 njurbäcken
T7X100 kastad urin
M001 normal morfologi
M69730 urotelial cellatypi
M81203 1, 2, 3 urotelial cancer, grad 1, grad 2, grad 3
M09450 inga hållpunkter för malignitet
M73220 skivepitelmetaplasi
M69710 skivepitelatypi
M80703 skivepitelcancer
M81403 adenocarcinom
b. Equalisutskick
Varje laboratorium deltar i enligt med Equalis instruktioner.
c. Kvalitetsindikatorer
Det finns ingen given andel för hur stor mängd av proverna som bör vara normala eller avvikande. Man bör dock följa diagnostiken årligen för att se om stringensen i diagnostiken av atypiska uroteliala celler ökar eller minskar enligt:
M00100, M00110 normal morfologi
M69700 Atypi UNS – bör användas mycket sparsamt, reaktiva förändringar är ingen äkta atypi. M69730 Urotelial cellatypi
M81203 Urotelial cancer 1, 2, 3
X. Övrigt
a. KVAST-arbetsgrupp exfoliativ cytologi
var god se KVAST exfoliativ cytologi på Svensk Förening för Patologis hemsida, svfp.se
b. Klinisk organisation som granskat och godkänt dokumentet
Svensk Förening för klinisk Urologi
Länk till nationellt vårdprogram:
https://doi.org/10.1007/978-3-030-88686-8
XI. Referenser
Artiklar och handböcker:
The Paris system for reporting urinary cytology. Dorothy L. Rosenthal, Eva M. Wojcik, Daniel F.I. Kurtycz Springer, 2022 https://doi.org/10.1007/978-3-030-88686-8
A review of the Paris system for reporting urinary cytology. Vanden Bussche, C. J. Cytopathology Vol 27:3 http://dx.doi.org/10.1111/cyt.12345
The 2022WHO classification of tumours of the urinary system and male genital organs Part B: Prostate and bladder tumours. Holger Moch, Mahul B. Amin, Daniel M. Berney, Eva M. Compérat, Anthony J. Gill, Arndt Hartmann, Santosh Menon, Maria R. Raspollini, Mark A. Rubin, John R. Srigley, Puay Hoon Tan, Satish K. Tickoo, Toyonori Tsuzuki, Samra Turajlic, Ian Cree, George J. Netto
Urinary Cytology Manual and Atlas 1993, Rathert, Peter, Roth, Stephan, Soloway, Mark S.
