Primär behandling
Blåscancer
Primär behandling av nyupptäckt blåstumör har i decennier varit transuretral resektion (TURB), som beroende på patientens ålder, slutgiltigt histopatologiskt utlåtande (grad, invasionsdjup, förekomst av Tis), och övriga tumörkarakteristika (tumörstorlek och antal tumörer) kan behöva kompletteras med ytterligare behandlingsmodaliteter. Hög kvalitet vid utförande av primär TURB är av stor vikt, eftersom den fortsatta behandlingsstrategin bygger på resultatet av operationen och eftersom risken för återfall har ett starkt samband med hur noggrant operationen är utförd. Rekommendationerna för optimalt utförande av TURB ges i bilaga 3. Nedan ges behandlingsrekommendationer med kortfattad bakgrundsinformation baserat på PAD-utlåtande från primär TURB.
Icke-muskelinvasiv blåscancer
Rekommendationer
Tidig endosinstillation bör övervägas i anslutning till TURB vid primär icke-muskelinvasiv blåscancer med låg risk om inte kontraindikationer föreligger (⊕⊕⊕⊕).
Patienter med intermediär risk för progression bör få adjuvant instillationsbehandling för att reducera risken för återfall (⊕⊕⊕⊕), där cytostatikabehandling kan vara att föredra framför BCG med hänsyn till biverkningsprofilen, medan BCG kan vara att föredra om progressionsrisken bedöms signifikant.
BCG-behandling (induktionsbehandling och underhållsinstillationer i minst ett år) bör ges vid tumörer med intermediär till hög risk för progression (TaG3, T1-tumörer och Tis) (⊕⊕⊕⊕).
I utvalda fall kan primär cystektomi vara av värde vid icke-muskelinvasiv blåscancer med hög risk eller mycket hög risk för progression (⊕⊕⊕).
TaG1-G2-tumörer
Rekommendationer
Behandlingsrekommendationerna styrs av beräknad risk för progression enligt EAU:s prognostiska modell från 2021 (bilaga 13).
Låg risk: TURB + eventuellt tidig endosinstillation
Intermediär risk: TURB + eventuellt tidig endosinstillation med cytostatika + intravesikal instillationsserie med cytostatika x 6 (alternativt BCG med underhållsbehandling 12 månader)
Prediktion av progression
Behandling av icke-muskelinvasiv blåscancer styrs av patientens prognos. För att prediktera risk för återfall och progression föreligger flera prognostiska modeller, där gradering enligt WHO 1973 ingår i samtliga. I EAU:s nya prognostiska modell från 2021 ingår gradering med både WHO 2004/2022 och WH0 1973, vilket gör detta system också användbart i den svenska kontexten med gradering enligt både WHO 1999 och WHO 2004/2022. Denna modell baseras på 3401 patienter behandlade med TURB med eller utan adjuvant intravesikal kemoterapi 191 stratifierade för ålder (> 70 år), tumörmultiplicitet (> en tumör), tumörstorlek (tre cm eller större), tumörstadium (T1), samtidig Tis, och tumörgrad (WHO 2004/2022 (HG) respektive WHO 1973 (G1, G2, G3)) i fyra riskgrupper med låg, intermediär, hög och mycket hög risk för progression. För svenska förhållanden görs antagandet att WHO 1999 kan approximeras till WHO 1973, men med speciella hänsyn taget till LMP avseende uppföljning och att LMP riskgrupperas tillsammans med WHO 2004/2022 LG i den prognostiska modellen, där den tregradiga graderingen har ett bättre prognostiskt värde än WHO 2004/2022 185, givet att WHO 1999 approximeras till WHO 1973.
Ytterligare riskfaktorer* i tabellen nedan utgörs av:
- ålder > 70 år
- fler än en tumör
- tumördiameter > 3 cm
Tabell 2. Riskgrupper för progression (gruppering enligt EAU:s prognostiska modell från 2021)
|
Riskgrupp |
|
|
Låg risk |
En enstaka, Ta/T1 LG/G1 tumör ≤ 3 cm i diameter utan Tis hos en patient ≤ 70 år |
|
En enstaka Ta LG/G1 tumör utan Tis med som mest en av de kliniska riskfaktorerna ovan* |
|
|
Intermediär risk |
Patienter utan Tis som varken ingår i låg, hög eller mycket hög risk-grupperna |
|
Hög risk |
|
|
Stadium, grad med ytterligare kliniska riskfaktorer
|
|
|
Mycket hög risk |
Stadium, grad med ytterligare kliniska riskfaktorer
|
Ovanstående modell innefattar inte patienter med primär Tis eller recidiverande tumörer, liksom andra patologiska faktorer som ökar risken för progression som histologisk subtyp, kärlinväxt, Tis i prostatiska uretra. Patienter med recidiverande tumörer kan inkluderas i grupperna med intermediär, hög och mycket hög risk utifrån övriga prognosfaktorer. Sannolikheterna för progression i respektive riskgrupp efter 1, 5 och 10 års uppföljning anges i tabellen nedan. Automatisk beräkning av progressionsrisk med hjälp av elektronisk kalkylator finns på nmibc.net.
Tabell 3. Progressionsrisk enligt EAU:s prognostiska modell från 2021
|
Riskgrupp |
Sannolikhet för progression med 95% konfidensintervall |
||
|
|
1 år |
5 år |
10 år |
|
Med WHO 2004/2016 |
|||
|
Låg risk |
0.06% |
0.93% |
3.7% (CI: 2.3%-5.9%) |
|
Intermediär risk |
1.0% |
4.9% |
8.5% (CI: 5.6%-13%) |
|
Hög risk |
3.5% |
9.6% |
14% (CI: 11%-18%) |
|
Mycket hög risk |
16% |
40% |
53% (CI: 36%-73%) |
|
Med WHO 1973 |
|||
|
Låg risk |
0.12% |
0.57% |
3.0% (CI: 1.5%-6.3%) |
|
Intermediär risk |
0.65% |
3.6% |
7.4% (CI: 5.5%-10%) |
|
Hög risk |
3.8% |
11% |
14% (CI: 10%-19%) |
|
Mycket hög risk |
20% |
44% |
59% (CI: 39%-79%) |
Kalkylator för beräkning av progressionsrisk finns också för mobil app på följande länkar:
Låg risk
Patienter med TaG1 tumör har mycket låg risk för progression till muskelinvasion (< 5 procent) och död i blåscancer, men en betydande risk för återfall. Tidig endosinstillation med kemoterapi som kan ges i samband med TURB har utvärderats i ett antal prospektiva studier och metaanalyser 192193. Nyligen publicerades resultaten av den hittills största jämförande studien som innefattade en planerad subgruppsanalys efter riskkategori där den relativa riskreduktionen var 27 procent (motsvarande 9 procent absolut riskreduktion) efter tre års uppföljning 194. Det föreligger sannolikt inte något tilläggsvärde av PDD/NBI i samband med TURB till tidig endosinstillation för att ytterligare reducera risken för recidiv 124. Förutom tidig endosinstillation har postoperativt spoldropp med koksalt eller sterilt vatten visat sig kunna reducera risken för återfall 193195.
Angående betydelsen av hur TURB genomförs och värdet av checklista i samband med operationen och risken för komplikationer och tumörrecidiv, se bilaga 3.
Intermediär risk
Hos patienter med intermediär risk för progression enligt EAU:s prognostiska modell rekommenderas tilläggsbehandling med 6 doser intravesikal cytostatikabehandling, en gång i veckan med start 2–4 veckor efter TURB (bilaga 5). Även om BCG-behandling anses vara det mest effektiva preparatet för att minska förekomsten av återfall 196197198199200, ger BCG upphov till väsentligt högre frekvens av biverkningar än mitomycin 201. Om risken för progression för en enskild individ i intermediärriskgruppen bedöms som hög, rekommenderas däremot BCG med underhållsbehandling i 12 månader. Vid upprepade återfall trots mitomycinbehandling rekommenderas adjuvanta BCG-instillationer som second-line med start 24 veckor efter TURB 202. Användande av PDD i samband med TURB ersätter inte behovet av adjuvant instillationsserie med kemoterapi vid intermediärrisksjukdom 123.
En specialutbildad sjuksköterska med för ändamålet lämplig kompetens bör utföra instillationsbehandlingen och utvärdera eventuella symtom och bieffekter efter given behandling samt vara uppmärksam på behandlingsbiverkningar som kan föranleda en förändring i behandlingsplanen.
Hög risk och mycket hög risk
Rekommendationer
Vid stadium T1 rekommenderas re-resektion av tumörbärande område om inte primär cystektomi är aktuellt utifrån prognostisk information redan efter primärresektionen (⊕⊕⊕).
För patienter i EAU:s högriskgrupp rekommenderas BCG-instillationer (6+3+3+3) med underhållsbehandling minst 12 månader (⊕⊕⊕).
I gruppen med mycket hög risk enligt EAU:s prognostiska modell bör radikal cystektomi övervägas alternativt BCG-instillationer med underhållsbehandling minst 12 månader (⊕⊕).
Denna patientgrupp har enligt EAU:s prognostiska modell betydande risk för progression till muskelinvasiv sjukdom (bilaga 13). Det är viktigt att komma ihåg att det finns en risk för understaging, dvs. att patienten faktiskt har en muskelinvasiv tumör trots att PAD-utlåtandet visar T1-tumör, vilket kan förekomma i upp till 10 procent av fallen 203. Flera studier har dessutom visat att patienter med T1-tumör som genomgår en kontrollundersökning 4–6 veckor efter TURB i mer än hälften av fallen har kvartumör i blåsan 204. Generellt rekommenderas därför re-resektion inom 2–6 veckor efter primär TURB i dessa fall (T1-tumörer) för att minska risken för missad muskelinvasion och för att säkerställa att blåsan är tumörfri, vilket minskar risken för progression 205. Däremot är re-resektion inte nödvändigt vid primärt radikalt resekerad TaG3-tumör om muskel finns med i resektatet 206207. Vid re-resektion ska alltid resektionsbiopsier tas från området där primärtumören förelåg. Vid re-resektion bör patienten också genomgå mapping-biopsier (alternativt PDD/NBI-assisterad provtagning) från blåsslemhinnan och prostatiska uretra om detta inte har gjorts i samband med primär TURB, eftersom konkomitant Tis eller tumörväxt i prostatiska uretra påverkar handläggningen.
I frånvaro av kvarvarande T1-tumör vid re-resektion (då en ny re-resektion (sk. ”third look”) kan övervägas om blåsbevarande behandling planeras) 161208209 och ingen muskelinvasiv tumör diagnosticeras vid re-resektionen, rekommenderas intravesikal BCG-behandling. Induktions-BCG-behandling ges en gång i veckan i 6 veckor, men under de senaste åren har ett antal studier visat att underhållsbehandling (maintenance) i åtminstone ett år ger lägre återfallsfrekvens 206210211212213. I en prospektiv randomiserad multicenterstudie förelåg ingen skillnad i progression, och endast en liten skillnad i återfallsfri överlevnad sågs mellan ett års och tre års underhållsbehandling med BCG (59 respektive 64 procent) vid sjuårsuppföljning 213. I detta vårdprogram rekommenderas därför att ge induktionsbehandling med BCG och ytterligare 3 instillationer en gång i veckan, 3 månader, 6 månader och 12 månader räknat från start av induktionsbehandling (sammanlagt 15 instillationer) (se nedan och bilaga 5).
- Induktions-BCG ges en gång i veckan i 6 veckor.
- Kontrollcystoskopi + cytologi utförs 6 veckor efter avslutad behandling (cystoskopi med biopsi behövs inte vid negativ cystoskopi och kastad urincytologi 214.)
- Underhålls-BCG ges en gång i veckan i 3 veckor vid negativ cystoskopi och kastad urincytologi vid 3, 6 och 12 månader efter induktionsbehandlingen.
- Om det finns kvarvarande Tis vid kontroll kan ytterligare en induktionsbehandling med BCG x 6 övervägas (se nedan angående återfall efter BCG).
Viktiga riskfaktorer för progression vid T1-tumör är stor tumör (> 3 cm), multipla T1tumörer, kvarvarande T1-tumör vid re-resektion 215(då en ny re-resektion (sk. ”third look”) kan övervägas om blåsbevarande behandling planeras), djup infiltration av lamina propria 161208209 eller en endoskopiskt svåråtkomlig tumör.
Tumör i divertikel är ett specialfall. Pga. avsaknad av detrusormuskel i blåsdivertiklar har en divertikeltumör med invasion av lamina propria mycket stor risk för underskattning av tumörstadium 216.
Bland övriga riskfaktorer för progression som oberoende av EAU:s prognostiska modell var och en innebär en mycket hög risk för progression är tumörinväxt i kärl 209 och histologisk subtyp såsom t.ex. mikropapillär, nested (inklusive storcellig nested), småcellig/neuroendokrin, plasmocytoid, och sarkomatoid histologisk subtyp 209 (se tabell nedan). Tis i prostatiska uretra innebär också en påtaglig och mycket stor risk för progression 217.
Femårsöverlevnaden efter primär cystektomi för patienter med T1-sjukdom överstiger 80 procent 218. Konkomitant Tis i blåsan ökar risk för att sådan tumör också föreligger i uretärer eller uretra som inte påverkas av blåsinstillationer. Vid blåsbevarande behandling måste därför även dessa lokaler monitoreras, varför kastad urincytologi har fördelar jämfört med blåssköljvätska vid uppföljning framför allt av denna patientgrupp med hög risk för progression 218.
|
Riskfaktorer för progression vid T1-tumör |
|
Stor T1-tumör (> 3 cm) |
|
Multipla T1-tumörer |
|
Kvarvarande T1-tumör vid re-resektion |
|
Kärlinväxt |
|
Djup inväxt i lamina propria (T1e) |
|
Tumör svåråtkomlig för resektion och tumör i divertikel |
|
Ogynnsam histologisk subtyp (mikropapillär, nested inklusive storcellig nested, småcellig/neuroendokrin, plasmocytoid, sarkomatoid m fl) |
|
Konkomitant Tis, speciellt i prostatiska uretra |
Återfall efter BCG-behandling
Rekommendationer
För icke-BCG-responsiv respektive BCG-refraktär blåscancer rekommenderas radikal cystektomi (⊕⊕).
Patienter med höggradigt (G3) lokalrecidiv efter BCG-instillationer, speciellt de med icke-BCG-responsiv sjukdom, bör bli värderade på MDK (⊕⊕).
|
Höggradigt återfall i samband med eller efter BCG-behandling av högrisk icke-muskelinvasiv blåscancer |
|
BCG-refraktär sjukdom |
|
|
|
|
|
Återfall efter avslutad underhålls-BCG |
|
|
Icke-BCG-responsiv sjukdom 219 |
|
|
Det föreligger olika kategorier med höggradigt tumöråterfall efter BCG-behandling, och tabellen ovan åskådliggör kategorierna BCG-refraktär, återfall efter avslutad underhålls-BCG-behandling, icke-BCG-responsiv sjukdom, och BCG-exponerad tumör under/efter behandling av icke-muskelinvasiv blåscancer. Låggradigt tumöråterfall efter BCG-instillationer betraktas ej som svikt på BCG-behandling. Definitionen av icke-BCG-responsiv sjukdom har föreslagits för att definiera en population där ytterligare BCG är associerat med ökad risk för progression och radikal cystektomi därför utgör primär behandlingsrekommendation 219. Eftersom progressionsrisken är ökad 223224 hos patienter med kvarvarande framför allt höggradig eller lamina propria-invasiv tumör efter en induktionsbehandling (BCG-refraktär sjukdom), bör tidig cystektomi också diskuteras med dessa patienter. Patienter med Tis vid första kontroll efter BCG-behandling kan i upp till 50 procent av fallen fortfarande svara på ytterligare BCG-behandling 225226, men om Tis eller exofytiskt återfall upptäcks vid den första kontrollen efter ytterligare en induktionsbehandling med BCG x 6, betraktas patienten också som icke-BCG-responsiv och bör därför rekommenderas cystektomi. För att ytterligare kategorisera patienter som inte uppfyller kriterier för icke-BCG-responsiv sjukdom (rödmarkerade fält) med höggradigt återfall i relation till föregående BCG-behandling, har BCG-exponerade patienter föreslagits en ny stratifiering enligt figuren nedan 222, för att definiera kliniska situationer där randomiserade studier med ytterligare behandlingsförsök med BCG som komparator är indicerade.
Figur 7.Höggradigt återfall efter BCG
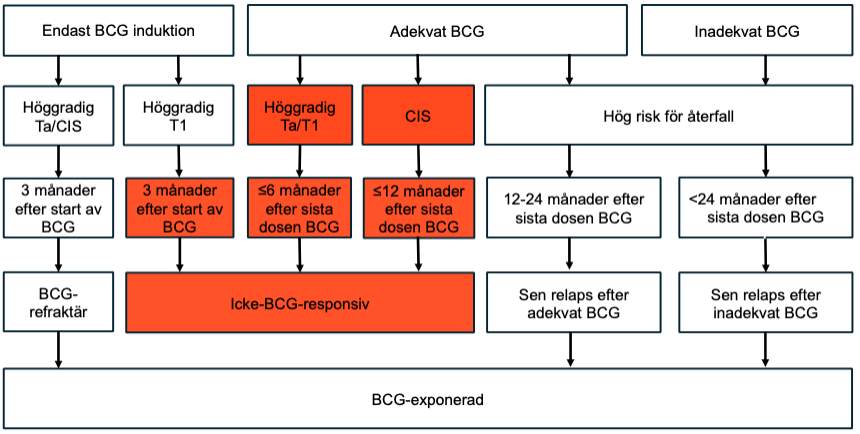
För patienter som återfaller sex månader eller senare efter avslutad underhålls-BCG-behandling med TaG3/HG eller Tis kan både radikal cystektomi och förnyad induktions-BCG-behandling övervägas (BCG-exponerad tumör). I en nypublicerad randomiserad studie (HYMN) randomiserades patienter med återfall efter induktion/underhålls-BCG mellan förnyad induktions-BCG och radiofrekvens-inducerade hyperterma mitomycininstillationer, där patienter med enbart papillär tumör hade samma sjukdomsfria överlevnad i bägge armarna (HR 0.50 (0.2–1.2), medan för de med samtidig Tis och papillär tumör var den experimentella behandlingen sämre (HR 2.1 (1.2–3.6) 227.
Möjligheten för framgångsrik ytterligare blåsbevarande behandling efter BCG-behandling är större i frånvaro av samtidig Tis 228. Ytterligare intravesikala behandlingar med andra intravesikala och systemiska preparat t.ex. sekventiell instillation med gemcitabin/docetaxel som f.n. prövas i en pågående nationell studie (ISRCTN17499170) 229 och de nyligen FDA-godkända alternativen systemisk pembrolizumab 230, och instillationer med nadofaragen-firadenovac 231. Övriga behandlingar anses vara experimentella och saknar ännu tillräckligt vetenskapligt underlag även om omfattande forskning pågår 232.
Carcinoma in situ (Tis)
Rekommendation
Patienter med primär Tis i urinblåsan rekommenderas BCG-instillationer (⊕⊕⊕⊕)
Att ha Tis i blåsan innebär hög risk för framtida utveckling av infiltrativ cancer 233. I de flesta fallen upptäcks Tis i blåsan tillsammans med en exofytisk tumör (konkomittant Tis) men i mer sällsynta fall har patienterna Tis-lesioner utan andra tumörmanifestationer. BCG är förstahandsbehandling för Tis 234 och tumörformen svarar generellt mycket bra på behandling med BCG; av de som svarar utvecklar endast 10–20 procent muskelinvasiv tumör på lång sikt. Däremot utvecklar 66 procent av de som inte svarar på BCG muskelinvasiv sjukdom 235236.
BCG-behandling bör inledas inom 2–4 veckor efter TURB och ges en gång i veckan i sex veckor. Om den första kontrollundersökningen inte påvisar kvarvarande sjukdom rekommenderas efter induktionsbehandling med BCG ytterligare 3 instillationer en gång i veckan efter 3 månader, 6 månader och 12 månader (sammanlagt 15 instillationer) (bilaga 5).
Precis som vid TaG3- och T1-tumör kan i fall av kvarvarande Tis ytterligare 6 behandlingar med BCG övervägas, eftersom vissa patienter med Tis svarar på behandlingen med fördröjning och därmed kan behöva två induktionsbehandlingar med BCG 226. Vid utebliven behandlingseffekt trots 12 instillationer får sjukdomen betraktas som BCG-refraktär (se tabell ovan) och cystektomi rekommenderas då för patienter utan allvarlig samsjuklighet.
Muskelinvasiv blåscancer (T2–T4b)
Rekommendationer
Patienter med muskelinvasiv blåscancer T2–T4aN0M0 med gott allmäntillstånd (PS 0–1) och god njurfunktion (GFR > 50 ml/min) bör erbjudas neoadjuvant cytostatikabehandling med cisplatin-innehållande kombinationscytostatika upp till 4 cykler och radikal cystektomi (⊕⊕⊕⊕).
Om cisplatin inte kan ges bör prioritet ges till omedelbar cystektomi (⊕⊕⊕⊕).
Fördröjd behandling försämrar överlevnaden (⊕⊕⊕⊕).
Patienter med goda medicinska och biologiska förutsättningar och med lokalt avancerad sjukdom (cT4b) eller begränsad lymfkörtelspridning bör kunna diskuteras på MDK för induktionskemoterapi. Vid remission kan radikal cystektomi/strålbehandling med konsoliderande resektion/strålbehandling av preterapeutiskt påvisad metastas övervägas i enstaka utvalda fall (⊕⊕).
Kurativ behandling
Vid muskelinvasiv blåscancer är standardbehandlingen radikal cystektomi som föregås av neoadjuvant cytostatikabehandling (gäller T2a–T4aN0M0) (se bilaga 8 och bilaga 10). Patientens allmäntillstånd, samsjuklighet och ålder påverkar om sådan radikal kirurgi är möjlig, men dessa faktorer påverkar också omfattningen av kirurgin, t.ex. val av urinavledning. Innan beslut om kirurgi fattas måste därför patientens hälsotillstånd vara klarlagt. Det finns också observationella data som i multivariat analys talar för ett samband mellan samsjuklighet och avancerat patologiskt tumörstadium inklusive sjukdomsfri överlevnad efter radikal cystektomi 237 liksom ett samband mellan ålder och sjukdomsfri överlevnad 238. Med åldern ökar också risken för sjuklighet och dödlighet sekundärt till ingreppet 239240. Det finns i dag rapporterat 15 procent 90-dagarsdödlighet efter radikal cystektomi hos patienter över 80 år 241. Andra indikationer för radikal cystektomi än T2–T4a-tumör är t.ex. BCG-refraktär respektive icke-BCG-responsiv sjukdom och icke-muskelinvasiv sjukdom med mycket hög risk för progression enligt EAUs prognostiska modell. Cystektomi bör genomföras utan fördröjning för att inte försämra överlevnaden efter kirurgin 242.
Ett alternativ till radikal cystektomi är kurativt syftande strålbehandling med eller utan konkomittant kemoterapi 243244 (se nedan).
Vid muskelinvasiv blåscancersjukdom utgör ”ren” urotelial cancer den vanligaste morfologin, men samtidigt inslag av annan morfologi ses hos en av tre patienter 245. Vid förekomst av annan än urotelial morfologi bör patologutlåtandet ange procentuell andel 246. Inslag av annan morfologi kan ha betydelse för prognos men även för val av behandling 247248, t.ex.:
- urotelial cancer med skivepitel, körtel, eller småcellig differentiering
- nested variant
- mikrocystisk
- mikropapillär
- lymphoepitheliom-lik
- plasmocytoid
- storcellig
- lipidrik
- klarcellig (glykogenrik)
- sarkomatoid.
Radikal cystektomi bör övervägas vid skivepitelcancer, adenokarcinom, sarkomatoid cancer, mikropapillär cancer eller nested variant med stadium T1–T4a. Blandad histologi (urotelial cancer med inslag av skivepitel eller körteldifferentiering) har sannolikt samma chans att respondera på neoadjuvant cytostatikabehandling som ren urotelial cancer inför cystektomi 249. Också småcellig/neuroendokrin och mikropapillär cancer kan ha nytta av neoadjuvant kemoterapi, men evidensen för detta är sparsamma 250251. Under senare år har molekylära subtyper vid blåscancer baserat på huvudsakligen RNA-uttryck identifierats 163164. De molekylära subtypernas exakta prognostiska och prediktiva potential återstår att definiera systematiskt liksom deras relation till de ovan beskrivna morfologiska varianterna av urotelial cancer. Även förekomst av kärlinväxt i transuretralt resektionsmaterial ökar risken för lymfkörtelmetastaser och blåscancerdöd 252253254255256 efter radikal cystektomi.
Vid urakuscancer (adenokarcinom utgånget från urakus) är regional lymfkörtelutrymning och blåsresektion aktuellt alternativt radikal cystektomi om detta krävs för att erhålla radikal excision. I en nypublicerad liten retrospektiv studie rapporterades porthålsmetastaser hos 25% av de som opererades med robotassisterad blåsresektion men inga fall av implantationsmetastaser efter öppen blåsresektion 257. För patienter med urakuscancer med peritoneal spridning kan cytoreduktiv kirurgi med hyperterm intraperitoneal kemoterapi (HIPEC) vara aktuell 258259260, varför diagnostisk laparoskopi med cytologi på bukvätska kan vara av värde för att planera den radikala kirurgin 261. Tumörmarkörer i serum kan också vara av värde preoperativt i diagnostiken av urachuscancer och möjligtvis i uppföljningen (t.ex. CEA).
Alla patienter med muskelinvasiv blåscancer bör diskuteras avseende neoadjuvant cytostatikabehandling (se nedan).
Induktionskemoterapi vid lokalt avancerad sjukdom, lymfkörtelmetastaserad sjukdom eller solitär fjärrmetastas
Patienter med lokalt avancerad sjukdom, dvs. bäckenfixerad tumör (T4b), lymfkörtelspridning (N+) eller solitär fjärrmetastas, bör övervägas för induktionscytostatikabehandling med platinumbaserad kombinationskemoterapi, varefter remissionsbedömning efter 3 behandlingar inför ytterligare kemoterapi till maximalt sex preoperativa behandlingar kan göras med syfte till eventuell radikal cystektomi och konsoliderande extirpation av samtlig preterapeutiskt påvisad spridning vid behandlingsrespons 262263264265. Retrospektiva data talar för att kemoterapi före kirurgi ger bättre överlevnad än primär kirurgi 266267268. Det finns också hypotesgenererande data som stödjer användandet av FDG-PET-DT för att monitorera respons på sådan induktionscytostatikabehandling 115116117118. Samtidig bäckenfixerad tumör (cT4b) och cytologiskt verifierad lymfkörtelspridning (N+) innebär sannolikt små möjligheter för bot, men inga klara riktlinjer finns för denna patientgrupp. För patienter med nedsatt njurfunktion, där cisplatinbaserad kombinationskemoterapi som induktionsbehandling för icke-organbegränsad tumör inte är möjlig, finns komplett patologisk respons rapporterat i samma omfattning med kombinationen karboplatin-gemcitabin (30 respektive 33 procent) 269 inklusive långtidsbot 270271.
Neoadjuvant cytostatikabehandling
Drygt 50 procent av de patienter som opererats med radikal cystektomi får återfall lokalt och/eller med fjärrmetastaser, vilket avspeglar en hög förekomst av mikrometastaser vid tidpunkten för kirurgi 272273274275. Syftet med perioperativ (neoadjuvant/adjuvant) cytostatikabehandling är att eliminera systemisk mikrometastasering och förbättra den sjukdomsfria överlevnaden.
Fördelen med neoadjuvant cytostatikabehandling är att den ges vid en tidpunkt då den mikrometastatiska tumörbördan förväntas vara låg och patientens allmäntillstånd samt tolerabilitet av cytostatika är bättre jämfört med efter operationen. Detta förbättrar möjligheterna till dosintensiv cytostatikabehandling och därmed möjligheten att eliminera eventuella mikrometastaser och samtidigt uppnå en gynnsam downstaging av primärtumören 276. Nackdelen med neoadjuvant cytostatikabehandling är potentiell överbehandling av lågriskpatienter och fördröjd kirurgi för patienter med tumörer som inte är känsliga för kemoterapin. Det finns dock ingen säkerställd skillnad i fördelningen av postoperativa komplikationer för patienter som erhållit neoadjuvant cytostatikabehandling jämfört med enbart cystektomi 277. Cystektomi utförs ungefär 4 veckor efter avslutad neoadjuvant behandling, så fort patientens allmäntillstånd och övriga parametrar tillåter.
Det finns stark evidens för användande av neoadjuvant cisplatin-innehållande kombinationskemoterapi inför kurativ behandling (cystektomi eller kurativ strålbehandling) av muskelinvasiv blåscancer. Tre metaanalyser av individuella patientdata från randomiserade studier visar 5 procents förbättrad överlevnad hos patienter som fått neoadjuvant cytostatikabehandling inför cystektomi eller strålbehandling 278279280. I ytterligare en global randomiserad fas III-multicenterstudie förbättrades tioårsöverlevnaden från 30 procent till 36 procent för de patienter som fick neoadjuvant cytostatikabehandling före kurativt syftande radikal kirurgi eller strålbehandling 281, vilket är kliniskt relevant. De flesta patienter som ingick i dessa studier var yngre än 70 år, hade performance status (PS) 0–1 och god njurfunktion (GFR > 50–60 ml/min). Olika platinum kombinationsbehandlingar ingick i de olika studierna, likväl som olika primära behandlingar (cystektomi, strålbehandling eller en kombination av dessa).
En rekommenderad cytostatikaregim är dd-MVAC (metotrexat, vinblastin, doxorubicin och cisplatin) givet varannan vecka, med stöd av GCSF, i 3–4 cykler 282283. Denna cytostatikaregim är vältolererad och ger en hög dosintensitet av cisplatin på kort tid. En annan vanligt använd neoadjuvant cytostatikaregim är GC (gemcitabin-cisplatin) som kan ges med antingen 3veckors eller 4-veckors schema i 3–4 cykler 284285. Dessa regimer har jämförts i en randomiserad fas 3 studie där 6 cykler perioperativ dd-MVAC (2veckors schema) evaluerats mot 4 cykler GC (3-veckors schema). I gruppen av patienter som erhöll dd-MVAC fullföljde ca 58 % de planerade 6 cyklerna, i gruppen av patienter som erhöll GC fullföljde 84 % de planerade 4 cyklerna. Ingen signifikant skillnad i överlevnad observerades för hela studiepopulationen men för subgruppen av patienter som erhöll neoadjuvant behandling gav dd-MVAC en signifikant bättre överlevnad vid 5 år (66 % vs 57 %; HR 0.71). Svår anemi, asteni och ≥ grad 3 GI-biverkningar var signifikant vanligare hos patienter som behandlades med dd-MVAC. Vidare observerades något fler behandlingsrelaterade dödsfall under behandling med dd-MVAC jämfört med GC 284285286. Data indikerar vidare att upp till 4 cykler dd-VAC/GC är eftersträvansvärt 287.
För patienter med rent småcellig differentiering rekommenderas cisplatin-etoposid 288.
Nyligen redovisade data från NIAGARA studien där tillägg av perioperativ immunterapi med durvalumab till konventionell cisplatin-baserad neoadjuvant kemoterapi studerades. Tillägget av durvalumab pre- och postoperativt förbättrade överlevnaden vid 24 månader till 82% (95% CI 78.7-85.2) jämfört med 75% (95% CI 71.3-78.8) i standardarmen (HR 0.75 (95% CI 0.59-0.93)), med jämförbar incidens av behandlingsrelaterade grad 3 och grad 4 biverkningar 289. Bedömning vid EMA pågår.
Ytterligare studier pågår med immunterapi, målstyrda läkemedel och antikroppsläkemedels-konjugat (ADC) ensamt eller i kombination som neoadjuvant och/eller adjuvant behandling.
Om cisplatin inte kan ges pga. exempelvis försämrad njurfunktion (GFR < 50 ml/min), samsjuklighet eller nedsatt allmäntillstånd bör neoadjuvant behandling inte ges, utan prioritet ges till omedelbar cystektomi.
Om den neoadjuvanta behandlingen måste avbrytas skall patienten planeras för cystektomi eller bedömas för kurativ strålbehandling om cystektomi inte längre är genomförbart.
Behandling muskelinvasiv blåscancer
Urinavledning
Förutom preoperativ information ska patienten ges möjlighet att träffa stomisköterska eller kontaktsjuksköterska med kunskap inom området före operationen inför beslutet om typ av urinavledning. Patienten bör också förutom principiella skillnader mellan olika typer av urinavledning få kunskap om aktuella resultat vid den enhet där den planerade kirurgin kommer att utföras. Om möjligt bör patienten också erbjudas att träffa en patient som genomgått liknande ingrepp.
Robotassisterad radikal cystektomi (RARC) och öppen cystektomi
RARC och öppen cystektomi har samma totala andel postoperativa komplikationer vid 90 dagar, negativa kirurgiska marginaler, livskvalitet, och onkologiskt utfall vid intermediär uppföljning (⊕⊕⊕⊕).
RARC har längre operationstid och är dyrare än öppen cystektomi, men ger mindre intraoperativ blödning (⊕⊕⊕⊕).
Kurativ extern strålbehandling och radiokemoterapi
Patienter som är aktuella för kurativa behandlingsalternativ och som inte kan eller vill genomgå radikal cystektomi bör erbjudas strålbehandling som ett kurativt behandlingsalternativ (⊕⊕).
Konkomittant kemoradioterapi bör om möjligt ges för att ytterligare öka lokoregional kontroll och totalöverlevnad (⊕⊕⊕).
Adjuvant systemisk behandling
I de fall där neoadjuvant cytostatikabehandling av något skäl inte givits enligt standardförfarande bör adjuvant cisplatin-baserad kombinationsbehandling övervägas till selekterade patienter med histopatologisk pT3/pT4a och/eller pN+ (⊕⊕).
Patienter med pT3, pT4a och/eller pN+ urotelial cancer i cystektomipreparatet och PD-L1 positiv tumör alternativt ypT2, ypT3, ypT4a och/eller ypN+ i operationspreparatet efter preoperativ cytostatikabehandling ska bedömas med avseende på adjuvant nivolumab (⊕⊕⊕).
Komplikationsregistrering efter cystektomi
Alla enheter som utför radikal cystektomi ska registrera komplikationer i det nationella registret.
Urinavledning
Robotassisterad radikal cystektomi (RARC)
Laparoskopisk cystektomi beskrevs redan 1992 298, och efter introduktionen av robotassisterad kirurgi med Da Vinci-systemet 2001 beskrevs de första robotassisterade radikala cystektomierna (RARC) 2003 299. Urinavledning efter RARC kan antingen göras med öppen (extrakorporeal) teknik eller intrakorporealt med robotteknik. Potentiella fördelar med RARC jämfört med öppen cystektomi är mindre perioperativ blödning och därmed transfusionsbehov och kortare vårdtid 300301.
Komplikationer efter radikal cystektomi inom 90 dagar efter operationen är vanligt vid standardiserad komplikationsregistrering och drabbar upp till två av tre patienter 302. Risken för komplikationer ökar med faktorer såsom hög ålder, tidigare buk- eller bäckenkirurgi och ASA-score > 2, och därför finns det sannolikt selektionsbias i de större studier som undersökt allvarliga komplikationer efter RARC 303304305. I de randomiserade studierna som föreligger rapporteras ingen skillnad i postoperativa komplikationer inom 90 dagar 306307308309310. I den största randomiserade studien förelåg dock lägre risk för tromboemboli postoperativt efter RARC jämfört med öppen cystektomi 307, och i en svensk populationsbaserad jämförelse rapporteras lägre risk för sårruptur men högre risk för oplanerad återinläggning efter RARC 311. Komplikationsfrekvensen efter RARC påverkas sannolikt också av tillkomsten av nya metodberoende komplikationer såsom ökad förekomst av stenos eller läckage i uretero-intestinala anastomoser i tidiga serier och populationsbaserade material 312313314315316, vilket dock inte har rapporterats från expertcentra 317. Eftersom dessa studier dessutom har olika lång uppföljningstid och rapporterar olika definitioner av endpoints, kan några säkra slutsatser ej dras.
Cancerspecifik överlevnad efter RARC finns i dag rapporterat från flera randomiserade studier serier 307318319 inklusive en studie med non-inferiority design 310. Rapportering av porthålsmetastaser är sannolikt föremål för publikationsbias, och i en svensk genomgång var sådant postoperativt återfall associerat med kärlinväxt i tumören 319. I en av de randomiserade studierna 318 och en systematisk översikt 320 rapporteras en liten ökad risk för atypiska metastaslokaler efter RARC jämfört med öppen cystektomi. Vid ultradjup sekvensering av sköljvätska från bäckenet påvisades tumörceller under och efter RARC, men inte före start av kirurgin 321, vilket var associerat med tumörrecidiv.
I randomiserade studier jämförande RARC och öppen cystektomi föreligger ingen skillnad i HRQoL estimerat med FACT-VCI 322 eller EORTC QLQ-BLM30 307 postoperativt efter 3 månader. Kostnadsjämförelser mellan RARC och öppen cystektomi har påvisat en mycket hög inkrementell kostnadseffektivitetskvot givet total kostnad och hälsovinst kalkylerad utifrån kvalitetsjusterade levnadsår 323. Således är öppen cystektomi mer kostnadseffektiv än RARC.
Kurativ extern strålbehandling och radiokemoterapi
Som alternativ till cystektomi kan kurativ strålbehandling ges. En av fördelarna med strålbehandling jämfört med cystektomi är att det är en organbevarande metod. Historiskt sett har dock kurativ strålbehandling givit en sämre överlevnad jämfört med cystektomi 324, även om detta utmanats av senare behandlingsresultat 325326327. Strålbehandlingen ges traditionellt med 2 Gy per fraktion (behandlingstillfälle) fem dagar per vecka i sex till sju veckor, upp till en totaldos av 64–70 Gy. Nyligen har s.k. hypo-fraktionerad strålbehandling med färre fraktioner och högre dos per fraktion påvisat likartade behandlingsresultat jämfört med sedvanlig fraktionering utan ökade biverkningar, exempelvis 2.75 Gy till slutdos 55 Gy 328. Detta är tilltalande då patienterna som är aktuella för strålbehandling ofta är äldre och/eller har samsjuklighet. Vid val av fraktioneringsmönster bör beaktas att stråldosen som man jämför med är något lägre än den som använts i Sverige vid strålbehandling utan samtidig cytostatika. Historiskt sett har även blåscancer räknats till de tumörer som gagnas av s.k. hyperfraktionering med stråldosen uppdelad på flera fraktioner per dag på grund av ett högt α/β enligt LQ-modellen 329. Detta styrks även av tidigare studier av hyperfraktionerad behandling 330.
Vanliga akuta biverkningar av strålbehandling mot urinblåsan är besvär från urinblåsan och ändtarmen. Reducerad blåskapacitet, blödningar från urinblåsa och tarm samt stenoserande processer i rektum hör till de allvarligaste komplikationerna. Allvarliga, sena biverkningar från gastrointestinalkanalen eller urinvägarna förekommer hos mindre än 5 procent 330331. Tekniken för strålbehandling har förbättrats under senare år genom möjlighet till adaptiv behandling som är anpassad till aktuell blåsvolym samt mer konform behandling, vilket ger minskad stråldos till omgivande vävnader trots bibehållen eller ökad dos till blåsan 332.
I en randomiserad fas III-studie av strålbehandling hos patienter med muskelinvasiv sjukdom med eller utan konkomitant (samtidig) cytostatika (fluorouracil och mitomycin C) påvisades både ökad lokoregional kontroll och överlevnad utan att biverkningar ökade signifikant (lokal kontroll vid 2 år 67 respektive 54 procent och femårsöverlevnaden 48 respektive 35 procent) 326. Poolade individuella patientdata från ett flertal fas I-II prövningar stöder också användandet av konkomitant gemcitabin vid kurativt syftande strålbehandling vid blåscancer 325333. Principerna med adaptiv strålbehandling och konkomitant radiokemoterapi tillämpas vid ett flertal centrum i Sverige. Vid konkomitant cytostatika rekommenderas att stråldosen reduceras till slutdos 64 Gy med fraktionsdos 2 Gy 326. Även vid hypofraktionerad behandling med konkomitant gemcitabin rekommenderas dosreducering till 52.5 Gy på 20 fraktioner 333.
Organbevarande behandlingsstrategier, så kallad trimodal behandling, har visat sig ge liknande fem- och tioårsöverlevnad som radikal cystektomi, motsvarande en femårsöverlevnad på 50–67 procent, med funktionell blåsa hos ca. 75 procent av patienterna 244334. Upplägget inkluderar radikal TURB, strålbehandling och cytostatika och rekommenderas i amerikanska riktlinjer (auanet.org/guidelines/guidelines/bladder-cancer-non-metastatic-muscle-invasive-guideline), men är inte i kliniskt bruk vid något svenskt sjukhus. Dock bör både radikal TURB och neoadjuvant cytostatika rekommenderas patienter med muskelinvasiv sjukdom före kurativt syftande strålbehandling med eller utan konkomitant cytostatika.
Adjuvant systemisk behandling
Adjuvant cytostatika
Eftersom det föreligger stark evidens för att ge neoadjuvant behandling inför cystektomi kommer andelen patienter som är kemonaiva och tillgängliga för adjuvant cytostatikabehandling relativt liten. En teoretisk fördel med adjuvant cytostatikabehandling (jämfört med neoadjuvant) är möjligheten att få en mer korrekt tumörklassificering utifrån cystektomi-PAD jämfört med preoperativ stadieindelning, och därmed undvika överbehandling 275. Det blir inte heller någon fördröjning till kirurgi för de fall där tumören har nedsatt känslighet för cytostatikabehandling. Nackdelarna är att det blir en fördröjning till cytostatikabehandling för patienter med mikrometastasering för vilka det är svårt att utvärdera behandlingseffekten. Patienten kan också vara så nedsatt i sitt allmäntillstånd efter en cystektomi att det kan vara svårt att tolerera tung cytostatikabehandling. Det finns retrospektiva studier vilka visat att cisplatinbaserad adjuvant behandling hos kemonaiva möjligen förbättrade överlevnaden, men det finns också studier som visar på motsatsen 335336337. Även randomiserade studier har gett divergerande resultat. Dessa randomiserade studier var antingen underdimensionerade, avslutades i förtid på grund av dålig rekrytering eller positiv effekt vid interimsanalys 338, eller hade brister i sin studiedesign 338339340341342343. I en metaanalys från 2022 förelåg en signifikant överlevnadsvinst på 6 % vid 5 år för de patienter som fått adjuvant cytostatikabehandling efter kurativ cystektomi eller strålbehandling 344345. Detta medför att patienter med pT3-4a som ej erhållit neoadjuvant cytostatika bör erbjudas adjuvant cytostatikabehandling efter cystektomi.
Adjuvant immunterapi
Adjuvant immunterapi med nivolumab ökar sjukdomsfri överlevnad (21 månader) jämfört med placebo (11 månader) vid behandling av radikalopererade patienter med hög risk för återfall. Finala OS är ännu inte presenterade 346.
Patienter med högrisk urotelial cancer lokaliserad till urinblåsa som genomgått radikal kirurgi skall därför bedömas med avseende på sådan tilläggsbehandling.
För populationen som inte genomgått neoadjuvant kemoterapi avses med högrisk för återfall pT3, pT4a och/eller pN+ i operationspreparatet. För de som genomgått preoperativ kemoterapi avses med högrisk för återfall ypT2, ypT3, ypT4a och/eller ypN+ i operationspreparatet. Störst effekt föreligger vid PD-L1 positiv tumör.
Komplikationsregistrering efter cystektomi
Radikal cystektomi innefattar kirurgi i urinvägarna, lymfsystem och mag-tarmkanalen samtidigt, vilket är en förklaring till att komplikationer efter ingreppet inte är ovanliga. Beroende på olika sätt att rapportera komplikationer och olika selektion av riskpatienter (case-mix) till ingreppet varierar andelen patienter med postoperativa komplikationer i litteraturen mellan 19 procent och 64 procent 302347. För rapportering av komplikationer efter kirurgi utgör Claviens standardiserade system 90 dagar postoperativt en standard efter cystektomi 348, eftersom allvarliga komplikationer och även dödlighet uppkommer även efter 30 dagar. Därför är 30 dagar en för snäv tidsperiod att definiera postoperativa komplikationer inom 291. I nationella blåscancerregistret pågår en prospektiv registrering av komplikationer efter radikal cystektomi, obligatorisk från 2013, där varje enhet som utför ingreppet ska gå in på respektive onkologiskt centrums hemsida och online i INCA registrera samtliga patienter och eventuella komplikationer efter 90 dagar enligt Clavien-Dindo 4. Vid validering av komplikationsregistreringen genomförd av en tredje part framkom viss underrapportering av komplikationer och återinläggning efter cystektomi 349, varför ökat fokus på dessa parametrar i samband med inrapportering anmodas. I Sverige har det sedan regional nivåstrukturering genomfördes 2017 observerats att andelen med samsjuklighet motsvarande ASA 3 eller 4 som opereras med cystektomi ökat från 32 % till 37 % och medianålder vid primär cystektomi ökat från 71 till 73 år 350. Samtidigt har inom 90 dagar postoperativt andelen reoperationer minskat från 12 % till 8 % och mortaliteten från 4 % till 3 % med bibehållna, om än för långa ledtider.
Njurbäcken- och uretärcancer
Nefrouretärektomi är standardbehandling vid icke-metastaserad njurbäcken- och uretärcancer som ej är lämplig för organbevarande kirurgi (⊕⊕⊕).
För patienter med distal uretärtumör är distal uretärresektion med reimplantation ett behandlingsalternativ med sannolikt bättre ipsilateral lokalrecidivfri överlevnad jämfört med endourologisk organbevarande behandling (⊕⊕).
Patienter med solitär och låggradig tumör och som är lämpliga för tät uppföljning bör erbjudas endourologisk behandling eventuellt tillsammans med adjuvant instillationsbehandling föregått av second-look uretäroskopi 6–8 veckor efter primärbehandlingen som organbevarande strategi (⊕⊕).
Templat-baserad regional lymfadenektomi bör övervägas vid invasiv urotelial cancer i de övre urinvägarna även om det vetenskapliga underlaget är begränsat (⊕⊕).
Efter nefrouretärektomi bör tidig intravesikal cytostatikainstillation i en dos ges för att minska risken för senare blåstumörer (⊕⊕⊕).
Efter nefrouretärektomi och uretärresektion ska patienter med pT2-T4 och/eller pN1-N2 bedömas avseende systemisk adjuvant kemoterapi med cisplatin- eller karboplatin-gemcitabin-kombination (⊕⊕⊕⊕).
Patienter med pT3, pT4 och/eller pN+ och PD-L1 positiv urotelial cancer i operationspreparatet som inte tål adjuvant platinum-baserad kemoterapi alternativt ypT2, ypT3, ypT4 och/eller ypN+ i operationspreparatet efter preoperativ kemoterapi skall bedömas avseende adjuvant nivolumab (⊕⊕⊕).
Standardbehandling av njurbäckencancer och uretärcancer är radikal nefrouretärektomi medtagande uretärostiet med en blåskuff. Operationen kan göras laparoskopiskt, med robotassisterad laparoskopi eller med öppen teknik, men för lokalt avancerad sjukdom (cT3/cT4 och/eller lymfkörtelpositiv sjukdom) rekommenderas öppen teknik då visst vetenskapligt stöd finns för sämre överlevnad vid minimalinvasiv nefrouretärektomi i dessa fall 351352. Det finns också en multicenterstudie som påvisar ökad risk för intravesikalt recidiv efter nefrouretärektomi med minimalinvasiv teknik jämfört med öppen kirurgi 353. Sedan 2021 görs dock majoriteten av alla radikala nefrouretärektomier i Sverige med robotassisterad teknik 354. För att undvika tumörspill bör uretären hållas intakt peroperativt liksom att en komplett excision av en blåskuff med distala uretären bör genomföras en bloc 355. Det finns vidare visst vetenskapligt stöd för att fler än sex nefrouretärektomier per opererande enhet per år ger en ökad överlevnad både på kort (3 månader) och lång sikt 356. För distala uretärtumörer kan distal uretärresektion med reimplantation vara ett behandlingsalternativ med eller utan samtidig regional lymfkörtelutrymning.
Lymfkörtelutrymning bör övervägas vid radikal nefrouretärektomi, eftersom lymfkörtelmetastaser är den vanligaste metastaslokalen och retrospektiva studier visar långtidsöverlevnad vid begränsad lymfkörtelspridning precis som vid blåscancer 357358359360361362. Ytterligare ett skäl för lymfkörtelutrymning i samband med nefrouretärektomi/uretärresektion är värdet av adjuvant kemoterapi för patienter med påvisad lymfkörtelspridning 363. Lymfkörtelmetastaser förekommer framför allt vid avancerade tumörer (cT2–T4), och selekterade patienter med hög risk för lymfkörtelmetastaser bör därför genomgå lymfkörtelkirurgi. Emellertid är omfattningen av lymfkörtelutrymningen oklar i frånvaro av mer omfattande väldesignade studier 364365, men en interimsanalys i den pågående prospektiva nordiska multicenterstudien har visat att de undersökta sidospecifika templaterna detekterade majoriteten av lymfkörtelmetastaserna med endast låg andel höggradiga komplikationer (ISRCTN83155790) 366. Regional lymfkörtelutrymning kan också övervägas i samband med distal uretärresektion för höggradig och/eller invasiv distal uretärcancer 362.
I samband med nefrouretärektomi har två randomiserade studier visat 11 respektive 25 procents absolut riskreduktion för återfall i urinblåsan om postoperativ instillation av cytostatikabehandling (mitomycin respektive pirarubicin) i endos användes undantaget patienter med känd blåscancersjukdom 367368. Däremot minskar en hel instillationsserie med kemoterapi inte ytterligare risken för intravesikalt tumörrecidiv 369.
Stöd finns för adjuvant kombinationskemoterapi vid invasiv (pT2 eller högre och/eller N+) efter nefrouretärektomi (POUT). Behandling ges endera med cisplatin- eller karboplatinbaserad kombination med gemcitabin i fyra kurer 363. I en prospektiv studie av neoadjuvant kemoterapi med cisplatin och gemcitabin svarade 11/57 (19 %) av patienterna med komplett respons 370. Även om neoadjuvant behandling har undersökts i en retrospektiv jämförande studie där neoadjuvant kemoterapi var associerat med HR 0.42 371, saknas det för närvarande vetenskapligt underlag för neoadjuvant kemoterapi vid urotelial cancer i övre urinvägarna. I en studie rapporteras att endast cirka 20 procent av patienter som genomgått nefrouretärektomi är behandlingsbara med cisplatin efter kirurgin pga. postoperativ njurfunktionsnedsättning 372373. Patienter som inte är primärt operabla pga. lokoregional spridning bör därför i stället för primär kirurgi inleda behandling med cisplatinbaserad induktionskemoterapi, där vidare intention med behandlingen bedöms utifrån behandlingsrespons då det finns visst stöd för överlevnadsfördel vid körtelpositiv urotelial cancer i övre urinvägarna jämfört med primär kirurgi enbart 374375.
För patienter med tumörer med låg risk (unifokal och liten tumör med frånvaro av misstanke om höggradig atypi i urincytologi (Paris 3–5), G1-tumör, och utan radiologisk misstanke om invasivitet samt en patient som lämpar sig för täta kontroller och second-look uretäroskopi) är organbevarande (endoskopisk) lokalbehandling aktuellt. Dessa fall bör opereras av en van endoskopist med tillgång till flexibelt uretäroskop, alternativt remitteras till en enhet som har dessa förutsättningar eftersom färre än 20 patienter per år i Sverige erhöll sådan behandling 2015–2021 enligt data från nationella kvalitetsregistret 354. Andra indikationer för endourologisk behandling är imperativt nefronsparande behandling. Gällande all endoskopisk diagnostik av urotelial tumör i övre urinvägarna är ett standardiserat protokoll viktigt 376. Second-look uretäroskopi efter 6–8 veckor ingår vid endoskopisk lokalbehandling, då förekomst av kvarvarande tumör påvisas hos varannan patient i samband med denna åtgärd 377378. I tillgänglig litteratur är lokalrecidivförekomsten i övre urinvägarna (ej medräknat intravesikala recidiv) efter endoskopisk lokalbehandling vid intermediär uppföljningslängd 28–85 procent 379380381382383384385386. Efter nefronsparande kirurgi med distal uretärresektion och uretäroneocystostomi visar tillgängliga studier lägre andel lokalrecidiv (0–18 procent) 387388389390.
Vid carcinoma in situ i övre urinvägarna kan nefronsparande behandling med BCG-instillationer övervägas, antingen via nefrostomikateter eller via blåsan i Trendelenburgläge med inlagd dubbel-J-kateter. BCG-behandlingen ges en gång i veckan i 6 veckor, och i fallet med administration via blåsan fordras cystografi i Trendelenburgläge för att verifiera att BCG-instillationen når njurbäckenet 391392 (bilaga 17).
För patienter som efter nefrouretärektomi uppvisar lokalt avancerad tumör (pT2-T4) med eller utan regional lymfkörtelspridning och för samtliga patienter med regional lymfkörtelspridning (pN1-N2) föreligger starkt vetenskapligt stöd för adjuvant cisplatin-gemcitabin alternativt karboplatin-gemcitabin givet fyra kurer postoperativt. Sådan tilläggsbehandling förbättrade sjukdomsfri överlevnad och total överlevnad vid fem år (HR 0.68 (CI 0.46-1.00)) jämfört med behandling vid tumöråterfall 363.
Adjuvant immunterapi med nivolumab ökar också sjukdomsfri överlevnad (21 månader) jämfört med placebo (11 månader) vid behandling av radikalopererade patienter med urotelial cancer i urinblåsa, uretär och njurbäcken med hög risk för återfall 346. Patienter med PD-L1 positiv högrisk urotelial cancer i uretär eller njurbäcken (pT3, pT4 och/eller pN+ i operationspreparatet) som genomgått radikal kirurgi skall därför bedömas med avseende på sådan tilläggsbehandling i andra hand efter platina-baserad adjuvant cytostatikabehandling 346.
Uretracancer
Rekommendationer
Det saknas data från prospektiva randomiserade studier, varför otillräckligt vetenskapligt underlag för samtliga behandlingsrekommendationer föreligger.
Utredning av primär uretracancer innefattar kastad urincytologi, uretrocystoskopi med biopsi, DT thorax-buk alternativt FDG-PET-DT, och lokal stadieindelning med MRT före invasiv diagnostik (⊕⊕).
Vid lokalt avancerad uretracancer (cT2-cT4) kan cisplatin-baserad neoadjuvant kemoterapi ge bättre överlevnad än enbart kemoterapi eller primär kirurgi och adjuvant kemoterapi (⊕⊕).
Alla fall av uretracancer bör handläggas vid regional urotelial multidisciplinär konferens och/eller nationell multidisciplinär peniscancerkonferens (⊕⊕).
Primär uretracancer (till skillnad från sekundär uretracancer då annan primär urotelial cancer först diagnosticerats på annan lokal i urinkanalen) är en ovanlig diagnos, med årligen mindre än 30 nydiagnostiserade fall i Sverige 4. Hos män är urotelial cancer vanligast, följt av skivepitelcancer och adenocarcinomhistologi. Hos kvinnor utgör adenocarcinom den vanligaste histologin vid uretracancer, där klarcelligt adenocarcinom utgör en egen subgrupp 393 följt av skivepitelcancer och urotelial cancer.
Klinisk diagnos ställs inte sällan till följd av symtom från en lokalt avancerad uretracancersjukdom med hematuri, infravesikal obstruktion, palpabel tumör och smärtor 394. Diagnostik av uretracancer baseras på urincytologi, uretroskopi med biopsi (gärna med klocktång) inklusive cystoskopi, DT-urografi vid urotelial histologi och lokal staging inklusive lymfkörtelstaging av inguinala och iliakala lymfkörtelstationer, där MR utförd före biopsi sannolikt har fördelar 395396397. Förstorade inguinala lymfkörtlar representerar oftare lymfkörtelspridning vid uretracancer jämfört med peniscancer 398.
Uretracancer hos män
TaG1
Solitär och multipel urotelial tumör grad 1 (och enstaka fall av grad 2-tumörer utan misstanke om infiltration) behandlas på följande sätt oberoende av lokalisation:
Uretracancer hos män övriga T-stadier
Grad 2–3, urotelial cancer, skivepitelcancer och adenocarcinom behandlas beroende på lokalisation enligt nedan:
- Prostatiska, membranösa och bulbära uretra: Cystoprostaturetrektomi, eventuellt kombinerad med total penektomi och iliakal lymfadenektomi.
- Penila uretra: Penisamputation med fri resektionsmarginal (fryssnitt) vid distala tumörer. Om man inte kan få användbar penisstump, rekommenderas total penektomi och perineal uretrostomi 401.
Radikal utrymning av inguinala lymfkörtlar genomförs vid palpabel inguinal lymfkörtel, vid lågt differentierad cancer och klinisk N0 kan sentinel node-diagnostik övervägas även om evidens för metodens tillförlitlighet vid denna tumörlokal saknas 398. Distal skivepitelcancer i fossa naviculare handläggs som peniscancer enligt riktlinjer i det nationella vårdprogrammet för peniscancer 402. - För patienter med urotelial histologi och skivepitelhistologi med avancerad tumör cT2-cT4 och cN0 rekommenderas neoadjuvant cisplatinbaserad kemoterapi alternativt induktionskemoterapi vid cN+ 403404405.
- Data från 25 patienter med lokalt avancerad skivepitelcancer i uretra talar för att kemoradioterapi (med konkomittant 5-FU och mitomycin) kan utgöra en organsparande strategi för dessa patienter 406407.
Uretrarecidiv efter cystoprostatektomi
Vid malign uretrasköljvätska eller synlig tumör vid uretroskopi under uppföljning efter tidigare cystoprostatektomi rekommenderas oberoende av tumörlokal sekundär uretrektomi enligt Whitmore 408. Vid engagemang av fossa naviculare görs en komplett uretrektomi innefattande delning av glans för extirpation av den mest distala delen av uretra. Det är rimligt att förnya metastasscreening preoperativt före en sekundär uretrektomi inklusive DT-urografi för att utesluta metakron urotelial cancer i övre urinvägarna. Vid klinisk misstanke om invasiv tumör rekommenderas lokal staging med MR och eventuellt FDG-PET-DT för lymfkörtelstaging. Vid påvisad regional spridning bör induktionskemoterapi övervägas. Några enheter i landet använder vid klinisk N0 perioperativ SN-diagnostik som invasiv lymfkörteldiagnostik.
Uretracancer hos kvinnor
TaG1
Solitär och multipel tumör grad 1 (och enstaka fall av grad 2-tumörer utan misstanke om infiltration) behandlas på följande sätt oberoende av lokalisation:
- Konservativ behandling (transuretral biopsi/resektion, koagulation eller laserevaporisering).
Uretracancer hos kvinnor övriga T-stadier
Grad 2–3 adenokarcinom inklusive klarcelligt adenocarcinom 393, skivepitelcancer och urotelial cancer behandlas beroende på lokalisation enligt nedan:
- Proximala 2/3 av uretra: Cystouretrektomi medtagande angränsande delar av vagina, samt iliakal lymfadenektomi.
Urotelial tumör grad 2 eller skivepitelcancer i distala delen av uretra:
- Distal uretrektomi innefattande innebär sannolikt en betydande risk för lokalrecidiv (22 %–60 %) 409 och om mer än 2 cm av distala uretra excideras drabbas varannan patient betydande inkontinens 410411, varför total uretrektomi och Mitrofanoff/Monti-utlopp därför kan övervägas 412.
- Radikal utrymning av inguinala lymfkörtlar genomförs vid palpabel inguinal lymfkörtel, vid lågt differentierad cancer och klinisk N0 kan sentinel node-diagnostik övervägas även om evidens för metodens tillförlitlighet vid denna tumörlokal saknas 398.
- För patienter med urotelial histologi och skivepitelhistologi med avancerad tumör cT2-cT4 och cN0 rekommenderas neoadjuvant cisplatinbaserad kemoterapi, medan induktionskemoterapi aktualiseras vid cN+ 404.
Övrig behandling
Diskussion av samtliga fall med distal uretracancer hos män rekommenderas vid den nationella peniscancerkonferensen, t.ex. för att överväga invasiv lymfkörtelstaging inguinalt med sentinel-node-teknik för utvalda fall 412. Men även i övriga fall av uretracancer bör synpunkter på utredning, handläggning och behandling inhämtas från regional urotelial multidisciplinär konferens och/eller nationell multidisciplinär peniscancerkonferens.
Urotelial cancer i prostatiska uretra och prostata
Rekommendationer
Patienter med Tis i prostatiska uretra kan eventuellt behandlas med efterföljande BCG-instillationer alternativt primär cystoprostatouretrektomi (⊕⊕).
Före start av BCG-instillationer bör kompletterande TURP genomföras för att utesluta urotelial cancer i prostatastromat (⊕⊕), eventuellt tillsammans med reresektion av samtidig laminapropria-invasiv blåscancer.
Patienter som uppvisar stroma-engagemang i prostata av urotelial cancer bör genomgå neoadjuvant kemoterapi följt av radikal cystoprostatouretrektomi (⊕⊕).
Konservativ behandling av Tis i prostatiska uretra med kompletterande TURP och BCG finns beskrivet i en review inkluderande några små retrospektiva fallserier om sammanlagt 89 patienter 413 och en nyare systematisk översikt och meta-analys inkluderande 175 patienter 414. Det har föreslagits att en prostataresektion teoretiskt förbättrar exponeringen för BCG lokalt i prostatiska uretra 415, även om reflux av BCG ut i perifera zonen har beskrivits 416, men framför allt är denna kompletterande åtgärd inför BCG-instillationer för att säkrare utesluta urotelial cancer med invasion i prostatastromat. Det saknas data rörande recidivfri och progressionsfri överlevnad efter BCG-instillationer för Tis i prostatiska uretra, men komplett respons hos 60 % har rapporterats liksom upp till 29 % progression respektive cystoprostatektomi 414. Även om typ av spridningsväg för urotelial cancer med invasion i prostatastromat (intrauretral visavi via blåshalsen eller extravesikal tumörväxt från blåsan) innebär att den förstnämnda har något bättre prognos, är cystoprostatouretrektomi standardbehandling i bägge dessa tumörsituationer.
Inför radikal cystektomi vid muskelinvasiv blåscancer kan tumörengagemang av prostatiska uretra och prostata kartläggas med preoperativa biopsier enligt ovan. Sådan kartläggning har betydelse prognostiskt, men även eftersom prostataengagemang ökar risken för uretra-återfall efter radikal cystoprostatektomi 417, och primär cystoprostatouretrektomi kan därför övervägas hos patienter med prostataengagemang av urotelial cancer i samband med radikal cystoprostatektomi. Fryssnitt från distala prostatiska uretra peroperativt är ett ofta använt sätt att bedöma prostataengagemang inför beslut om ortotop urinavledning, men varken preoperativa biopsier eller intraoperativt fryssnitt har hundraprocentig sensitivitet, och jämförande studier med långtidsuppföljning innefattar endast två små serier om sammanlagt 168 patienter 418419. Det är också oklart hur neoadjuvant kemoterapi påverkar tillförlitligheten av intraoperativt fryssnitt från uretra. Följaktligen kan man rekommendera att blåssubstitut används om man inte hittar någon tumör i den preoperativa resektionsbiopsin från prostatiska uretra samt att avstå från blåssubstitut vid tumör i den preoperativa resektionsbiopsin, även om det föreligger peroperativ fri marginal i prostatiska uretra vid intraoperativt fryssnitt. Det gäller även om det saknas absolut kontraindikation. Omvänt bör konkomitant uretrektomi en bloc med blåspreparatet övervägas om patienten inte får blåssubstitut med preoperativt påvisad tumör i prostatiska uretra.
