Kategorisering av tumören
Rekommendationer
Rapportering av urincytologi med användande av Paris-systemet rekommenderas (⊕⊕⊕).
För T1 tumörer i urinblåsan rekommenderas subklassificering i T1m (minimal nedväxt i lamina propria) i enstaka focus och T1e (extensiv nedväxt i lamina propria överstigande 0.5 mm) (⊕⊕⊕).
Det är viktigt att beakta kliniskt tumörstadium vid registrering, och utifrån patologisk, radiologisk och klinisk information stratifiera mellan t.ex. kliniskt stadium T2 och T3.
Patologins roll i den diagnostiska processen
Se bilaga 12.
Anvisningar för provtagarens hantering av provet
Cytologi
Provet kan tas från blåssköljvätska eller kastad urin. Kastad urin har samma sensitivitet som blåssköljvätska i studier genomförda innan införandet av Paris-systemet 157, men teoretiskt kan inte blåssköljvätska monitorera övre urinvägar eller prostatiska uretra/uretra. Redan vid provtagningstillfället ska man ha vetskap om vilken analysmetod som används på tillhörande patologi/cytologilaboratorium. Här kan det variera med mängd och typ av vätska samt fixeringsmetod.
Prov kan inkomma ofixerade för att sedan fixeras på laboratoriet eller redan fixerade med exempelvis 50 % etanol 1:1, metanol/ättiksyra 1:1 eller CytoRichRed beroende av prepareringsmetod. Fixering är viktigt om man senare vill göra kompletterande utredningar med t. ex. FISH-analys.
Patologi
Som fixativ rekommenderas buffrad formalin 10 % (formaldehyd 4 %). Använd en volym motsvarande minst 10 gånger preparatvikten.
- Biopsier – mapping: Antalet biopsier anges för varje fraktion. De numreras enligt remissuppgifter.
- TUR-material: För säkrare bedömning av invasion rekommenderas fraktionering av resektionsmaterialet i huvudprov och tumörbas.
- Cystektomipreparat inskickas färskt eller formalinfyllt. Preparatet kan lämnas till patologavdelningen färskt och ouppklippt med kateter i uretra, alternativt fylls blåsan maximalt via kateter med formalin (buffrad formalin 10 %). Kateter och uretra knyts om, och uretärer utmärks på valfritt sätt. Om detta förfarande inte är genomförbart fixeras blåsan uppklippt i framvägg så att man ser till att formalin kommer in i blåsan.
- Nefrouretärektomipreparat inskickas färskt eller formalinfixerat. Fixeringssnitt av njuren kan läggas lateralt ifrån.
Anamnestisk remissinformation
Cytologi
- Typ av prov (taget på kastad urin eller sköljvätska i samband med cystoskopi).
- Indikation för provtagning.
- Tidigare tumörer.
- Klinisk information om cystoskopisk bild, rodnad, tumör.
- Tidigare behandlingar med BCG/Mitomycin eller tidigare genomgången strålbehandling.
Patologi
- Korrekt namn och personnummer. Stämplade uppgifter ska vara rätt placerade på remissen och texten ska vara läslig.
- Adekvata och utförliga uppgifter om sjukhistoria och undersökningsfynd samt eventuell tidigare BCG-/mitomycinbehandling och tidigare lokalisation av behandlad tumör.
- Uppgifter om vad insänt material i sin helhet utgörs av.
- Antalet burkar ska anges på remiss. Numrering eller annan märkning på preparatburk ska överensstämma med remissuppgifter. (OBS! Ej märkning på locket.)
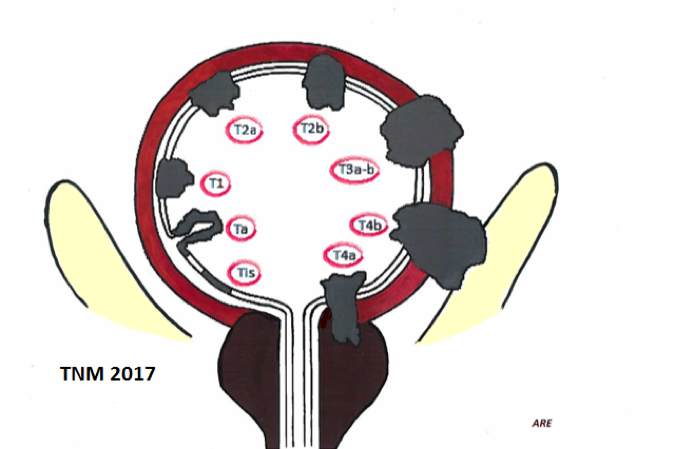
Klassificering av tumören – TNM
UICC:s TNM-klassifikation version 8 bör ligga till grund för primär rapportering av nyupptäckta blåscancerpatienter 160. Diagnosen ska verifieras med cytologiskt och helst även histologiskt preparat.
Observera att klassifikation av primär tumörstatus ska baseras på kunskap om tumören efter cystoskopi och provexcision eller transuretral resektion samt radiologiska undersökningar och ger därmed en samlad bild av resultatet av samtliga undersökningar. Man ska inte bara från ett PAD-svar ”minst T2” schablonmässigt skriva T2 om det finns andra tecken som tyder på T3-tumör, exempelvis dilatation av ena uretären. Man ska heller inte i förkommande fall avvakta klinisk kategorisering av tumören till PAD efter cystektomi (som utgör det s.k. patologiska tumörstadiet, jämför kliniskt tumörstadium ovan). I den nya TNM-klassifikationen finns en förändrad klassifikation av fjärrspridning som stratifieras i M1a och M1b för icke-regional lymfkörtelspridning respektive annan fjärrspridning enligt tabellen nedan och för urotelial cancer i prostatiska uretra/prostata med intrauretral spridning enligt skiss och tabell ovan, medan övrigt i TNM-klassifikationen är identiskt med föregående version.
|
T |
Primärtumör urinblåsa (Baseras på fynd efter fysikalisk undersökning, radiologiska metoder och endoskopi med provexcision) |
|
Tx |
Primär tumör ej bedömbar |
|
T0 |
Primär tumör ej påvisbar vid histologisk undersökning av preparat |
|
Ta |
Icke-invasiv papillär tumör |
|
Tis |
Carcinoma in situ: "flat tumour" |
|
T1m/e |
Tumören infiltrerar subepitelial bindväv (lamina propria) (minimal/extensiv infiltration) |
|
T2a |
Tumören infiltrerar inre hälften av detrusormuskulaturen |
|
T2b |
Tumören infiltrerar yttre, djupare hälften av detrusormuskulaturen |
|
T3a |
Tumören infiltrerar perivesikal vävnad – mikroskopiskt |
|
T3b |
Tumören infiltrerar perivesikal vävnad – makroskopiskt (palpabel resistens) |
|
T4a |
Tumören infiltrerar prostata, uterus eller vagina |
|
T4b |
Tumören fixerad till bäckenvägg eller bukvägg |
Figur 6. TNM-systemet för urinblåsecancer
|
T |
Uretra |
|
Ta |
Icke-invasiv papillär, polypoid eller verruköst karcinom |
|
Tis |
Carcinoma in situ |
|
T1 |
Tumören infiltrerar subepitelial bindväv |
|
T2 |
Tumören infiltrerar något av följande: prostatastroma, corpus spongiosum eller periuretral muskel |
|
T3 |
Tumören infiltrerar något av följande: corpus cavernosum, utanför prostatakapseln eller blåshalsen |
|
T4 |
Tumören infiltrerar andra närliggande organ (urinblåsan) |
|
T |
Urotelial cancer i prostatiska uretra/prostata med intrauretral spridning (se också figur 5 ovan) |
|
Tis |
Carcinoma in situ i prostatiska uretra |
|
T1 |
Tumören infiltrerar subepitelial bindväv |
|
T2 |
Tumören infiltrerar något av följande: prostatastroma, corpus spongiosum eller periuretral muskel |
|
T3 |
Tumören infiltrerar något av följande: corpus cavernosum, utanför prostatakapseln eller blåshalsen |
|
T4 |
Tumören infiltrerar andra närliggande organ (urinblåsan) |
|
N |
Regionala lymfkörtlar (Avser körtelstationer belägna nedom aortabifurkationen. Baseras på fynd efter fysikalisk undersökning och radiologiska metoder) |
|
NX |
Regionala lymfkörtlar ej bedömbara |
|
N0 |
Inga påvisbara lymfkörtelmetastaser |
|
N1 |
Metastas i en lymfkörtel i bäckenet (iliaca externa-, iliaca interna-, eller obturatoriusområdet eller presakralt) |
|
N2 |
Metastas i flera lymfkörtlar i bäckenet (iliaca externa-, iliaca interna-, eller obturatoriusområdet eller presakralt) |
|
N3 |
Metastas i en eller flera lymfkörtlar i iliaca communis-området |
|
M |
Fjärrmetastaser (Baseras på fynd efter fysikalisk undersökning och radiologiska metoder) |
|
MX |
Fjärrmetastasering ej bedömbar |
|
M0 |
Fjärrmetastasering ej påvisad |
|
M1a |
Fjärrmetastasering påvisad till icke-regional lymfkörtel |
|
M1b |
Annan fjärrmetastasering än icke-regional lymfkörtel |
|
G |
Histopatologisk gradering WHO (1999) |
|
LMP |
Tumör med låg malignitetspotential |
|
G1 |
Högt differentierad |
|
G2 |
Medelhögt differentierad |
|
G3 |
Lågt differentierad eller odifferentierad |
|
G |
Histopatologisk gradering WHO (2004/2022) |
|
LMP |
Tumör med låg malignitetspotential |
|
Low-grade |
Låggradigt malign tumör |
|
High-grade |
Höggradigt malign tumör |
Obs! papillom ska inte anmälas. Tills vidare bör både WHO 1999 och 2004/2022 anges.
T1 tumörer i urinblåsan skall bedömas som ytlig eller utbredd laminapropria-invasiv tumörväxt. I TNM8 finns inte subklassificering men i WHO 2022 rekommenderas detta utan att någon metod förordas, finns det visst stöd för indelning i T1m (minimal/ytlig) enstaka focus mindre än 0.5 mm i diameter och T1e (extensiv/utbredd) multipla minimala foci eller utbredd mer än 0.5 mm i diameter 161162.
TNM-klassifikation 2017 för urotelial cancer i övre urinvägar 157
|
T |
Primär tumör |
|
TX |
Primär tumör ej bedömbar |
|
T0 |
Primär tumör ej påvisbar vid histologisk undersökning av preparat |
|
Ta |
Icke-invasiv papillär tumör |
|
Tis |
Carcinoma in situ: "flat tumour" |
|
T1 |
Tumören infiltrerar subepitelial bindväv (lamina propria) |
|
T2 |
Tumören infiltrerar muskulaturen |
|
T3 |
(Njurbäcken) Tumör invaderar peripelvint fett eller njurparenkym (Uretär) Tumör invaderar bortom muscularis in i periureteral fettvävnad |
|
T4 |
Tumör invaderar omgivande organ eller genom njurparenkymet i peripelvint fett |
|
N |
Regionala lymfkörtlar |
|
NX |
Regionala lymfkörtlar ej bedömbara |
|
N0 |
Inga påvisbara lymfkörtelmetastaser |
|
N1 |
Metastas i en lymfkörtel 2 cm eller mindre i största diametern |
|
N2 |
Metastas i en lymfkörtel större än 2 cm eller multipla lymfkörtlar |
|
M |
Fjärrmetastaser (Baseras på fynd efter fysikalisk undersökning och radiologiska metoder) |
|
M0 |
Inga fjärrmetastaser |
|
M1 |
Fjärrmetastaser |
För gradering används både WHO 1999- och WHO 2004/2022-klassifikationerna.
Molekylära subtyper vid blåscancer
Molekylära subtyper vid blåscancer beskrevs 2012 163, och en konsensusklassning har etablerats för muskelinvasiv blåscancer 164. Med molekylär karaktärisering finns möjligheter att den stora interobservatörsvariabilitet som föreligger för t.ex. tumörgrad 165 kan reduceras genom att i stället använda molekylär gradering 166.
Det finns hypotesgenererande fynd som talar för olika progressionsrisk i de molekylära subtyperna vid icke muskelinvasiv blåscancer och specifikt vid blåscancer stadium T1 167168169, där tidigare publicerade prognosmarkörer utgör proxys för molekylär subtyp 169.
Vidare finns data som stödjer att molekylär subtyp predikterar svar på neoadjuvant cisplatinbaserad kombinationskemoterapi 170, och jämfört med patienter med Basal/Skivepitel-lik subtyp (Ba/Sq) predikterar genomiskt instabil subtyp (GU) oberoende av tumörstadium komplett respons i cystektomiprepratat och överlevnad (HR 0.29 (0.11-0.79) 171. Motsvarande subtypsberoende respons på cisplatinbaserad kombinationskemoterapi föreligger också vid behandling av metastatisk sjukdom 172. Ba/Sq-subtyp predikterar respons på checkpoint-hämmarbehandling 173174, tillsammans med bl.a. PD-L1-uttryck.
Omfattande ansatser pågår för att implementera prognostisk och prediktiv information från molekylära subtyper vid behandling av blåscancer i klinisk rutin inklusive kostnadseffektivitetsanalyser av de-eskalerad användning av neoadjuvant kemoterapi utifrån molekylär subtyp. Analys för FGFR3-mutation och/eller FGFR2/3-fusioner i tumörmaterial och/eller ctDNA kommer också att krävas i klinisk rutin för prediktion av respons på erdafitinib både vid metastatisk sjukdom 175176 och BCG-behandlad högrisk icke-muskelinvasiv sjukdom 177.
Panelsekvensering
En bredare genetisk profilering av tumörens arvsmassa kan i vissa fall vara av värde för patientens fortsatta behandling inklusive medverkande i läkemedelsstudier. Behovet av sådan genomisk karaktärisering kommer sannolikt öka för patienter med lokalt avancerad och metastaserad sjukdom i takt med fler tillgängliga precisionsinriktade s.k. targetläkemedel. Inom Sverige finns en bred, nationellt utvecklad panel med ca 560 cancerassocierade gener (Genomic Medicine Sweden 560 (GMS560)) som inkluderar flera kända genetiska avvikelser. Det finns även andra kommersiella alternativ. Vid behov ta kontakt med ditt patologilaboratorium för vägledning.
