Diagnostik
Rekommendationer
Den primära utredningen bör inledas med DT-urografi, där misstanke om T3- eller T4-tumör bör beskrivas alternativt negeras i röntgensvaret (⊕⊕⊕), följt av cystoskopi (⊕).
Urincytologi på kastad urin utsvarad enligt Paris-systemet har hög sensitivitet för detektion av höggradig cancer (G3-tumörer) i urinvägarna (⊕⊕⊕).
Manuell kompression av påsen med spolvätskan när externa uretrasfinktern passeras med det flexibla cystoskopet minskar obehaget för patienten (⊕⊕⊕⊕), liksom musik under undersökningen (⊕⊕⊕⊕).
FDG-PET- DT utförd före TURB är av värde för patienter där misstanke om muskelinvasiv blåscancer föreligger och vid avancerad urotelial cancer i övre urinvägarna där kurativ behandling planeras eftersom undersökningen ökar detektionen av metastatisk sjukdom och kan användas för att monitorera svar på induktionskemoterapi (⊕⊕).
Separat resektat av tumörbas vid TURB bör inkludera muskel i preparatet (⊕⊕).
Bimanuell palpation bör utföras före och efter resektion vid TURB (⊕⊕).
Checklista bör användas i samband med TURB (⊕⊕).
Vid misstanke om G3-tumör (klinisk misstanke och/eller om Paris 3, 4 eller 5 föreligger i urincytologin) bör biopsier tas från normal slemhinna i blåsan (PDD/NBI) och biopsier från prostatiska uretra övervägas (⊕⊕).
Utvalda patienter bör erbjudas PDD eller NBI för att förbättra detektion av Tis (⊕⊕⊕).
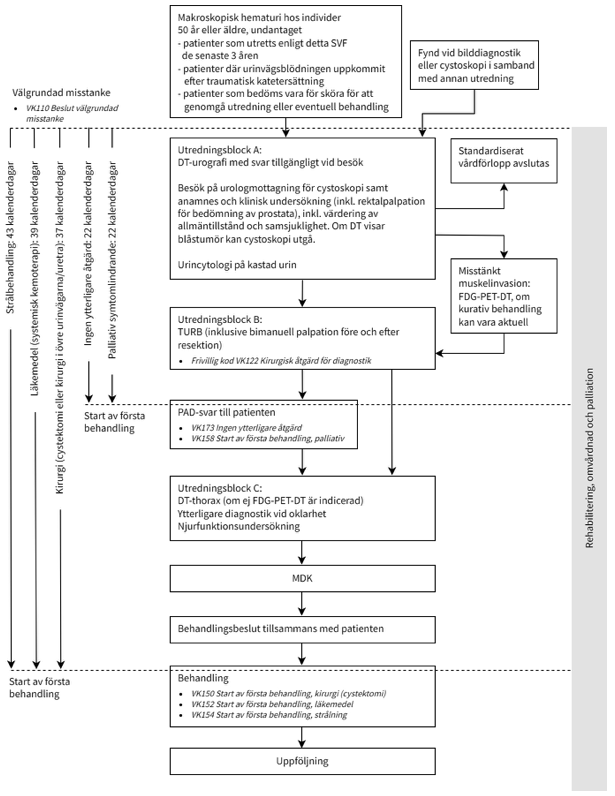
Det standardiserade vårdförloppet visar vilka steg som bör ingå i utredningen och vilken utredningstid som bör eftersträvas.
Figur 4.Flödesschema för standardiserat vårdförlopp
DT-urografi
Den primära utredningen bör inledas med DT-urografi. DT-urografi ger en bra bedömning av njurparenkym, njurbäcken och uretärer, av avflödesförhållanden och ofta av urinblåsan 61. DTurografin bör utföras med ett protokoll i minst tre faser innefattande icke-kontrastförstärkt fas, antingen kortikomedullär eller nefrografisk fas, och utsöndringsfas. Av strålhygieniska skäl bör individer 50 år och yngre med lägre risk för tumörfynd undersökas med mindre omfattande protokoll 86, se bilaga 18. En studie 62 visade att man vid klart fynd av blåscancer vid DT-urografi minskade andelen individer med makrohematuri som behöver göra cystoskopi i lokalbedövning med 17 procent, då dessa patienter kunde sättas upp direkt för transuretral resektion av den på röntgen påvisade blåstumören. För individer som genomgått en DT av buken med intravenös kontrast och god kvalitet inom 6 månader före hematuridebut, kan en riktad eftergranskning av denna undersökning vara tillräckligt och ersätta en DT-urografi.
Cystoskopi
DT-urografin följs av cystoskopi, som i dag vanligen utförs med flexibelt instrument både hos män och kvinnor innefattande undersökning av uretra. Enheter som utför cystoskopi bör ha lokala instruktioner om förberedelse och utförande av cystoskopi. Bedövningsgel bör appliceras långsamt för att minska obehag för patienten. Patienten bör vara välinformerad om undersökningens syfte och hur undersökningen utförs, samt om utrustningen tillåter erbjudas att följa undersökningen via bildskärm. Två randomiserade studier visar att manuell kompression av påsen med spolvätskan när externa uretrasfinktern passeras med det flexibla cystoskopet minskar obehaget för patienten 8788. Flera randomiserade studier och en meta-analys har visat att musik i samband med undersökningen också minskar obehag och oro upplevd i samband med cystoskopiundersökningen 899091. Efter undersökningen ges information om att urinträngningar, sveda och eventuellt blod i urinen kan förekomma i upp till en vecka utan att urinvägsinfektion föreligger. Det föreligger vetenskapligt stöd för sjuksköterske-ledd cystoskopimottagning för patienter med hematuri 92, och det pågår för närvarande en randomiserad svensk studie (ISRCTN15685750).
Cytologi
Cytologi på kastad urin (eller blåssköljvätska som dock inte monitorerar övre urinvägar eller uretra) ger ytterligare information och har hög sensitivitet för höggradig urotelial cancer (G3-tumörer), och kan därför vara av värde för att prediktera G3-tumörer liksom för planering av den transuretrala resektionen (TURB) avseende behov av resektionsbiopsier från prostatiska uretra och biopsier från urinblåsan för att utesluta cancer in situ 93 . En svensk version för kategorisering enligt Paris-systemet version 2.0 för rapportering av urincytologier föreligger nedan, med målet att minska andelen cytologier som besvaras med oklar atypi respektive öka sensitiviteten för detektion av höggradig urotelial cancer 94 95, även vid selektiv cytologi från de övre urinvägarna 96 97 . Betydelse av Paris-systemets klassificering i respektive kategori är följande:
Paris 1 - otillräckligt material eller otillfredsställande
Paris 2 - inga hållpunkter för höggradiga maligna uroteliala celler
Paris 3 – urotelial cellatypi
Paris 4 – misstanke på höggradiga maligna uroteliala celler
Paris 5 – höggradiga maligna uroteliala celler
Paris 6 – maligna celler av annan typ, specificera om möjligt.
Allt som bedöms som reaktivt p.g.a. inflammation, svamp eller behandling besvaras som Paris 2.
Skivepitelatypier, körtelcellsatypier och oklara atypier (skall undvikas) faller inom Paris 6.
Tumördiagnostiken i övre urinvägarna kan skärpas med selektiv cytologi från övre urinvägarna insamlad via uretärkateter eller i samband med ureteropyeloskopi (med eller utan biopsi).
Kompletterande diagnostik – urinmarkörer
Det finns ett flertal urinmarkörer för diagnostik av urinvägstumörer. Det föreligger en randomiserad studie som påvisade ökad detektion av blåstumörrecidiv hos de individer som vid cystoskopikontroll för känd blåscancersjukdom uppvisade positivt test jämfört med kontrollgruppen som endast undersöktes med cystoskopi 98. I en nypublicerad prospektiv randomiserad studie med non-inferiority design undersöktes Xpert Bladder Cancer Monitor (XBCM) som detekterar fem mRNA i urinen 99. I studien randomiserades patienter med höggradig icke muskelinvasiv tumörfri cystoskopi mellan standarduppföljning med kastad urincytologi och cystoskopi och i interventionsarmen ersattes två av tre konsekutiva cystoskopier alternerande med kastad urincytologi och XBCM. Endast två höggradiga Ta-tumörer missades i studien med XBCM-testet. I en mindre randomiserad studie undersöktes jämfördes flera olika urinmarkörer vid uppföljning av låg och intermediärrisk icke muskelinvasiv blåscancer.100. Ytterligare vetenskapligt underlag fordras innan någon av dessa urinmarkörer kan ersätta cystoskopi som uppföljning i denna grupp av icke-muskelinvasiv blåscancer 101.
Stadieindelning blåscancer
DT-urografi
För stadieindelning av blåstumörer avseende lokalt tumörstadium, lymfkörtelspridning och fjärrmetastaser används DT-urografi, ofta redan utförd i den initiala hematuri-utredningen. Med denna modalitet kan inte stadium Ta, T1 och T2 särskiljas, men förekomst eller misstanke om T3- eller T4-tumör bör beskrivas alternativt negeras, eftersom lokalt avancerad tumör kan föranleda tilläggsdiagnostik med FDG-PET-DT och/eller MRT före TURB med en accelererad utredningsgång. Mer detaljerad beskrivning av hur ett komplett radiologiskt utlåtande bör utformas finns i bilaga 18.
TURB
Mer precis stadieindelning samt gradering av iakttagna blåstumörer sker genom TURB i generell anestesi, där det är viktigt att representativ detrusormuskel finns med i preparatet i en separat fraktion från tumörbasen för att man korrekt ska kunna bedöma tumörens infiltrationsdjup. Patienten palperas bimanuellt före och efter resektionen (se bilaga 3).
Biopsi från normal slemhinna, s.k. mapping, utfördes tidigare vid negativ cystoskopi med positiv urincytologi samt vid icke-papillära ej uppenbart muskelinvasiva tumörer (G3-tumörer). I dag rekommenderas istället fluorescensdiagnostik med biopsier av fluorescerande slemhinna alternativt narrow band imaging eller motsvarande vid sådan kartläggning av urinblåsan tillsammans med resektionsbiopsier från prostatiska uretra. Resektionsbiopsier från prostatiska uretra tas vid misstanke om höggradig urotelial cancer i den preoperativa urincytologin (Paris 3, 4 eller 5), vid kliniskt suspekt carcinoma in situ, vid positiv urincytologi med negativ cystoskopi enligt ovan, vid tumörväxt i blåshalsen och vid patologiska fynd i prostatiska uretra. Biopsier från prostatiska uretra respektive blåshals hos kvinnor är också av värde för att bedöma lokal tumörutbredning och senare risk för återfall i uretra inför radikal cystektomi, speciellt då neoadjuvant kemoterapi planeras eftersom värdet av fryssnittsdiagnostik på uretra efter sådan förbehandling inte är klarlagt.
Användning av checklista i samband med TURB för att öka andel med detrusormuskel i resektatet rekommenderas 102, då även visst stöd för att systematisk användning av checklista i samband med operationen kan förbättra återfallsfri överlevnad vid icke-muskelinvasiv sjukdom (se Checklista vid TURB (modifierad efter 36–38) 103104.
MRT
Vid lokalt avancerad tumör där DT-urografi bedöms otillräcklig för att adekvat bedöma överväxt på andra organ och bäckenvägg, men även meatus uretra internus hos kvinnor, kan MRT ibland ge tydligare information före TURB och därmed underlätta bedömningen av resektabilitet och lämplig operationsmetod. Med MRT genomförd efter TURB föreligger svårigheter med att göra en korrekt stadieindelning p.g.a. postoperativt ödem efter TURB. I en studie från Södra sjukvårdsregionen överskattades kliniskt tumörstadium jämfört med tumörstadium i cystektomipreparatet hos varannan patient 105 , medan underskattning av tumörstadium och förekomst av lymfkörtelmetastaser 106 också är vanligt med samtliga radiologiska metoder. Det är således viktigt att MRT-undersökningen görs före TURB för att undvika artefakter.
För att standardisera multiparametrisk MRT för att detektera muskelinvasiv sjukdom innan TURB är genomförd, har VI-RADS (Vesical Imaging-Reporting and Data System) utarbetats 107 . I en översiktsartikel från 2020, rapporteras sammanlagd sensitivitet och specificitet för att detektera muskelinvasiv tumör vara 0.90 respektive 0.86 med VI-RADS 3 som cut off 108 . Prospektiva studier av MRT vid suspekt muskelinvasiv sjukdom har dock visat bristande specificitet i denna kliniska situation 109 110 . Jämfört med TURB, hade endast 5/15 individer där MRT visade muskelinvasion patologiskt konfirmerad sådan 109.
FDG-PET-DT
Fluorodeoxyglukos (FDG) positronemissionstomografi med datortomografi (PET-DT) rekommenderas vid misstänkt muskelinvasiv sjukdom då undersökningen enligt flera studier ökar detektionen av metastatisk sjukdom hos patienter där kurativ behandling planeras 111 112 . En nyligen utförd DT-urografi finns oftast tillgänglig inför PET-DT, och då kan undersökningen utföras med s.k. lågdos DT och utan intravenös kontrast. Föreligger ingen DT av thorax, kan denna göras i samband med PET-undersökningen för att öka detektionen av små lungmetastaser, men bör då göras med diagnostisk kvalitet.
Regional lymfkörtelspridning påvisad med PET-DT är en oberoende riskfaktor för blåscancerdöd 112 113 . Ändrad handläggning till följd av preoperativt utförd FDG-PET-DT-undersökning inför cystektomi vid muskelinvasiv blåscancer har rapporterats hos mellan 18 % och 25 % av patienterna 114 115 , och för en av 10 patienter med icke-muskelinvasiv sjukdom inför planerad cystektomi 116 . Specificiteten för PET-DT för detektion av metastatisk sjukdom är hög (0.89) i de studier som finns publicerade117 118 , vilket överensstämmer med en ny svensk studie 119 . Vidare finns visst stöd för att specificiteten för lymfkörtelmetastaser ökar med ökande SUV i lymfkörtel som är detekterad i samband med PET-DT 120 . Vid enbart begränsat upptag i lymfkörtlar bör möjligheten att dessa står för reaktiva förändringar beaktas. Metoden kan inte säkert skilja mellan inflammation och malignitet utan speglar glukosmetabolism i förändringen. Specificiteten avseende regional lymfkörteldiagnostik är sannolikt högre om PET-DT görs före TURB.
Det finns också data som talar för att PET-DT kan vara av värde för att prediktera respons på induktionskemoterapi och överlevnad vid lymfkörtelspridd sjukdom 121 122 123 124 , och före start av sådan behandling kan PET-DT alltså vara indicerat. För patienter där jodkontrast är kontraindicerat pga. t.ex. nedsatt njurfunktion eller allergi, har PET-DT utan jodkontrast också tilläggsvärde jämfört med metastasscreening enbart med DT utan kontrast.
Särskilda tekniker
Fluorescensdiagnostik, Narrow Band Imaging och IMAGE1 S
Fluorescensdiagnostik kan förbättra den endoskopiska diagnostiken och vara vägledande för biopsering av slemhinna som ter sig normal i vitt ljus 125. Undersökningen kan också utföras i lokalbedövning med flexibelt instrument, och i en randomiserad studie jämförande fluorescensdiagnostik med hexaminolevulinat och konventionell flexibel cystoskopi i vitt ljus vid första cystoskopikontrollen efter TURB kunde risken för senare recidiv reduceras med 33 procent i den experimentella studiearmen 126 .
Fotodynamisk diagnostik (PDD) innebär att man använder ultraviolett ljus efter instillation av 5-ALA eller hexaminolevulinat (HAL = Hexvix) i urinblåsan. PDD är mer sensitivt när det gäller diagnostiken av blåscancer vid cystoskopi och transuretral resektion (TURB) jämfört med konventionell teknik. Studier rapporterar en ökad detektion av framför allt carcinoma in situ 127 och i äldre studier förbättrad recidivfri överlevnad efter TURB 128 , vilket dock inte kunnat valideras i nyare randomiserade studier 129 130 . Hexaminolevulinat har bättre dokumentation än 5-ALA, men bägge preparaten har bristande specificitet då de även tas upp i inflammatoriska lesioner (både akuta och kroniska) samt för att tekniken även ger en fluorescens vid tangentiellt ljus. Detta leder till överdiagnostik och lägre specificitet jämfört med konventionell cystoskopi 131 . Observera speciellt risken för överdiagnostik efter tidigare BCG-behandling (första tre månaderna 131 , nyligen genomgången TURB och pågående kateterbehandling.
PDD vid TURB rekommenderas vid
- alla fall med en positiv urincytologi utan synlig tumör vid ordinär cystoskopi
- multipla blåstumörer
och kan även användas vid
- nydiagnosticerade blåstumörer som inte bedömts som uppenbara cystektomifall.
Teknik
- Hexvix 85 mg blandas med medföljande 50 ml vätska, till koncentrationen 8 mmol/l, enligt instruktion i FASS.
- 50 ml av Hexvix-lösningen (8 mmol/l) instilleras i blåsan genom en kateter. Patienten ska hålla kvar vätskan i ungefär 60 minuter. Efter tömning av blåsan ska cystoskopin med blått ljus påbörjas inom ungefär 1–2 timmar. Hexvix är atoxiskt, men risk för hypersensibilisering kan finnas 132 .
Tilläggskod vid flourescensassisterad TURB är ZXM40, och TKC25 för intravesikal instillation av läkemedel (Hexvix).
Narrow Band Imaging (NBI) i samband med cystoskopi förstärker kontrasten mellan normal och hypervaskulariserad vävnad genom att ljuset filtreras i två våglängder (415 och 540 nm) vilka absorberas av hemoglobin, och underlättar därmed upptäckten av tumör i urinblåsan. Fördelarna med NBI är att metoden är lätt att använda och inte kräver någon föregående instillation i blåsan som vid fotodynamisk diagnostik (PDD), och att metoden finns inbyggd i cystoskopiutrustningen. Precis som vid PDD ger tekniken en bristande specificitet vid inflammatoriska lesioner i blåsan.
Det finns vetenskapligt stöd för att NBI förbättrar detektionen av icke-muskelinvasiv cancer inkluderande carcinoma in situ, men metoden är mindre studerad än PDD men har samma eller bättre detektionsförmåga 128 133 . Förbättrad recidivfrihet efter TURB med användande av NBI finns rapporterat efter tre och tolv månader i en subgruppsanalys av lågrisktumörer i en randomiserad studie jämförande TURB med eller utan NBI 134 (se också bilaga 19).
IMAGE1 S™ (tidigare SPIES) är ett annat kontrastförstärkningssystem som precis som NBI baserar sig på filtrering av färgkomponenter. Det föreligger visst vetenskapligt stöd för förbättrad tumördetektion jämfört med cytsoskopi i vitt ljus 135 136 medan en randomiserad studie utföll negativt avseende recidivfri överlevnad efter TURB, om än med förbättrad recidivfri överlevnad i subgruppen primär låg- och intermediärrisk icke-muskelinvasiv blåscancer 137 .
Utredning av njurbäcken- och uretär cancer
Rekommendationer
Samtliga patienter med urotelial cancer i övre urinvägarna bör diskuteras på en multidisciplinär konferens eftersom valida data för sjukdomen är sparsamma i litteraturen p.g.a. sjukdomens låga incidens. Lämpligen diskuteras patienten innan beslut om diagnostisk uretäroskopi tas.
Eftersom risken för Lynchs syndrom är särskilt hög vid urotelial cancer
i de övre urinvägarna rekommenderas reflextestning för mismatch-reparationsstatus med immunhistokemisk färgning för MSH2, MSH6, MLH1 och PMS2 vid urotelial cancer i de övre urinvägarna (⊕⊕).
Familjeanamnes ska upptas vid urotelial cancer, med särskild uppmärksamhet på kolorektalcancer och endometriecancer hos förstagradssläktingar (⊕⊕).
Patienter med urotelial cancer i övre urinvägarna bör förutom DT-urografi utredas med cystoskopi och urincytologi på kastad urin för att utesluta synkron blåscancer (⊕⊕⊕).
Liksom vid urinblåsecancer är det vanligaste symtomet vid urotelial cancer i övre urinvägarna makroskopisk hematuri eller symptom relaterade till avflödeshinder. Basal diagnostik består av cystoskopi, urincytologi på kastad urin och röntgendiagnostik av de övre urinvägarna. DT-urografi har hög sensitivitet (92 %) och hög specificitet (95 %) för detektion av urotelial cancer i övre urinvägarna 138 , och kan samtidigt också ge en uppfattning om eventuellt lokalt avancerat tumörstadium samt lymfkörtel- eller fjärrmetastasering. Vid diagnostiska tveksamheter eller då intravenös jodkontrastmedel är kontraindicerat, kan MRT-urografi (med eller utan gadoliniumbaserat kontrastmedel beroende på klinisk situation) utgöra ett komplement eller alternativ 139 , inklusive för lokal staging 140 . En alternativ utredningsmodalitet är vidare utredning med selektiv urincytologi för diagnostik med eller utan retrograd pyelouretärografi via en uretärkateter upplagd i lokalbedövning. I många fall kan man med denna diagnostik få tillräcklig diagnostisk säkerhet (entydig röntgenbild och positiv urincytologi eller selektiv cytologi) för att kunna planera adekvat behandling. Om den selektiva urincytologin är negativ och/eller röntgenfyndet icke konklusivt, eller om man av någon anledning betvivlar malign diagnos, bör uretäroskopi med biopsi utföras. Uretäroskopi med biopsi bör också övervägas om nefronsparande kirurgi övervägs och vid singelnjure eller om histologisk verifikation inför induktionskemoterapi krävs. Dock innebär diagnostisk uretäroskopi före nefrouretärektomi ökad risk för senare intravesikalt tumörrecidiv 141 142 143 144 145 , speciellt vid uretärcancer i en svensk populationsbaserad studie 146 .
Det finns också hypotesgenererande data som stödjer att inläggning av dubbel-j-kateter före cystektomi eller i samband med TURB ökar risken för senare metakron urotelial tumör i övre urinvägarna 147 148 149 150 . Vid avflödeshinder i de övre urinvägarna vid muskelinvasiv blåscancer och behov av avlastning rekommenderas därför i första hand nefrostomi.
Det är svårt att säkert förutsäga stadium och grad utifrån preoperativa röntgenundersökningar, men i det radiologiska utlåtandet bör eventuella tecken på T3- eller T4-tumör beskrivas eller negeras, liksom förekomst av lymfkörtel- eller fjärrmetastaser (se bilaga 18) 151 . Uretäroskopi med biopsi underskattar ofta både grad och stadium, och patologisk uppgradering i nefrouretärektomipreparatet har i vissa studier överskridit 50 procent 152 153 154 155 .
Metastasutredning med DT av thorax ingår som standardutredning för stadieindelning, men FDGPETDT kan också vara av värde speciellt med hänsyn till undersökningens höga sensitivitet (82 %) och specificitet för detektion av lymfkörtelmetastaser (84 %) 156 , jämfört med 25 procent sensitivitet med DT 157. FDG-PET-DT är särskilt värdefullt hos individer med nedsatt njurfunktion som omöjliggör användning av intravenöst jodkontrastmedel. Inför val av radikal eller konservativ behandling kan separatclearance innefattande iohexolclearance och renografi övervägas för patienter med nedsatt njurfunktion.
Utredning av urotelial cancer i prostatiska uretra och prostata
Vid misstanke om höggradig urotelial cancer (urincytologi med Paris 3,4 eller 5) och/eller infiltrativt växande blåstumör utförs PDD eller NBI-assisterad kartläggning av urinblåsan med kall klocktång (i andra hand randomiserade biopsier (mapping)) för att identifiera samtidig carcinoma in situ (Tis) samt resektionsbiopsier från blåshals till kollikel i prostatiska uretra klockan fem och sju, och hos kvinnor med klocktång från blåshalsen. Hos män är området kring kollikeln viktigast att kartlägga eftersom det är där de flesta prostatautförsgångarna mynnar, vilket gör att möjligheten att detektera intraduktal växt är bäst här 158 .
Incidensen av urotelial cancer i prostatiska uretra och prostata konkomittant med Ta- och T1-tumörer i urinblåsan är överlag låg. Bland patienter med icke-muskelinvasiv blåscancer med högrisk-karaktäristika är dock tumöråterfall i prostatiska uretra och prostata beskrivna hos 13–39 procent i tre studier 159 160 161 . I cystoprostatektomipreparat är incidensen av urotelial cancer i prostatiska uretra och prostata högre, speciellt om prostata undersöks noggrant med storsnittsteknik, då 2948 procent av patienterna uppvisar sådan växt 162 163 .
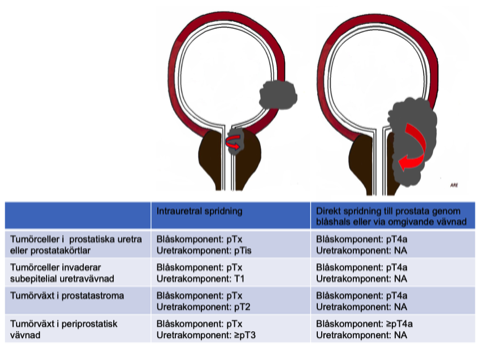
I den senaste TNM-klassifikationen från 2017 har stadieindelningen för urotelial cancer i prostatiska uretra och prostata ändrats och bl.a. har intraduktal Tis tagits bort 164 , och betydelsen av spridningsväg (intrauretral visavi via blåshalsen eller extravesikal tumörväxt från blåsan) förtydligats 165 , där den intrauretrala spridningsvägen är den vanligaste. Den viktigaste prognostiska diskriminatorn mellan spridningsvägarna är cT2 vid intrauretral spridning (med urotelial cancer i prostatastroma) som har bättre prognos jämfört med direktöverväxt i prostatastromat från blåshalsen eller extravesikalt (cT4a). Den kliniska stadieindelningen är behäftad med osäkerhet jämfört med cystoprostatektomipreparatet (patologisk stadieindelning), eftersom den kliniska baserar sig på det transuretrala resektionspreparatet utan orientering tillsammans med radiologi och endoskopifynd (se figur nedan) 166 .
Figur 5. TNM-klassificering av urotelial cancer i prostatiska uretra/prostata