Behandling vid metastatisk sjukdom
Rekommendationer
Första linjens behandling för patienter som tolererar kombinationsbehandling:
I första hand rekommenderas kombinationen enfortumab vedotin/pembrolizumab (EV/P) (⊕⊕⊕⊕).
Om EV är olämpligt och patienten är tolererar cisplatin, rekommenderas kombinationsbehandling med cytostatika-immunterapi med GC/nivolumab (⊕⊕⊕⊕).
Om nivolumab är olämpligt, rekommenderas cisplatin-baserad kombinationscytostatika med GC, MVAC eller GCP (⊕⊕⊕⊕). GC bör användas framför MVAC och GCP på grund av mildare biverkningsprofil.
För patienter som varken tolererar EV/P- eller cisplatin rekommenderas i första linjen kombinationscytostatika med karboplatin-gemcitabin (⊕⊕⊕).
Patienter med stabil sjukdom eller respons på första linjens cisplatin- eller karboplatin-innehållande kombinationsbehandling med gemcitabin, och där inte samtidig nivolumab givits, rekommenderas fortsatt underhållsbehandling med avelumab (⊕⊕⊕⊕).
Första linjens behandling för patienter som inte bedöms tåla kombinationsbehandling:
För patienter med PD-L1 positiva tumörer kan immunterapi med pembrolizumab eller atezolizumab övervägas (⊕⊕) alternativt singelbehandling med gemcitabin (⊕).
Analys av PD-L1 uttryck i tumören bör genomföras för patienter som ej tolererar cisplatin och som kan vara aktuella för immunterapi (⊕⊕).
Andra linjens behandling:
I andra linjen efter enfortumab vedotin/pembrolizumab (EV/P) rekommenderas i första hand platinum-kombinationskemoterapi (⊕) alternativt erdafitinib (⊕) om tumören uppvisar FGFR2/3 alteration.
Efter GC/nivolumab rekommenderas monoterapi med enfortumab vedotin (⊕⊕⊕⊕) alternativt erdafitinib om tumören uppvisar FGFR2/3 alteration (⊕⊕⊕⊕) alternativt vinflunin (⊕).
Efter platinumkombinationskemoterapi följt av underhållsbehandling med avelumab rekommenderas monoterapi med enfortumab vedotin (⊕⊕⊕⊕) alternativt erdafitinib om tumören uppvisar FGFR2/3 alteration (⊕⊕⊕⊕) alternativt vinflunin (⊕).
I andra linjen efter platinumkombinationskemoterapi rekommenderas monoterapi med pembrolizumab om inte immunterapi givits tidigare (⊕⊕⊕⊕) alternativt vinflunin (⊕⊕⊕).
Tredje linjens behandling:
I tredje linjen beaktas tidigare givna behandlingar i första och andra linjen. Både behandling med enfortumab vedotin (⊕⊕⊕⊕), erdaftinib om tumören uppvisar FGFR2/3 alteration (⊕⊕⊕⊕) eller konventionell kemoterapi (⊕) kan vara aktuellt om någon av dessa inte tidigare givits.
Patienter med skelettmetastaserad urotelial cancer bör behandlas med zoledronsyra eller denosumab för att förebygga skelettrelaterade komplikationer (SRE) (⊕⊕⊕).
Palliativ strålbehandling i smärtlindrande syfte bör utnyttjas generöst.
Systemisk behandling
Generaliserad urinblåsecancer är känslig för konventionella cytostatika, immunterapier och målriktad onkologisk behandling. Innan konventionella cytostatika introducerades var medianöverlevnaden begränsad till cirka 4–6 månader 436 , men den har förbättrats till cirka 2–2.5 år för patienter som tål kombinationer av nya systemiska behandlingar 437 438 439 440 .
Under senare år har det skett genombrott avseende utveckling och introduktion av nya målriktade läkemedel, s.k. antikropp läkemedels-konjugat (ADC). ADC-läkemedel består av en monoklonal antikropp (Mab) med specificitet mot antigen som är överuttryckt i tumörceller, med en länkad cytotoxisk substans (s.k. ”payload”) som genom antikroppen får en riktad effekt mot tumörcellerna. Olika ADC-läkemedel skiljer sig åt genom att ha olika specificitet och/eller ”payload”, vilket har betydelse för effekt och biverkningsprofil. Kombinationen av ADC-läkemedel och immunterapi har visat sig särskilt effektiv vid generaliserad urotelial cancer och en ny standardbehandling som inte innehåller konventionell cytostatika har nyligen godkänts i första linjen, enfortumab vedotin/pembrolizumab (EV/P), vilket innebär ett paradigmskifte i hanteringen av dessa patienter. I enfortumab vedotin utgörs den cytotoxiska substansen av monomethyl auristatin E (MMAE) och målantigenet är transmembranproteinet nectin4, som i mycket hög grad är uttryckt i avancerad urotelcellscancer 184 441 . När antikroppen binder till nectin-4 internaliseras ADC-nectin-4 komplexet, MMAE frisläpps vilket påverkar mikrotubuli och apoptos induceras.
Tillsammans med konventionella cytostatika och ADC-läkemedel utgör systemisk immunterapi en ytterligare hörnpelare i behandlingen i flera sjukdomsfaser. Immunterapin utövar sin effekt genom s.k. checkpoint-inhibition med hjälp av antikroppar. Det finns flera immunologiska checkpoints, t.ex. cytotoxiskt T-lymfocytiskt associerat protein 4 (CTLA-4) och PD1-PD-L1/PD-L2 som negativt reglerar Tcellernas aktivitet. PD-1 (Programmerad celldöd-1) är en receptor som uttrycks på Tceller. När någon av dess ligander PD-L1 eller PD-L2, som kan återfinnas på cancercellerna och/eller tumörinfiltrerande immunceller binder till receptorn, nedregleras T-cellssvaret mot cancercellerna. Effekten utövas genom blockad av PD-1-PD-L1/PD-L2-interaktionen genom att endera binda till receptorn (anti-PD1-antikroppar) eller liganden PD-L1 (anti-PDL1-antikroppar) och därigenom hämmas den blockerande signalen och immunsystemet kan re-aktiveras mot cancern. Sammantaget finns fyra immunterapeutiska antikroppar för urotelcellscancer som är rekommenderade av NT rådet i olika sjukdomssituationer (avelumab, atezolizumab, nivolumab, pembrolizumab). Det finns inga direkt jämförande studier av de godkända immunterapierna vid blåscancer. Uttryck av PD-L1 expression är relevant att analysera inför behandling i vissa sjukdomssituationer och måste då mätas med för den terapeutiska antikroppen avsedd metod och diagnostiska plattform 442 443 .
Utöver konventionell cytostatika, immunterapier och ADC-läkemedel har även målriktad behandling med tyrosinkinashämmare (erdafitinib) nyligen godkänts som ett ytterligare systemiskt behandlingsalternativ. Erdafitinib ges peroralt och är en pan-FGFR hämmare som kan erbjudas patienter som tidigare erhållit behandling med immunterapi och har påvisade FGFR2/3 mutationer/fusioner i tumörcellerna.
Även bisfosfonater, RANK-L-hämmare och strålbehandling är viktiga behandlingsmodaliteter vid metastaserad blåscancer (se separata avsnitt nedan).
Flera etablerade kliniska faktorer har historiskt använts för att vägleda terapi och bedöma prognos vid cytostatikabehandling, såsom Karnofsky index < 80 procent och förekomst av viscerala metastaser 444 . Även vid senare linjers behandling har faktorer som lågt Hb (<100 g/l), ECOG/WHO PS > 1, levermetastasering och kort tid från föregående behandling visats vara prognostiskt ogynnsamma 445 446 . Relevansen av dessa faktorer vid dagens förstahandsbehandling med EV/P är ännu inte fullt klarlagd.
Vårdprogramgruppen förordar generellt om möjligt att patienter inkluderas i kliniska studier. Det finns ett pågående nationellt akademiskt samarbete för kliniska prövningar inom Svensk Förening för Urologisk Onkologi (SFUO) respektive nordiskt samarbete inom Nordic Urothelial Cancer Oncology Group (NUCOG).
Figur 8.Förenklad översikt av aktuella behandlingslinjer
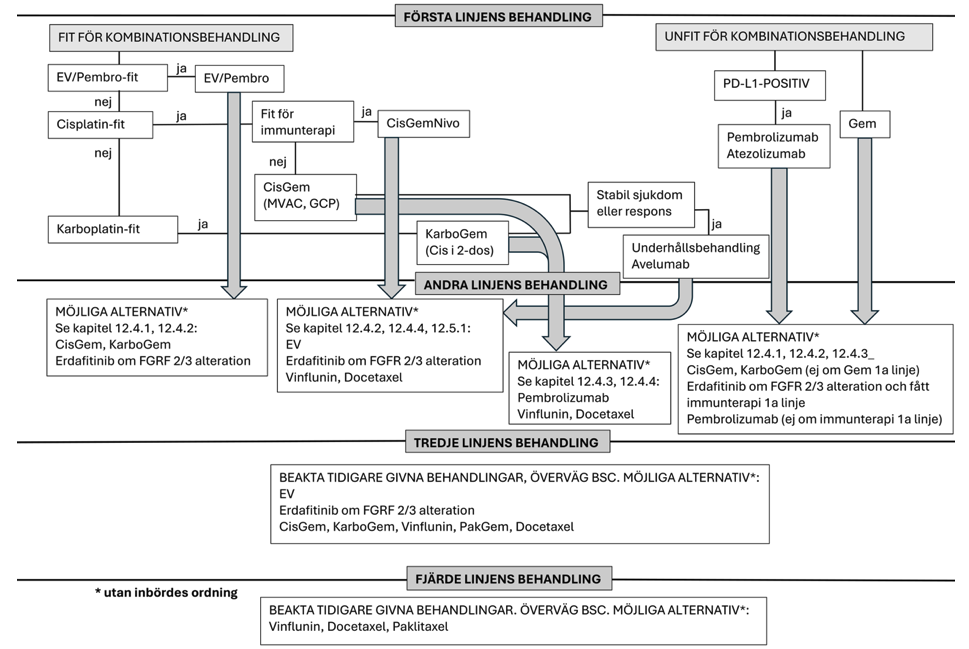
Bedömning av tolerans för kombinationsbehandling
Vid bedömning av patient inför val av systemisk behandling har ett paradigmskifte skett såtillvida att patienter skall bedömas primärt avseende om de tål systemisk kombinationsbehandling eller ej, och inte som tidigare om patienten är primärt behandlingsbar med cisplatin-innehållande kombinationsbehandling eller ej.
Denna förändring är en konsekvens av godkännande och introduktion av enfortumab vedotin i kombination med pembrolizumab (EV/P) som ny förstalinjes behandling (se nedan kapitel 12.1.2.1). För att bedöma om en patient tål systemisk kombinationsbehandling eller ej rekommenderas att huvudkriterierna för inklusion i den registreringsgrundande studien (EV302/KN39A), där EV/P jämfördes mot tidigare standardbehandling med cisplatin-gemcitabin alternativt karboplatin-gemcitabin utnyttjas.
I och med att standardarmen i EV-302/KN39A studien var cisplatin-gemcitabin alternativt karboplatin-gemcitabin, kan huvudinklusionskriterierna sammanfattas till dem vi tidigare använt för att selektera patienter för kombinationsbehandling med cisplatin-gemcitabin alternativt karboplatin-gemcitabin (ECOG performance status 0–2, GFR > 30 ml/min) och blodvärden och övriga organfunktioner förenliga med EV/P behandling (se nedan 12.3.1.1). Vid implementering av dessa inklusionskriterier i klinisk rutin är det viktigt att komma ihåg att patienterna i EV-302/KN39A studien också bedömdes vara lämpliga för studiedeltagande som helhet.
Bedömning av tolerans för platinum
Vid bedömning av systemiska behandlingsalternativ är värdering av tolerans för platinum-baserad kemoterapi fortsatt central för patienter som inte primärt bedöms som kandidater för EV/P, men också vid progress på EV/P inför andra linjes behandling. Patienter kategoriseras in enligt följande; de som tål cisplatin-baserad kombinationskemoterapi, de som tål karboplatin-baserad kombinationskemoterapi men inte tål cisplatin-baserad kemoterapi, samt de som inte tål vare sig cisplatin- eller karboplatin-innehållande kombinationskemoterapi. Dessa tre kategorier benämns i klinisk praxis för ”cisplatin-fit”, ”cisplatin-unfit” respektive ”platinum-unfit”. Patienter med gott allmäntillstånd (PS 0–1), bibehållen njurfunktion (GFR > 50–60 ml/min) och i övrigt utan komplicerande sjukdomstillstånd utgör cisplatin-fit gruppen, medan patienter som har en eller flera av följande karakteristiska: PS ≥ 2, nedsatt njurfunktion (GFR 30–50/60 ml/min), hörselnedsättning (> grad 1), perifer neuropati (> grad 1) och hjärtsvikt (NYHA klass > grad II) tillhör cisplatin-unfit gruppen (bilaga 9), och patienter med PS > 2 eller gravt nedsatt njurfunktion (< 30 ml/min) eller kombination av PS 2 och GFR < 50–60 ml/min) kategoriseras till platinum-unfit 447 448 .
Behandling i första linjen
Behandling i första linjen för patienter som tolererar kombinationsbehandling
Enfortumab vedotin/Pembrolizumab (ADC-Immunterapi)
Kombinationsbehandling med EV/P utgör standardbehandling i första linjen för patienter som bedöms tåla kombinationsbehandling enligt definitionen i avsnitt 12.1.1 ovan. I EV-302/KN39A studien jämfördes EV/P mot konventionell platinum-kombinationskemoterapi med cisplatin-gemcitabin alternativt karboplatin-gemcitabin utifrån platinumtolerans. I interventionsarmen gavs EV till progress tillsammans med maximalt 35 cykler pembrolizumab och i standardarmen upp till sex cykler platinum-kombinationskemoterapi. Både progressionsfri överlevnad (PFS) och total överlevnad (OS) förlängdes med EV/P jämfört kontrollarmen (median PFS 13 vs 6 månader (HR 0.45 (CI 0.38–0.54) och median OS 32 vs 16 månader (HR 0.47 (CI 0.38–0.58)). Överlevnadsvinst för behandling med EV/P sågs över lag i de på förhand definierade subgrupperna. Vidare var behandlingsrespons (ORR) signifikant högre i EV/P än i standardarmen (ORR 68 % vs 44 %) liksom andel komplett respons (CR) (CR 29 % vs 13 %). Ett observandum är att endast ca 30 procent av patienterna i standardarmen erhöll underhållsbehandling med avelumab.
Även om incidensen av biverkningar grad ≥ 3 för EV/P sammantaget var något lägre än för standardbehandling (56 % vs 70 %), skiljer sig biverkningsprofilen markant gentemot platinum-baserad kombinationskemoterapi. Därför rekommenderas extra uppmärksamhet avseende biverkningar med proaktiv uppföljning och eventuell dosjustering av EV, särskilt under introduktionsfasen. EV-specifika biverkningar under EV/P behandling inkluderar bl. a. hudtoxicitet (ofta tidigt i förloppet med karaktäristisk utbredning), perifer neuropati (ofta dosbegränsande på sikt), ögonsjukdomar och hyperglykemi. Det kan ibland vara utmanande att avgöra om en biverkan är relaterad till EV eller pembrolizumab, alternativt av kombinationen. Var god se avsnitt 12.6 nedan avseende immunrelaterade biverkningar till följd av pembrolizumab. För råd kring hantering av biverkningar till följd av EV/P respektive hudtoxicitet till följd av EV, var god se följande två referenser 449 450.
Kemo-immunoterapi till patienter som tolererar cisplatin
Patienter som tolererar cisplatin (cisplatin-fit) men inte bedöms tåla EV (kan vara t.ex. patienter som sedan tidigare har en svår/kontrollerad diabetes, neuropati grad ≥ 2 eller besvärande hudsjukdom) bör i stället bedömas avseende behandling med kemo-immunterapi. EMA och NT-rådet godkände våren 2024 den första kombinationsbehandlingen vilket baseras på en randomiserad fas 3 studie där standardbehandling med gemcitabin-cisplatin jämfördes med tillägg av nivolumab i kombination med gemcitabin-cisplatin (GC/N) följt av underhållsbehandling med nivolumab till progress eller maximalt 24 månader 438 . Denna nya kombinationsstrategi med GC/N visade en förbättrad ORR inklusive en högre andel komplett remission, som i vissa fall var långvarig 438 . Även OS var bättre (22 vs 19 månader (HR 0.78 (CI 0.63–0.96) men behandlingen var också associerad med en något högre incidens av behandlingsrelaterad grad 3 toxicitet. Ett alternativ för patienter som inleder behandling med endast GC och utvecklar minst stabil sjukdom är att ge avelumab som underhållsbehandling (kapitel 12.2.1.5).
Kemoterapi till patienter som tolererar cisplatin
För patienter som inte bedöms tåla EV/P eller GC/N skall cisplatin-baserad kombinationskemoterapi övervägas. I randomiserade studier har MVAC (metotrexat/vinblastin/doxorubicin/cisplatin) varit mer effektivt jämfört med t.ex. endast cisplatin, cisplatin/metotrexat, metotrexat/vinblastin, cisplatin/ifosfamid/doxorubicin och cisplatin/metotrexat/vinblastin 451 452 453 454 455 456 . Kombinationen gemcitabin/cisplatin (GC) har jämförts med MVAC var fjärde vecka i en randomiserad fas III-studie med jämförbara resultat avseende overall response rate (ORR) (49 % vs 46 %) och total överlevnad (OS) (14 månader vs 15 månader), men med mindre toxicitet 299 . För patienter med lätt till måttligt nedsatt GFR kan man överväga alternativet att ge cisplatindosen uppdelad på två dagar 457 . Vidare har trippelbehandling med gemcitabin/cisplatin/paklitaxel (GCP) jämförts med gemcitabin/cisplatin. Man fann en signifikant förbättrad ORR men ingen signifikant förbättrad OS jämfört med gemcitabin/cisplatin. Incidensen av neutropeni och neutropen feber var vidare högre för trippelbehandlingen 457 .
Flera studier har visat att karboplatin i olika kombinationer också har effekt vid metastaserad sjukdom med OS på ca 8–10 månader, men ingen studie har kunnat visa att dessa är likvärdiga eller bättre än regimer innehållande cisplatin 447 458 459 460 461 462 463 464 465 466 467 468 469 470 . Real-world data studier indikerar också att cisplatin är mer effektivt än karboplatin 471 472 . Patienter som är cisplatin-fit bör således i första hand ges cisplatin-innehållande kombinationskemoterapi.
De vanligaste biverkningarna vid platinum-innehållande kombinationscytostatikabehandling är benmärgspåverkan, håravfall, och varierande grad av illamående och kräkningar. Slemhinnebesvär (mukosit) och trötthet är också vanligt förekommande, och vid framför allt cisplatin-innehållande regimer föreligger även risk för nedsättning av njurfunktion och hörsel liksom perifer neuropati. Kombinationen gemcitabin/cisplatin är på de flesta onkologkliniker i Sverige förstahandsval vid första linjens cytostatikabehandling till välmående patienter p.g.a. dess gynnsammare biverkningsprofil jämfört med MVAC och GCP.
Kemoterapi till patienter som ej tolererar EV/P eller cisplatin
För patienter som är EV/P- samt cisplatin-unfit skall karboplatin-innehållande kombinationskemoterapi övervägas. I en randomiserad fas 3-studie visades att kombinationen gemcitabin/karboplatin är att föredra framför trippelbehandling med metotrexat, karboplatin och vinblastin (M-CAVI) för patienter där man bedömer att cisplatin inte är lämpligt 447 . Gemcitabin/karboplatin anses idag vara standardkemoterapi i denna kliniska situation.
Underhållsbehandling med immunterapi efter primärbehandling med platinum-innehållande kombinationsterapi
Patienter som erhållit inledande platinum-innehållande kombinationsterapi med endera gemcitabin/cisplatin (utan samtidig nivolumab) eller gemcitabin/karboplatin skall övervägas för kompletterande behandling med underhållsbehandling med avelumab baserat på fas 3-data 439 440 473 . I JAVELIN Bladder 100-studien randomiserades patienter som efter primärbehandling med 4–6 cykler cisplatin- eller karboplatin-baserad kombinationskemoterapi som utvecklat stabil sjukdom eller behandlingsrespons till vidare underhållsbehandling med avelumab eller bästa möjliga omvårdnad (BSC). Patienter som erhöll avelumab uppvisade en median OS på 21 månader jämfört med 14 månader efter enbart BSC. Överlevnadsvinst för behandling med avelumab sågs över lag i de på förhand definierade subgrupperna inklusive cisplatin- eller karboplatin-innehållande primärbehandling och respons eller stabil sjukdom efter den primära kemoterapin. Mer än hälften av de patienter som avslutade BSC och som startade ny behandling erhöll immunterapi 473 . En långtidsuppföljning har nyligen redovisats som bekräftar primära data och värdet av denna behandlingsprincip, där patienter som erhöll tillägg av underhållsbehandling med avelumab uppvisade en OS på 24 månader jämfört med 15 månader i standardarmen (HR 0.76 (CI 0.63–0.91) 439 .
Behandling i första linjen för patienter som ej tolererar kombinationsbehandling
Immunterapi som singelbehandling
För patienter som inte bedöms tåla kombinationsbehandling och är cisplatin-unfit kan monoterapi med pembrolizumab och atezolizumab övervägas i första linjen. För pembrolizumab redovisades en ORR på 29 procent (varav 9 procent CR) vid långtidsuppföljningen av patienterna i den registreringsgrundande Keynote 052-studien 474. Medianöverlevnaden var ca 11 månader. För atezolizumab sågs i IMvigor 210-studien (kohort 1) en ORR på 23 procent med 9 procent CR och OS på 16 månader 475 . EMA och svenska myndigheter har senare baserat på nya data från IMvigor 130 respektive Keynote 361 reserverat godkännande för såväl pembrolizumab som atezolizumab till att i första linjen endast gälla patienter som också har högt PD-L1 uttryck, analyserat med för respektive antikropp avsedd metod 442 443 . För pembrolizumab gäller specifikt att klon 22C3 används och en s.k. combined positive score ≥ 10 som definition av PDL1-positivitet.
Kemoterapi som singelbehandling
För patienter med nedsatt allmäntillstånd och som inte tål primär systemisk kombinationsbehandling kan gemcitabin i monoterapi vara ett symptomlindrande alternativ, t.ex. för PD-L1 negativa patienter. I fas 2-studier har sådan med gemcitabin genererat en ORR på 23–28 procent, men randomiserade fas 3data saknas 476 477 478 .
Behandling i andra linjen
I takt med den snabba utveckling som skett under senaste åren avseende behandling i första linjen har val av behandling i andra linjen och efterföljande linjer blivit komplex och många gånger utmanande. Flera alternativ är tänkbara enligt nedan. Det är sannolikt att ytterligare studier, såväl observationella real-world studier och interventionsstudier inom kort kommer att kunna ge ytterligare klarhet avseende optimala behandlingsalgoritmer med utgångspunkt från patientens behandling i första linjen.
Andra linjens behandling med platinum-innehållande kombinationskemoterap
I och med introduktion av EV/P som nytt standardalternativ i första linjen för patienter som bedöms tåla systemisk kombinationsbehandling, är det rimligt att överväga platinum-baserad kombinationskemoterapi i andra linjen, även om randomiserad evidens till stöd för behandlingsval i denna kliniska situation ännu saknas 479 . Eventuellt kvarvarande biverkningar från EV/P såsom perifer neuropati, hudtoxicitet m.fl. behöver beaktas. Cisplatin-gemcitabin alternativt karboplatin-gemcitabin kan således erbjudas utifrån principer för tolerans för platinum avsnitt 12.1.2 ovan med individualiserad behandlingslängd och antal cykler utifrån tolerans och effekt, men med upp till sex cykler som utgångspunkt. Ett annat behandlingsalternativ är behandling med targetläkemedlet erdafitinib avsnitt 12.3.2 nedan.
Andra linjens behandling med targetläkemedel mot FGFR 2/3
För patienter som tidigare erhållit behandling med immunterapi är behandling med targetläkemedel mot FGFR 2/3 ett alternativ. Pan-FGFR (fibroblasttillväxtfaktorreceptor) hämmaren erdafitinib är godkänd av EMA och svenska myndigheter som första läkemedel i klassen tyrosinkinashämmare för patienter med avancerad urotelial cancer och FGFR 2/3 alteration som tidigare behandlats med minst en linje innehållande immunterapi. I en nyligen redovisad fas 3-studie (THOR-studien, kohort 1) inkluderades 266 patienter med FGFR 2/3 alteration som tidigare erhållit immunterapi med checkpointhämmare och upp till två linjers behandling 184 . Patienterna randomiserades till erdafitinib alternativt prövarens val av kemoterapi (docetaxel eller vinflunin). Patienter som behandlades med erdafitinib uppvisade en förbättrad ORR (46 % vs 12 %), bättre median PFS (6 vs 3 månader (HR 0.58 [CI 0.44–0.78]) samt bättre median OS (12 månader vs 8 månader (HR 0.64 [CI 0.47–0.88]) med jämförbar incidens behandlings-relaterade biverkningar ≥ grad 3 för erdafitinib och standardbehandlingen. Biverkningsprofilen för erdafitinib skiljer sig dock väsentligt från konventionell kemoterapi och preparatspecifik toxicitet som särskilt behöver monitoreras vid behandling med erdafitinib inkluderande bl.a. hyperfosfatemi, hypofosfatemi, stomatit, asteni, samt biverkningar från hud (hand-fot-syndrom) och ögon 184 441 . Flera metoder kan utnyttjas för analys av FGFR 2/3 alteration, exempelvis panelsekvensering avsnitt 9.4.2 ovan.
Andra linjens behandling med immunterapi
För patienter som erhållit platinum-baserad kombinationskemoterapi (utan tidigare immunterapi i kombination eller som underhållsbehandling) i första linjen och progredierar, är immunterapi ett behandlingsalternativ i andra linjen. Flera checkpoint-hämmare är godkända, men pembrolizumab förordas i denna situation eftersom godkännande baseras på den positiva randomiserade fas 3-studien Keynote 045. I Keynote 045 randomiserades patienter mellan pembrolizumab och standardkemoterapi (vinflunin, docetaxel eller paklitaxel) efter progress på första linjens platinum-baserade kombinationskemoterapi. I resultaten redovisades högre ORR och CR för pembrolizumab (21 % vs 11 %) respektive CR (7 % vs 3 %) jämfört med kemoterapi samt längre medianöverlevnad för pembrolizumab jämfört med kemoterapi (10 månader vs 7 månader). Långvariga tumörsvar noterades hos patienter som behandlats med pembrolizumab och mediantid för tumörsvar var inte uppnådd vid datacutoff 480 .
Andra linjens behandling med kemoterapi
Vinflunin är den enda konventionella kemoterapin som är registrerad för behandling efter svikt på platinum-baserad kombinationskemoterapi i Europa. Den registreringsgrundande fas 3-studien där man randomiserat jämförde vinflunin och bästa möjliga omvårdnad med enbart bästa möjliga omvårdnad visade en begränsad ORR på 9 procent och överlevnadsvinst på 2 månader till fördel för vinflunin 481 . Real-world studier bekräftar också möjlig klinisk nytta av vinflunin i denna sjukdomssituation 482 . Docetaxel i monoterapi har genererat jämförbara effektdata 483 . Givet övriga aktuella behandlingsalternativ år 2025, rekommenderas att överväga vinflunin i andra linjen efter platinum-baserad kombinationskemoterapi endast för patienter med gott allmäntillstånd (ECOG 0/1) och företrädesvis endast om kontraindikationer mot immunterapi föreligger enligt avsnitt 12.3.3 ovan och förutsättningar för behandling med erdafitinib saknas enligt avsnitt 12.3.2 ovan.
Behandling i tredje linjen
Tredje linjens behandling med enfortumab vedotin (EV) i monoterapi
EV i monoterapi utgör en standardbehandling i 3:e linjen för patienter som tidigare behandlats med platinum-baserad kombinationskemoterapi och med tidigare immunterapi, den senare som andra linjens behandling (kapitel 12.3.3 ovan), eller som del i kombinationsbehandling i första linjen (kapitel 12.2.1.2) eller som underhållsbehandling (kapitel 12.2.1.5). Behandlingsindikationen vilar på högsta evidensgrad från randomiserade fas-3 data (EV-301 studien) där EV jämfördes i tredje linjen efter tidigare platinum-baserad kombinationskemoterapi och immunterapi mot prövarens val av kemoterapi (vinflunin, docetaxel eller paklitaxel). I EV-301 observerades bättre OS för EV jämfört med kemoterapi (13 månader vs 9 månader) och högre ORR (41 % vs 18 %) 484 . Biverkningar från hud, ögon samt infusions-reaktioner, perifer neuropati och hyperglykemi är preparatspecifika för EV och behöver särskilt följas. EMA och svenska myndigheter har godkänt och NT-rådet rekommenderar EV i denna kliniska situation.
Tredje linjens behandling med targetläkemedel mot FGFR 2/3
Behandling med erdafitinib i monoterapi är ett standardterapialternativ i trejde linjen enligt samma principer som är beskrivna för behandling för andra linjes behandling med samma läkemedel kapitel 12.3.2 ovan. Sammantaget skall patienter som är aktuella för erdafitinib i denna kliniska situation bedömas tåla läkemedlet och tidigare ha genomgått behandling med två linjer, vara en måste varit immunterapi med checkpointhämmare.
Tredje linjens behandling med kemoterapi
Evidensgraden för behandling med tredje linjens kemoterapi är svag, vilket delvis bottnar i den snabba utveckling som skett avseende förstalinjesbehandlingar under senaste åren kapitel 12.1. Bästa möjliga omvårdnad (BSC) bör alltid övervägas som rimligaste strategi, inte minst för patienter med nedsatt allmäntillstånd, omfattande samsjuklighet eller som av andra skäl har svaga förutsättningar att dra nytta av behandlingen och tvärtom löper risk att försämras av densamma.
För behandlingsbenägna patienter med gott allmäntillstånd och som i övrigt uppfyller kriterier för platinum-baserad kombinationsbehandling är det rimligt att erbjuda sådan behandling om den inte tidigare givits i första eller andra linjen.
Behandling med övriga kemoterapier, vinflunin eller paklitaxel/gemcitabin, kan övervägas som alternativ för patienter som tidigare genomgått EV/P och platinum-baserad kombinationskemoterapi, men som saknar förutsättningar för behandling med erdafitinib enligt kapitel 12.4.2 ovan.
Paklitaxel/gemcitabin har i mindre enarmade fas 2studier uppvisat ORR på 38–60 procent men saknar utvärdering i randomiserade fas 3studier 485 486 .
Behandling i fjärde linjen
Standardalternativ saknas i denna kliniska situation. Bästa möjliga omvårdnad (BSC) bör alltid övervägas som rimligaste strategi, inte minst för patienter med nedsatt allmäntillstånd, omfattande samsjuklighet eller som av andra skäl har svaga förutsättningar att dra nytta av behandlingen och tvärtom löper risk att försämras av densamma.
För patienter som tidigare genomgått EV/P, platinum-baserad kombinationskemoterapi och erdafitinib kan symptomlindrande behandling med vinflunin eller paklitaxel/gemcitabin övervägas för selekterade patienter med gott allmäntillstånd utan kontraindikationer eller andra begränsande kliniska faktorer.
Särskilda överväganden
Återexponering med platinum-baserad kombinationskemoterapi
För patienter som erhållit platinum-baserad kombinationskemoterapi (utan samtidig immunterapi eller immunterapi som underhållsbehandling) i första linjen med god tolerans, gott tumörsvar och klinisk nytta, kan återexponering (re-challenge) för samma regim övervägas vid senare sjukdomsprogress, företrädesvis om minst 6–12 månader förflutit sedan denna behandling. Evidensgraden för sådan strategi är låg, men i en äldre retrospektiv studie var återexponering mer effektiv än behandling med icke-platinum-innehållande kemoterapi 487 . Studien genomfördes på patienter som behandlats före introduktionen av immunterapi, FGFR2/3 hämmare och ADC-läkemedel i behandlingsarsenalen. Idag rekommenderas andra linjens behandling i första hand i enlighet med kapitel 12.3 ovan. Återexponering med övriga första linjens alternativ är inte systematiskt studerat och kan inte rutinmässigt rekommenderas.
Behandling av patienter som tidigare erhållit perioperativ behandling
Behandlingslandskapet avseende perioperativa behandlingsstrategier (avsnitt 11.1.2.2, 11.1.2.3, 11.1.7.1, 11.1.7.2, och 11.2) är under snabb utveckling och det är sannolikt att vi inom en snar framtid integrerar immunterapi och/eller ADC-läkemedel som del i perioperativa kombinationsbehandlingar i denna kliniska situation. För patienter som erhållit någon av dagens standardbehandlingar med perioperativ kemoterapi och/eller immunterapi i samband med cystektomi eller nefrouretärektomi och återfaller i generaliserad och/eller lokalt avancerad sjukdom behöver tidigare behandlingar och tid sedan föregående systemisk behandling beaktas vid bedömning avseende första linjens behandling för spridd sjukdom (kapitel 12.2 ovan).
Prediktiva biomarkörer
FGFR 2/3 alteration i tumörceller predikterar behandlingsnytta av erdafitinib och genomisk profilering behöver således genomföras inför ställningstagande till behandling med detta läkemedel (kapitel 9.4.1 och 12.3.2). Givet dagens kunskapsläge är det rimligt att genomföra testning under första- eller senast inför andra linjens behandling på patienter som man bedömer kan vara aktuella för ytterligare linjers behandling. Flera metoder kan utnyttjas för analys av FGFR2/3 alteration, exempelvis panelsekvensering (kapitel9.4.2 ovan), och utöver väletablerad vävnadstestning sker ett betydande utvecklingsarbete kring analyser av ctDNA. Betydelsen av högt PD-L1-uttryck i tumör eller immunceller för behandlingsnytta är ännu ofullständigt studerad. Även patienter med lågt uttryck kan erhålla kliniskt viktiga behandlingseffekter. För patienter som bedöms vara cisplatin-unfit i första linjen har emellertid EMA infört en restriktion för pembrolizumab och atezolizumab till att enbart omfatta patienter med högt proteinuttryck av PD-L1 (kapitel 12.2.2.1 ovan). Denna indikationsförändring innebär att immunhistokemisk analys av PDL1 bör genomföras för alla patienter som är cisplatin-unfit och där immunterapi övervägs som behandling (se ovan). För att analys av proteinuttryck av PDL1 skall bli korrekt måste rätt immunhistokemisk metodik och för den terapeutiska antikroppen avsedd plattform användas 442 443 . Interferon-gamma-signalering, mutationsbörda (mutational load), ctDNA-baserade analyser (nivåer samt alterationer) samt molekylär subtyp är exempel på andra föreslagna prediktiva biomarkörer vid systemisk terapi där studier pågår.
Immunrelaterade biverkningar av immunterapi med checkpoint-hämmare
Monoklonala checkpoint-hämmare ger ökad risk för immunrelaterade biverkningar och har således en annan biverkningsprofil än systemiska kemoterapier, tyrosinkinashämmare och ADC-läkemedel. De vanligaste biverkningarna inkluderar autoimmun pneumonit, kolit/diarré, hudutslag, nefrit, hepatit, hypofysit och hyper- respektive hypotyroidism 475 480 488 489 490 491 492 493 494 . Behandlingskrävande biverkningar bör så snart de upp hanteras enligt algoritmer och guidelines 495 496 497 .
Biverkningar av grad ≥ 3 förekommer i upp till 15–20 procent av patienterna, vilket är avsevärt lägre incidens än vid cytostatika (cirka 50 %). Allvarliga immunrelaterade biverkningar uppstår i ca 6 procent av patienterna och behandlingsrelaterad död < 0,2 procent 498 . Biverkningar kan även uppstå och förekomma sent efter avslutad behandling (upp till 6 månader senare).
En sammanställning och vägledning för hantering av immunrelaterade biverkningar finns tillgänglig på svenska på Kunskapsbanken: Bedömning och hantering av biverkningar vid behandling med checkpointhämmare 497 .
Samtliga ovan beskrivna monoklonana antikroppar kan också orsaka lindriga till allvarliga/livshotande infusionsreaktioner, och patienter ska behandlas under noggrann övervakning och premedicineras i enlighet med klinikens lokala riktlinjer för profylax mot infusionsreaktioner
Systemisk immunterapi för patienter med Lynchs syndrom
Patienter med Lynchs syndrom (se Kapitel 6 Urotelial cancer vid Lynchs syndrom) har tumörer med defekt mismatch-reparation (s.k. dMMR), vilket innebär frekvent förekomst av mutationer (hög mutationsbörda). För patienter med dMMR och sjukdomsprogress på tidigare standardbehandling samt utan andra behandlingsalternativ har FDA godkänt behandling med pembrolizumab. Godkännandet baseras på 149 behandlade patienter i totalt fem separata studier vid 15 olika diagnoser och följer rekommendationen för pembrolizumab vid urotelial cancer, var god se ovan. Av dessa behandlade patienter uppvisade 40 procent CR eller partiell remission, och hos 78 procent av dessa patienter varade tumörkrympningen i 6 månader eller längre 489 . Godkännandet är unikt såtillvida att det spänner över många olika diagnosgrupper av solida tumörer och baseras enbart på underliggande genetiska förändringar i patienternas tumörer.
Pågående utveckling och möjliga systemiska behandlingar i framtiden
Ett flertal ADC-läkemedel med olika målstrukturer, ”payload” och varianter av antikroppsderivat är under utveckling och prövas i monoterapi och i kombinationer med bland annat immunterapi. Särskilt lovande är ADCläkemedel med specificitet mot Trop2 och HER2. FDA har beviljat accelererat godkännande för det HER2-specifika ADC-läkemedlet trastuzumab deruxtecan för HER2-posititva patienter med avancerad urotelial cancer som saknar behandlingsalternativ. Godkännande baseras på data från DESTINY-PanTumor02 studien, där patienter med avancerad urotelial cancer ingick 499 . Läkemedlet är ännu inte godkänt av svenska myndigheter på denna indikation. Disitamab vedotin (DV) är ytterligare ett HER2-specifikt ADC-läkemedel med lovande fas 2-data och som för närvarande utvärderas både som monoterapi och i kombinationer i fas 2/3-studier 500 . DV har erhållit ”therapy breakthrough designation” status av FDA och är godkänt i Kina men ännu inte av svenska myndigheter. Utöver ADC-läkemedel prövas även nya immunterapier mot andra checkpoint-hämmare än PD1/PDL1 och ett flertal nya lovande FGFR hämmare där target-selektivitet och biverkningsprofiler skiljer sig gentemot erdafitinib, exempelvis infigratinib 501 och rogaratinib 502 .
Utveckling av behandlingsprediktiva biomarkörer och ytterligare förbättrad individualiserad precisionsmedicin är med tanke på den snabbt expanderande behandlingsarsenalen ett mycket angeläget område för att kunna erbjuda varje patient bästa möjliga behandling, i varje sjukdomssituation, samtidigt som resursutnyttjandet optimeras. I den svenska akademiska nationella kliniska prövningen BioBladder är det övergripande syftet att driva sådan utveckling med hjälp prospektivt systematiskt insamlade vävnadsprover från kliniska rutinpatienter.
Aktuella studier
Aktuella kliniska prövningar som finns tillgängliga i landet för patienter med avancerad/metastaserad blåscancer finns registrerade i databasen Cancerstudier i Sverige. En bred genomisk profilering av tumörens DNA genom analys av tumörvävnad eller cirkulerande tumör DNA (ctDNA) kan vara av värde för att utvärdera möjligheter att delta i biomarkör-drivna läkemedelsprövningar (kapitel 9.4.2 ovan).
Aktuella behandlingsscheman
Behandlingsscheman för aktuella regimer finns att tillgå på Kunskapsbanken: Regimbiblioteket Urinblåse- och urinvägscancer.
Läkemedelsbehandling av skelettmetastaser
Prevalensen av skelettmetastaser har rapporterats till 30–40 procent hos patienter med metastaserad blåscancer 503 . Skelettmetastaserna är ofta lytiska. När sjukdomen progredierar kommer nästan hälften av patienterna med skelettmetastaser att drabbas av skelettrelaterade komplikationer (SRE) (dvs. patologisk fraktur, medullakompression, behov av ortopedisk kirurgi, skelettsmärta som kräver palliativ strålbehandling eller hyperkalcemi). Behandling med intravenösa bisfosfonater såsom zoledronsyra har visat sig minska skelettrelaterade komplikationer och fördröja deras uppkomst hos patienter med skelettmetastaser från solida tumörer, inklusive vid blåscancer 504 505 . Denosumab är en human monoklonal antikropp som genom en principiellt annan verkningsmekanism, blockering av RANK-L, hämmar osteoklastfunktion och därmed benresorption. Effekten av intravenösa bisfosfonater och denosumab, som administreras subkutant, är likvärdig med avseende på att minska och fördröja SRE 506 .
Vid behandling med intravenösa bisfosfonater och denosumab bör man beakta risken för utvecklandet av osteonekros i käken. Innan behandlingen påbörjas bör tandstatus kontrolleras och eventuella kirurgiska ingrepp åtgärdas. Dessa patienter får sin tandvård enligt sjukvårdstaxan. Vidare bör patienter som behandlas med intravenösa bisfosfonater eller denosumab substitueras med kalcium och vitamin D för att minimera risk för utveckling av hypokalcemi.
Strålbehandling vid metastaserad sjukdom
Palliativ strålbehandling mot urinblåsan kan lindra lokal smärta, smärtsamma trängningar och återkommande blödningar om det finns en kvarvarande tumör i blåsan eller vid återfall. I vissa fall kan passage från njurbäcken till urinblåsa återskapas om tumörobstruktion föreligger i distala uretären. Olika fraktioneringsscheman förekommer. Ett vanligt schema är en totaldos på 21 Gy uppdelad i tre fraktioner om 7 Gy varannan dag 507 . Andra vanliga alternativ är 5 Gy x 5, 4 Gy x 7 och 10 Gy x 3 med en månads mellanrum. Om man vill åstadkomma en tumörkrympande effekt kan dosen 3 Gy till totalt minst 30 Gy övervägas med 3- eller 4-fältsteknik för att minska toxiciteten (ej enkla bak-fram-fält).
Vidare kan palliativ strålbehandling ges med gott resultat mot skelettmetastaser. Indikationerna är vanligtvis smärta men strålbehandling kan även ges vid frakturrisk och postoperativt efter ortopediska ingrepp vid t.ex. patologiska frakturer och medullakompression. Vid indikationen smärta kan strålbehandlingen ges som en engångsbehandling på 8 Gy med god smärtlindring i över 80 procent av fallen. Man kan också ge fraktionerad behandling med 4 Gy x 5 mot smärta, men stora studier har visat att engångsbehandling ger lika stor smärtlindrande effekt. Fraktionerad strålbehandling ska dock användas vid indikationer på medullakompression, frakturrisk, patologisk fraktur postoperativt eller vid bestrålning av mjukdelskomponenter 508 509 .
Palliativ strålbehandling kan även användas mot andra symtomgivande metastaslokaler, t.ex. hjärn-, lymfkörtel- och mjukdelsmetastaser.
