Sammanfattning
Initiativet till att ta fram ett nationellt vårdprogram för sköldkörtelcancer kom från planeringsgruppen för tyreoideaforskning i Sverige, ett multidisciplinärt nätverk av forskare och kliniker engagerade i tyreoideasjukdomar. Det utarbetades under ledning av en nationell arbetsgrupp och var klart i december 2012. Det är sedan 2013 i bruk nationellt och finns upplagt på Regionala cancercentrums webbplats www.cancercentrum.se och har efter det reviderats vartannat till vart tredje år.
Orden sköldkörtelcancer och tyreoideacancer är synonyma. I vårdprogrammet används i första hand ordet tyreoideacancer.
Vårdprogrammet är anpassat till principer och rekommendationer i följande konsensusdokument 1:
- American Thyroid Association (ATA): 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Task Force on Thyroid Nodules and Differentiated Thyroid Cancer där även medlemmar från European Thyroid Association (ETA) har deltagit i arbetet.
- 2021 American Thyroid Association Guidelines for Management of Patients with Anaplastic Thyroid Cancer.
- ESMO Clinical Practice Guideline update on the use of systemic therapy in advanced thyroid cancer 2022.
- Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up 2019:
- ‘NCCN Guidelines: Thyroid Carcinoma 2024.
- 2022 ETA Consensus Statement: What are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer?
- SNMMI/EANM practice guideline vs. ETA Consensus Statement: differences and similarities in approaching differentiated thyroid cancer management—the EANM perspective.
Nya behandlingar såsom perorala målinriktade behandlingar har markant förbättrat överlevnaden vid lokalt avancerad eller metastaserad jodrefraktär sjukdom, RET-muterad medullär tyreoideacancer och visat lovande resultat även för BRAFV600E-muterad anaplastisk tyreoideacancer.
Avsikten är att vårdprogrammet ska ses över kontinuerligt och vid behov revideras av den nationella vårdprogramgruppen.
Nationellt kvalitetsregister
Förutom vårdprogrammet finns det ett nationellt kvalitetsregister (Nationellt kvalitetsregister sköldkörtelcancer) som är i bruk sedan 2013 och kopplat till INCA-plattformen (Informationsnätverk i cancervården). Ambitionen är att kvalitetsregistret ska vara ett heltäckande nationellt register, där behandlingsdata från alla patienter som diagnostiserats med tyreoideacancer kan samlas i en nationell databas. En sådan populationsbaserad, heltäckande databas kan bli ett kraftfullt verktyg för att studera sjukdomens epidemiologi och utvärdera resultaten av de i vårdprogrammet fastslagna behandlingsrekommendationerna.
Behandlingsöversikter
I det här avsnittet finns de viktigaste behandlingsöversikterna samlade.
Initial riskvärdering för DTC är baserad på ATAs riktlinjer från 2015 och anpassade efter WHO klassifikation av tumörer från 2022. Tabell 3 Definition av riskstratifiering av differentierad tyreoideacancer sammanfattar riskvärdering baserad på histopatologisk undersökning efter primär kirurgi.
Tabell 3. Definition av riskstratifiering av differentierad tyreoideacancer
|
Riskgrupp |
Definition |
|
Hög |
PTC minst en av följande
Differentierad höggradig tyreoideacancer Lågt differentierad tyreoideacancer Massivt infiltrerande FTC/onkocytär (wiFTC, wiOTC) |
|
Intermediär
|
PTC minst en av följande
Avkapslat angioinvasiv FTC/OTC |
|
Låg
|
DTC T1a, cN0 PTC pT1b-T2 samtliga kriterier
Minimalt invasiv FTC/OTC (miFTC, miOTC) pT1b-T2 |
Differentierad tyreoideacancer
Figur 1. Rekommendationer för kirurgi för DTC
Figur 2. Rekommendationer radiojodbehandling efter kirurgi enligt riskstratifiering
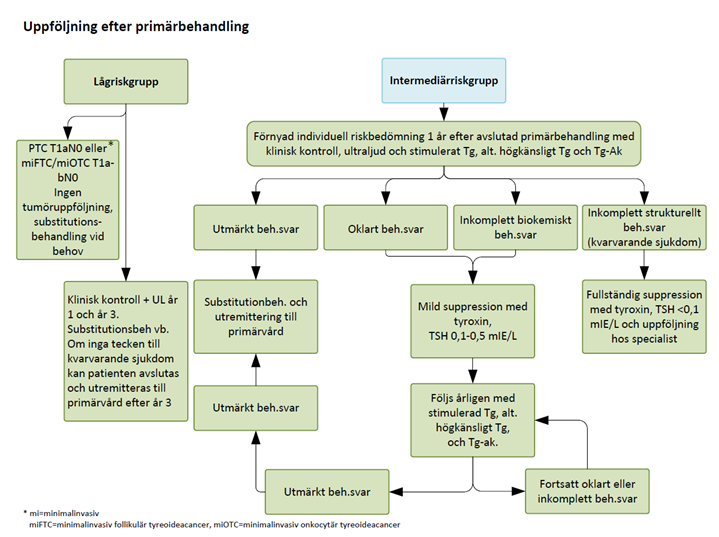
Figur 3. Rekommendationer av uppföljning låg- och intermediärrriskgrupp efter primärbehandling
Figur 4. Rekommendationer av uppföljning högriskgrupp efter primärbehandling
Medullär tyreoideacancer (MTC)
Tabell 4. Behandlingsöversikt för MTC
|
Riskgrupp |
Kirurgi |
Onkologi |
Uppföljning |
|
pT1a (≤ 1 cm) |
Operation kan begränsas till aktuell lob. |
Ingen onkologisk behandling (++) |
Tyroxinsubstitution vid behov. S-kalcitonin + CEA årligen i 5 år. |
|
pT1b–T3
|
Total tyreoidektomi (+++) Central lymfkörtelutrymning (+++) Vid pN1b även lateral utrymning |
Ingen onkologisk behandling (++) |
Tyroxinsubstitution. Basalt S-kalcitonin samt CEA efter 3 och 6 månader och därefter basalt årligen i 10 år (stimulerat v.b.). Vid normala värden och negativ RET-analys kan tumörkontrollerna avslutas efter 10 år. Om förhöjda markörer: radiologisk utredning. |
|
pT4
|
Total tyreoidektomi Central och lateral lymfkörtelutrymning (+++) |
Vid icke-radikal kirurgi extern strålbehandling (++) |
Tyroxinsubstitution. S-kalcitonin + CEA individualiserat. Om förhöjda markörer: radiologisk utredning. |
|
Makroskopisk resttumör |
Reoperation möjlig (++) |
Extern strålbehandling om reoperation inte är möjlig eller vid icke-radikal kirurgi (++) Tyrosinkinashämmare bör övervägas (++++) |
Tyroxinsubstitution. S-kalcitonin + CEA.
|
|
Icke-resektabel cancer Påvisad fjärrmetastasering eller inoperabel patient |
Tumörreducerande kirurgi om möjligt (++) |
Eventuellt extern strålbehandling (++) Tyrosinkinashämmare bör övervägas (++++) Alt. cytostatika vid proliferativ cancer (++) |
Tyroxinsubstitution. S-kalcitonin + CEA. |
Fotnot: RET-mutationsanalys i samtliga fall för att säkerställa ärftlig sjukdom eller inte. Uteslut alltid feokromocytom preoperativt samt analysera S-kalcium om ärftlig sjukdom inte kan uteslutas.
Multifokala tumörer anges som (m). Största härdens tumördiameter utgör grund för T-klassificering och risktillhörighet.
* Nivåstrukturering C.
Anaplastisk tyreoideacancer (ATC)
Tabell 5. Behandlingsöversikt för ATC
|
Diagnos |
Behandling |
|
Diagnos via mellannålsbiopsi, alternativt cytologi av erfaren patolog/cytolog. Grovnålsbiopsi och kirurgisk biopsi kontraindicerad Om diagnos först vid PAD Kompletterande diagnostik vid tillräckligt gott AT inkluderar DT hals-torax-buk (iv kontrast) eller FDG-PET-DT (ev. DT/MRT hjärna) Laryngoskopi för luftvägar och stämbandskontroll Ev. gastroskopi för esofagus invasion Snabb BRAFV600E-analys (IHC) Skyndsam kontakt till närmaste sjukhus med högspecialiserad enhet för tyreoideacancer och diskussion på MDK |
A. Vid gott PS ≤ 2 Primärt resektabel stadium IVa och IVb:
Primärt ej resektabel stadium IVa och IVb:
Stadium IVc:
B. Om skör patient och/eller vid nedsatt AT PS >2: palliation.
|
Nivåstrukturering C. Att vissa patienter till viss del vårdas/utreds på centrallasarett/länssjukhus med onkologklinik (nivå B) i samarbete med nivå C kan vara är ett bättre alternativ för många patienter.
Höggradig follikelcellsderiverad tyreoideacancer
|
Diagnos och behandling |
|
I möjligaste mån följs riktlinjerna för papillär/follikulär tyreoideacancer (både differentierad höggradig tyreoideacancer (DHGTC) och lågt differentierad tyreoideacancer räknas som aggressiv histologi). |
Övrigt
|
Blandad medullär och follikulär cancer |
|
Individualiserad behandling. |
|
Tyreoidealymfom |
|
Se vårdprogram för lymfom. Differentialdiagnos till anaplastisk tyreoideacancer och lymfocytär tyreoidit. Diagnos via finnålspunktion/mellannålsbiopsi + immunhistokemi. Vid oklar diagnos ompunktion. |
2.3 Klassifikation enligt pTNM 8th edition enligt AJCC och UICC (2017)
Tabell 6. Definition av pT-stadium
|
pT – Primärtumör* |
|
|
pTX |
Primärtumören kan inte bedömas |
|
pT0 |
Inga tecken till primärtumör |
|
pT1 |
Tumör 2 cm eller mindre, begränsad till tyreoidea |
|
pT1a |
Tumör 1 cm eller mindre |
|
pT1b |
Tumör större än 1 cm men inte större än 2 cm |
|
pT2 |
Tumör större än 2 cm men inte större än 4 cm i största diameter, begränsad till tyreoidea |
|
pT3 |
Tumör större än 4 cm i största diameter, begränsad till tyreoidea eller tumör med extratyreoidal invasion endast i Mm. infrahyoidei (eng. ”strap muscles”) |
|
pT3a |
Tumör större än 4 cm begränsad till tyreoidea |
|
pT3b |
Tumör som oavsett storlek har extratyreoidal invasion av Mm. infrahyoidei |
|
pT4a |
Tumören har en extratyreoidal utbredning utanför tyreoideas kapsel och invaderar något av följande: subkutan mjukvävnad, larynx, trakea, esofagus eller N. laryngeus recurrens |
|
pT4b |
Tumören har en extratyreoidal utbredning och invaderar prevertebral fascia, mediastinala kärl eller växer runt A. carotis |
I TNM 8 klassificeras alla tyreoideatumörer på samma sätt oavsett om de är papillära, follikulära, onkocytära, medullära, lågt differentierade eller anaplastiska.
Multifokala tumörer anges som (m), största härdens tumördiameter utgör grund för T-klassificering och risktillhörighet.
Notera att klinisk information s.k. ”gross invasion” (pre- eller peroperativt) avseende extratyreoidal utbredning i skelettmuskulatur (cT3b) och invasion av andra vävnader (cT4a eller b) gäller även om respektive pTNM säger något annat i dessa avseenden.
Tabell 7. Definition av pN-stadium
|
pN – Regionala lymfkörtlar omfattar centrala (pre- och paratrakeala, prelaryngeala), laterala, cervikala och övre mediastinala lymfkörtlar |
|
|
pNX* |
Regionala lymfkörtlar kan inte bedömas |
|
pN0** |
Inga regionala lymfkörtelmetastaser (minst 6 undersökta körtlar) |
|
pN1 |
Regionala lymfkörtelmetastaser |
|
pN1a |
Metastaser i centrala lymfkörtlar/regio VI (pretrakealt, paratrakealt och prelaryngealt/Delphiska noden) eller övre/främre mediastinum |
|
pN1b |
Metastaser ipsilateralt, bilateralt eller kontralateralt till cervikala (regio I, II, III, IV eller V) eller retrofaryngeala lymfkörtlar |
* Minst 6 histologiskt undersökta och friade körtlar krävs för pN0, annars blir klassifikationen pNX.
** Om regelrätt lymfkörtelutrymning av centrala rummet skett men 6 lymfkörtlar inte uppnåtts bedöms det trots det som N0 (och inte som pNx).
Notera att man riskmässigt inte skiljer på pN1a och pN1b.
ATA har definierat att små metastaser i begränsat antal (mindre än eller lika med 2 mm i diameter och färre eller lika med 5 metastaser) talar för låg risk för återfall i tyreoideacancer. Detta mikrometastasbegrepp finns inte i TNM-systemet, men har inarbetats i nationella vårdprogrammets riskbedömning och ska därför finnas med i PAD.
Tabell 8. Definition av M-stadium
|
M – Fjärrmetastasering |
|
|
MX |
Fjärrmetastasering kan inte bedömas |
|
M0*** |
Ingen fjärrmetastasering |
|
M1 |
Fjärrmetastasering |
*** Icke-detekterad fjärrmetastasering vid utredning enligt vårdprogrammets riktlinjer.
Tabell 9. Stadium vid ATC
|
Stadium |
T |
N |
M |
|
IVA |
T1-T3a |
N0/NX |
M0 |
|
IVB |
T1-T3a |
N1 |
M0 |
|
T3b |
N0-N1 |
M0 |
|
|
T4 |
N0-N1 |
M0 |
|
|
IVC |
T1-T4 |
N0-N1 |
M1 |
Tabell 10. Performance status (WHO/ECOG)
|
Poäng |
Grad av aktivitet |
|
0 |
Klarar all normal aktivitet utan begränsning |
|
1 |
Klarar begränsad fysiskt krävande aktivitet men är uppegående och i stånd till lättare arbete |
|
2 |
Är uppegående och kan sköta sig själv men klarar inte att arbeta; är uppegående mer än 50 procent av dygnets vakna timmar |
|
3 |
Kan endast delvis sköta sig själv; är bunden till säng eller stol mer än 50 procent av dygnets vakna timmar. |
|
4 |
Klarar inte någonting; kan inte sköta sig själv; är helt bunden till säng eller stol |
|
5 |
Avliden |

